广东省汕头市某校2024-2025学年高二下学期期中化学试卷(含答案)
文档属性
| 名称 | 广东省汕头市某校2024-2025学年高二下学期期中化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 356.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-10 17:44:49 | ||
图片预览



文档简介
2024-2025 学年度第二学期期中考试 高二 化学
注意事项:考试时长 75 分钟,满分 100 分。请将答案填在答题卷上。
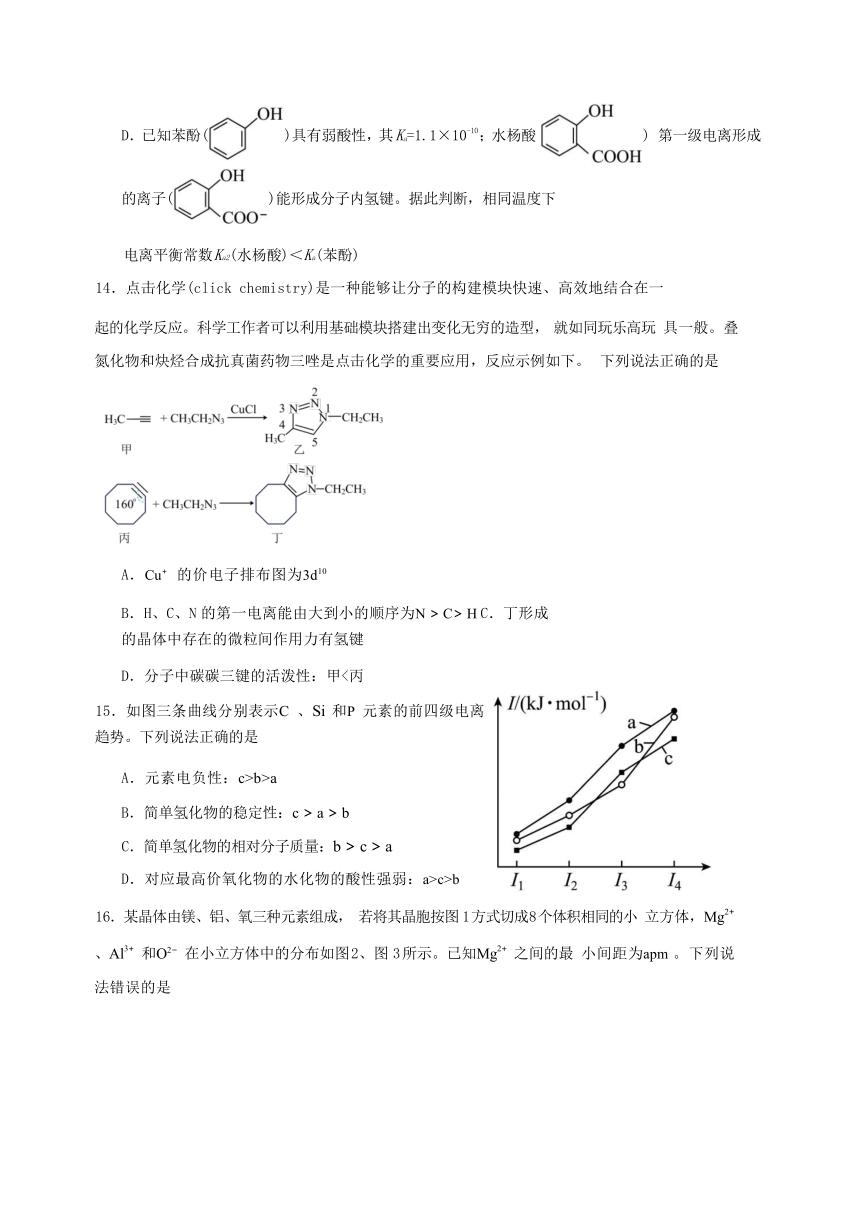
可能用到的相对原子质量:H 1 C 12 B 11 N 14 O 16 F 19 Na 23 Si 28
P 31 S 32 Cl 35.5 Cu 64 Br 80 I 127
一、选择题(每小题只有一个选项符合题意。1-10 每小题 2 分共 20 分,11-16 每小题 4 分共 24 分)
1.生活中的化学无处不在,下列关于生活中的化学描述错误的是
A.电视和电脑的液晶显示器使用的液晶材料属于晶体,能体现晶体的各向异性
B.在霓虹灯的灯管里存在等离子体
C.可以用光谱分析的方法来确定太阳的组成元素是否含氦
D.我国科学家近期成功构筑了一类超分子金属配位笼,超分子具有分子识别和自组 装特征
2.NM-3 是处于临床试验阶段的抗癌药物,其分子结构如图。下列说法不正确的是
A.该有机化合物的分子式为 C12H10O6
B.该有机化合物含有 4 种官能团
C.该物质不属于芳香族化合物
D.该有机化合物可属于羧酸类
3.设NA 为阿伏加德罗常数的值。下列说法错误的是
A.1mol 过氧化氢所含的共价键数目为3NA
B.1mol 白磷含6NA 个P P 键,1mol 二氧化硅中含4NA 个Si O
C.等物质的量的CO2 和N2 中含有τ 键的数目均为2NA
D.金刚石晶体中1mol 碳原子含有2NA 个C C 键
4.软硬酸碱理论认为,常见的硬酸有Li+ 、Be2+ 、Fe3+ 等,软酸有Ag+ 、Hg2+ 等;硬碱有F 、NH3 等,软碱有I 、CN 等;酸碱结合的原则为:“硬酸优先与硬碱结合,软酸优先与软碱结合,软和硬结合一般不稳定 ”。该原则一般可用于判断物质稳定性及 反应发生的方向等。下列叙述错误的是
A.稳定性比较:BeF2 > BeI2
B.稳定性比较: Ag (NH3 )2 + < Ag (CN)2
C.反应LiI + CsF=LiF + CsI 难以向右进行
D.含 Fe (SCN)6 3 的红色溶液中加入适量 NaF 后溶液褪色,说明碱的“硬度 ”:
F > SCN
5.下列说法正确的是
A.Na2SO4 中,阴离子空间结构为正四面体形,S 原子的杂化方式为sp3
B.各种含氯元素的酸性由强到弱排列为HCl< HClO < HClO2 < HClO3 < HClO4
C.乙醇在水中的溶解度小于丁醇(CH3CH2CH2CH2OH ),可以用相似相溶原理解释
D.三氧化硫有单分子气体和三聚分子固体()两种存在形式;
两种分子中 S 原子的杂化轨道类型相同
6.网红减压玩具水晶泥,是由聚乙烯醇(俗称 PVA 胶水)和硼砂以一定比例混合而成 的一种凝胶,其中硼砂(一般写作Na2B4 O7 .10H2O )为白色晶体,易溶于水,结构式 如图所示。当小孩不慎食用硼砂后,硼砂会在胃酸作用下转变为硼酸(结构式为
),硼酸易被人体吸收蓄积而中毒。下列说法错误的是
A.聚乙烯醇中所含元素的电负性大小顺序为 H<C<O
B.硼酸的中心 B 原子的 VSEPR 构型为平面三角形 C.硼酸分子中的原子均满足 8 电子稳定结构
D.硼砂为离子晶体
7.意大利化学家阿伏加德罗在化学上的重大贡献是建立分子学说,下列说法正确的是
A.18 个碳原子构成的碳环分子的结构如图甲所示,该分子属于有机物
B.N2O5 的结构如图乙,可看作 H2O 分子中H 原子被硝基取代而成,N2O5 是非极性分子 C.白磷(P4)晶胞如图丙所示,白磷晶体中 1 个 P4 分子周围有 8 个紧邻的 P4 分子
D.同温、同压下,等质量的 CH4 、CO2 气体分别吹出两个体积大小不同的气球(如图
丁所示),气球①和气球②中原子数之比为 12:55
8.下列说法中不正确的是
A.硫难溶于水,微溶于酒精,易溶于 CS2,说明分子极性:H2O>C2H5OH>CS2
B.CCl2F2 无同分异构体,说明其中碳原子采取 sp3 杂化
C.H2CO3 与 H3PO4 的非羟基氧原子数均为 1,二者的酸性强度非常相近
D.由第 ⅠA 族和第ⅥA 族元素形成的原子个数比为 1:1、电子总数为 38 的化合物, 是含有共价键的离子化合物
9.某物质 M 是制造染料的中间体,它的球棍模型如图所示,由短周期 X、Y、Z、W 四种 元素组成,X 元素原子半径最小,W 的3p 轨道有一个未成对电子,Y、Z 同主族.下列说 法正确的是
A.电负性:Y > Z > W
B. X2Y2 是极性分子
C.最简单氢化物沸点:Y < Z
D.W 的最高价氧化物对应水化物的空间构型为三角锥
10.(CH3NH3 )PbI3 是钙钛矿太阳能电池的重要吸光材料,其晶胞结构如图 1 所示, Walsh 提出H2 O 降解(CH3NH3 )PbI3 的机理如图 2 所示。
下列说法不正确的是
A.H3O+ 的键角小于H2 O 的键角
B.1 个(CH3NH3 )PbI3 晶胞含有 3 个I
C.CH3NH 中 C 和 N 原子的杂化方式相同
D.H2 O 可与CH3NH反应生成H3O+ 和CH3NH2
11.冠醚是一类皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子。18- 冠-6 可以通过图示方法制备。下列说法错误的是
A.18-冠-6 分子中 C、O 都采用 sp3 杂化
B.18-冠-6 和碱金属离子通过离子键形成超分子
C.冠醚的空穴结构对离子有选择作用,在有机反应中可作催化剂
D.制取方法中(1)为取代反应,另一种产物为HCl
12.S4 N4 具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图 所示。将干燥的氨气通入S2Cl2 的CCl4 溶液中,可制得该物质:
6S2Cl2 +16NH3 = S4N4 + S8 +12NH4Cl [已知S8 (分子结构为 )是硫单质中
最稳定的]。下列说法错误的是
A.S4 N4 属于分子晶体,1molS4N4 中含有8mol 极性键
B.32gS8 中含有1mol 非极性键
C.40.5gS2Cl2 参与上述制备反应,转移0.3mol 电子
D.NH3、NH 的 VSEPR 模型均为四面体形
13.物质的组成与结构决定了物质的性质与变化,结构化学是化学研究的重要领域。下 列说法正确的是
A.元素周期系和元素周期表都不只有一个,都是多种多样的
B.在基态 14C 原子中,核外存在 2 对自旋相反的电子,其核外电子有 4 种运动状态
C.I 离子的几何构型为 V 型,其中心原子的杂化形式为 sp2 杂化
D.已知苯酚()具有弱酸性,其 Ka=1.1×10-10 ;水杨酸 ) 第一级电离形成的离子()能形成分子内氢键。据此判断,相同温度下
电离平衡常数 Ka2(水杨酸)<Ka(苯酚)
14.点击化学(click chemistry)是一种能够让分子的构建模块快速、高效地结合在一
起的化学反应。科学工作者可以利用基础模块搭建出变化无穷的造型, 就如同玩乐高玩 具一般。叠氮化物和炔烃合成抗真菌药物三唑是点击化学的重要应用,反应示例如下。 下列说法正确的是
A.Cu+ 的价电子排布图为3d10
B.H、C、N 的第一电离能由大到小的顺序为N > C> H C.丁形成的晶体中存在的微粒间作用力有氢键
D.分子中碳碳三键的活泼性:甲<丙
15.如图三条曲线分别表示C 、Si 和P 元素的前四级电离 能变化趋势。下列说法正确的是
A.元素电负性:c>b>a
B.简单氢化物的稳定性:c > a > b
C.简单氢化物的相对分子质量:b > c > a
D.对应最高价氧化物的水化物的酸性强弱:a>c>b
16.某晶体由镁、铝、氧三种元素组成, 若将其晶胞按图 1 方式切成 8 个体积相同的小 立方体,Mg2+ 、Al3+ 和O2 在小立方体中的分布如图 2、图 3 所示。已知Mg2+ 之间的最 小间距为apm 。下列说法错误的是
A.晶体中Mg2+ 的配位数为 4
B.晶胞的体积为 ×10 30 cm3
C.晶体中三种元素的第一电离能:O > Mg > Al
D.晶体的化学式为MgAl2O4
二.非选择题(4 小题每题 14 分共 56 分)
17.(每空 2 分,共 14 分)请按照要求回答下列问题。
(1)中含氧官能团有: (填名称)。
(2)的分子式为 ,按碳的骨架分,该有机物属于 (填字母)。
a.脂环烃 b.芳香化合物 c.环状化合物 d.苯的同系物
(3)奥沙拉秦 ,其核磁共振氢谱有 组峰,
峰面积比为 。
(4)分子式为C8H10 的芳香烃,苯环上的一溴取代物只有一种,该芳香烃的名称为
(填字母)。
A.乙苯 B.邻二甲苯 C.对二甲苯 D.间二甲苯
(5)已知化合物A(C4Si4H8 ) 与立方烷的分子结构相似,如图所示,则C4Si4 H8 的二氯代 物的同分异构体数目为 。
18.(每空 2 分,共 14 分)已知 A、B、C、D、E、F 都是元素周期表中前四周期的元素, 它们的原子序数依次增大。A 是宇宙中含量最丰富的元素,B、D 原子的 L 层有 2 个未成 对电子。E3+离子 M 层 3d 轨道电子为半满状态,F 比 E 原子序数大 1 且位于同一族。请 根据以上情况,回答下列问题: (答题时,用所对应的元素符号表示)
(1)写出 E 的电子排布式 ,E 位于周期表 区。
(2) A、B、D 三种元素可以形成组成为 A2BD、A4BD、A2BD2 的分子,其中 B 原子采取 sp3 杂 化的是 (填结构简式)
(3)CA 的键角为 。
(5)F 可形成分子式均为 F(NH3)5BrSO4 的两种配合物,其中一种化学式为[F(NH3)5Br]SO4 往其溶液中加 BaCl2 溶液时,现象是 ;往另一种配合物的溶液
中加入 BaCl2 溶液时,无明显现象,若加入 AgNO3 溶液时产生淡黄色沉淀,则第二种配 合物的化学式为 。
(6)B 元素在自然界有多种同素异形体,硬度最大的晶体中每个晶胞中平均含有 个 B 原子。
19.(每空 2 分,共 14 分)电池在人类生产生活中具有十分重要的作用,单晶硅和铜、锗、 镓等的化合物常作为制备太阳能电池的原料。回答下列问题:
(1)基态镓原子的价层电子排布图是 。
(2)四氯化硅属于 晶体,硅原子的杂化方式是 。
(3)下列锗卤化物的熔点和沸点,产生该变化规律的原因是 。
GeCl4 GeBr4 GeI4
熔点/℃ -49.5 26 146
沸点/℃ 83.1 186 约 400
(4)下图为铜的某种氯化物晶胞示意图,试回答下列问题
①该物质的化学式是 。原子坐标参数可表示晶胞内部各原子的相对位置, 图中各原子标参数分别为 A(0,0,0);B(0,1,1);C(1,1,0);则 D 原子的坐标参 数为 。
②晶胞中 C、D 两原子核间距为 298pm,阿伏加德罗常数的值为 NA,则该晶体的密度 g/cm3 (列出计算式即可)。
20.(每空 2 分,共 14 分)铟被广泛应用于电子、太阳能等领域。以某炼锌废渣(主要含 ZnO、In2O3,还含少量 SnO2 、PbO、SiO2 等物质)为原料,制备粗铟的工艺流程如下:
已知:①In(铟)与 Al 是同主族元素,Sn(锡)是第ⅣA 族元素;
②H2A2 为萃取剂,萃取 In3+原理为:
In3+ (水相)+3H2A2 (有机相) ÷ InA3 ·3HA(有机相)+3H+ (水相)
(1)In 元素位于第五周期,In 原子的原子序数为 。
(2)“酸浸 ”中滤渣的主要成分是 。
(3)“反萃取 ”中,从有机相 InA3 ·3HA 中分离铟时,需加入浓度较大的盐酸,从平衡 移动的角度说明其原因 。
(4)“沉铟 ”中,SnCl 转化为SnO 。
①SnO 的 VSEPR 模型名称是 ;
②写出该步转化的离子方程式 。
(5)“酸溶 ”后,铟主要以InCl形式存在溶液中;加入锌粉制得粗铟,同时还生成一种
具有还原性的气体。
写出“还原 ”步骤中发生反应的化学方程式 。 (6)一种铜铟硒晶体(化学式为 CuInSe2)的晶胞结构如图所示,晶胞中 In 和 Se 未标明, 用 A 或者 B 代替(B 球在体内)。
推断 In 是 (填“A”或“B”)
参考答案
选择题(本题有且只有一个正确答案,1~10题每小题2分,共20分;11~16题每小题4分,共24分)
1 2 3 4 5 6 7 8 9 10
A C C C A C D C B A
11 12 13 14 15 16 1~10题每小题2分,共20分; 11~16题每小题4分,共24分。
B C D D C B
二、非选择题:本题共4小题,每小题14分,共56分。
17、 每空各2分
(1) 羟基、酯基 (2) ; ac
(3) 4 ; (4) C (5) 4
18 、每空各2分
(1) 1s22s22p63s23p63d64s2(或[Ar] 3d64s2) ; d (2)CH3OH
(3) 109.5°(或109°28′) (4) 产生白色沉淀 ; [Co(NH3)5SO4]Br (5) 8
19、每空各2分
(1) (2) 分子 ;
(3)锗的卤化物均为分子晶体,随相对分子质量增加,分子间作用力增强,熔沸点升高
(4) ① CuCl ; ; ②
20、每空各2分
(1)49 (2)PbSO4、SiO2
(3)c(HCl)增大,反萃取平衡正向移动,提高反萃取率
(4) ①平面三角形 ; ②
(5)4Zn+2+2H+=2In+4Zn2++8Cl-+H2↑
(6) A
注意事项:考试时长 75 分钟,满分 100 分。请将答案填在答题卷上。
可能用到的相对原子质量:H 1 C 12 B 11 N 14 O 16 F 19 Na 23 Si 28
P 31 S 32 Cl 35.5 Cu 64 Br 80 I 127
一、选择题(每小题只有一个选项符合题意。1-10 每小题 2 分共 20 分,11-16 每小题 4 分共 24 分)
1.生活中的化学无处不在,下列关于生活中的化学描述错误的是
A.电视和电脑的液晶显示器使用的液晶材料属于晶体,能体现晶体的各向异性
B.在霓虹灯的灯管里存在等离子体
C.可以用光谱分析的方法来确定太阳的组成元素是否含氦
D.我国科学家近期成功构筑了一类超分子金属配位笼,超分子具有分子识别和自组 装特征
2.NM-3 是处于临床试验阶段的抗癌药物,其分子结构如图。下列说法不正确的是
A.该有机化合物的分子式为 C12H10O6
B.该有机化合物含有 4 种官能团
C.该物质不属于芳香族化合物
D.该有机化合物可属于羧酸类
3.设NA 为阿伏加德罗常数的值。下列说法错误的是
A.1mol 过氧化氢所含的共价键数目为3NA
B.1mol 白磷含6NA 个P P 键,1mol 二氧化硅中含4NA 个Si O
C.等物质的量的CO2 和N2 中含有τ 键的数目均为2NA
D.金刚石晶体中1mol 碳原子含有2NA 个C C 键
4.软硬酸碱理论认为,常见的硬酸有Li+ 、Be2+ 、Fe3+ 等,软酸有Ag+ 、Hg2+ 等;硬碱有F 、NH3 等,软碱有I 、CN 等;酸碱结合的原则为:“硬酸优先与硬碱结合,软酸优先与软碱结合,软和硬结合一般不稳定 ”。该原则一般可用于判断物质稳定性及 反应发生的方向等。下列叙述错误的是
A.稳定性比较:BeF2 > BeI2
B.稳定性比较: Ag (NH3 )2 + < Ag (CN)2
C.反应LiI + CsF=LiF + CsI 难以向右进行
D.含 Fe (SCN)6 3 的红色溶液中加入适量 NaF 后溶液褪色,说明碱的“硬度 ”:
F > SCN
5.下列说法正确的是
A.Na2SO4 中,阴离子空间结构为正四面体形,S 原子的杂化方式为sp3
B.各种含氯元素的酸性由强到弱排列为HCl< HClO < HClO2 < HClO3 < HClO4
C.乙醇在水中的溶解度小于丁醇(CH3CH2CH2CH2OH ),可以用相似相溶原理解释
D.三氧化硫有单分子气体和三聚分子固体()两种存在形式;
两种分子中 S 原子的杂化轨道类型相同
6.网红减压玩具水晶泥,是由聚乙烯醇(俗称 PVA 胶水)和硼砂以一定比例混合而成 的一种凝胶,其中硼砂(一般写作Na2B4 O7 .10H2O )为白色晶体,易溶于水,结构式 如图所示。当小孩不慎食用硼砂后,硼砂会在胃酸作用下转变为硼酸(结构式为
),硼酸易被人体吸收蓄积而中毒。下列说法错误的是
A.聚乙烯醇中所含元素的电负性大小顺序为 H<C<O
B.硼酸的中心 B 原子的 VSEPR 构型为平面三角形 C.硼酸分子中的原子均满足 8 电子稳定结构
D.硼砂为离子晶体
7.意大利化学家阿伏加德罗在化学上的重大贡献是建立分子学说,下列说法正确的是
A.18 个碳原子构成的碳环分子的结构如图甲所示,该分子属于有机物
B.N2O5 的结构如图乙,可看作 H2O 分子中H 原子被硝基取代而成,N2O5 是非极性分子 C.白磷(P4)晶胞如图丙所示,白磷晶体中 1 个 P4 分子周围有 8 个紧邻的 P4 分子
D.同温、同压下,等质量的 CH4 、CO2 气体分别吹出两个体积大小不同的气球(如图
丁所示),气球①和气球②中原子数之比为 12:55
8.下列说法中不正确的是
A.硫难溶于水,微溶于酒精,易溶于 CS2,说明分子极性:H2O>C2H5OH>CS2
B.CCl2F2 无同分异构体,说明其中碳原子采取 sp3 杂化
C.H2CO3 与 H3PO4 的非羟基氧原子数均为 1,二者的酸性强度非常相近
D.由第 ⅠA 族和第ⅥA 族元素形成的原子个数比为 1:1、电子总数为 38 的化合物, 是含有共价键的离子化合物
9.某物质 M 是制造染料的中间体,它的球棍模型如图所示,由短周期 X、Y、Z、W 四种 元素组成,X 元素原子半径最小,W 的3p 轨道有一个未成对电子,Y、Z 同主族.下列说 法正确的是
A.电负性:Y > Z > W
B. X2Y2 是极性分子
C.最简单氢化物沸点:Y < Z
D.W 的最高价氧化物对应水化物的空间构型为三角锥
10.(CH3NH3 )PbI3 是钙钛矿太阳能电池的重要吸光材料,其晶胞结构如图 1 所示, Walsh 提出H2 O 降解(CH3NH3 )PbI3 的机理如图 2 所示。
下列说法不正确的是
A.H3O+ 的键角小于H2 O 的键角
B.1 个(CH3NH3 )PbI3 晶胞含有 3 个I
C.CH3NH 中 C 和 N 原子的杂化方式相同
D.H2 O 可与CH3NH反应生成H3O+ 和CH3NH2
11.冠醚是一类皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子。18- 冠-6 可以通过图示方法制备。下列说法错误的是
A.18-冠-6 分子中 C、O 都采用 sp3 杂化
B.18-冠-6 和碱金属离子通过离子键形成超分子
C.冠醚的空穴结构对离子有选择作用,在有机反应中可作催化剂
D.制取方法中(1)为取代反应,另一种产物为HCl
12.S4 N4 具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图 所示。将干燥的氨气通入S2Cl2 的CCl4 溶液中,可制得该物质:
6S2Cl2 +16NH3 = S4N4 + S8 +12NH4Cl [已知S8 (分子结构为 )是硫单质中
最稳定的]。下列说法错误的是
A.S4 N4 属于分子晶体,1molS4N4 中含有8mol 极性键
B.32gS8 中含有1mol 非极性键
C.40.5gS2Cl2 参与上述制备反应,转移0.3mol 电子
D.NH3、NH 的 VSEPR 模型均为四面体形
13.物质的组成与结构决定了物质的性质与变化,结构化学是化学研究的重要领域。下 列说法正确的是
A.元素周期系和元素周期表都不只有一个,都是多种多样的
B.在基态 14C 原子中,核外存在 2 对自旋相反的电子,其核外电子有 4 种运动状态
C.I 离子的几何构型为 V 型,其中心原子的杂化形式为 sp2 杂化
D.已知苯酚()具有弱酸性,其 Ka=1.1×10-10 ;水杨酸 ) 第一级电离形成的离子()能形成分子内氢键。据此判断,相同温度下
电离平衡常数 Ka2(水杨酸)<Ka(苯酚)
14.点击化学(click chemistry)是一种能够让分子的构建模块快速、高效地结合在一
起的化学反应。科学工作者可以利用基础模块搭建出变化无穷的造型, 就如同玩乐高玩 具一般。叠氮化物和炔烃合成抗真菌药物三唑是点击化学的重要应用,反应示例如下。 下列说法正确的是
A.Cu+ 的价电子排布图为3d10
B.H、C、N 的第一电离能由大到小的顺序为N > C> H C.丁形成的晶体中存在的微粒间作用力有氢键
D.分子中碳碳三键的活泼性:甲<丙
15.如图三条曲线分别表示C 、Si 和P 元素的前四级电离 能变化趋势。下列说法正确的是
A.元素电负性:c>b>a
B.简单氢化物的稳定性:c > a > b
C.简单氢化物的相对分子质量:b > c > a
D.对应最高价氧化物的水化物的酸性强弱:a>c>b
16.某晶体由镁、铝、氧三种元素组成, 若将其晶胞按图 1 方式切成 8 个体积相同的小 立方体,Mg2+ 、Al3+ 和O2 在小立方体中的分布如图 2、图 3 所示。已知Mg2+ 之间的最 小间距为apm 。下列说法错误的是
A.晶体中Mg2+ 的配位数为 4
B.晶胞的体积为 ×10 30 cm3
C.晶体中三种元素的第一电离能:O > Mg > Al
D.晶体的化学式为MgAl2O4
二.非选择题(4 小题每题 14 分共 56 分)
17.(每空 2 分,共 14 分)请按照要求回答下列问题。
(1)中含氧官能团有: (填名称)。
(2)的分子式为 ,按碳的骨架分,该有机物属于 (填字母)。
a.脂环烃 b.芳香化合物 c.环状化合物 d.苯的同系物
(3)奥沙拉秦 ,其核磁共振氢谱有 组峰,
峰面积比为 。
(4)分子式为C8H10 的芳香烃,苯环上的一溴取代物只有一种,该芳香烃的名称为
(填字母)。
A.乙苯 B.邻二甲苯 C.对二甲苯 D.间二甲苯
(5)已知化合物A(C4Si4H8 ) 与立方烷的分子结构相似,如图所示,则C4Si4 H8 的二氯代 物的同分异构体数目为 。
18.(每空 2 分,共 14 分)已知 A、B、C、D、E、F 都是元素周期表中前四周期的元素, 它们的原子序数依次增大。A 是宇宙中含量最丰富的元素,B、D 原子的 L 层有 2 个未成 对电子。E3+离子 M 层 3d 轨道电子为半满状态,F 比 E 原子序数大 1 且位于同一族。请 根据以上情况,回答下列问题: (答题时,用所对应的元素符号表示)
(1)写出 E 的电子排布式 ,E 位于周期表 区。
(2) A、B、D 三种元素可以形成组成为 A2BD、A4BD、A2BD2 的分子,其中 B 原子采取 sp3 杂 化的是 (填结构简式)
(3)CA 的键角为 。
(5)F 可形成分子式均为 F(NH3)5BrSO4 的两种配合物,其中一种化学式为[F(NH3)5Br]SO4 往其溶液中加 BaCl2 溶液时,现象是 ;往另一种配合物的溶液
中加入 BaCl2 溶液时,无明显现象,若加入 AgNO3 溶液时产生淡黄色沉淀,则第二种配 合物的化学式为 。
(6)B 元素在自然界有多种同素异形体,硬度最大的晶体中每个晶胞中平均含有 个 B 原子。
19.(每空 2 分,共 14 分)电池在人类生产生活中具有十分重要的作用,单晶硅和铜、锗、 镓等的化合物常作为制备太阳能电池的原料。回答下列问题:
(1)基态镓原子的价层电子排布图是 。
(2)四氯化硅属于 晶体,硅原子的杂化方式是 。
(3)下列锗卤化物的熔点和沸点,产生该变化规律的原因是 。
GeCl4 GeBr4 GeI4
熔点/℃ -49.5 26 146
沸点/℃ 83.1 186 约 400
(4)下图为铜的某种氯化物晶胞示意图,试回答下列问题
①该物质的化学式是 。原子坐标参数可表示晶胞内部各原子的相对位置, 图中各原子标参数分别为 A(0,0,0);B(0,1,1);C(1,1,0);则 D 原子的坐标参 数为 。
②晶胞中 C、D 两原子核间距为 298pm,阿伏加德罗常数的值为 NA,则该晶体的密度 g/cm3 (列出计算式即可)。
20.(每空 2 分,共 14 分)铟被广泛应用于电子、太阳能等领域。以某炼锌废渣(主要含 ZnO、In2O3,还含少量 SnO2 、PbO、SiO2 等物质)为原料,制备粗铟的工艺流程如下:
已知:①In(铟)与 Al 是同主族元素,Sn(锡)是第ⅣA 族元素;
②H2A2 为萃取剂,萃取 In3+原理为:
In3+ (水相)+3H2A2 (有机相) ÷ InA3 ·3HA(有机相)+3H+ (水相)
(1)In 元素位于第五周期,In 原子的原子序数为 。
(2)“酸浸 ”中滤渣的主要成分是 。
(3)“反萃取 ”中,从有机相 InA3 ·3HA 中分离铟时,需加入浓度较大的盐酸,从平衡 移动的角度说明其原因 。
(4)“沉铟 ”中,SnCl 转化为SnO 。
①SnO 的 VSEPR 模型名称是 ;
②写出该步转化的离子方程式 。
(5)“酸溶 ”后,铟主要以InCl形式存在溶液中;加入锌粉制得粗铟,同时还生成一种
具有还原性的气体。
写出“还原 ”步骤中发生反应的化学方程式 。 (6)一种铜铟硒晶体(化学式为 CuInSe2)的晶胞结构如图所示,晶胞中 In 和 Se 未标明, 用 A 或者 B 代替(B 球在体内)。
推断 In 是 (填“A”或“B”)
参考答案
选择题(本题有且只有一个正确答案,1~10题每小题2分,共20分;11~16题每小题4分,共24分)
1 2 3 4 5 6 7 8 9 10
A C C C A C D C B A
11 12 13 14 15 16 1~10题每小题2分,共20分; 11~16题每小题4分,共24分。
B C D D C B
二、非选择题:本题共4小题,每小题14分,共56分。
17、 每空各2分
(1) 羟基、酯基 (2) ; ac
(3) 4 ; (4) C (5) 4
18 、每空各2分
(1) 1s22s22p63s23p63d64s2(或[Ar] 3d64s2) ; d (2)CH3OH
(3) 109.5°(或109°28′) (4) 产生白色沉淀 ; [Co(NH3)5SO4]Br (5) 8
19、每空各2分
(1) (2) 分子 ;
(3)锗的卤化物均为分子晶体,随相对分子质量增加,分子间作用力增强,熔沸点升高
(4) ① CuCl ; ; ②
20、每空各2分
(1)49 (2)PbSO4、SiO2
(3)c(HCl)增大,反萃取平衡正向移动,提高反萃取率
(4) ①平面三角形 ; ②
(5)4Zn+2+2H+=2In+4Zn2++8Cl-+H2↑
(6) A
同课章节目录
