2025高考大题闯关---化学原理综合题练习二(含答案)
文档属性
| 名称 | 2025高考大题闯关---化学原理综合题练习二(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 18:51:52 | ||
图片预览



文档简介
2025高考大题闯关---化学原理综合题练习二
1.(23-24高三上·上海·阶段练习)(一)完成下列问题
(1)在2L密闭容器中进行如下反应:,在2s内用X表示的平均反应速率是,则2s时W增加的物质的量是_______
A. B. C. D.
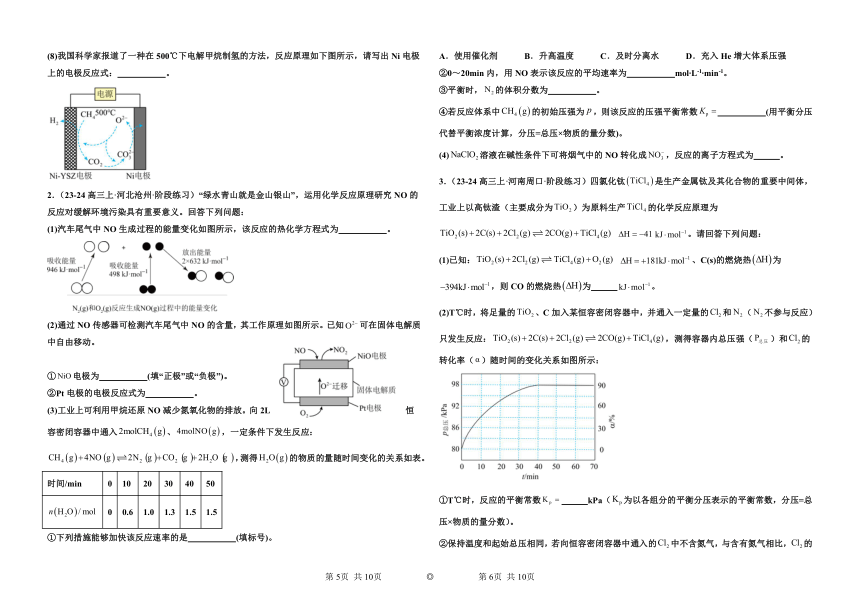
(2)科学家从天然产物中筛选物质开发出了一款完全可食用、可充电的电池。维生素为负极,从水果皮中提取的槲皮素为正极,水溶液为电解质溶液,如图所示。电池的性能测试显示电压为0.6~0.8V,水电解所需最低电压为1.23V。下列说法错误的是_________
A.放电过程中海藻片中向维生素电极迁移
B.放电时负极反应:-2e-+2H+
C.充电时总反应:+→+
D.该电池即使儿童误食也不会导致体内水电解而损害身体
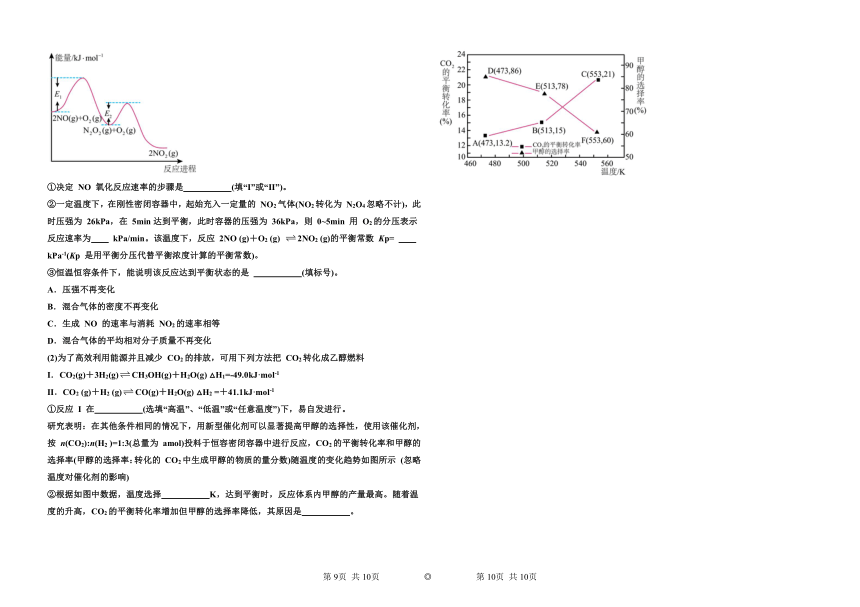
(3)一定温度下,在体积可变的反应器中充入足量的黄钠铁矾[],发生反应:,达到平衡时压强为,保持温度不变,将体积变为原来的一半,平衡时测得压强为p。判断与p的关系,并说明理由
(4)以酚酞为指示剂,用0.1000的NaOH溶液滴定20.00mL未知浓度的二元酸溶液。溶液中,pH、分布系数随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
[比如的分布系数:]知:常温下,。
下列叙述正确的是______
A.曲线①代表,
B.的电离常数
C.滴定过程,pH=2时溶液中
D.向溶液中加入少量溶液,发生离子反应:
(二)神舟十五号顺利发射升空,标志着我国航天事业的飞速发展。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼()、液氢等,具有不同的推进效能。回答下列问题:
(5)火箭推进剂可用作燃料,作氧化剂,反应的热化学方程式可表示为 。相关物质的摩尔生成焓如下表所示。
物质 (g) (l) (g)
摩尔生成焓(kJ/mol) +10.8 +165.8 -242.0
注:一定温度下,由元素的最稳定单质生成1mol纯物质的热效应称为该物质的摩尔生成焓,用表示。如(l)的摩尔生成焓:
① kJ/mol。
②结合化学反应原理分析,(l)作推近剂燃料可与(g)自发进行反应的原因是
。
(6)火箭推进器内氨氧燃烧的简化反应历程如下图所示,分析其反应机理。
该历程分 步进行,其中氢氧燃烧决速步对应的反应方程式为 。
Ⅱ.利用“一碳化学”技术可有效实现工业制氢,为推进剂提供了丰富的氢燃料,该工业制氢方法主要涉及以下两个反应:
a:
b:
已知为反应的标准压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的相对分压代替浓度;气体的相对分压等于其分压(单位为kPa)除以标准压力()。反应a、b的ln随(T为温度)的变化如图所示。
(7)①能表示反应b的曲线为 ,反应a的标准压强平衡常数表达式 。
②维持温度下,往恒容密闭容器中通入等量、、混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下的平衡转化率为 ,的平衡分压为(结果保留3位有效数字) kPa。
Ⅲ.电解法在物质制备中具有巨大的研究价值,可广泛用于化工生产。
(8)我国科学家报道了一种在500℃下电解甲烷制氢的方法,反应原理如下图所示,请写出Ni电极上的电极反应式: 。
2.(23-24高三上·河北沧州·阶段练习)“绿水青山就是金山银山”,运用化学反应原理研究NO的反应对缓解环境污染具有重要意义。回答下列问题:
(1)汽车尾气中NO生成过程的能量变化如图所示,该反应的热化学方程式为 。
(2)通过NO传感器可检测汽车尾气中NO的含量,其工作原理如图所示。已知可在固体电解质中自由移动。
①电极为 (填“正极”或“负极”)。
②Pt电极的电极反应式为 。
(3)工业上可利用甲烷还原NO减少氮氧化物的排放。向2L恒容密闭容器中通入、,一定条件下发生反应:,测得的物质的量随时间变化的关系如表。
时间/min 0 10 20 30 40 50
0 0.6 1.0 1.3 1.5 1.5
①下列措施能够加快该反应速率的是 (填标号)。
A.使用催化剂 B.升高温度 C.及时分离水 D.充入He增大体系压强
②0~20min内,用NO表示该反应的平均速率为 mol L-1 min-1。
③平衡时,的体积分数为 。
④若反应体系中的初始压强为,则该反应的压强平衡常数 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)溶液在碱性条件下可将烟气中的NO转化成,反应的离子方程式为 。
3.(23-24高三上·河南周口·阶段练习)四氯化钛是生产金属钛及其化合物的重要中间体,工业上以高钛渣(主要成分为)为原料生产的化学反应原理为 。请回答下列问题:
(1)已知: 、C(s)的燃烧热为,则CO的燃烧热为 。
(2)T℃时,将足量的、C加入某恒容密闭容器中,并通入一定量的和(不参与反应)只发生反应:,测得容器内总压强()和的转化率()随时间的变化关系如图所示:
①T℃时,反应的平衡常数 kPa(为以各组分的平衡分压表示的平衡常数,分压=总压×物质的量分数)。
②保持温度和起始总压相同,若向恒容密闭容器中通入的中不含氮气,与含有氮气相比,的平衡转化率 (填“增大”“减小”或“不变”),其原因为 。
(3)利用先制得,焙烧可获得纳米。用电解法生产钛的原理如图所示。电解过程中,被还原的Ca进一步还原得到钛,用化学用语表示制钛过程: 、 ;石墨电极需要定期更换的原因为 。
4.(2023·湖南衡阳·三模)2023年甲醇作为能源类化工产品备受关注,回答下列问题:
已知:键能为气态分子中化学键解离成气态原子所吸收的能量。相关化学键键能如表所示:
化学键
键能 728 436 354.5 464 358
(1)热催化加氢合成甲醇过程中存在如下反应:
①
②
则反应③:的 。
(2)键、键的键长和键角数值可以通过 实验获得。
(3)①和反应生成,同时分子间脱水生成:
i.
ii.
在、的反应条件下,向密闭容器中充入和各,发生反应i和反应ii,测得平衡时和的物质的量分别为、,反应ii的平衡常数 (以分压表示,分压=总压×气体物质的量分数,保留三位有效数字)。
②如图分别为研究温度和压强(其他条件不变)对反应ii的影响,曲线a为不同温度下达到平衡时甲醇的转化率,曲线b和c分别为不同温度或压强下相同时间内测得反应体系中的甲醇的转化率,结合曲线a分析可知,反应ii的 (填“>”或“<”)0;请用化学反应原理知识解释曲线b变化趋势的原因: ,该反应适宜的温度和压强分别为 。
(4)在合成甲醇有机反应中,的化合物常作催化剂。晶体的密度为,其晶胞结构如图所示,晶胞中所有晶面夹角均为,已知:晶胞参数,,则 (保留两位小数),与其相邻的离子中心的距离有 种。(,摩尔质量取)
5.(22-23高三上·江西·阶段练习)倡导生态文明建设,环境问题一直是我们关注的焦点。运用化学反应原理研究氮、碳的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)NO 的氧化反应 2NO(g)+O2 (g)2NO2(g)分两步进行;
I.2NO(g) N2O2 (g) II.N2O2(g+O2(g)2NO2(g)
其反应过程能量变化如图所示:
①决定 NO 氧化反应速率的步骤是 (填“I”或“II”)。
②一定温度下,在刚性密闭容器中,起始充入一定量的 NO2气体(NO2转化为 N2O4忽略不计),此时压强为 26kPa,在 5min达到平衡,此时容器的压强为 36kPa,则 0~5min 用 O2的分压表示反应速率为 kPa/min。该温度下,反应 2NO (g)+O2 (g) 2NO2 (g)的平衡常数 Kp= kPa-1(Kp 是用平衡分压代替平衡浓度计算的平衡常数)。
③恒温恒容条件下,能说明该反应达到平衡状态的是 (填标号)。
A.压强不再变化
B.混合气体的密度不再变化
C.生成 NO 的速率与消耗 NO2的速率相等
D.混合气体的平均相对分子质量不再变化
(2)为了高效利用能源并且减少 CO2的排放,可用下列方法把 CO2转化成乙醇燃料
I.CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
II.CO2 (g)+H2 (g)CO(g)+H2O(g) △H2 =+41.1kJ·mol-1
①反应 I 在 (选填“高温”、“低温”或“任意温度”)下,易自发进行。
研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按 n(CO2):n(H2 )=1:3(总量为 amol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的 CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示 (忽略温度对催化剂的影响)
②根据如图中数据,温度选择 K,达到平衡时,反应体系内甲醇的产量最高。随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,其原因是 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
《2025高考大题闯关---原理综合题练习二》参考答案
1.(1)A
(2)C
(3) =p ,温度不变,平衡常数不变
(4)CD
(5) -1310.4 △H<0 △S>0
(6) 4
(7) y 25% 21.8
(8)
【详解】(1)在2L密闭容器中进行如下反应:,在2s内用X表示的平均反应速率是,则2s内消耗X的物质的量为,根据反应方程式,2s时W增加的物质的量是,故选A;
(2)A.电池放电过程中,阴离子向负极移动,海藻片中向维生素电极迁移,故A正确;
B.放电时负极失电子发生氧化反应,负极反应式为-2e-→+2H+,故B正确;
C.充电时,阳极发生氧化反应生成、阴极发生还原反应生成,总反应为+→+,故C错误;
D.该电池的电压为0.6~0.8V,水电解所需最低电压为1.23V,该电池即使儿童误食也不会导致体内水电解而损害身体,故D正确;
选C。
(3)一定温度下,在体积可变的反应器中充入足量的黄钠铁矾[],发生反应:,达到平衡时压强为,保持温度不变,将体积变为原来的一半,平衡时测得压强为p,,温度不变,平衡常数不变,所以=p。
(4)A.40ml 0.1000的NaOH溶液与20.00mL二元酸溶液恰好完全反应,则的浓度为0.1mol/L;0.1mol/L的H2A的pH=0.1,可知H2A第一步完全电离,则①代表、②代表;故A错误;
B.根据图示c(HA-)=c(A2-)时pH=2,的电离常数,故B错误;
C.根据电荷守恒,滴定过程,,pH=2时c(HA-)=c(A2-),所以,故C正确;
D.的电离常数大于,向溶液中加入少量溶液,发生离子反应:,故D正确;
选CD。
(5)① Ⅰ
Ⅱ
Ⅲ
根据盖斯定律Ⅲ×4-Ⅰ×2-Ⅱ得 (-242×4-165.8×2-10.8)kJ/mol=-1310.4kJ/mol。
②结合化学反应原理分析,(l)作推近剂燃料可与(g)自发进行反应的原因是△H<0、△S>0。
(6)根据图示,该历程分4步进行;活化能越多反应速率越慢,慢反应决定总反应速率,第一步反应活化能最大,第一步是决速步,对应的反应方程式为。
(7)①反应b正反应放热,随温度升高,平衡逆向移动,平衡常数减小,能表示反应b的曲线为y,反应a的标准压强平衡常数表达式。
②维持温度下,往恒容密闭容器中通入、、的物质的量均为amol,初始压强为120kPa,达平衡时体系压强为140kPa,则反应后气体的总物质的量为3.5amol,可知发生反应a气体物质的量增加0.5amol,设反应消耗甲烷的物质的量为xmol,
x=0.25amol,该温度下的平衡转化率为,反应a消耗0.25amol甲烷、消耗0.25amol二氧化碳、生成0.5amolCO、生成0.25amol H2;设反应消耗水bmol,则容器中CO的物质的量为(0.5a-b)mol、H2O的物质的量为(a-b)mol、CO2的物质的量为(a-0.25a+b)mol=(0.75a+b)mol、H2的物质的量为(0.5a+b)mol。根据图像可知温度下,反应b得标准压强平衡常数为1,则,解得b=0.04545amol,则氢气的物质的量为(0.5a+0.04545a)mol=0.54545amol,的平衡分压为kPa。
(8)根据图示,甲烷在Ni-YSZ电极发生氧化反应生成氢气和二氧化碳,则Ni-YSZ电极阳极、Ni电极是阴极,Ni电极上的电极反应式为。
2.(1)N2(g)+O2(g)=2NO(g) =+180kJ/mol
(2) 负极 O2+4e-=2O2-
(3) AB 0.05 25%
(4)3+4NO+4OH-=4+3Cl-+2H2O
【详解】(1)由示意图可知,1molN2和1mol O2完全反应断键共吸收1444kJ能量,生成2molNO成键共放出1264kJ能量,故反应吸收能量180kJ,该反应的热化学方程式为:N2(g)+O2(g)=2NO(g) =+180kJ/mol。
(2)①由图可知该传感器是原电池,NO在NiO电极失电子变为NO2,NiO电极为负极;
②由图可知,O2在Pt电极得电子变为O2-,电极反应式为:O2+4e-=2O2-。
(3)①A.使用催化剂能降低反应的活化能,增大反应速率,故A选;
B.升高温度能增大反应速率,故B选;
C.及时分离水,反应物浓度减小,反应速率减小,故C不选;
D.充入He增大体系压强,反应物和生成物的浓度不变,反应速率不变,故D不选;
故答案为AB;
②0~20min内,用NO表示该反应的平均速率为v(NO)=2v(H2O)= =0.05 mol L-1 min-1;
③根据已知条件列出“三段式”
平衡时,的体积分数为=25%;
④若反应体系中的初始压强为,则初始总压为p+2p=3p,该反应是气体体积不变的反应,则平衡时总压为3p,该反应的压强平衡常数=。
(4)溶液在碱性条件下可将烟气中的NO转化成,根据得失电子守恒和电荷守恒配平离子方程式为:3+4NO+4OH-=4+3Cl-+2H2O。
3.(1)-283
(2) 1458 减小 保持总压不变,不含氮气时,相当于增大压强,平衡逆向移动
(3) 阳极生成的会氧化石墨电极
【详解】(1)①;
②;
③;
根据盖斯定律,得:;
(2)①设起始有xmol和ymol,起始压强为80kPa,平衡时总压强为98kPa,的转化率为90%,反应氯气0.9xmol,则平衡时有0.1xmol氯气,0.9xmol一氧化碳,0.45xmol四氯化钛,ymol氮气,共有1.45xmol+ymol,恒温恒容,压强之比等于物质的量之比,总的物质的量增加0.45xmol、压强增加18mol,则可得,平衡时氯气、一氧化碳、四氯化钛分压分别为、、,该反应的平衡常数;
②保持温度和起始总压相同,若向恒容密闭容器中通入的中不含氮气,与含有氮气相比,的平衡转化率减小,原因:保持总压不变,不含氮气时,相当于增大压强,平衡逆向移动;
(3)电解过程中,被还原的Ca进一步还原得到钛,即:、;反应过程中阳极生成的氧气会氧化石墨,导致石墨电极需要定期更换。
4.(1)
(2)X射线衍射
(3) 10.7 温度低于时,该反应未达到平衡状态,温度升高,反应速率加快,转化率升高;温度高于时,该反应达到平衡状态,温度升高,平衡逆向移动,转化率下降 、()
(4) 486.25 2
【详解】(1)反应物总键能-生成物总键能,故,结合三个方程式可知,反应①可由反应②和反应③相加得到,所以。故答案为:;
(2)键、键的键长和键角数值可以通过X射线衍射实验获得。故答案为:X射线衍射;
(3)①i.
ii.
平衡时,,,,反应ii的分压平衡常数。故答案为:10.7;
②由图可知,随温度升高甲醇的转化率下降,说明升温时反应ii平衡逆向移向,则正反应为放热反应,;由图可知温度低于时,该反应未达到平衡状态,温度升高,反应速率加快,转化率升高;温度高于时,该反应达到平衡状态,温度升高,平衡逆向移动,转化率下降。未达平衡时,压强增大,反应速率加快、转化率升高,结合图像及实际生产中设备、成本、能耗等因素,适宜的压强为。综上所述,适宜的条件为、。故答案为:<;温度低于时,该反应未达到平衡状态,温度升高,反应速率加快,转化率升高;温度高于时,该反应达到平衡状态,温度升高,平衡逆向移动,转化率下降;、();
(4),解得,,由图可知,与其相邻的离子中心的距离有2种。故答案为:486.25;2。
5.(1) I 2 0.009 AD
(2) 低温 553 当温度升高时,反应I平衡逆向移动,而反应II平衡正向移动且幅度更大
【详解】(1)①由能量变化图可以看出,第I步活化能较大,反应速率较慢,因此决定NO氧化反应速率的步骤是I;理由是反应I的活化能大;
②设反应进行过程中O2的压强增加为x,因为是刚性容器,可利用压强建立三段式:
从而得出:2x+x+26-2x=36 x=10kPa;
则 0~5min 用 O2 的分压表示反应速率为=2 kPa/min。该温度下,反应 2NO (g)+O2 (g) 2NO2 (g)的平衡常数 Kp= kPa-1=0.009kPa-1;
③A.因为反应前后气体的分子数不等,所以在平衡移动的过程中压强发生不断改变,当压强不再变化时,反应达平衡状态,选项A符合题意;
B.在反应过程中,混合气体的质量不变,气体的体积不变,混合气体的密度始终不变,所以密度不变时反应不一定达平衡状态,选项B不符合题意;
C.生成 NO的方向与消耗 NO2 的方向相同,所以速率相等时反应不一定达平衡状态,选项C不符合题意;
D.混合气体质量不变,随着反应的进行,物质的量发生不断改变,平均相对分子质量不断发生改变,当平均相对分子质量不变时,反应达平衡状态,选项D符合题意;
答案选AD;
答案为:I;反应I的活化能大;2;0.009;AD;
(2)①反应 I 为放热反应,则在低温下,易自发进行。
②由反应方程式CO2(g)+3H2(g)CH3OH(g)+H2O(g)可知,生成CH3OH的物质的量等于参加反应的CO2的物质的量。473K时,CO2的平衡转化率为13.2%,甲醇的选择率为86%,则生成CH3OH的物质的量为0.25amol×13.2%×86%=0.02838amol;513K时,CO2的平衡转化率为15%,甲醇的选择率为78%,则生成CH3OH的物质的量为0.25amol×15%×78%=0.02925amol;553K时,CO2的平衡转化率为21%,甲醇的选择率为60%,则生成CH3OH的物质的量为0.25amol×21%×60%=0.0315amol,由此可得,温度选择553K,达到平衡时,反应体系内甲醇的产量最高。因为反应I为放热反应,而反应II为吸热反应,且反应II对CO2的转化起主导地位,所以随着温度的升高,CO2 的平衡转化率增加但甲醇的选择率降低,其原因是当温度升高时,反应I平衡逆向移动,而反应II平衡正向移动且幅度更大。答案为:低温;553;当温度升高时,反应I平衡逆向移动,而反应II平衡正向移动且幅度更大。
答案第1页,共2页
答案第1页,共2页
1.(23-24高三上·上海·阶段练习)(一)完成下列问题
(1)在2L密闭容器中进行如下反应:,在2s内用X表示的平均反应速率是,则2s时W增加的物质的量是_______
A. B. C. D.
(2)科学家从天然产物中筛选物质开发出了一款完全可食用、可充电的电池。维生素为负极,从水果皮中提取的槲皮素为正极,水溶液为电解质溶液,如图所示。电池的性能测试显示电压为0.6~0.8V,水电解所需最低电压为1.23V。下列说法错误的是_________
A.放电过程中海藻片中向维生素电极迁移
B.放电时负极反应:-2e-+2H+
C.充电时总反应:+→+
D.该电池即使儿童误食也不会导致体内水电解而损害身体
(3)一定温度下,在体积可变的反应器中充入足量的黄钠铁矾[],发生反应:,达到平衡时压强为,保持温度不变,将体积变为原来的一半,平衡时测得压强为p。判断与p的关系,并说明理由
(4)以酚酞为指示剂,用0.1000的NaOH溶液滴定20.00mL未知浓度的二元酸溶液。溶液中,pH、分布系数随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
[比如的分布系数:]知:常温下,。
下列叙述正确的是______
A.曲线①代表,
B.的电离常数
C.滴定过程,pH=2时溶液中
D.向溶液中加入少量溶液,发生离子反应:
(二)神舟十五号顺利发射升空,标志着我国航天事业的飞速发展。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼()、液氢等,具有不同的推进效能。回答下列问题:
(5)火箭推进剂可用作燃料,作氧化剂,反应的热化学方程式可表示为 。相关物质的摩尔生成焓如下表所示。
物质 (g) (l) (g)
摩尔生成焓(kJ/mol) +10.8 +165.8 -242.0
注:一定温度下,由元素的最稳定单质生成1mol纯物质的热效应称为该物质的摩尔生成焓,用表示。如(l)的摩尔生成焓:
① kJ/mol。
②结合化学反应原理分析,(l)作推近剂燃料可与(g)自发进行反应的原因是
。
(6)火箭推进器内氨氧燃烧的简化反应历程如下图所示,分析其反应机理。
该历程分 步进行,其中氢氧燃烧决速步对应的反应方程式为 。
Ⅱ.利用“一碳化学”技术可有效实现工业制氢,为推进剂提供了丰富的氢燃料,该工业制氢方法主要涉及以下两个反应:
a:
b:
已知为反应的标准压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的相对分压代替浓度;气体的相对分压等于其分压(单位为kPa)除以标准压力()。反应a、b的ln随(T为温度)的变化如图所示。
(7)①能表示反应b的曲线为 ,反应a的标准压强平衡常数表达式 。
②维持温度下,往恒容密闭容器中通入等量、、混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下的平衡转化率为 ,的平衡分压为(结果保留3位有效数字) kPa。
Ⅲ.电解法在物质制备中具有巨大的研究价值,可广泛用于化工生产。
(8)我国科学家报道了一种在500℃下电解甲烷制氢的方法,反应原理如下图所示,请写出Ni电极上的电极反应式: 。
2.(23-24高三上·河北沧州·阶段练习)“绿水青山就是金山银山”,运用化学反应原理研究NO的反应对缓解环境污染具有重要意义。回答下列问题:
(1)汽车尾气中NO生成过程的能量变化如图所示,该反应的热化学方程式为 。
(2)通过NO传感器可检测汽车尾气中NO的含量,其工作原理如图所示。已知可在固体电解质中自由移动。
①电极为 (填“正极”或“负极”)。
②Pt电极的电极反应式为 。
(3)工业上可利用甲烷还原NO减少氮氧化物的排放。向2L恒容密闭容器中通入、,一定条件下发生反应:,测得的物质的量随时间变化的关系如表。
时间/min 0 10 20 30 40 50
0 0.6 1.0 1.3 1.5 1.5
①下列措施能够加快该反应速率的是 (填标号)。
A.使用催化剂 B.升高温度 C.及时分离水 D.充入He增大体系压强
②0~20min内,用NO表示该反应的平均速率为 mol L-1 min-1。
③平衡时,的体积分数为 。
④若反应体系中的初始压强为,则该反应的压强平衡常数 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)溶液在碱性条件下可将烟气中的NO转化成,反应的离子方程式为 。
3.(23-24高三上·河南周口·阶段练习)四氯化钛是生产金属钛及其化合物的重要中间体,工业上以高钛渣(主要成分为)为原料生产的化学反应原理为 。请回答下列问题:
(1)已知: 、C(s)的燃烧热为,则CO的燃烧热为 。
(2)T℃时,将足量的、C加入某恒容密闭容器中,并通入一定量的和(不参与反应)只发生反应:,测得容器内总压强()和的转化率()随时间的变化关系如图所示:
①T℃时,反应的平衡常数 kPa(为以各组分的平衡分压表示的平衡常数,分压=总压×物质的量分数)。
②保持温度和起始总压相同,若向恒容密闭容器中通入的中不含氮气,与含有氮气相比,的平衡转化率 (填“增大”“减小”或“不变”),其原因为 。
(3)利用先制得,焙烧可获得纳米。用电解法生产钛的原理如图所示。电解过程中,被还原的Ca进一步还原得到钛,用化学用语表示制钛过程: 、 ;石墨电极需要定期更换的原因为 。
4.(2023·湖南衡阳·三模)2023年甲醇作为能源类化工产品备受关注,回答下列问题:
已知:键能为气态分子中化学键解离成气态原子所吸收的能量。相关化学键键能如表所示:
化学键
键能 728 436 354.5 464 358
(1)热催化加氢合成甲醇过程中存在如下反应:
①
②
则反应③:的 。
(2)键、键的键长和键角数值可以通过 实验获得。
(3)①和反应生成,同时分子间脱水生成:
i.
ii.
在、的反应条件下,向密闭容器中充入和各,发生反应i和反应ii,测得平衡时和的物质的量分别为、,反应ii的平衡常数 (以分压表示,分压=总压×气体物质的量分数,保留三位有效数字)。
②如图分别为研究温度和压强(其他条件不变)对反应ii的影响,曲线a为不同温度下达到平衡时甲醇的转化率,曲线b和c分别为不同温度或压强下相同时间内测得反应体系中的甲醇的转化率,结合曲线a分析可知,反应ii的 (填“>”或“<”)0;请用化学反应原理知识解释曲线b变化趋势的原因: ,该反应适宜的温度和压强分别为 。
(4)在合成甲醇有机反应中,的化合物常作催化剂。晶体的密度为,其晶胞结构如图所示,晶胞中所有晶面夹角均为,已知:晶胞参数,,则 (保留两位小数),与其相邻的离子中心的距离有 种。(,摩尔质量取)
5.(22-23高三上·江西·阶段练习)倡导生态文明建设,环境问题一直是我们关注的焦点。运用化学反应原理研究氮、碳的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)NO 的氧化反应 2NO(g)+O2 (g)2NO2(g)分两步进行;
I.2NO(g) N2O2 (g) II.N2O2(g+O2(g)2NO2(g)
其反应过程能量变化如图所示:
①决定 NO 氧化反应速率的步骤是 (填“I”或“II”)。
②一定温度下,在刚性密闭容器中,起始充入一定量的 NO2气体(NO2转化为 N2O4忽略不计),此时压强为 26kPa,在 5min达到平衡,此时容器的压强为 36kPa,则 0~5min 用 O2的分压表示反应速率为 kPa/min。该温度下,反应 2NO (g)+O2 (g) 2NO2 (g)的平衡常数 Kp= kPa-1(Kp 是用平衡分压代替平衡浓度计算的平衡常数)。
③恒温恒容条件下,能说明该反应达到平衡状态的是 (填标号)。
A.压强不再变化
B.混合气体的密度不再变化
C.生成 NO 的速率与消耗 NO2的速率相等
D.混合气体的平均相对分子质量不再变化
(2)为了高效利用能源并且减少 CO2的排放,可用下列方法把 CO2转化成乙醇燃料
I.CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
II.CO2 (g)+H2 (g)CO(g)+H2O(g) △H2 =+41.1kJ·mol-1
①反应 I 在 (选填“高温”、“低温”或“任意温度”)下,易自发进行。
研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按 n(CO2):n(H2 )=1:3(总量为 amol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的 CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示 (忽略温度对催化剂的影响)
②根据如图中数据,温度选择 K,达到平衡时,反应体系内甲醇的产量最高。随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,其原因是 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
《2025高考大题闯关---原理综合题练习二》参考答案
1.(1)A
(2)C
(3) =p ,温度不变,平衡常数不变
(4)CD
(5) -1310.4 △H<0 △S>0
(6) 4
(7) y 25% 21.8
(8)
【详解】(1)在2L密闭容器中进行如下反应:,在2s内用X表示的平均反应速率是,则2s内消耗X的物质的量为,根据反应方程式,2s时W增加的物质的量是,故选A;
(2)A.电池放电过程中,阴离子向负极移动,海藻片中向维生素电极迁移,故A正确;
B.放电时负极失电子发生氧化反应,负极反应式为-2e-→+2H+,故B正确;
C.充电时,阳极发生氧化反应生成、阴极发生还原反应生成,总反应为+→+,故C错误;
D.该电池的电压为0.6~0.8V,水电解所需最低电压为1.23V,该电池即使儿童误食也不会导致体内水电解而损害身体,故D正确;
选C。
(3)一定温度下,在体积可变的反应器中充入足量的黄钠铁矾[],发生反应:,达到平衡时压强为,保持温度不变,将体积变为原来的一半,平衡时测得压强为p,,温度不变,平衡常数不变,所以=p。
(4)A.40ml 0.1000的NaOH溶液与20.00mL二元酸溶液恰好完全反应,则的浓度为0.1mol/L;0.1mol/L的H2A的pH=0.1,可知H2A第一步完全电离,则①代表、②代表;故A错误;
B.根据图示c(HA-)=c(A2-)时pH=2,的电离常数,故B错误;
C.根据电荷守恒,滴定过程,,pH=2时c(HA-)=c(A2-),所以,故C正确;
D.的电离常数大于,向溶液中加入少量溶液,发生离子反应:,故D正确;
选CD。
(5)① Ⅰ
Ⅱ
Ⅲ
根据盖斯定律Ⅲ×4-Ⅰ×2-Ⅱ得 (-242×4-165.8×2-10.8)kJ/mol=-1310.4kJ/mol。
②结合化学反应原理分析,(l)作推近剂燃料可与(g)自发进行反应的原因是△H<0、△S>0。
(6)根据图示,该历程分4步进行;活化能越多反应速率越慢,慢反应决定总反应速率,第一步反应活化能最大,第一步是决速步,对应的反应方程式为。
(7)①反应b正反应放热,随温度升高,平衡逆向移动,平衡常数减小,能表示反应b的曲线为y,反应a的标准压强平衡常数表达式。
②维持温度下,往恒容密闭容器中通入、、的物质的量均为amol,初始压强为120kPa,达平衡时体系压强为140kPa,则反应后气体的总物质的量为3.5amol,可知发生反应a气体物质的量增加0.5amol,设反应消耗甲烷的物质的量为xmol,
x=0.25amol,该温度下的平衡转化率为,反应a消耗0.25amol甲烷、消耗0.25amol二氧化碳、生成0.5amolCO、生成0.25amol H2;设反应消耗水bmol,则容器中CO的物质的量为(0.5a-b)mol、H2O的物质的量为(a-b)mol、CO2的物质的量为(a-0.25a+b)mol=(0.75a+b)mol、H2的物质的量为(0.5a+b)mol。根据图像可知温度下,反应b得标准压强平衡常数为1,则,解得b=0.04545amol,则氢气的物质的量为(0.5a+0.04545a)mol=0.54545amol,的平衡分压为kPa。
(8)根据图示,甲烷在Ni-YSZ电极发生氧化反应生成氢气和二氧化碳,则Ni-YSZ电极阳极、Ni电极是阴极,Ni电极上的电极反应式为。
2.(1)N2(g)+O2(g)=2NO(g) =+180kJ/mol
(2) 负极 O2+4e-=2O2-
(3) AB 0.05 25%
(4)3+4NO+4OH-=4+3Cl-+2H2O
【详解】(1)由示意图可知,1molN2和1mol O2完全反应断键共吸收1444kJ能量,生成2molNO成键共放出1264kJ能量,故反应吸收能量180kJ,该反应的热化学方程式为:N2(g)+O2(g)=2NO(g) =+180kJ/mol。
(2)①由图可知该传感器是原电池,NO在NiO电极失电子变为NO2,NiO电极为负极;
②由图可知,O2在Pt电极得电子变为O2-,电极反应式为:O2+4e-=2O2-。
(3)①A.使用催化剂能降低反应的活化能,增大反应速率,故A选;
B.升高温度能增大反应速率,故B选;
C.及时分离水,反应物浓度减小,反应速率减小,故C不选;
D.充入He增大体系压强,反应物和生成物的浓度不变,反应速率不变,故D不选;
故答案为AB;
②0~20min内,用NO表示该反应的平均速率为v(NO)=2v(H2O)= =0.05 mol L-1 min-1;
③根据已知条件列出“三段式”
平衡时,的体积分数为=25%;
④若反应体系中的初始压强为,则初始总压为p+2p=3p,该反应是气体体积不变的反应,则平衡时总压为3p,该反应的压强平衡常数=。
(4)溶液在碱性条件下可将烟气中的NO转化成,根据得失电子守恒和电荷守恒配平离子方程式为:3+4NO+4OH-=4+3Cl-+2H2O。
3.(1)-283
(2) 1458 减小 保持总压不变,不含氮气时,相当于增大压强,平衡逆向移动
(3) 阳极生成的会氧化石墨电极
【详解】(1)①;
②;
③;
根据盖斯定律,得:;
(2)①设起始有xmol和ymol,起始压强为80kPa,平衡时总压强为98kPa,的转化率为90%,反应氯气0.9xmol,则平衡时有0.1xmol氯气,0.9xmol一氧化碳,0.45xmol四氯化钛,ymol氮气,共有1.45xmol+ymol,恒温恒容,压强之比等于物质的量之比,总的物质的量增加0.45xmol、压强增加18mol,则可得,平衡时氯气、一氧化碳、四氯化钛分压分别为、、,该反应的平衡常数;
②保持温度和起始总压相同,若向恒容密闭容器中通入的中不含氮气,与含有氮气相比,的平衡转化率减小,原因:保持总压不变,不含氮气时,相当于增大压强,平衡逆向移动;
(3)电解过程中,被还原的Ca进一步还原得到钛,即:、;反应过程中阳极生成的氧气会氧化石墨,导致石墨电极需要定期更换。
4.(1)
(2)X射线衍射
(3) 10.7 温度低于时,该反应未达到平衡状态,温度升高,反应速率加快,转化率升高;温度高于时,该反应达到平衡状态,温度升高,平衡逆向移动,转化率下降 、()
(4) 486.25 2
【详解】(1)反应物总键能-生成物总键能,故,结合三个方程式可知,反应①可由反应②和反应③相加得到,所以。故答案为:;
(2)键、键的键长和键角数值可以通过X射线衍射实验获得。故答案为:X射线衍射;
(3)①i.
ii.
平衡时,,,,反应ii的分压平衡常数。故答案为:10.7;
②由图可知,随温度升高甲醇的转化率下降,说明升温时反应ii平衡逆向移向,则正反应为放热反应,;由图可知温度低于时,该反应未达到平衡状态,温度升高,反应速率加快,转化率升高;温度高于时,该反应达到平衡状态,温度升高,平衡逆向移动,转化率下降。未达平衡时,压强增大,反应速率加快、转化率升高,结合图像及实际生产中设备、成本、能耗等因素,适宜的压强为。综上所述,适宜的条件为、。故答案为:<;温度低于时,该反应未达到平衡状态,温度升高,反应速率加快,转化率升高;温度高于时,该反应达到平衡状态,温度升高,平衡逆向移动,转化率下降;、();
(4),解得,,由图可知,与其相邻的离子中心的距离有2种。故答案为:486.25;2。
5.(1) I 2 0.009 AD
(2) 低温 553 当温度升高时,反应I平衡逆向移动,而反应II平衡正向移动且幅度更大
【详解】(1)①由能量变化图可以看出,第I步活化能较大,反应速率较慢,因此决定NO氧化反应速率的步骤是I;理由是反应I的活化能大;
②设反应进行过程中O2的压强增加为x,因为是刚性容器,可利用压强建立三段式:
从而得出:2x+x+26-2x=36 x=10kPa;
则 0~5min 用 O2 的分压表示反应速率为=2 kPa/min。该温度下,反应 2NO (g)+O2 (g) 2NO2 (g)的平衡常数 Kp= kPa-1=0.009kPa-1;
③A.因为反应前后气体的分子数不等,所以在平衡移动的过程中压强发生不断改变,当压强不再变化时,反应达平衡状态,选项A符合题意;
B.在反应过程中,混合气体的质量不变,气体的体积不变,混合气体的密度始终不变,所以密度不变时反应不一定达平衡状态,选项B不符合题意;
C.生成 NO的方向与消耗 NO2 的方向相同,所以速率相等时反应不一定达平衡状态,选项C不符合题意;
D.混合气体质量不变,随着反应的进行,物质的量发生不断改变,平均相对分子质量不断发生改变,当平均相对分子质量不变时,反应达平衡状态,选项D符合题意;
答案选AD;
答案为:I;反应I的活化能大;2;0.009;AD;
(2)①反应 I 为放热反应,则在低温下,易自发进行。
②由反应方程式CO2(g)+3H2(g)CH3OH(g)+H2O(g)可知,生成CH3OH的物质的量等于参加反应的CO2的物质的量。473K时,CO2的平衡转化率为13.2%,甲醇的选择率为86%,则生成CH3OH的物质的量为0.25amol×13.2%×86%=0.02838amol;513K时,CO2的平衡转化率为15%,甲醇的选择率为78%,则生成CH3OH的物质的量为0.25amol×15%×78%=0.02925amol;553K时,CO2的平衡转化率为21%,甲醇的选择率为60%,则生成CH3OH的物质的量为0.25amol×21%×60%=0.0315amol,由此可得,温度选择553K,达到平衡时,反应体系内甲醇的产量最高。因为反应I为放热反应,而反应II为吸热反应,且反应II对CO2的转化起主导地位,所以随着温度的升高,CO2 的平衡转化率增加但甲醇的选择率降低,其原因是当温度升高时,反应I平衡逆向移动,而反应II平衡正向移动且幅度更大。答案为:低温;553;当温度升高时,反应I平衡逆向移动,而反应II平衡正向移动且幅度更大。
答案第1页,共2页
答案第1页,共2页
