1.2 课时1原电池的工作原理 练习(含解析) 2024-2025学年高二化学苏教版(2019)选择性必修第一册
文档属性
| 名称 | 1.2 课时1原电池的工作原理 练习(含解析) 2024-2025学年高二化学苏教版(2019)选择性必修第一册 |
|
|
| 格式 | docx | ||
| 文件大小 | 517.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 00:00:00 | ||
图片预览


文档简介
课时1 原电池的工作原理
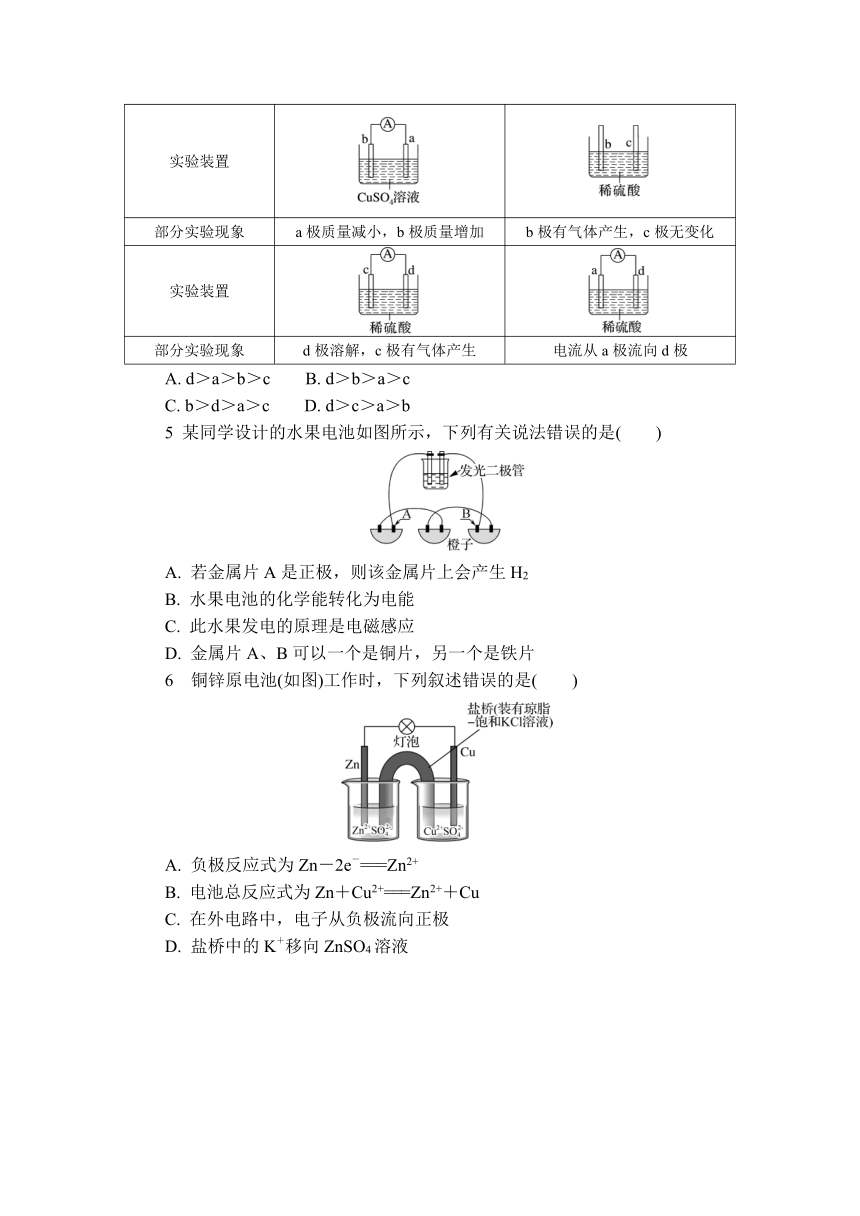
1 下列装置中,电流表指针不能发生偏转的是( )
A B
C D
2 用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂 KNO3的U形管)构成一个原电池。下列有关该原电池的叙述正确的是( )
①铜电极的质量减少 ②正极反应为Ag++e-===Ag ③在外电路中,电流由铜电极流向银电极 ④实验过程中取出盐桥,原电池仍继续工作
A. ①② B. ②③ C. ②④ D. ③④
3 如图所示的原电池装置,X、Y为两个电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,下列关于此装置的叙述正确的是( )
A. 外电路中的电流方向为X→外电路→Y
B. 若两个电极分别为Zn和碳棒,则X为碳棒,Y为Zn
C. 若两个电极都是金属,则它们的活动性顺序为X>Y
D. X极上发生的是还原反应,Y极上发生的是氧化反应
4 有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如表。由此可判断这四种金属的活动性顺序是( )
实验装置
部分实验现象 a极质量减小,b极质量增加 b极有气体产生,c极无变化
实验装置
部分实验现象 d极溶解,c极有气体产生 电流从a极流向d极
A. d>a>b>c B. d>b>a>c
C. b>d>a>c D. d>c>a>b
5 某同学设计的水果电池如图所示,下列有关说法错误的是( )
A. 若金属片A是正极,则该金属片上会产生H2
B. 水果电池的化学能转化为电能
C. 此水果发电的原理是电磁感应
D. 金属片A、B可以一个是铜片,另一个是铁片
6 铜锌原电池(如图)工作时,下列叙述错误的是( )
A. 负极反应式为Zn-2e-===Zn2+
B. 电池总反应式为Zn+Cu2+===Zn2++Cu
C. 在外电路中,电子从负极流向正极
D. 盐桥中的K+移向ZnSO4溶液
7 某课外活动小组设计的用化学电源使LED灯发光的装置如图所示。下列说法不正确的是( )
A. 电子的流动方向:锌片→LED灯→铜片
B. 锌片上发生的电极反应式为Zn-2e-===Zn2+
C. 如果将稀硫酸换成柠檬汁,则LED灯不发光
D. 溶液中H+移向铜片
8 某化学兴趣小组利用反应Zn+2FeCl3===ZnCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( )
A. a为负极,发生还原反应
B. b电极反应式为2Fe3++2e-===2Fe2+
C. 电子流动方向是a电极→FeCl3溶液→b电极
D. 电池的正极材料可以选用石墨、铂电极,也可以用铜电极
9 锂电池是一代新型高能电池,它以质量轻、能量高而被重视,目前已研制成功多种锂电池。某种锂电池的总反应方程式为Li+MnO2===LiMnO2,下列说法正确的是( )
A. Li是正极,电极反应式为Li-e-===Li+
B. Li是负极,电极反应式为Li-e-===Li+
C. MnO2是负极,电极反应式为MnO2+e-===MnO
D. Li是负极,电极反应式为Li-2e-===Li2+
10 热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiClKCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。下列有关说法不正确的是( )
A. 正极反应式为PbSO4+2e-+2Li+===Li2SO4+Pb
B. 放电过程中,Li+向PbSO4电极移动
C. 每转移0.2 mol电子,理论上生成20.7 g Pb
D. 放电时,电子由Ca电极流出经LiClKCl混合物到达硫酸铅电极
11 结合下图判断,下列叙述不正确的是( )
Ⅰ Ⅱ
A. Ⅰ、Ⅱ的反应原理均是Zn+Cu2+===Zn2++Cu
B. Ⅰ、Ⅱ中均有电子转移,均是把化学能转化为电能
C. 随着反应的进行,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅
D. 取a中溶液,加足量Ba(NO3)2溶液,过滤后向滤液中加AgNO3溶液,有白色沉淀产生
12 现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图所示),每次实验时,通过灵敏电流计测出电子流动方向如下表所示。
实验分组 所用金属 电子流向
① A、Cu A→Cu
② C、D D→C
③ A、C C→A
④ B、Cu Cu→B
⑤ … …
根据上述情况,回答下列问题。
(1) 上述五种金属的活动性顺序:_____________________________________。
(2) 在①中,Cu片上观察到的现象是________________。
(3) 在②中,溶液中H+向金属片________移动。
(4) 如果实验⑤用B、D,则导线中电流方向为________(填“B→D”或“D→B”)。
(5) 已知反应:Cu+2Fe3+===Cu2++2Fe2+。请用下列试剂和材料,用题图所示装置,将此反应设计成原电池。
试剂:CuCl2溶液、FeCl3溶液、FeCl2溶液、KSCN溶液、双氧水、NaOH溶液。材料:Cu片、Fe片、石墨棒。
设计电池应选用的试剂和材料是__________________________。
13 某原电池装置如图所示。
请回答下列问题。
(1) 若溶液C为稀硫酸,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为__________________;反应进行一段时间后溶液C的pH将________(填“升高”“降低”或“基本不变”)。
(2) 若C为CuCl2溶液,Zn是________极,Cu极发生____________反应,电极反应式为______________________________。反应过程溶液中c(Cu2+)________
(填“变大”“变小”或“不变”)。
14 某探究活动小组想利用原电池反应检测金属的活动性顺序,甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入 6 mol/L 稀硫酸中,乙同学将电极放入 6 mol/L NaOH溶液中,如图所示。
(1) 写出甲池中发生的有关电极反应式:
负极______________________________________________________________,
正极______________________________________________________________。
(2) 乙池中负极为________,正极发生________反应。
(3) 如果甲与乙两位同学均认为“构成原电池的电极材料若是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________(填元素符号,下同)活动性更强,而乙会判断出________活动性更强。
(4) 由此实验分析,下列结论正确的是________(填字母)。
A. 利用原电池反应判断金属活动性顺序应注意选择合适的介质
B. 镁的金属性不一定比铝的金属性强
C. 该实验说明金属活动性顺序表已过时,已没有实用价值
D. 该实验说明化学研究对象复杂,反应条件多变,应具体问题具体分析
课时1 原电池的工作原理
1. A 锌插入氯化铜溶液,锌置换出铜,电子不经过导线,没有电流产生,则电流表指针不发生偏转,A符合题意;镁为负极,铝为正极,可构成原电池,电流表指针发生偏转,B不符合题意;锌为负极,铜为正极,可构成原电池,电流表指针发生偏转,C不符合题意;锌为负极,铜为正极,可构成原电池,电流表指针发生偏转,D不符合题意。
2. A 金属活动性:Cu>Ag,Cu为负极,失去电子,Cu-2e-===Cu2+,①正确;Ag为正极,得到电子,Ag++e-===Ag,②正确;电子由铜电极经外电路流向银电极,电流由银电极流向铜电极,③错误;取出盐桥不能形成闭合回路,不能构成原电池,④错误。故选A。
3. C 外电路的电子流向为X→外电路→Y,则电流流向为Y→外电路→X,A错误;若两个电极分别为Zn和碳棒,则Zn作负极,X为Zn,Y为碳棒,B错误;若两个电极都是金属,则活动性:X>Y,C正确;X极失去电子,发生氧化反应,Y极得到电子,发生还原反应,D错误。
4. A 由第一个装置a极质量减小可知,a极是负极,金属活动性:a>b;第二个装置依据氧化性、还原性的规律推出金属活动性:b>c;第三个装置的金属活动性:d>c;由第四个装置电流a→d,则电子d→a,故金属活动性:d>a。综上所述,这四种金属的活动性顺序是d>a>b>c。故选A。
5. C
6. D 金属性锌强于铜,锌是负极,负极反应式为Zn-2e-===Zn2+,A正确;铜是正极,Cu2+得到电子,电池总反应为Zn+Cu2+===Zn2++Cu,B正确;负极失去电子,在外电路中,电子从负极流向正极,C正确;原电池中阳离子移向正极,所以盐桥中的K+移向CuSO4溶液,D错误。
7. C 原电池中电子由负极锌电极流出,经LED灯再流向正极铜电极,A正确; 该原电池中,锌片作负极,电极反应式为Zn-2e-===Zn2+,B正确;柠檬汁可以导电,能作电解质溶液,将稀硫酸换成柠檬汁仍然能构成原电池,所以LED灯能发光,C错误;原电池中阳离子H+移向正极铜片,D正确。
8. D 根据Cl-的移动方向可知,b电极为负极,a电极为正极,根据电池反应式可知,Zn发生失电子的氧化反应,即b电极反应式为Zn-2e-===Zn2+,A、B错误;电子流动方向是b电极→导线→a电极,C错误;正极材料的活泼性应比负极材料弱,D正确。
9. B 根据锂电池的总反应式Li+MnO2===LiMnO2,失电子的金属Li为负极,电极反应式为Li-e-===Li+,A、D错误,B正确;MnO2是正极,电极反应式为MnO2+e-===MnO,C错误。
10. D 正极发生还原反应:PbSO4+2e-+2Li+===Li2SO4+Pb,A正确;放电过程中,Li+向正极移动,B正确;每转移0.2 mol电子,理论上生成0.1 mol Pb,质量为0.1 mol×207 g/mol=20.7 g,C正确;放电时,电子由Ca电极流出经外电路达硫酸铅电极,D错误。
11. B Ⅰ中发生的是化学反应,没有电能产生,Ⅱ中发生的是电化学反应,化学能转化为电能,但二者的反应原理都是Zn+Cu2+===Zn2++Cu,A正确,B错误;随着反应的进行,Ⅰ、Ⅱ中c(Cu2+)逐渐减小,溶液颜色均渐渐变浅,C正确;在原电池工作过程中,盐桥中的Cl-移向负极,即a中溶液含有Cl-,故取a中溶液,加足量Ba(NO3)2溶液,过滤后向滤液中加AgNO3溶液,有AgCl沉淀产生,D正确。
12. (1) D>C>A>Cu>B
(2) 有无色气泡生成
(3) C (4) B→D
(5) FeCl3溶液、Cu片、石墨棒
13. (1) 2H++2e-===H2↑ 升高
(2) 负 还原 Cu2++2e-===Cu 变小
14. (1) Mg-2e-===Mg2+ 2H++2e-===H2↑ (2) Al 还原 (3) Mg Al (4) AD
1 下列装置中,电流表指针不能发生偏转的是( )
A B
C D
2 用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂 KNO3的U形管)构成一个原电池。下列有关该原电池的叙述正确的是( )
①铜电极的质量减少 ②正极反应为Ag++e-===Ag ③在外电路中,电流由铜电极流向银电极 ④实验过程中取出盐桥,原电池仍继续工作
A. ①② B. ②③ C. ②④ D. ③④
3 如图所示的原电池装置,X、Y为两个电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,下列关于此装置的叙述正确的是( )
A. 外电路中的电流方向为X→外电路→Y
B. 若两个电极分别为Zn和碳棒,则X为碳棒,Y为Zn
C. 若两个电极都是金属,则它们的活动性顺序为X>Y
D. X极上发生的是还原反应,Y极上发生的是氧化反应
4 有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如表。由此可判断这四种金属的活动性顺序是( )
实验装置
部分实验现象 a极质量减小,b极质量增加 b极有气体产生,c极无变化
实验装置
部分实验现象 d极溶解,c极有气体产生 电流从a极流向d极
A. d>a>b>c B. d>b>a>c
C. b>d>a>c D. d>c>a>b
5 某同学设计的水果电池如图所示,下列有关说法错误的是( )
A. 若金属片A是正极,则该金属片上会产生H2
B. 水果电池的化学能转化为电能
C. 此水果发电的原理是电磁感应
D. 金属片A、B可以一个是铜片,另一个是铁片
6 铜锌原电池(如图)工作时,下列叙述错误的是( )
A. 负极反应式为Zn-2e-===Zn2+
B. 电池总反应式为Zn+Cu2+===Zn2++Cu
C. 在外电路中,电子从负极流向正极
D. 盐桥中的K+移向ZnSO4溶液
7 某课外活动小组设计的用化学电源使LED灯发光的装置如图所示。下列说法不正确的是( )
A. 电子的流动方向:锌片→LED灯→铜片
B. 锌片上发生的电极反应式为Zn-2e-===Zn2+
C. 如果将稀硫酸换成柠檬汁,则LED灯不发光
D. 溶液中H+移向铜片
8 某化学兴趣小组利用反应Zn+2FeCl3===ZnCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( )
A. a为负极,发生还原反应
B. b电极反应式为2Fe3++2e-===2Fe2+
C. 电子流动方向是a电极→FeCl3溶液→b电极
D. 电池的正极材料可以选用石墨、铂电极,也可以用铜电极
9 锂电池是一代新型高能电池,它以质量轻、能量高而被重视,目前已研制成功多种锂电池。某种锂电池的总反应方程式为Li+MnO2===LiMnO2,下列说法正确的是( )
A. Li是正极,电极反应式为Li-e-===Li+
B. Li是负极,电极反应式为Li-e-===Li+
C. MnO2是负极,电极反应式为MnO2+e-===MnO
D. Li是负极,电极反应式为Li-2e-===Li2+
10 热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiClKCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。下列有关说法不正确的是( )
A. 正极反应式为PbSO4+2e-+2Li+===Li2SO4+Pb
B. 放电过程中,Li+向PbSO4电极移动
C. 每转移0.2 mol电子,理论上生成20.7 g Pb
D. 放电时,电子由Ca电极流出经LiClKCl混合物到达硫酸铅电极
11 结合下图判断,下列叙述不正确的是( )
Ⅰ Ⅱ
A. Ⅰ、Ⅱ的反应原理均是Zn+Cu2+===Zn2++Cu
B. Ⅰ、Ⅱ中均有电子转移,均是把化学能转化为电能
C. 随着反应的进行,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅
D. 取a中溶液,加足量Ba(NO3)2溶液,过滤后向滤液中加AgNO3溶液,有白色沉淀产生
12 现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图所示),每次实验时,通过灵敏电流计测出电子流动方向如下表所示。
实验分组 所用金属 电子流向
① A、Cu A→Cu
② C、D D→C
③ A、C C→A
④ B、Cu Cu→B
⑤ … …
根据上述情况,回答下列问题。
(1) 上述五种金属的活动性顺序:_____________________________________。
(2) 在①中,Cu片上观察到的现象是________________。
(3) 在②中,溶液中H+向金属片________移动。
(4) 如果实验⑤用B、D,则导线中电流方向为________(填“B→D”或“D→B”)。
(5) 已知反应:Cu+2Fe3+===Cu2++2Fe2+。请用下列试剂和材料,用题图所示装置,将此反应设计成原电池。
试剂:CuCl2溶液、FeCl3溶液、FeCl2溶液、KSCN溶液、双氧水、NaOH溶液。材料:Cu片、Fe片、石墨棒。
设计电池应选用的试剂和材料是__________________________。
13 某原电池装置如图所示。
请回答下列问题。
(1) 若溶液C为稀硫酸,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为__________________;反应进行一段时间后溶液C的pH将________(填“升高”“降低”或“基本不变”)。
(2) 若C为CuCl2溶液,Zn是________极,Cu极发生____________反应,电极反应式为______________________________。反应过程溶液中c(Cu2+)________
(填“变大”“变小”或“不变”)。
14 某探究活动小组想利用原电池反应检测金属的活动性顺序,甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入 6 mol/L 稀硫酸中,乙同学将电极放入 6 mol/L NaOH溶液中,如图所示。
(1) 写出甲池中发生的有关电极反应式:
负极______________________________________________________________,
正极______________________________________________________________。
(2) 乙池中负极为________,正极发生________反应。
(3) 如果甲与乙两位同学均认为“构成原电池的电极材料若是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________(填元素符号,下同)活动性更强,而乙会判断出________活动性更强。
(4) 由此实验分析,下列结论正确的是________(填字母)。
A. 利用原电池反应判断金属活动性顺序应注意选择合适的介质
B. 镁的金属性不一定比铝的金属性强
C. 该实验说明金属活动性顺序表已过时,已没有实用价值
D. 该实验说明化学研究对象复杂,反应条件多变,应具体问题具体分析
课时1 原电池的工作原理
1. A 锌插入氯化铜溶液,锌置换出铜,电子不经过导线,没有电流产生,则电流表指针不发生偏转,A符合题意;镁为负极,铝为正极,可构成原电池,电流表指针发生偏转,B不符合题意;锌为负极,铜为正极,可构成原电池,电流表指针发生偏转,C不符合题意;锌为负极,铜为正极,可构成原电池,电流表指针发生偏转,D不符合题意。
2. A 金属活动性:Cu>Ag,Cu为负极,失去电子,Cu-2e-===Cu2+,①正确;Ag为正极,得到电子,Ag++e-===Ag,②正确;电子由铜电极经外电路流向银电极,电流由银电极流向铜电极,③错误;取出盐桥不能形成闭合回路,不能构成原电池,④错误。故选A。
3. C 外电路的电子流向为X→外电路→Y,则电流流向为Y→外电路→X,A错误;若两个电极分别为Zn和碳棒,则Zn作负极,X为Zn,Y为碳棒,B错误;若两个电极都是金属,则活动性:X>Y,C正确;X极失去电子,发生氧化反应,Y极得到电子,发生还原反应,D错误。
4. A 由第一个装置a极质量减小可知,a极是负极,金属活动性:a>b;第二个装置依据氧化性、还原性的规律推出金属活动性:b>c;第三个装置的金属活动性:d>c;由第四个装置电流a→d,则电子d→a,故金属活动性:d>a。综上所述,这四种金属的活动性顺序是d>a>b>c。故选A。
5. C
6. D 金属性锌强于铜,锌是负极,负极反应式为Zn-2e-===Zn2+,A正确;铜是正极,Cu2+得到电子,电池总反应为Zn+Cu2+===Zn2++Cu,B正确;负极失去电子,在外电路中,电子从负极流向正极,C正确;原电池中阳离子移向正极,所以盐桥中的K+移向CuSO4溶液,D错误。
7. C 原电池中电子由负极锌电极流出,经LED灯再流向正极铜电极,A正确; 该原电池中,锌片作负极,电极反应式为Zn-2e-===Zn2+,B正确;柠檬汁可以导电,能作电解质溶液,将稀硫酸换成柠檬汁仍然能构成原电池,所以LED灯能发光,C错误;原电池中阳离子H+移向正极铜片,D正确。
8. D 根据Cl-的移动方向可知,b电极为负极,a电极为正极,根据电池反应式可知,Zn发生失电子的氧化反应,即b电极反应式为Zn-2e-===Zn2+,A、B错误;电子流动方向是b电极→导线→a电极,C错误;正极材料的活泼性应比负极材料弱,D正确。
9. B 根据锂电池的总反应式Li+MnO2===LiMnO2,失电子的金属Li为负极,电极反应式为Li-e-===Li+,A、D错误,B正确;MnO2是正极,电极反应式为MnO2+e-===MnO,C错误。
10. D 正极发生还原反应:PbSO4+2e-+2Li+===Li2SO4+Pb,A正确;放电过程中,Li+向正极移动,B正确;每转移0.2 mol电子,理论上生成0.1 mol Pb,质量为0.1 mol×207 g/mol=20.7 g,C正确;放电时,电子由Ca电极流出经外电路达硫酸铅电极,D错误。
11. B Ⅰ中发生的是化学反应,没有电能产生,Ⅱ中发生的是电化学反应,化学能转化为电能,但二者的反应原理都是Zn+Cu2+===Zn2++Cu,A正确,B错误;随着反应的进行,Ⅰ、Ⅱ中c(Cu2+)逐渐减小,溶液颜色均渐渐变浅,C正确;在原电池工作过程中,盐桥中的Cl-移向负极,即a中溶液含有Cl-,故取a中溶液,加足量Ba(NO3)2溶液,过滤后向滤液中加AgNO3溶液,有AgCl沉淀产生,D正确。
12. (1) D>C>A>Cu>B
(2) 有无色气泡生成
(3) C (4) B→D
(5) FeCl3溶液、Cu片、石墨棒
13. (1) 2H++2e-===H2↑ 升高
(2) 负 还原 Cu2++2e-===Cu 变小
14. (1) Mg-2e-===Mg2+ 2H++2e-===H2↑ (2) Al 还原 (3) Mg Al (4) AD
