1.2 课时3电解池的工作原理及应用 练习(含解析) 2024-2025学年高二化学苏教版(2019)选择性必修第一册
文档属性
| 名称 | 1.2 课时3电解池的工作原理及应用 练习(含解析) 2024-2025学年高二化学苏教版(2019)选择性必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 788.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 20:40:05 | ||
图片预览



文档简介
课时3 电解池的工作原理及应用
1 下列化工生产原理错误的是( )
①可以用电解熔融氯化钠的方法来制取金属钠 ②将钠加入氯化镁饱和溶液中制取镁 ③用电解法冶炼铝时,原料可选用氯化铝 ④湿法炼铜是用锌和硫酸铜溶液反应置换出铜
A. ②③ B. ①③
C. ①②③ D. ②③④
2 在日常生活中,很多物品都离不开电镀,现将一块铜牌镀上一层银,装置如图所示,下列说法正确的是( )
A. 银片与电源的正极相连
B. 电镀一段时间后,AgNO3溶液的浓度会变小
C. 阴极的电极反应式为Cu-2e-===Cu2+
D. 反应一段时间后,将电源反接,铜牌可以恢复到原来的状态
3 下图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法正确的是( )
A. 从E口逸出的气体是Cl2
B. 每生成22.4 L Cl2,同时产生2 mol NaOH
C. 从B口加入含少量NaOH的水溶液以增强导电性
D. 依次用Na2CO3、NaOH、BaCl2、盐酸等试剂除去粗盐水中Ca2+、Mg2+、Fe3+、SO等离子
4 [2024南通启东期中]电解原理具有广泛的应用。下列装置不正确的是( )
甲 乙 丙 丁
A. 用装置甲制取Cl2和NaOH溶液
B. 用装置乙在金属制品表面镀银
C. 用装置丙电解精炼粗铜
D. 用装置丁制取Na
5 [2024苏州期末]电解法制备H2O2的装置如图所示。下列说法正确的是( )
A. 该装置工作时将化学能转化为电能
B. 电极b与电源负极相连接
C. 电解时a极电极反应式:O2+2e-+2H+===H2O2
D. 电解生成2 mol H2O2时,理论上有4 mol H+从a极室通过质子交换膜进入b极室
6 [2024徐州期末]我国科研工作者提出“铁铜(FeCu)双原子催化硝酸盐法”制氨,装置如题图所示。下列叙述正确的是( )
A. 直流电源的b极为负极
B. FeCu极的电极反应为NO+6H2O+8e-===NH3↑+9OH-
C. 电解一段时间后,阳极区溶液pH不变
D. 每生成4.48 L O2,有0.4 mol SO向FeCu极迁移
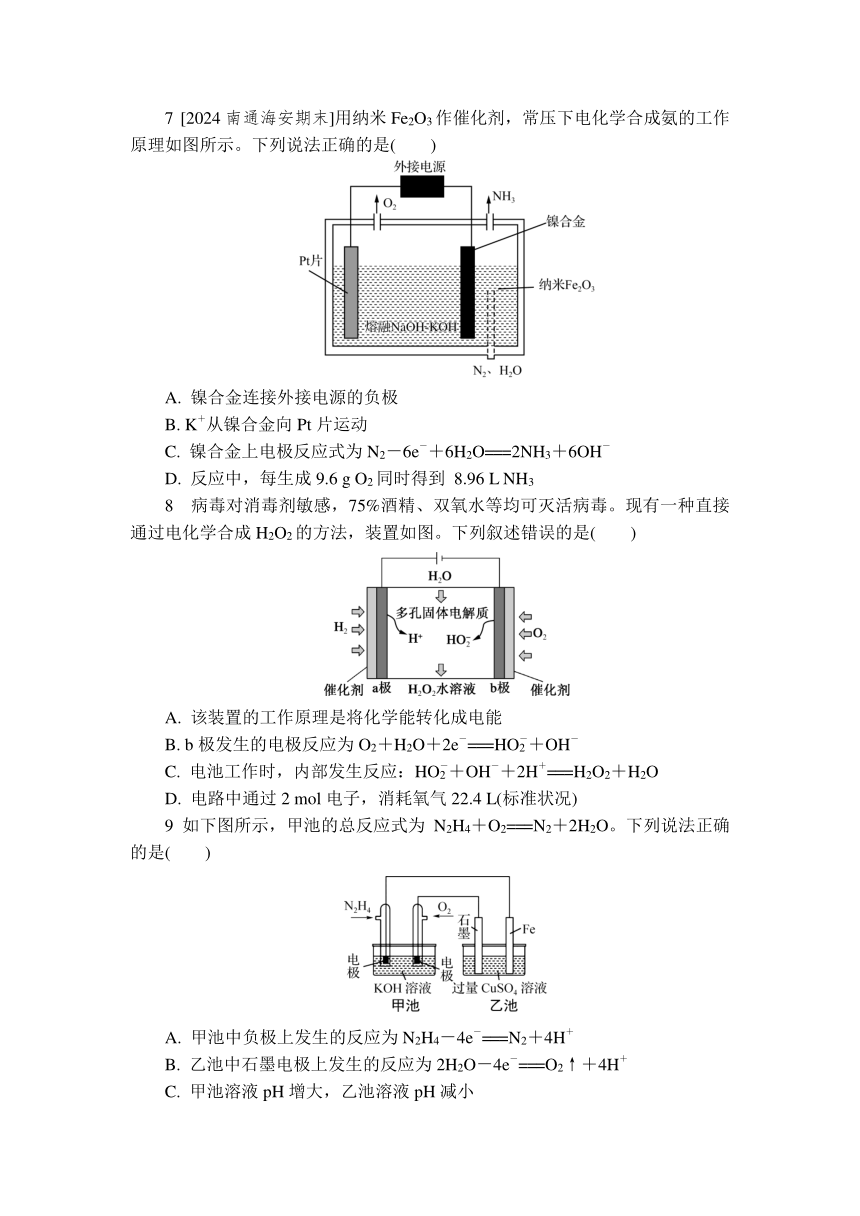
7 [2024南通海安期末]用纳米Fe2O3作催化剂,常压下电化学合成氨的工作原理如图所示。下列说法正确的是( )
A. 镍合金连接外接电源的负极
B. K+从镍合金向Pt片运动
C. 镍合金上电极反应式为N2-6e-+6H2O===2NH3+6OH-
D. 反应中,每生成9.6 g O2同时得到 8.96 L NH3
8 病毒对消毒剂敏感,75%酒精、双氧水等均可灭活病毒。现有一种直接通过电化学合成H2O2的方法,装置如图。下列叙述错误的是( )
A. 该装置的工作原理是将化学能转化成电能
B. b极发生的电极反应为O2+H2O+2e-===HO+OH-
C. 电池工作时,内部发生反应:HO+OH-+2H+===H2O2+H2O
D. 电路中通过2 mol电子,消耗氧气22.4 L(标准状况)
9 如下图所示,甲池的总反应式为N2H4+O2===N2+2H2O。下列说法正确的是( )
A. 甲池中负极上发生的反应为N2H4-4e-===N2+4H+
B. 乙池中石墨电极上发生的反应为2H2O-4e-===O2↑+4H+
C. 甲池溶液pH增大,乙池溶液pH减小
D. 甲池中每消耗0.1 mol N2H4,乙池电极上则会析出6.4 g 固体
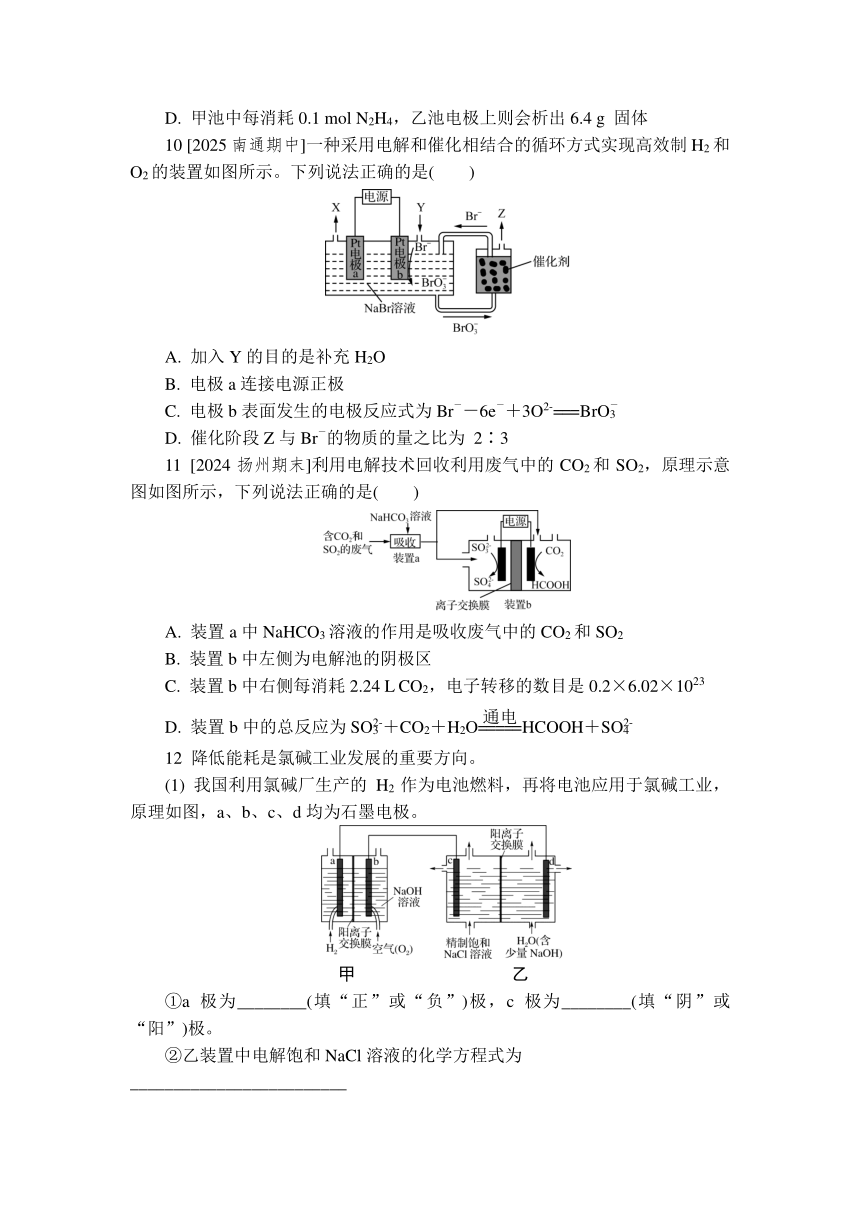
10 [2025南通期中]一种采用电解和催化相结合的循环方式实现高效制H2和O2的装置如图所示。下列说法正确的是( )
A. 加入Y的目的是补充H2O
B. 电极a连接电源正极
C. 电极b表面发生的电极反应式为Br--6e-+3O2-===BrO
D. 催化阶段Z与Br-的物质的量之比为 2∶3
11 [2024扬州期末]利用电解技术回收利用废气中的CO2和SO2,原理示意图如图所示,下列说法正确的是( )
A. 装置a中NaHCO3溶液的作用是吸收废气中的CO2和SO2
B. 装置b中左侧为电解池的阴极区
C. 装置b中右侧每消耗2.24 L CO2,电子转移的数目是0.2×6.02×1023
D. 装置b中的总反应为SO+CO2+H2OHCOOH+SO
12 降低能耗是氯碱工业发展的重要方向。
(1) 我国利用氯碱厂生产的H2作为电池燃料,再将电池应用于氯碱工业,原理如图,a、b、c、d均为石墨电极。
甲 乙
①a极为________(填“正”或“负”)极,c 极为________(填“阴”或“阳”)极。
②乙装置中电解饱和NaCl溶液的化学方程式为_________________________
______________________________;反应一段时间后,d极产生1 mol气体时,乙装置中转移电子________mol。
③下列说法正确的是________(填字母,下同)。
A. 甲装置可实现化学能向电能的转化
B. 甲装置中Na+透过阳离子交换膜向a极移动
C. 乙装置中c极一侧流出的是浓盐水
④结合电极反应式解释d极区产生NaOH的原因:_______________________
______________________________________________________________________。
⑤实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为________________________________;下列生产措施有利于提高Cl2产量、降低阳极O2含量的是________。
A. 使用Cl-浓度低的食盐水为原料
B. 定期检查并更换阳离子交换膜
C. 停产一段时间后,继续生产
(2) 降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为________________________________________________。
13 某课外活动小组用如图所示装置进行实验,试回答下列问题。
(1) 若开始时开关K与a连接,则B极的电极反应式为____________________
_____________________________。
(2) 若开始时开关K与b极连接,则B极的电极反应式为__________________,总反应的离子方程式为_____________________________________。
(3) 若开始时开关K与b连接,下列说法正确的是________(填字母)。
A. 溶液中Na+向A极移动
B. 从A极处逸出的气体能使湿润的淀粉KI试纸变蓝
C. 反应一段时间后加适量盐酸可恢复到电解前电解质溶液的浓度
D. 若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4) 该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用惰性电极及如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为____________________________________。
②制得的氢氧化钾溶液从出口________(填字母)导出。
14 (1) [2025宿迁期中]电催化CO2合成尿素。向KNO3溶液中通CO2至饱和,在电极上生成CO(NH2)2原理如图所示。
①电极b是电解池________极。
②生成CO(NH2)2的电极反应式是_____________________________________。
(2) [2024连云港期末]工业上可用电解磷铁渣(主要含FeP等)制备FePO4,电解原理如图所示。
①a为直流电源的________极。
②生成FePO4的电极反应式为________________________________________。
(3) [2024苏州期中]电解法合成氨反应装置如图所示:
①写出a极电极反应式:_____________________________________________。
②电解装置中质子交换膜的作用为____________________________________
______________________________________________________________________。
③若b极产生的O2在一定条件下的体积为336 L,a极中通入相同条件下N2的总体积为672 L,则N2的转化率为________%(保留两位有效数字)。
(4) [2025南通期中]采用电解法将CO2转化为HCOO-的工作原理如图所示。
①阳极表面发生的电极反应式为______________________________________。
②若有1 mol H+通过质子交换膜,则两极产生的HCOOH和HCOO-的物质的量之和为________mol。
(5) [2024南京江宁期末]CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,原理如图所示。
①a为电源的________(填“正”或“负”)极。
②电极A的反应式为________________________________________________,电极B生成乙烯和水的反应式为__________________________________________
______________________________________________________________________。
③若生成的乙烯和乙烷的体积比为2∶1,则消耗CH4和CO2的体积比为________。
课时3 电解池的工作原理及应用
1. D 钠是活泼金属,可以用电解熔融氯化钠的方法来制取金属钠,①正确;将钠加入氯化镁溶液中,钠先和水反应生成NaOH,氯化镁会和NaOH发生复分解反应,所以得不到镁单质,应采用电解熔融氯化镁的方法冶炼镁,②错误;氯化铝熔融状态下不导电,故不能用电解熔融氯化铝的方法得到铝,③错误;湿法炼铜是用铁和硫酸铜溶液反应置换出铜,④错误。故选D。
2. A 银片与电源的正极相连,A正确;电镀过程中AgNO3溶液的浓度不变,B错误;铜作阴极,阴极的电极反应式为Ag++e-===Ag,C错误;Cu的活泼性比Ag强,将电源反接,铜牌作阳极,发生的电极反应为Cu-2e-===Cu2+,故铜牌不能恢复到原来的状态,D错误。
3. C 右边是阴极区,电极反应式为2H2O+2e-===H2↑+2OH-,所以从E口逸出的气体是H2,A错误;没有指明温度和压强,无法计算生成22.4 L Cl2的物质的量,B错误;为增强导电性,可从B口加入NaOH(增强导电性)的水溶液,C正确;粗盐提纯所加试剂的顺序中Na2CO3必须在BaCl2的后面,D错误。
4. A 电解饱和NaCl溶液,饱和NaCl溶液应从阳极进入,Cl2在阳极产生,且应选用阳离子交换膜,A错误;在金属制品表面镀银,Ag作阳极,与电源正极相连,金属制品作阴极,与电源负极相连,B正确;粗铜精炼时,粗铜作阳极,与电源正极相连,精铜作阴极,与电源负极相连,C正确;制取金属Na,用惰性电极电解熔融的NaCl,D正确。
5. C 该装置为电解池,工作时将电能转化为化学能,A错误;电极b上水转化为O2,发生氧化反应,作阳极,与电源正极相连,B错误;电解生成 2 mol H2O2时,理论上有4 mol H+从b极室通过质子交换膜进入a极室,D错误。
6. B 由图可知,铁铜电极上NO被还原生成NH3,故铁铜电极为阴极,直流电源的b极为正极,阴极反应式为NO+6H2O+8e-===NH3↑+9OH-,A错误,B正确;石墨电极反应式为4H2O-8e-===2O2↑+8H+,每转移8 mol电子,阴极上产生的8 mol OH-透过阴离子交换膜转移至阳极区与阳极上产生的8 mol H+反应生成水,阳极区原来的n(H+)不变,但溶液中水的量增多,故酸性减弱,溶液pH增大,C错误;未指明是否为标准状况,故无法计算O2的物质的量,SO迁移的物质的量也无法计算,D错误。
7. A 由图可知,Pt电极上OH-失去电子发生氧化反应生成O2:4OH--4e-===O2↑+2H2O,Pt为阳极,镍合金为阴极,阴极上N2得到电子发生还原反应生成NH3:N2+6e-+6H2O===2NH3+6OH-,A正确,C错误;阳离子向阴极移动,B错误;没有指明是在标准状况下,不确定生成的NH3的体积,D错误。
8. A 该装置是电解池,将电能转化为化学能,A错误;b电极为阴极,O2得电子生成HO,电极反应式为O2+H2O+2e-===HO+OH-,B正确;装置中阴极生成HO、OH-,阳极生成H+,所以电池工作时,内部生成的HO、OH-与H+反应生成H2O2和H2O,C正确;b电极为阴极,电极反应式为O2+H2O+2e-===HO+OH-,电路中通过2 mol电子,消耗1 mol O2,标准状况下的体积为22.4 L,D正确。
9. B 分析题图知,甲是燃料电池,乙是电解池,甲池中电解质溶液为氢氧化钾溶液,则负极不可能生成H+,应该是N2H4-4e-+4OH-===N2+4H2O,A错误。乙池中石墨电极是阳极,发生氧化反应,B正确。根据甲池总反应式知反应中生成了水,则氢氧化钾溶液的浓度变小,pH减小;乙池中阴极析出铜,阳极OH-放电,乙池的溶液pH减小,C错误。根据各个电极通过的电量相等知N2H4~2Cu,则甲池中消耗0.1 mol N2H4时,乙池电极上会析出12.8 g铜,D错误。
10. A 由图可知,b极溴元素化合价升高,失电子发生氧化反应,b极为阳极,电极反应式为Br--6e-+3H2O=== BrO+6H+,消耗水,Y为水,A正确;a极为阴极,接电源负极,电极反应式为2H++2e-===H2↑,X为H2,B错误;O2-不能在水溶液中存在,C错误;循环阶段BrO被还原为Br-,同时生成O2,Z为O2,生成 1 mol O2转移 4 mol 电子,消耗1 mol BrO 转移6 mol电子,生成O2与Br-的物质的量之比为6∶4=3∶2,D错误。
11. D NaHCO3溶液能和SO2反应但不能和CO2反应, NaHCO3溶液不能吸收CO2,A错误;电解池中,左侧电极上SO失电子生成SO,该电极上失电子发生氧化反应,为阳极区,B错误;气体状态未知,无法计算转移电子的数目,C错误。
12. (1) ①负 阳 ②2NaCl+2H2O2NaOH+H2↑+Cl2↑ 2 ③A ④2H2O+2e-===H2↑+2OH-,Na+从c极区透过阳离子交换膜进入d极区,与OH-结合生成NaOH
⑤4OH--4e-===O2↑+2H2O B
(2) O2+4e-+2H2O===4OH-
13. (1) Fe-2e-===Fe2+
(2) 2H2O+2e-===H2↑+2OH-
2Cl-+2H2O2OH-+H2↑+Cl2↑
(3) B
(4) ①2H2O-4e-===4H++O2↑ ②D
14. (1) ①阳 ②CO2+2NO+18H++16e-===CO(NH2)2+7H2O
(2) ①正 ②FeP-8e-+4H2O===FePO4+8H+
(3) ①N2+6e-+6H+===2NH3 ②为质子的迁移和输送提供通道,并且阻碍阴、阳两极产物接触 ③33
(4) ①CH3OH+H2O-4e-===HCOOH+4H+ ②0.75 mol
(5) ①负 ②CO2+2e-===CO+O2- 2CH4+2O2--4e-===C2H4+2H2O ④6∶5
1 下列化工生产原理错误的是( )
①可以用电解熔融氯化钠的方法来制取金属钠 ②将钠加入氯化镁饱和溶液中制取镁 ③用电解法冶炼铝时,原料可选用氯化铝 ④湿法炼铜是用锌和硫酸铜溶液反应置换出铜
A. ②③ B. ①③
C. ①②③ D. ②③④
2 在日常生活中,很多物品都离不开电镀,现将一块铜牌镀上一层银,装置如图所示,下列说法正确的是( )
A. 银片与电源的正极相连
B. 电镀一段时间后,AgNO3溶液的浓度会变小
C. 阴极的电极反应式为Cu-2e-===Cu2+
D. 反应一段时间后,将电源反接,铜牌可以恢复到原来的状态
3 下图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法正确的是( )
A. 从E口逸出的气体是Cl2
B. 每生成22.4 L Cl2,同时产生2 mol NaOH
C. 从B口加入含少量NaOH的水溶液以增强导电性
D. 依次用Na2CO3、NaOH、BaCl2、盐酸等试剂除去粗盐水中Ca2+、Mg2+、Fe3+、SO等离子
4 [2024南通启东期中]电解原理具有广泛的应用。下列装置不正确的是( )
甲 乙 丙 丁
A. 用装置甲制取Cl2和NaOH溶液
B. 用装置乙在金属制品表面镀银
C. 用装置丙电解精炼粗铜
D. 用装置丁制取Na
5 [2024苏州期末]电解法制备H2O2的装置如图所示。下列说法正确的是( )
A. 该装置工作时将化学能转化为电能
B. 电极b与电源负极相连接
C. 电解时a极电极反应式:O2+2e-+2H+===H2O2
D. 电解生成2 mol H2O2时,理论上有4 mol H+从a极室通过质子交换膜进入b极室
6 [2024徐州期末]我国科研工作者提出“铁铜(FeCu)双原子催化硝酸盐法”制氨,装置如题图所示。下列叙述正确的是( )
A. 直流电源的b极为负极
B. FeCu极的电极反应为NO+6H2O+8e-===NH3↑+9OH-
C. 电解一段时间后,阳极区溶液pH不变
D. 每生成4.48 L O2,有0.4 mol SO向FeCu极迁移
7 [2024南通海安期末]用纳米Fe2O3作催化剂,常压下电化学合成氨的工作原理如图所示。下列说法正确的是( )
A. 镍合金连接外接电源的负极
B. K+从镍合金向Pt片运动
C. 镍合金上电极反应式为N2-6e-+6H2O===2NH3+6OH-
D. 反应中,每生成9.6 g O2同时得到 8.96 L NH3
8 病毒对消毒剂敏感,75%酒精、双氧水等均可灭活病毒。现有一种直接通过电化学合成H2O2的方法,装置如图。下列叙述错误的是( )
A. 该装置的工作原理是将化学能转化成电能
B. b极发生的电极反应为O2+H2O+2e-===HO+OH-
C. 电池工作时,内部发生反应:HO+OH-+2H+===H2O2+H2O
D. 电路中通过2 mol电子,消耗氧气22.4 L(标准状况)
9 如下图所示,甲池的总反应式为N2H4+O2===N2+2H2O。下列说法正确的是( )
A. 甲池中负极上发生的反应为N2H4-4e-===N2+4H+
B. 乙池中石墨电极上发生的反应为2H2O-4e-===O2↑+4H+
C. 甲池溶液pH增大,乙池溶液pH减小
D. 甲池中每消耗0.1 mol N2H4,乙池电极上则会析出6.4 g 固体
10 [2025南通期中]一种采用电解和催化相结合的循环方式实现高效制H2和O2的装置如图所示。下列说法正确的是( )
A. 加入Y的目的是补充H2O
B. 电极a连接电源正极
C. 电极b表面发生的电极反应式为Br--6e-+3O2-===BrO
D. 催化阶段Z与Br-的物质的量之比为 2∶3
11 [2024扬州期末]利用电解技术回收利用废气中的CO2和SO2,原理示意图如图所示,下列说法正确的是( )
A. 装置a中NaHCO3溶液的作用是吸收废气中的CO2和SO2
B. 装置b中左侧为电解池的阴极区
C. 装置b中右侧每消耗2.24 L CO2,电子转移的数目是0.2×6.02×1023
D. 装置b中的总反应为SO+CO2+H2OHCOOH+SO
12 降低能耗是氯碱工业发展的重要方向。
(1) 我国利用氯碱厂生产的H2作为电池燃料,再将电池应用于氯碱工业,原理如图,a、b、c、d均为石墨电极。
甲 乙
①a极为________(填“正”或“负”)极,c 极为________(填“阴”或“阳”)极。
②乙装置中电解饱和NaCl溶液的化学方程式为_________________________
______________________________;反应一段时间后,d极产生1 mol气体时,乙装置中转移电子________mol。
③下列说法正确的是________(填字母,下同)。
A. 甲装置可实现化学能向电能的转化
B. 甲装置中Na+透过阳离子交换膜向a极移动
C. 乙装置中c极一侧流出的是浓盐水
④结合电极反应式解释d极区产生NaOH的原因:_______________________
______________________________________________________________________。
⑤实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为________________________________;下列生产措施有利于提高Cl2产量、降低阳极O2含量的是________。
A. 使用Cl-浓度低的食盐水为原料
B. 定期检查并更换阳离子交换膜
C. 停产一段时间后,继续生产
(2) 降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为________________________________________________。
13 某课外活动小组用如图所示装置进行实验,试回答下列问题。
(1) 若开始时开关K与a连接,则B极的电极反应式为____________________
_____________________________。
(2) 若开始时开关K与b极连接,则B极的电极反应式为__________________,总反应的离子方程式为_____________________________________。
(3) 若开始时开关K与b连接,下列说法正确的是________(填字母)。
A. 溶液中Na+向A极移动
B. 从A极处逸出的气体能使湿润的淀粉KI试纸变蓝
C. 反应一段时间后加适量盐酸可恢复到电解前电解质溶液的浓度
D. 若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4) 该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用惰性电极及如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为____________________________________。
②制得的氢氧化钾溶液从出口________(填字母)导出。
14 (1) [2025宿迁期中]电催化CO2合成尿素。向KNO3溶液中通CO2至饱和,在电极上生成CO(NH2)2原理如图所示。
①电极b是电解池________极。
②生成CO(NH2)2的电极反应式是_____________________________________。
(2) [2024连云港期末]工业上可用电解磷铁渣(主要含FeP等)制备FePO4,电解原理如图所示。
①a为直流电源的________极。
②生成FePO4的电极反应式为________________________________________。
(3) [2024苏州期中]电解法合成氨反应装置如图所示:
①写出a极电极反应式:_____________________________________________。
②电解装置中质子交换膜的作用为____________________________________
______________________________________________________________________。
③若b极产生的O2在一定条件下的体积为336 L,a极中通入相同条件下N2的总体积为672 L,则N2的转化率为________%(保留两位有效数字)。
(4) [2025南通期中]采用电解法将CO2转化为HCOO-的工作原理如图所示。
①阳极表面发生的电极反应式为______________________________________。
②若有1 mol H+通过质子交换膜,则两极产生的HCOOH和HCOO-的物质的量之和为________mol。
(5) [2024南京江宁期末]CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,原理如图所示。
①a为电源的________(填“正”或“负”)极。
②电极A的反应式为________________________________________________,电极B生成乙烯和水的反应式为__________________________________________
______________________________________________________________________。
③若生成的乙烯和乙烷的体积比为2∶1,则消耗CH4和CO2的体积比为________。
课时3 电解池的工作原理及应用
1. D 钠是活泼金属,可以用电解熔融氯化钠的方法来制取金属钠,①正确;将钠加入氯化镁溶液中,钠先和水反应生成NaOH,氯化镁会和NaOH发生复分解反应,所以得不到镁单质,应采用电解熔融氯化镁的方法冶炼镁,②错误;氯化铝熔融状态下不导电,故不能用电解熔融氯化铝的方法得到铝,③错误;湿法炼铜是用铁和硫酸铜溶液反应置换出铜,④错误。故选D。
2. A 银片与电源的正极相连,A正确;电镀过程中AgNO3溶液的浓度不变,B错误;铜作阴极,阴极的电极反应式为Ag++e-===Ag,C错误;Cu的活泼性比Ag强,将电源反接,铜牌作阳极,发生的电极反应为Cu-2e-===Cu2+,故铜牌不能恢复到原来的状态,D错误。
3. C 右边是阴极区,电极反应式为2H2O+2e-===H2↑+2OH-,所以从E口逸出的气体是H2,A错误;没有指明温度和压强,无法计算生成22.4 L Cl2的物质的量,B错误;为增强导电性,可从B口加入NaOH(增强导电性)的水溶液,C正确;粗盐提纯所加试剂的顺序中Na2CO3必须在BaCl2的后面,D错误。
4. A 电解饱和NaCl溶液,饱和NaCl溶液应从阳极进入,Cl2在阳极产生,且应选用阳离子交换膜,A错误;在金属制品表面镀银,Ag作阳极,与电源正极相连,金属制品作阴极,与电源负极相连,B正确;粗铜精炼时,粗铜作阳极,与电源正极相连,精铜作阴极,与电源负极相连,C正确;制取金属Na,用惰性电极电解熔融的NaCl,D正确。
5. C 该装置为电解池,工作时将电能转化为化学能,A错误;电极b上水转化为O2,发生氧化反应,作阳极,与电源正极相连,B错误;电解生成 2 mol H2O2时,理论上有4 mol H+从b极室通过质子交换膜进入a极室,D错误。
6. B 由图可知,铁铜电极上NO被还原生成NH3,故铁铜电极为阴极,直流电源的b极为正极,阴极反应式为NO+6H2O+8e-===NH3↑+9OH-,A错误,B正确;石墨电极反应式为4H2O-8e-===2O2↑+8H+,每转移8 mol电子,阴极上产生的8 mol OH-透过阴离子交换膜转移至阳极区与阳极上产生的8 mol H+反应生成水,阳极区原来的n(H+)不变,但溶液中水的量增多,故酸性减弱,溶液pH增大,C错误;未指明是否为标准状况,故无法计算O2的物质的量,SO迁移的物质的量也无法计算,D错误。
7. A 由图可知,Pt电极上OH-失去电子发生氧化反应生成O2:4OH--4e-===O2↑+2H2O,Pt为阳极,镍合金为阴极,阴极上N2得到电子发生还原反应生成NH3:N2+6e-+6H2O===2NH3+6OH-,A正确,C错误;阳离子向阴极移动,B错误;没有指明是在标准状况下,不确定生成的NH3的体积,D错误。
8. A 该装置是电解池,将电能转化为化学能,A错误;b电极为阴极,O2得电子生成HO,电极反应式为O2+H2O+2e-===HO+OH-,B正确;装置中阴极生成HO、OH-,阳极生成H+,所以电池工作时,内部生成的HO、OH-与H+反应生成H2O2和H2O,C正确;b电极为阴极,电极反应式为O2+H2O+2e-===HO+OH-,电路中通过2 mol电子,消耗1 mol O2,标准状况下的体积为22.4 L,D正确。
9. B 分析题图知,甲是燃料电池,乙是电解池,甲池中电解质溶液为氢氧化钾溶液,则负极不可能生成H+,应该是N2H4-4e-+4OH-===N2+4H2O,A错误。乙池中石墨电极是阳极,发生氧化反应,B正确。根据甲池总反应式知反应中生成了水,则氢氧化钾溶液的浓度变小,pH减小;乙池中阴极析出铜,阳极OH-放电,乙池的溶液pH减小,C错误。根据各个电极通过的电量相等知N2H4~2Cu,则甲池中消耗0.1 mol N2H4时,乙池电极上会析出12.8 g铜,D错误。
10. A 由图可知,b极溴元素化合价升高,失电子发生氧化反应,b极为阳极,电极反应式为Br--6e-+3H2O=== BrO+6H+,消耗水,Y为水,A正确;a极为阴极,接电源负极,电极反应式为2H++2e-===H2↑,X为H2,B错误;O2-不能在水溶液中存在,C错误;循环阶段BrO被还原为Br-,同时生成O2,Z为O2,生成 1 mol O2转移 4 mol 电子,消耗1 mol BrO 转移6 mol电子,生成O2与Br-的物质的量之比为6∶4=3∶2,D错误。
11. D NaHCO3溶液能和SO2反应但不能和CO2反应, NaHCO3溶液不能吸收CO2,A错误;电解池中,左侧电极上SO失电子生成SO,该电极上失电子发生氧化反应,为阳极区,B错误;气体状态未知,无法计算转移电子的数目,C错误。
12. (1) ①负 阳 ②2NaCl+2H2O2NaOH+H2↑+Cl2↑ 2 ③A ④2H2O+2e-===H2↑+2OH-,Na+从c极区透过阳离子交换膜进入d极区,与OH-结合生成NaOH
⑤4OH--4e-===O2↑+2H2O B
(2) O2+4e-+2H2O===4OH-
13. (1) Fe-2e-===Fe2+
(2) 2H2O+2e-===H2↑+2OH-
2Cl-+2H2O2OH-+H2↑+Cl2↑
(3) B
(4) ①2H2O-4e-===4H++O2↑ ②D
14. (1) ①阳 ②CO2+2NO+18H++16e-===CO(NH2)2+7H2O
(2) ①正 ②FeP-8e-+4H2O===FePO4+8H+
(3) ①N2+6e-+6H+===2NH3 ②为质子的迁移和输送提供通道,并且阻碍阴、阳两极产物接触 ③33
(4) ①CH3OH+H2O-4e-===HCOOH+4H+ ②0.75 mol
(5) ①负 ②CO2+2e-===CO+O2- 2CH4+2O2--4e-===C2H4+2H2O ④6∶5
