全册综合练习(含答案) 2024-2025学年高二化学苏教版(2019)选择性必修第一册
文档属性
| 名称 | 全册综合练习(含答案) 2024-2025学年高二化学苏教版(2019)选择性必修第一册 |  | |
| 格式 | DOCX | ||
| 文件大小 | 601.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 20:57:08 | ||
图片预览


文档简介
综合评价
一、 单项选择题(本题包括13题,每题3分,共39分)
1 下列说法正确的是( )
A. “天问一号”探测器运载火箭使用的燃料液氢是高能清洁燃料
B. “祝融号”火星车的太阳能电池板表面涂层须有很好的反光性
C. “天问一号”选择使用新型SiC增强铝基复合材料的主要依据是其导电性好
D. “火星快车”轨道器上的锂离子蓄电池是一次电池
2 [2024宿迁期末]下列化学反应表示正确的是( )
A. 泡沫灭火器的工作原理:Al3++3HCO===Al(OH)3↓+3CO2↑
B. 甲烷的燃烧:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=+890.3 kJ/mol
C. HCO的水解:HCO+H2O CO+H3O+
D. 将Mg(HCO3)2溶液与过量的NaOH溶液混合:HCO+OH-===CO+H2O
3 下列关于金属腐蚀和防腐的说法错误的是( )
A. 可以在船舶外壳装上锌块,用牺牲阳极法防止金属腐蚀
B. 海上舰艇的腐蚀主要为金属的化学腐蚀
C. 刷防锈漆,使金属与空气、水等物质隔离,可防止金属被腐蚀
D. 外加电流,需要保护的金属作阴极,可以起到保护金属的作用
4 下列叙述不正确的是( )
A. 常温下,NH3(g)+HCl(g)===NH4Cl(s)能够自发进行,则该反应的ΔH<0
B. 需加热才能进行的反应是吸热反应,无需加热就能进行的反应是放热反应
C. C(金刚石,s)===C(石墨,s) ΔH=-1.9 kJ/mol,则石墨比金刚石稳定
D. 常温下,0.1 mol/L CH3COONa溶液加水稀释后,溶液中的值增大
5 [2024无锡期末]根据下列实验操作及现象能得出相应结论的是( )
选项 探究目的 实验方案
A S与C的非金属性强弱 将SO2通入饱和NaHCO3溶液中,产生使澄清石灰水变浑浊的气体
B H2S、H2SO4酸性强弱 将H2S通入CuSO4溶液中,产生黑色沉淀
C SO2是否具有氧化性 将SO2通入Na2S溶液中,产生淡黄色沉淀
D Na2SO3溶液是否变质 向Na2SO3溶液中加入盐酸酸化的Ba(NO3)2溶液,观察是否产生白色沉淀
6 [2025南航苏州附中月考]CH4消除NO2的反应为CH4(g)+2NO2(g) N2(g)+2H2O(g)+CO2(g) ΔH<0。下列说法正确的是( )
A. 该反应中反应物的能量总和小于生成物的能量总和
B. 增大压强(缩小容器容积),化学反应速率加快是因为活化分子百分数变大
C. 反应中生成22.4 L N2,转移电子数目为8×6.02×1023
D. 实际应用中,适当增加CH4的量有利于消除NO2 ,减轻空气污染程度
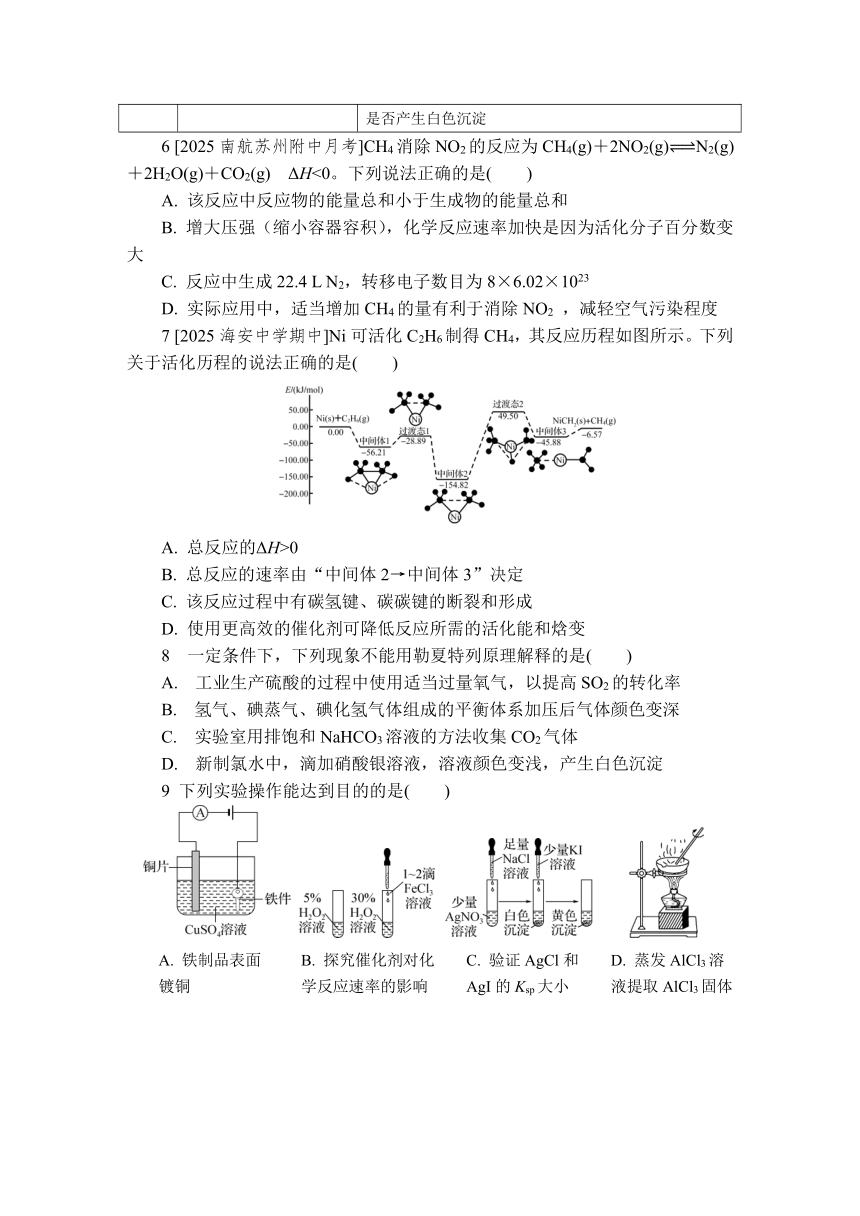
7 [2025海安中学期中]Ni可活化C2H6制得CH4,其反应历程如图所示。下列关于活化历程的说法正确的是( )
A. 总反应的ΔH>0
B. 总反应的速率由“中间体2→中间体3”决定
C. 该反应过程中有碳氢键、碳碳键的断裂和形成
D. 使用更高效的催化剂可降低反应所需的活化能和焓变
8 一定条件下,下列现象不能用勒夏特列原理解释的是( )
A. 工业生产硫酸的过程中使用适当过量氧气,以提高SO2的转化率
B. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后气体颜色变深
C. 实验室用排饱和NaHCO3溶液的方法收集CO2气体
D. 新制氯水中,滴加硝酸银溶液,溶液颜色变浅,产生白色沉淀
9 下列实验操作能达到目的的是( )
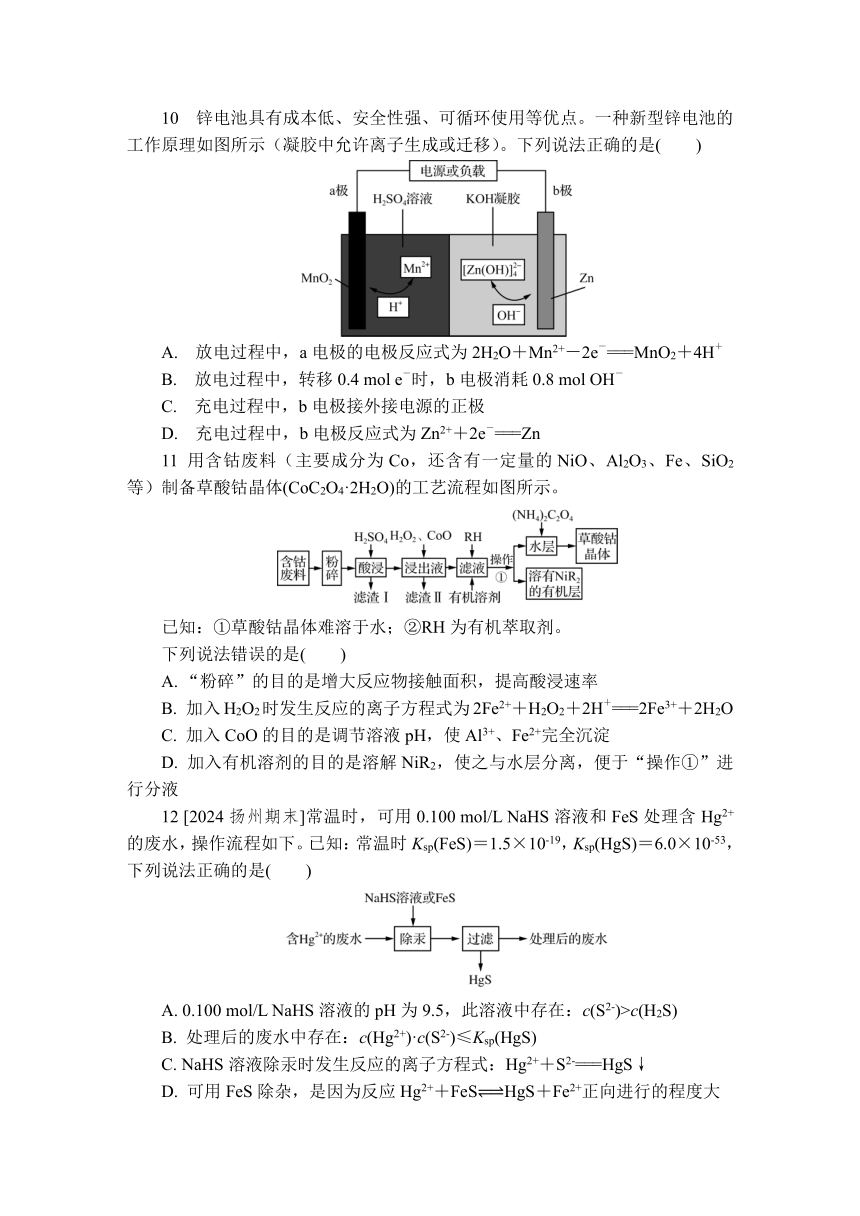
10 锌电池具有成本低、安全性强、可循环使用等优点。一种新型锌电池的工作原理如图所示(凝胶中允许离子生成或迁移)。下列说法正确的是( )
A. 放电过程中,a电极的电极反应式为2H2O+Mn2+-2e-===MnO2+4H+
B. 放电过程中,转移0.4 mol e-时,b电极消耗0.8 mol OH-
C. 充电过程中,b电极接外接电源的正极
D. 充电过程中,b电极反应式为Zn2++2e-===Zn
11 用含钴废料(主要成分为Co,还含有一定量的NiO、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的工艺流程如图所示。
已知:①草酸钴晶体难溶于水;②RH为有机萃取剂。
下列说法错误的是( )
A. “粉碎”的目的是增大反应物接触面积,提高酸浸速率
B. 加入H2O2时发生反应的离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O
C. 加入CoO的目的是调节溶液pH,使Al3+、Fe2+完全沉淀
D. 加入有机溶剂的目的是溶解NiR2,使之与水层分离,便于“操作①”进行分液
12 [2024扬州期末]常温时,可用0.100 mol/L NaHS溶液和FeS处理含Hg2+的废水,操作流程如下。已知:常温时Ksp(FeS)=1.5×10-19,Ksp(HgS)=6.0×10-53,下列说法正确的是( )
A. 0.100 mol/L NaHS溶液的pH为9.5,此溶液中存在:c(S2-)>c(H2S)
B. 处理后的废水中存在:c(Hg2+)·c(S2-)≤Ksp(HgS)
C. NaHS溶液除汞时发生反应的离子方程式:Hg2++S2-===HgS↓
D. 可用FeS除杂,是因为反应Hg2++FeS HgS+Fe2+正向进行的程度大
13 [2024苏州期末]CO2和H2反应得到甲烷的主要反应如下:
CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH=-165 kJ/mol
CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41 kJ/mol
将一定比例CO2和H2混合气体以一定流速通过装有催化剂的反应管,CO2的转化率、CH4的选择性如图所示,下列有关说法不正确的是( )
A. CH4的平衡选择性随温度的升高而增大
B. 320 ℃时,CH4的实际选择性可能高于CH4的平衡选择性
C. 240~300 ℃范围内,CO2转化率增大主要是因为催化剂活性增强
D. 若使用该催化剂,根据测得数据,实际生产中应选择反应温度约为320 ℃
二、 非选择题(本题共4题,共61分)
14 (14分)[2024淮安期末]氢能是能源体系的组成部分,强化制氢、储氢等各个环节的技术研发具有积极的现实意义。
Ⅰ. 制氢
(1) 乙醇 水蒸气催化重整制氢的部分反应过程如图所示:
已知:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41.2 kJ/mol
CH3CH2OH(g)+3H2O(g) 2CO2(g)+6H2(g) ΔH2=+174.1 kJ/mol
①反应Ⅰ:CH3CH2OH(g)+H2O(g) 2CO(g)+4H2(g) ΔH= kJ/mol。
②反应Ⅱ的ΔS (填“>”“<”“=”)0。
③已知:CaO(s)+CO2(g)===CaCO3(s) ΔH=-178.8 kJ/mol。向重整反应体系中加入适量多孔CaO,其优点是_________________________________________
______________________________________________________________________。
(2) 目前全球每年约7 000万吨H2的需求,95%来自化石能源,相当于每年8.3亿吨的CO2排放。从经济、环保、低碳等角度考量,获取氢气的技术发展方向应是__________________________________________________(任写一条)。
Ⅱ. 储氢
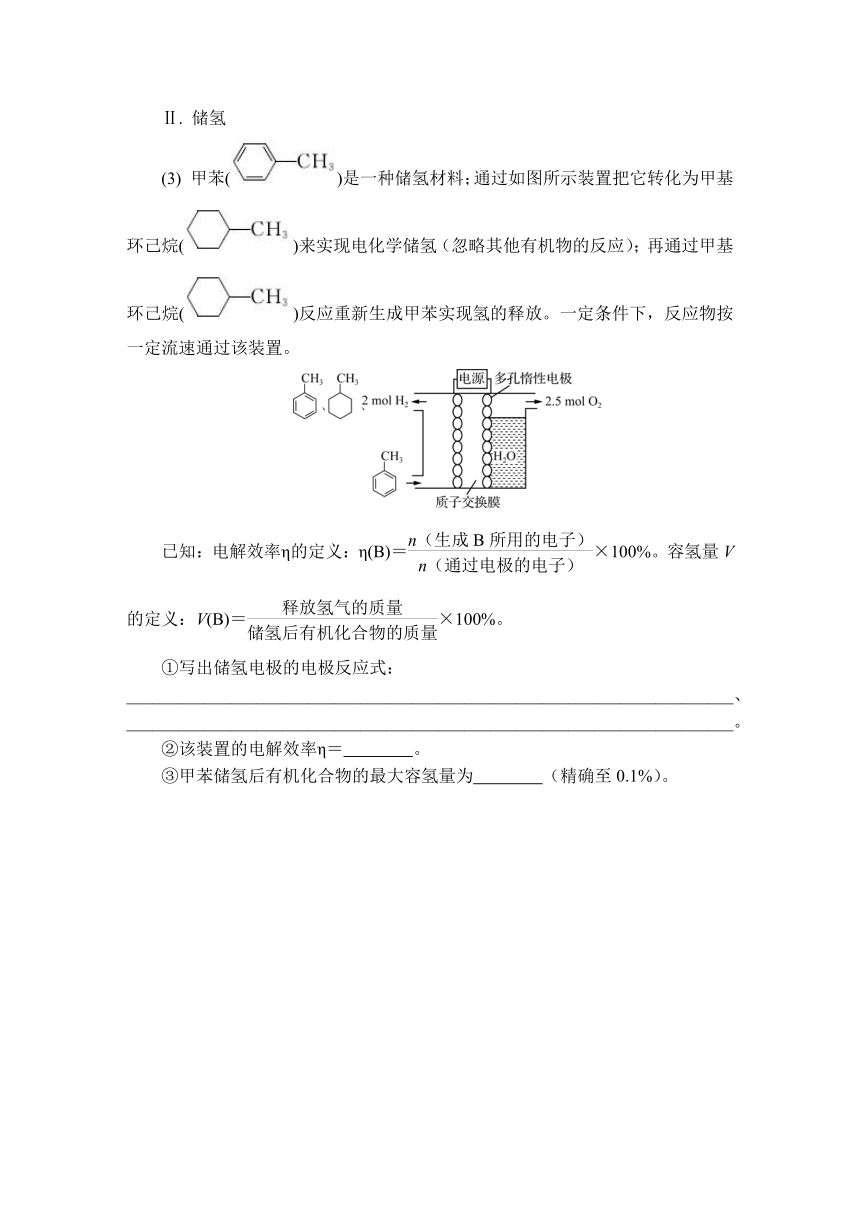
(3) 甲苯()是一种储氢材料;通过如图所示装置把它转化为甲基环己烷()来实现电化学储氢(忽略其他有机物的反应);再通过甲基环己烷()反应重新生成甲苯实现氢的释放。一定条件下,反应物按一定流速通过该装置。
已知:电解效率η的定义:η(B)=×100%。容氢量V的定义:V(B)=×100%。
①写出储氢电极的电极反应式:
______________________________________________________________________、
______________________________________________________________________。
②该装置的电解效率η= 。
③甲苯储氢后有机化合物的最大容氢量为 (精确至0.1%)。
15 (16分)[2025海门中学期中]一定条件下,水气变换反应CO+H2O CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
Ⅰ. HCOOH CO+H2O(快)
Ⅱ. HCOOH CO2+H2(慢)
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
(1) 一定条件下,反应Ⅰ、Ⅱ的焓变分别为ΔH1、ΔH2,则该条件下水气变换反应的焓变ΔH= (用含ΔH1、ΔH2的代数式表示)。
(2) 反应 Ⅰ 正反应速率方程为:v=kc(H+)·c(HCOOH),k为反应速率常数。某温度下,HCOOH电离平衡常数为Ka=1.6×10-4,当HCOOH平衡浓度为0.1 mol/L时,H+浓度为 mol/L,此时反应Ⅰ正反应速率v= (用含k的代数式表示)mol/(L·h)。
(3) T温度下,在密封石英管内完全充满 1.0 mol/L HCOOH水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。t1时刻测得CO、CO2的浓度分别为0.70 mol/L、0.16 mol/L,此时CO达到峰值,反应Ⅰ达到化学平衡状态,反应Ⅰ的平衡常数为 ;此后,随着c(CO2)逐渐增大,c(CO)逐渐减少,结合反应Ⅰ、Ⅱ说明原因:___________________________________________________________
______________________________________________________________________。
(4) 相同条件下,若反应起始时溶液中同时还含有0.10 mol/L盐酸,则如图所示点a、b、c、d中,CO的浓度峰值点可能是 (填字母)。与不用盐酸相比,CO达浓度峰值时,CO2浓度 (填“增大”“减小”或“不变”,下同),的值 。
16 (15分)[2024苏州期末]FeCO3是白色固体,可用于制备补血剂。某研究小组制备FeCO3,并对FeCO3的性质和纯度进行实验研究。
已知:①常温下,Ksp(FeCO3)=3.2×10-11,Ksp[Fe(OH)2]=8.0×10-16,
②Fe2++6SCN- [Fe(SCN)6]4-(无色) K1
(1) FeCO3的制取:如图所示,向装置甲中滴加稀盐酸,产生气体经洗气后通入装置丙中的1.0 mol/L Na2CO3溶液(pH=11.9),当溶液的pH约为7时,滴入0.8 mol/L FeSO4溶液,生成FeCO3沉淀。
甲 乙 丙
①装置乙中盛装的试剂是 (填化学式)溶液。
②Na2CO3溶液呈碱性的原因:______________________________(用离子方程式表示)。
③装置丙中生成FeCO3的离子方程式为________________________________。
④仅以1.0 mol/L Na2CO3溶液和0.8 mol/L FeSO4溶液为原料制备FeCO3。补充完整实验方案:_______________________________________________________
______________________________,所得沉淀用蒸馏水洗涤干净。(可使用 pH计)
(2) FeCO3的性质探究
步骤1:取少量FeCO3固体,向其中滴加3 mL 4 mol/L KSCN溶液,充分振荡。
步骤2:过滤,取少量无色滤液,向其中加入 5滴酸化的H2O2溶液,溶液显红色。
①步骤1中反应FeCO3+6SCN [Fe(SCN)6]4-+CO的平衡常数K2= [用含K1和Ksp(FeCO3)的代数式表示]。
②步骤2中[Fe(SCN)6]4-转化为Fe(SCN)3,该反应的离子方程式为___________
______________________________________________________________________。
(3) FeCO3纯度的测定
准确称取1.200 0 g制得的FeCO3样品,加过量稀硫酸溶解,配制成250 mL溶液。量取25.00 mL上述溶液于锥形瓶中,用 0.010 00 mol/L的KMnO4标准溶液进行滴定,平行滴定3次,平均消耗KMnO4标准溶液20.00 mL。
①注入KMnO4标准溶液前,滴定管需要进行的操作:检漏、用蒸馏水洗净和 。
②计算样品中FeCO3的纯度: (写出计算过程)。
17 (16分)氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1) 催化氧化法去除NO指在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图1所示。
①n(NH3)∶n(NO)的物质的量之比为1∶3时,对应的是曲线 (填“a”“b”或“c”)。
②由图1可知,无论以何种比例反应,在温度超过900 ℃时NO脱除率都会骤然下降的原因可能是 。
图1 图2
(2) NO氧化反应:2NO(g)+O2(g) 2NO2(g)分两步进行,其反应过程能量变化示意图如图2所示。
Ⅰ:2NO(g)―→N2O2(g) ΔH1
Ⅱ:N2O2(g)+O2(g)―→2NO2(g) ΔH2
①化学反应速率由速率较慢的反应步骤决定。以上反应决定NO氧化反应速率的步骤是 (填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其他条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随时间(t)的变化曲线如图3所示。转化相同量的NO,在温度 (填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量变化示意图(图2)分析其原因:
。
图3 图4
(3) NH3催化还原NO是重要的烟气脱硝技术,研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图4所示,写出脱硝过程的总反应化学方程式:____
________________________________________________。
综合评价
1. A 液氢燃烧无污染,燃烧热值大,是高能清洁燃料,A正确;太阳能电池需要吸收阳光,所以表面涂层须有很好的吸光性,B错误;“天问一号”的外壳采用的SiC增强铝基复合材料是一种颗粒增强金属基复合材料,采用铝合金作基体,按设计要求,以一定形式、比例和分布状态,用SiC颗粒作增强体,构成有明显界面的多组相复合材料,兼具单一金属不具备的综合优越性能,具有优异的耐高温、抗氧化性能,C错误;锂离子电池是可充电电池,属于二次电池,D错误。
2. A 甲烷的燃烧是放热反应,ΔH<0, B错误;HCO在水溶液中水解产生H2CO3和OH-,C错误;NaOH溶液过量生成Mg(OH)2沉淀,D错误。
3. B 船舶外壳装上锌块,因锌比铁活泼,构成原电池时,锌作负极,铁作正极,铁被保护,此方法为牺牲阳极法,A正确;海上舰艇的腐蚀主要为电化学腐蚀,B错误;防锈漆可以避免金属与空气、水的接触,防止金属被腐蚀,C正确;根据电解原理,被保护的金属作阴极,金属本身不参与反应,可以防止被腐蚀,此方法为外加电流法,D正确。
4. B NH3(g)+HCl(g)===NH4Cl(s)为气体体积减小的反应,该反应的ΔS<0,室温下可自发进行的反应需要满足ΔH-TΔS<0,所以该反应的ΔH<0,A正确;反应条件与吸热、放热反应无关,需加热发生的反应可能为吸热反应,如C与CO2反应,也可能为放热反应,如C与O2反应,放热反应可能需要加热,如Fe与Cl2的反应为放热反应,B错误;ΔH<0,可知石墨的能量低,则石墨比金刚石稳定,C正确;常温下,0.1 mol/L CH3COONa溶液加水稀释过程中,水解平衡正向移动,n(CH3COO-)减小,n(CH3COOH)增大,溶液中=,因而增大,D正确。
5. C 未反应完的SO2也能使澄清石灰水变浑浊,会干扰CO2的检验,A错误;CuS是黑色不溶于硫酸的沉淀,该反应能发生是由于生成沉淀,而非生成弱电解质,通过该实验不能比较H2S、H2SO4酸性强弱,B错误;SO2和Na2S发生归中反应生成单质S,SO2中S元素化合价降低,SO2得电子被还原,作氧化剂,具有氧化性,C正确;盐酸酸化后,NO具有强氧化性,能将Na2SO3氧化为Na2SO4,通过该实验不能检验Na2SO3溶液是否变质,D错误。
6. D 该反应为放热反应,反应物的能量总和大于生成物的能量总和,A错误;增大压强(缩小容器容积),化学反应速率加快是因为单位体积内活化分子总数增加,但活化分子百分数不变,B错误;未指明是标准状况,C错误;增大一种反应物的浓度,可以提高另外一种反应物的转化率.故适当增加CH4的量有利于消除NO2 ,减轻空气污染程度,D正确。
7. B 由图可知,总反应为反应物总能量大于生成物总能量的放热反应,反应的焓变小于0,A错误;反应的活化能越大,反应速率越小,总反应取决于慢反应,根据图像可知,中间体2→中间体3的活化能最大,反应速率最小,则总反应的速率由中间体2→中间体3的反应速率决定,B正确;由图可知,中间体1生成过渡态1的过程中有碳碳键的断裂,中间体2生成过滤态2的过程中有碳氢键的断裂,过滤态2生成中间体3的过程中有碳氢键的形成,整个过程中没有碳碳键的形成,C错误;催化剂可降低反应所需的活化能但不能改变焓变,D错误。
8. B 工业生产硫酸的过程中,存在2SO2+O22SO3,使用过量的氧气,平衡正向移动,A不符合题意;平衡体系加压,平衡不移动,但浓度增大,颜色加深,不能用勒夏特列原理解释,B符合题意;CO2溶于水发生CO2+H2O H2CO3 H++HCO,加入饱和NaHCO3溶液,HCO浓度增大,平衡逆向移动,抑制CO2的溶解,可用勒夏特列原理解释,C不符合题意;氯水中存在 Cl2+H2O H++Cl-+HClO,滴加硝酸银溶液,发生反应Ag++Cl-===AgCl↓,平衡正向移动,溶液颜色变浅,产生白色沉淀,能用勒夏特列原理解释,D不符合题意。
9. C 电镀时用镀层金属作阳极,含镀层金属离子的电解质作电解质溶液,镀件作阴极,故利用该装置不能实现铁制品表面镀铜,A错误;探究FeCl3溶液对H2O2分解反应速率的影响,应使两试管中H2O2溶液的浓度相同,B错误;少量AgNO3溶液中加入足量NaCl溶液,得到白色的AgCl沉淀,向该沉淀中加入少量KI溶液,出现黄色沉淀,说明Ksp:AgCl>AgI,C正确;Al3+水解,HCl易挥发,蒸干AlCl3溶液不能得到AlCl3固体,D错误。
10. B 放电时,a极为正极,电极反应式为MnO2+2e-+4H+===Mn2++2H2O,A错误;放电时,b极作负极,电极反应式为Zn-2e-+4OH-===[Zn(OH)4]2-,转移0.4 mol e-时,b电极消耗OH-的物质的量=0.4 mol×2=0.8 mol,B正确;充电时,a极为阳极,接外接电源的正极,b极为阴极,接外接电源的负极,C错误;充电时,b极为阴极,电极反应式为[Zn(OH)4]2-+2e-===Zn+4OH-,D错误。
11. C 将块状含钴废料粉碎,可以增大反应物间的接触面积,能提高酸浸速率,A正确;浸出液中加入H2O2,H2O2具有氧化性,能氧化具有还原性的Fe2+生成Fe3+,离子方程式为2Fe2++2H++H2O2===2Fe3++2H2O,B正确;H2O2氧化Fe2+生成Fe3+,CoO能和稀硫酸反应而调节溶液的pH,使Fe3+、Al3+分别转化为沉淀而除去,C错误;由图可知,加入有机溶剂后得到水层和溶有NiR2的有机层,故目的是溶解NiR2,使之与水层分离,便于“操作①”进行分液,D正确。
12. D HS-既可水解生成H2S,也可以电离生成S2-,由于溶液呈碱性,说明HS-离子的水解程度大于电离程度,c(S2-)105,通过计算可知可用FeS除杂,是因为反应正向进行的程度大,D正确。
13. A 生成CH4的反应为放热反应,温度升高,CH4的平衡选择性降低,A错误;由图可知,320 ℃时,CO2转化率最高,CH4的选择性接近100%,此时生成CH4反应的催化剂活性最强,CH4的实际选择性可能高于CH4的平衡选择性,B正确;240~300 ℃范围内,CO2转化率快速增大,CH4的选择性升高,主要是因为生成CH4反应的催化剂活性增强,C正确;若使用该催化剂,由图可知,反应温度约为320 ℃时,CO2转化率最高,且此时CH4的选择性接近100%,故实际生产中应选择反应温度约为320 ℃,D正确。
14. (1) ①+256.5 ②< ③吸收CO2,提高氢气的产率;CaO与CO2反应放热,提供热量;多孔CaO与CO2接触面积大,吸收CO2速率快,使重整反应更完全
(2) 利用可再生清洁能源分解水、太阳能光解水、寻找新型催化剂常温下分解水等
(3) ①2H++2e-===H2↑ +6H++6e-=== ②60% ③6.1%
解析:(1) ②已知反应CO2(g)+H2(g) CO(g)+H2O(g)的ΔH>0,该反应的ΔH-TΔS<0,则ΔS>0,则其逆反应的ΔS<0。(3) ②阴极生成 1 mol和2 mol H2,~6e-,H2~2e-,η=×100%=60%;③1 mol 可释放3 mol H2,则V=×100%≈6.1%。
15. (1) ΔH2-ΔH1 (2) 0.004 0.000 4k
(3) 5 反应Ⅰ是快反应,达到平衡所需时间短,反应Ⅱ消耗HCOOH,使Ⅰ的平衡逆向移动,c(CO)逐渐减小
(4) a 减小 不变
16. (1) ①NaHCO3
②CO+H2O HCO+OH-
③Fe2++2HCO===FeCO3↓+H2O+CO2↑
④在搅拌下向0.8 mol/L FeSO4溶液中逐滴缓慢加入1.0 mol/L Na2CO3溶液,控制溶液pH不大于6.5,静置后过滤
(2) ①K1·Ksp(FeCO3)
②2[Fe(SCN)6]4-+H2O2+2H+===2Fe(SCN)3+6SCN-+2H2O或2[Fe(SCN)6]4-+H2O2+
8H+===2Fe(SCN)3+6HSCN+2H2O
(3) ①用KMnO4标准溶液润洗2~3次 ② 96.67%
由MnO+5Fe2++8H+===Mn2++5Fe3++4H2O可得MnO~5Fe2+
n(MnO)=0.010 00 mol/L×20.00×10-3 L=2×10-4 mol
n总(Fe2+)=5×2×10-4 mol×=0.01 mol
m(FeCO3)=0.01 mol×116 g/mol=1.16 g
w=×100%≈96.67%
17. (1) ①c ②温度高于900 ℃时,催化剂可能失去活性,反应速率降低
(2) ①Ⅱ ②T4 ΔH1<0,温度升高,反应Ⅰ平衡逆向移动,c(N2O2)减小,浓度降低的影响大于温度对反应Ⅱ速率的影响
(3) 4NH3+4NO+O24N2+6H2O
一、 单项选择题(本题包括13题,每题3分,共39分)
1 下列说法正确的是( )
A. “天问一号”探测器运载火箭使用的燃料液氢是高能清洁燃料
B. “祝融号”火星车的太阳能电池板表面涂层须有很好的反光性
C. “天问一号”选择使用新型SiC增强铝基复合材料的主要依据是其导电性好
D. “火星快车”轨道器上的锂离子蓄电池是一次电池
2 [2024宿迁期末]下列化学反应表示正确的是( )
A. 泡沫灭火器的工作原理:Al3++3HCO===Al(OH)3↓+3CO2↑
B. 甲烷的燃烧:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=+890.3 kJ/mol
C. HCO的水解:HCO+H2O CO+H3O+
D. 将Mg(HCO3)2溶液与过量的NaOH溶液混合:HCO+OH-===CO+H2O
3 下列关于金属腐蚀和防腐的说法错误的是( )
A. 可以在船舶外壳装上锌块,用牺牲阳极法防止金属腐蚀
B. 海上舰艇的腐蚀主要为金属的化学腐蚀
C. 刷防锈漆,使金属与空气、水等物质隔离,可防止金属被腐蚀
D. 外加电流,需要保护的金属作阴极,可以起到保护金属的作用
4 下列叙述不正确的是( )
A. 常温下,NH3(g)+HCl(g)===NH4Cl(s)能够自发进行,则该反应的ΔH<0
B. 需加热才能进行的反应是吸热反应,无需加热就能进行的反应是放热反应
C. C(金刚石,s)===C(石墨,s) ΔH=-1.9 kJ/mol,则石墨比金刚石稳定
D. 常温下,0.1 mol/L CH3COONa溶液加水稀释后,溶液中的值增大
5 [2024无锡期末]根据下列实验操作及现象能得出相应结论的是( )
选项 探究目的 实验方案
A S与C的非金属性强弱 将SO2通入饱和NaHCO3溶液中,产生使澄清石灰水变浑浊的气体
B H2S、H2SO4酸性强弱 将H2S通入CuSO4溶液中,产生黑色沉淀
C SO2是否具有氧化性 将SO2通入Na2S溶液中,产生淡黄色沉淀
D Na2SO3溶液是否变质 向Na2SO3溶液中加入盐酸酸化的Ba(NO3)2溶液,观察是否产生白色沉淀
6 [2025南航苏州附中月考]CH4消除NO2的反应为CH4(g)+2NO2(g) N2(g)+2H2O(g)+CO2(g) ΔH<0。下列说法正确的是( )
A. 该反应中反应物的能量总和小于生成物的能量总和
B. 增大压强(缩小容器容积),化学反应速率加快是因为活化分子百分数变大
C. 反应中生成22.4 L N2,转移电子数目为8×6.02×1023
D. 实际应用中,适当增加CH4的量有利于消除NO2 ,减轻空气污染程度
7 [2025海安中学期中]Ni可活化C2H6制得CH4,其反应历程如图所示。下列关于活化历程的说法正确的是( )
A. 总反应的ΔH>0
B. 总反应的速率由“中间体2→中间体3”决定
C. 该反应过程中有碳氢键、碳碳键的断裂和形成
D. 使用更高效的催化剂可降低反应所需的活化能和焓变
8 一定条件下,下列现象不能用勒夏特列原理解释的是( )
A. 工业生产硫酸的过程中使用适当过量氧气,以提高SO2的转化率
B. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后气体颜色变深
C. 实验室用排饱和NaHCO3溶液的方法收集CO2气体
D. 新制氯水中,滴加硝酸银溶液,溶液颜色变浅,产生白色沉淀
9 下列实验操作能达到目的的是( )
10 锌电池具有成本低、安全性强、可循环使用等优点。一种新型锌电池的工作原理如图所示(凝胶中允许离子生成或迁移)。下列说法正确的是( )
A. 放电过程中,a电极的电极反应式为2H2O+Mn2+-2e-===MnO2+4H+
B. 放电过程中,转移0.4 mol e-时,b电极消耗0.8 mol OH-
C. 充电过程中,b电极接外接电源的正极
D. 充电过程中,b电极反应式为Zn2++2e-===Zn
11 用含钴废料(主要成分为Co,还含有一定量的NiO、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的工艺流程如图所示。
已知:①草酸钴晶体难溶于水;②RH为有机萃取剂。
下列说法错误的是( )
A. “粉碎”的目的是增大反应物接触面积,提高酸浸速率
B. 加入H2O2时发生反应的离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O
C. 加入CoO的目的是调节溶液pH,使Al3+、Fe2+完全沉淀
D. 加入有机溶剂的目的是溶解NiR2,使之与水层分离,便于“操作①”进行分液
12 [2024扬州期末]常温时,可用0.100 mol/L NaHS溶液和FeS处理含Hg2+的废水,操作流程如下。已知:常温时Ksp(FeS)=1.5×10-19,Ksp(HgS)=6.0×10-53,下列说法正确的是( )
A. 0.100 mol/L NaHS溶液的pH为9.5,此溶液中存在:c(S2-)>c(H2S)
B. 处理后的废水中存在:c(Hg2+)·c(S2-)≤Ksp(HgS)
C. NaHS溶液除汞时发生反应的离子方程式:Hg2++S2-===HgS↓
D. 可用FeS除杂,是因为反应Hg2++FeS HgS+Fe2+正向进行的程度大
13 [2024苏州期末]CO2和H2反应得到甲烷的主要反应如下:
CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH=-165 kJ/mol
CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41 kJ/mol
将一定比例CO2和H2混合气体以一定流速通过装有催化剂的反应管,CO2的转化率、CH4的选择性如图所示,下列有关说法不正确的是( )
A. CH4的平衡选择性随温度的升高而增大
B. 320 ℃时,CH4的实际选择性可能高于CH4的平衡选择性
C. 240~300 ℃范围内,CO2转化率增大主要是因为催化剂活性增强
D. 若使用该催化剂,根据测得数据,实际生产中应选择反应温度约为320 ℃
二、 非选择题(本题共4题,共61分)
14 (14分)[2024淮安期末]氢能是能源体系的组成部分,强化制氢、储氢等各个环节的技术研发具有积极的现实意义。
Ⅰ. 制氢
(1) 乙醇 水蒸气催化重整制氢的部分反应过程如图所示:
已知:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41.2 kJ/mol
CH3CH2OH(g)+3H2O(g) 2CO2(g)+6H2(g) ΔH2=+174.1 kJ/mol
①反应Ⅰ:CH3CH2OH(g)+H2O(g) 2CO(g)+4H2(g) ΔH= kJ/mol。
②反应Ⅱ的ΔS (填“>”“<”“=”)0。
③已知:CaO(s)+CO2(g)===CaCO3(s) ΔH=-178.8 kJ/mol。向重整反应体系中加入适量多孔CaO,其优点是_________________________________________
______________________________________________________________________。
(2) 目前全球每年约7 000万吨H2的需求,95%来自化石能源,相当于每年8.3亿吨的CO2排放。从经济、环保、低碳等角度考量,获取氢气的技术发展方向应是__________________________________________________(任写一条)。
Ⅱ. 储氢
(3) 甲苯()是一种储氢材料;通过如图所示装置把它转化为甲基环己烷()来实现电化学储氢(忽略其他有机物的反应);再通过甲基环己烷()反应重新生成甲苯实现氢的释放。一定条件下,反应物按一定流速通过该装置。
已知:电解效率η的定义:η(B)=×100%。容氢量V的定义:V(B)=×100%。
①写出储氢电极的电极反应式:
______________________________________________________________________、
______________________________________________________________________。
②该装置的电解效率η= 。
③甲苯储氢后有机化合物的最大容氢量为 (精确至0.1%)。
15 (16分)[2025海门中学期中]一定条件下,水气变换反应CO+H2O CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
Ⅰ. HCOOH CO+H2O(快)
Ⅱ. HCOOH CO2+H2(慢)
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
(1) 一定条件下,反应Ⅰ、Ⅱ的焓变分别为ΔH1、ΔH2,则该条件下水气变换反应的焓变ΔH= (用含ΔH1、ΔH2的代数式表示)。
(2) 反应 Ⅰ 正反应速率方程为:v=kc(H+)·c(HCOOH),k为反应速率常数。某温度下,HCOOH电离平衡常数为Ka=1.6×10-4,当HCOOH平衡浓度为0.1 mol/L时,H+浓度为 mol/L,此时反应Ⅰ正反应速率v= (用含k的代数式表示)mol/(L·h)。
(3) T温度下,在密封石英管内完全充满 1.0 mol/L HCOOH水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。t1时刻测得CO、CO2的浓度分别为0.70 mol/L、0.16 mol/L,此时CO达到峰值,反应Ⅰ达到化学平衡状态,反应Ⅰ的平衡常数为 ;此后,随着c(CO2)逐渐增大,c(CO)逐渐减少,结合反应Ⅰ、Ⅱ说明原因:___________________________________________________________
______________________________________________________________________。
(4) 相同条件下,若反应起始时溶液中同时还含有0.10 mol/L盐酸,则如图所示点a、b、c、d中,CO的浓度峰值点可能是 (填字母)。与不用盐酸相比,CO达浓度峰值时,CO2浓度 (填“增大”“减小”或“不变”,下同),的值 。
16 (15分)[2024苏州期末]FeCO3是白色固体,可用于制备补血剂。某研究小组制备FeCO3,并对FeCO3的性质和纯度进行实验研究。
已知:①常温下,Ksp(FeCO3)=3.2×10-11,Ksp[Fe(OH)2]=8.0×10-16,
②Fe2++6SCN- [Fe(SCN)6]4-(无色) K1
(1) FeCO3的制取:如图所示,向装置甲中滴加稀盐酸,产生气体经洗气后通入装置丙中的1.0 mol/L Na2CO3溶液(pH=11.9),当溶液的pH约为7时,滴入0.8 mol/L FeSO4溶液,生成FeCO3沉淀。
甲 乙 丙
①装置乙中盛装的试剂是 (填化学式)溶液。
②Na2CO3溶液呈碱性的原因:______________________________(用离子方程式表示)。
③装置丙中生成FeCO3的离子方程式为________________________________。
④仅以1.0 mol/L Na2CO3溶液和0.8 mol/L FeSO4溶液为原料制备FeCO3。补充完整实验方案:_______________________________________________________
______________________________,所得沉淀用蒸馏水洗涤干净。(可使用 pH计)
(2) FeCO3的性质探究
步骤1:取少量FeCO3固体,向其中滴加3 mL 4 mol/L KSCN溶液,充分振荡。
步骤2:过滤,取少量无色滤液,向其中加入 5滴酸化的H2O2溶液,溶液显红色。
①步骤1中反应FeCO3+6SCN [Fe(SCN)6]4-+CO的平衡常数K2= [用含K1和Ksp(FeCO3)的代数式表示]。
②步骤2中[Fe(SCN)6]4-转化为Fe(SCN)3,该反应的离子方程式为___________
______________________________________________________________________。
(3) FeCO3纯度的测定
准确称取1.200 0 g制得的FeCO3样品,加过量稀硫酸溶解,配制成250 mL溶液。量取25.00 mL上述溶液于锥形瓶中,用 0.010 00 mol/L的KMnO4标准溶液进行滴定,平行滴定3次,平均消耗KMnO4标准溶液20.00 mL。
①注入KMnO4标准溶液前,滴定管需要进行的操作:检漏、用蒸馏水洗净和 。
②计算样品中FeCO3的纯度: (写出计算过程)。
17 (16分)氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1) 催化氧化法去除NO指在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图1所示。
①n(NH3)∶n(NO)的物质的量之比为1∶3时,对应的是曲线 (填“a”“b”或“c”)。
②由图1可知,无论以何种比例反应,在温度超过900 ℃时NO脱除率都会骤然下降的原因可能是 。
图1 图2
(2) NO氧化反应:2NO(g)+O2(g) 2NO2(g)分两步进行,其反应过程能量变化示意图如图2所示。
Ⅰ:2NO(g)―→N2O2(g) ΔH1
Ⅱ:N2O2(g)+O2(g)―→2NO2(g) ΔH2
①化学反应速率由速率较慢的反应步骤决定。以上反应决定NO氧化反应速率的步骤是 (填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其他条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随时间(t)的变化曲线如图3所示。转化相同量的NO,在温度 (填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量变化示意图(图2)分析其原因:
。
图3 图4
(3) NH3催化还原NO是重要的烟气脱硝技术,研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图4所示,写出脱硝过程的总反应化学方程式:____
________________________________________________。
综合评价
1. A 液氢燃烧无污染,燃烧热值大,是高能清洁燃料,A正确;太阳能电池需要吸收阳光,所以表面涂层须有很好的吸光性,B错误;“天问一号”的外壳采用的SiC增强铝基复合材料是一种颗粒增强金属基复合材料,采用铝合金作基体,按设计要求,以一定形式、比例和分布状态,用SiC颗粒作增强体,构成有明显界面的多组相复合材料,兼具单一金属不具备的综合优越性能,具有优异的耐高温、抗氧化性能,C错误;锂离子电池是可充电电池,属于二次电池,D错误。
2. A 甲烷的燃烧是放热反应,ΔH<0, B错误;HCO在水溶液中水解产生H2CO3和OH-,C错误;NaOH溶液过量生成Mg(OH)2沉淀,D错误。
3. B 船舶外壳装上锌块,因锌比铁活泼,构成原电池时,锌作负极,铁作正极,铁被保护,此方法为牺牲阳极法,A正确;海上舰艇的腐蚀主要为电化学腐蚀,B错误;防锈漆可以避免金属与空气、水的接触,防止金属被腐蚀,C正确;根据电解原理,被保护的金属作阴极,金属本身不参与反应,可以防止被腐蚀,此方法为外加电流法,D正确。
4. B NH3(g)+HCl(g)===NH4Cl(s)为气体体积减小的反应,该反应的ΔS<0,室温下可自发进行的反应需要满足ΔH-TΔS<0,所以该反应的ΔH<0,A正确;反应条件与吸热、放热反应无关,需加热发生的反应可能为吸热反应,如C与CO2反应,也可能为放热反应,如C与O2反应,放热反应可能需要加热,如Fe与Cl2的反应为放热反应,B错误;ΔH<0,可知石墨的能量低,则石墨比金刚石稳定,C正确;常温下,0.1 mol/L CH3COONa溶液加水稀释过程中,水解平衡正向移动,n(CH3COO-)减小,n(CH3COOH)增大,溶液中=,因而增大,D正确。
5. C 未反应完的SO2也能使澄清石灰水变浑浊,会干扰CO2的检验,A错误;CuS是黑色不溶于硫酸的沉淀,该反应能发生是由于生成沉淀,而非生成弱电解质,通过该实验不能比较H2S、H2SO4酸性强弱,B错误;SO2和Na2S发生归中反应生成单质S,SO2中S元素化合价降低,SO2得电子被还原,作氧化剂,具有氧化性,C正确;盐酸酸化后,NO具有强氧化性,能将Na2SO3氧化为Na2SO4,通过该实验不能检验Na2SO3溶液是否变质,D错误。
6. D 该反应为放热反应,反应物的能量总和大于生成物的能量总和,A错误;增大压强(缩小容器容积),化学反应速率加快是因为单位体积内活化分子总数增加,但活化分子百分数不变,B错误;未指明是标准状况,C错误;增大一种反应物的浓度,可以提高另外一种反应物的转化率.故适当增加CH4的量有利于消除NO2 ,减轻空气污染程度,D正确。
7. B 由图可知,总反应为反应物总能量大于生成物总能量的放热反应,反应的焓变小于0,A错误;反应的活化能越大,反应速率越小,总反应取决于慢反应,根据图像可知,中间体2→中间体3的活化能最大,反应速率最小,则总反应的速率由中间体2→中间体3的反应速率决定,B正确;由图可知,中间体1生成过渡态1的过程中有碳碳键的断裂,中间体2生成过滤态2的过程中有碳氢键的断裂,过滤态2生成中间体3的过程中有碳氢键的形成,整个过程中没有碳碳键的形成,C错误;催化剂可降低反应所需的活化能但不能改变焓变,D错误。
8. B 工业生产硫酸的过程中,存在2SO2+O22SO3,使用过量的氧气,平衡正向移动,A不符合题意;平衡体系加压,平衡不移动,但浓度增大,颜色加深,不能用勒夏特列原理解释,B符合题意;CO2溶于水发生CO2+H2O H2CO3 H++HCO,加入饱和NaHCO3溶液,HCO浓度增大,平衡逆向移动,抑制CO2的溶解,可用勒夏特列原理解释,C不符合题意;氯水中存在 Cl2+H2O H++Cl-+HClO,滴加硝酸银溶液,发生反应Ag++Cl-===AgCl↓,平衡正向移动,溶液颜色变浅,产生白色沉淀,能用勒夏特列原理解释,D不符合题意。
9. C 电镀时用镀层金属作阳极,含镀层金属离子的电解质作电解质溶液,镀件作阴极,故利用该装置不能实现铁制品表面镀铜,A错误;探究FeCl3溶液对H2O2分解反应速率的影响,应使两试管中H2O2溶液的浓度相同,B错误;少量AgNO3溶液中加入足量NaCl溶液,得到白色的AgCl沉淀,向该沉淀中加入少量KI溶液,出现黄色沉淀,说明Ksp:AgCl>AgI,C正确;Al3+水解,HCl易挥发,蒸干AlCl3溶液不能得到AlCl3固体,D错误。
10. B 放电时,a极为正极,电极反应式为MnO2+2e-+4H+===Mn2++2H2O,A错误;放电时,b极作负极,电极反应式为Zn-2e-+4OH-===[Zn(OH)4]2-,转移0.4 mol e-时,b电极消耗OH-的物质的量=0.4 mol×2=0.8 mol,B正确;充电时,a极为阳极,接外接电源的正极,b极为阴极,接外接电源的负极,C错误;充电时,b极为阴极,电极反应式为[Zn(OH)4]2-+2e-===Zn+4OH-,D错误。
11. C 将块状含钴废料粉碎,可以增大反应物间的接触面积,能提高酸浸速率,A正确;浸出液中加入H2O2,H2O2具有氧化性,能氧化具有还原性的Fe2+生成Fe3+,离子方程式为2Fe2++2H++H2O2===2Fe3++2H2O,B正确;H2O2氧化Fe2+生成Fe3+,CoO能和稀硫酸反应而调节溶液的pH,使Fe3+、Al3+分别转化为沉淀而除去,C错误;由图可知,加入有机溶剂后得到水层和溶有NiR2的有机层,故目的是溶解NiR2,使之与水层分离,便于“操作①”进行分液,D正确。
12. D HS-既可水解生成H2S,也可以电离生成S2-,由于溶液呈碱性,说明HS-离子的水解程度大于电离程度,c(S2-)
13. A 生成CH4的反应为放热反应,温度升高,CH4的平衡选择性降低,A错误;由图可知,320 ℃时,CO2转化率最高,CH4的选择性接近100%,此时生成CH4反应的催化剂活性最强,CH4的实际选择性可能高于CH4的平衡选择性,B正确;240~300 ℃范围内,CO2转化率快速增大,CH4的选择性升高,主要是因为生成CH4反应的催化剂活性增强,C正确;若使用该催化剂,由图可知,反应温度约为320 ℃时,CO2转化率最高,且此时CH4的选择性接近100%,故实际生产中应选择反应温度约为320 ℃,D正确。
14. (1) ①+256.5 ②< ③吸收CO2,提高氢气的产率;CaO与CO2反应放热,提供热量;多孔CaO与CO2接触面积大,吸收CO2速率快,使重整反应更完全
(2) 利用可再生清洁能源分解水、太阳能光解水、寻找新型催化剂常温下分解水等
(3) ①2H++2e-===H2↑ +6H++6e-=== ②60% ③6.1%
解析:(1) ②已知反应CO2(g)+H2(g) CO(g)+H2O(g)的ΔH>0,该反应的ΔH-TΔS<0,则ΔS>0,则其逆反应的ΔS<0。(3) ②阴极生成 1 mol和2 mol H2,~6e-,H2~2e-,η=×100%=60%;③1 mol 可释放3 mol H2,则V=×100%≈6.1%。
15. (1) ΔH2-ΔH1 (2) 0.004 0.000 4k
(3) 5 反应Ⅰ是快反应,达到平衡所需时间短,反应Ⅱ消耗HCOOH,使Ⅰ的平衡逆向移动,c(CO)逐渐减小
(4) a 减小 不变
16. (1) ①NaHCO3
②CO+H2O HCO+OH-
③Fe2++2HCO===FeCO3↓+H2O+CO2↑
④在搅拌下向0.8 mol/L FeSO4溶液中逐滴缓慢加入1.0 mol/L Na2CO3溶液,控制溶液pH不大于6.5,静置后过滤
(2) ①K1·Ksp(FeCO3)
②2[Fe(SCN)6]4-+H2O2+2H+===2Fe(SCN)3+6SCN-+2H2O或2[Fe(SCN)6]4-+H2O2+
8H+===2Fe(SCN)3+6HSCN+2H2O
(3) ①用KMnO4标准溶液润洗2~3次 ② 96.67%
由MnO+5Fe2++8H+===Mn2++5Fe3++4H2O可得MnO~5Fe2+
n(MnO)=0.010 00 mol/L×20.00×10-3 L=2×10-4 mol
n总(Fe2+)=5×2×10-4 mol×=0.01 mol
m(FeCO3)=0.01 mol×116 g/mol=1.16 g
w=×100%≈96.67%
17. (1) ①c ②温度高于900 ℃时,催化剂可能失去活性,反应速率降低
(2) ①Ⅱ ②T4 ΔH1<0,温度升高,反应Ⅰ平衡逆向移动,c(N2O2)减小,浓度降低的影响大于温度对反应Ⅱ速率的影响
(3) 4NH3+4NO+O24N2+6H2O
