江西省南昌市2025届高考化学5月模拟卷(含答案)
文档属性
| 名称 | 江西省南昌市2025届高考化学5月模拟卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 20:49:32 | ||
图片预览


文档简介
江西省南昌市2025届高考化学5月模拟卷
可能用到的相对原子质量:H—1、O—16、Mn—55。
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.跨越时间的长河,探寻古文化流传的化学精髓。下列有关古文化的叙述错误的是( )
A.《开宝本草》中记载“取钢煅作叶,……,于醋瓮中阴处埋之一百日,铁上衣生,铁华成矣。”说明铁具有和醋发生反应的性质
B.《天工开物》中记载“西川有火井(),……,一头插入井底,其上曲接,以口紧对釜脐,注卤水釜中,只见火意烘烘,水即滚沸。”说明天然气具有可燃性
C.《格物粗谈·果品》中记载“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”说明乙烷具有催熟的性质
D.《周易参同契》中记载“河上姹女(水银),灵而最神,得火则飞,……,将预制之(HgS),黄芽(硫黄)为根。”说明汞具有与硫反应的性质
2.下列有关物质结构或性质的描述中,错误的是( )
A.硬度:金刚石>碳化硅,是由于金刚石中C原子半径小于碳化硅中硅原子半径,C-C键键长比C-Si键键长短,键能大
B.稳定性:>,是因为分子间含有氢键
C.氯化钠晶体中每个周围紧邻且距离相等的共有12个
D.键角:>,是由于、中心原子孤电子对数不一样
3.下列实验方法及所选玻璃仪器(其他材质仪器任选)均正确的是( )
A.制备硝基苯,仪器为③⑩
B.除去苯中混有的少量苯酚:加入NaOH,然后过滤,仪器为①⑦⑨
C.分离乙醇和的混合液体,直接用蒸馏法,仪器为②③⑤⑥
D.使用酸性重铬酸钾标准溶液通过氧化滴定法测定某未知浓度的溶液的浓度,仪器为④⑦
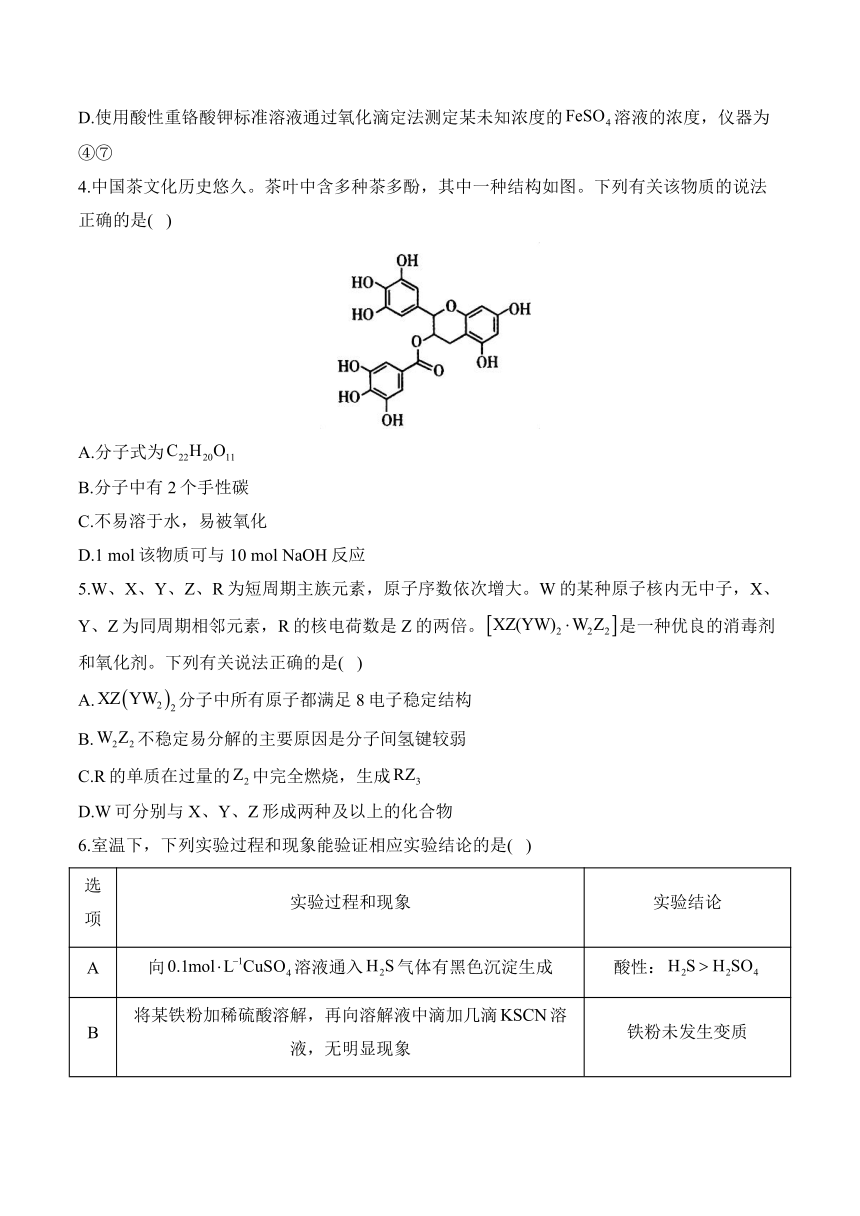
4.中国茶文化历史悠久。茶叶中含多种茶多酚,其中一种结构如图。下列有关该物质的说法正确的是( )
A.分子式为
B.分子中有2个手性碳
C.不易溶于水,易被氧化
D.1 mol该物质可与10 mol NaOH反应
5.W、X、Y、Z、R为短周期主族元素,原子序数依次增大。W的某种原子核内无中子,X、Y、Z为同周期相邻元素,R的核电荷数是Z的两倍。是一种优良的消毒剂和氧化剂。下列有关说法正确的是( )
A.分子中所有原子都满足8电子稳定结构
B.不稳定易分解的主要原因是分子间氢键较弱
C.R的单质在过量的中完全燃烧,生成
D.W可分别与X、Y、Z形成两种及以上的化合物
6.室温下,下列实验过程和现象能验证相应实验结论的是( )
选项 实验过程和现象 实验结论
A 向溶液通入气体有黑色沉淀生成 酸性:
B 将某铁粉加稀硫酸溶解,再向溶解液中滴加几滴溶液,无明显现象 铁粉未发生变质
C 将相同大小的钠块和钙块放入相同体积的蒸馏水中,钙与水反应不如钠剧烈 金属活动性:
D 向的水溶液中滴加硝酸银溶液无明显现象 该配合物中的配位数是6
7.“84”消毒液与双氧水混合时发生反应:.已知为阿伏加德罗常数的值。下列说法正确的是( )
A.常温下,生成,转移的电子数为2
B.溶液含有的数为0.5
C.含的溶液中含有的键数为3
D.标准状况下,中含有的氢键数为
8.一种以纳米铜()为原料制备的工艺流程如下。
已知:为白色粉末,微溶于水,不溶于乙醇,在潮湿的空气中易被氧化。下列说法错误的是( )
A.“溶解”时X可以是热空气或
B.“还原”时氧化剂与还原剂的物质的量之比为
C.“过滤”用到的玻璃仪器有漏斗、烧杯、玻璃棒
D.为提高的纯度,可采用乙醇洗涤、真空干燥
9.一定条件下,在5L恒容密闭容器中进行反应,在0~2min内,NO的物质的量增加了0.6mol。下列说法错误的是( )
A.在0~1min内,用NO表示的平均速率v(NO)>0.06mol/(L·min)
B.在0~2min内,用表示的平均速率
C.其他条件不变,降低温度,v(正)增大,v(逆)减小
D.其他条件不变,升高温度,v(正)、v(逆)均增大
10.叔丁基溴在纯溶剂中会发生溶剂解,叔丁基溴在水中的溶剂解反应生成两种产物的机理分别为:
下列说法错误的是( )
A.两种机理的控速步骤是相同的
B.两种机理中都用到了孤对电子
C.把叔丁基溴换成叔丁基碘,产物比例不变
D.把换成,消去产物比例减小
11.西北工业大学推出一种新型电池,该电池能有效地捕获并将其转化为。现利用电池将产生的电解制氨,过程如图所示。下列说法正确的是( )
A.b电极是阳极,在b电极上发生氧化反应
B.当电路中转移电子时,丙室溶液质量减少
C.电解池的总反应式为
D.为增强丙中水的导电性,可以加入一定量的固体
12.已知合金的立方晶胞结构如图1所示,原子以金刚石方式堆积,八面体空隙和半数的四面体空隙中填入四面体;沿x轴投影晶胞中所有原子的分布图如图2所示,A点的分数坐标为。设晶胞参数为的摩尔质量为,为阿伏加德罗常数的值。下列说法错误的是( )
A.电负性: B.B点的分数坐标为
C.A、C两原子间的距离为 D.该晶体的密度为
13.在一定温度下,和的溶液中部分粒子的分布系数[如]与初始浓度关系分别如图所示。下列说法正确的是( )
A.减小盐溶液初始浓度,离子水解程度可能减小
B.溶液中存在
C.溶液的初始浓度越小,其水解程度越大
D.溶液中存在
14.常温下,某溶液A中含有中的若干种,且各离子的物质的量浓度均为0.1,现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是( )
A.溶液A中存在
B.沉淀乙中只有
C.溶液A可能是由按物质的量之比为1:1:1混合而成的溶液
D.要确定A溶液中是否存在或中的一种,能通过检验来确定
二、非选择题:本大题共4小题,共58分。
15.(15分)工业利用软锰矿进行烟气脱硫并制备和的工艺流程如图所示。软锰矿的主要成分是,还含有少量FeO、、、MgO、ZnO、NiO、等物质。
已知:常温下,,。各金属离子开始沉淀和完全沉淀时的pH如表:
金属离子
开始沉淀时的pH 8.8 7.5 2.2 4.1 9.6 6.5 6.4
完全沉淀时的pH 10.8 9.5 3.5 5.4 11.6 8.5 8.4
回答下列问题:
(1)晶体为______________晶体,为测定其结构通常使用的仪器是_____________。
(2)若保持温度不变,“脱硫浸锰”时体系中和随反应时间的变化如图所示。
则导致溶液中和的变化产生明显差异的原因可能是____________________。
(3)“调pH”至5.5左右,则“滤渣2”的成分为_________________(填化学式)。
(4)已知“滤渣3”的主要成分为NiS和ZnS,则“除杂”后的溶液中_______。(当溶液中某离子的物质的量浓度小于或等于时,视作该离子已完全沉淀)
(5)“沉锰”时发生反应的离子方程式为______________________________________。
(6)锰含量测定:为测定产品中锰的含量,取ag样品于烧杯中,加水溶解,加入足量的稀硫酸,再滴加过量的溶液将锰元素转化为,充分反应后加热一段时间,冷却后将烧杯中的溶液配成250mL溶液。取出25.00mL溶液于锥形瓶中,用标准溶液滴定,到达滴定终点时,消耗溶液的体积为VmL。已知:在水溶液中不稳定,会逐渐分解为和。
①滴定终点的现象是____________________________________________。
②“充分反应后加热一段时间”的目的为__________________________________。
③该产品中锰的质量分数为_______(用含a、V的式子表示)。
16.(14分)利用可见光催化还原,将转化为增值化学原料HCOOH、HCHO、等),被认为是一种可持续的资源化有效途径。
(1)已知:
。
__________
(2)在一定温度下,将和通入某恒容密闭容器中,发生反应,测得不同时刻容器中的体积分数如表所示。
t/min 0 10 20 30 40 50
0.250 0.230 0.215 0.205 0.200 0.200
达到平衡时的转化率为____________________(保留1位小数)
(3)将的混合气体充入某密闭容器中,同时发生反应Ⅰ和反应Ⅱ.
反应Ⅰ:。
反应Ⅱ:。
在相同时间内,测得的平衡转化率随温度、压强的变化关系如图甲。
①压强、、由小到大的顺序为___________________;条件下,温度从之后,转化率变化的主要原因是________________________________。
②在一定温度下,向容积为2L的恒容密闭容器中充入和,仅发生反应Ⅱ,起始时容器内气体的总压强为8pkPa,若10min时实验测得的平衡分压为pkPa,则0~10min内,__________,该反应的____________。
(4)Bi与BiIn合金催化剂电化学还原生产HCOOH的催化机理及在催化剂表面还原过程各物质的相对能量变化,如图乙所示(带“*”表示物质处于吸附态)。
从图乙进行分析,两种催化剂中,效果更好的催化剂是_______________________,原因是_________________________________________。
17.(14分)某实验小组在完成铜与浓硫酸、浓硝酸的反应实验后,为了探究铜与浓盐酸的反应,设计了如下实验方案:
实验序号 试管①中试剂 实验现象
A 稀盐酸 无明显现象
B 浓盐酸 铜丝溶解,溶液由无色缓慢变黄最终变为浅蓝色
反应装置图如下:
已知:
物质
颜色 白色 无色 深蓝色 浅蓝色 无色 黄色
I.在实验过程中,甲同学发现铜丝溶解缓慢,溶液中有些许气泡冒出,于是用足量铜粉代替铜丝,重新进行实验。
II.同学们对变黄前的无色溶液的成分进行了讨论,认为其中含有,为了验证猜想,同学们进行了如下实验:
甲同学:将试管①中产生的气体通入试管②中吸收,发现气体通过试管②中足量氢氧化钠溶液后,试管③中仍然有气泡冒出;
乙同学:取试管①无色溶液少许加水稀释发现有白色沉淀生成,对白色沉淀过滤,充分洗涤,进行下列检测实验;
丙同学:取试管①无色溶液少许加入溶液,发现溶液由无色变为黄色,经检测,溶液中含有,放置一段时间后溶液逐渐变为绿色,最终溶液变为浅蓝色。
根据实验现象,回答下列问题:
(1)甲同学用铜粉代替铜丝的目的是____________________________。
(2)a.运用化学平衡原理解释试管①加水稀释后产生白色沉淀的原因____________________________________________。试管③中的气体是_______________填化学式。
b.乙同学实验中,第i步实验的离子方程式为______________________________________。
第ⅱ步深蓝色配离子的空间结构为_________________(填“平面正方形”或“正四面体”)。
c.写出丙同学实验中溶液由无色到浅蓝色的总反应离子方程式_____________________________________________________。
d.结合该实验推测王水溶金实验中(已知可与形成配离子),浓盐酸的作用是_____________________________________________。
18.(15分)一种昆虫信息素的部分合成过程如下(加料顺序、部分反应条件略):
(1)I的名称是_______________,I比Ⅳ沸点更高的原因是_________________________________。
(2)Ⅱ的同分异构体M不能与发生加成反应,且核磁共振氢谱的峰面积比为1:1,写出M的结构简式______________________________________。
(3)根据化合物V的结构特征,分析预测其可能的化学性质,完成下表。
序号 反应试剂、条件 反应形成的有机产物的结构简式 反应类型
a ___________ ___________
b 催化剂,加热 ___________ 加聚反应
(4)反应⑥中,Ⅶ与Y反应生成Ⅷ,原子利用率为100%,Y为___________(填化学式)。
(5)关于反应③的说法正确的有___________(填字母)。
A.反应过程中,有键和键的断裂
B.反应过程中,有三键和键的生成
C.反应物Ⅲ中,C原子的杂化方式有和
D.产物Ⅳ中存在手性碳原子
(6)以和为主要原料,利用反应⑤和反应⑧的原理合成化合物Z。
①最后一步反应中,有机反应物是_____________________和___________(写结构简式)。
②从甲苯出发,第一步反应的化学方程式为______________________________________(注明反应条件)。
答案以及解析
1.答案:C
2.答案:B
故选B。
3.答案:A
4.答案:B
5.答案:D
6.答案:D
7.答案:A
8.答案:B
9.答案:C
10.答案:D
11.答案:B
12.答案:C
13.答案:C
14.答案:D
15.答案:(1)共价(1分);X射线衍射仪(1分)
(2),催化与、反应,生成(1分)
(3)、(2分)
(4)16(2分)
(5)(2分)
(6)当滴入最后半滴标准溶液时,溶液褪色且半分钟内不恢复原色(2分);使溶液中过量的受热分解,以免影响后续实验[或除去分解产生的](2分);(或)(2分)
16.答案:(1)-44(2分)
(2)8.3%(2分)
(3)(2分);反应Ⅰ吸热,反应Ⅱ放热,温度从之后,转化率主要取决于反应Ⅰ(2分);0.025(2分);(2分)
(4)BiIn合金(催化剂);相对于Bi催化剂,BiIn合金催化剂对应的活化能更小(能够促进的吸附,增强对*OCHO中间体的吸附)(2分)
17.答案:(1)增加铜和盐酸的接触面积,加快反应速率(2分)
(2)加入蒸馏水后氯离子和浓度减小,使,,反应逆向移动,析出沉淀(2分);(2分);(2分);平面正方形;(2分)(2分);与形成配离子,增强的还原性(2分)
18.答案:(1)2-甲基-1-丙醇(1分);I中存在分子间氢键,与Ⅳ相比具有更强的分子间作用力(1分)
(2)(1分)
(3),催化剂,加热(1分);氧化反应(1分);(2分)
(4)(1分)
(5)AB(2分)
(6)(1分);(2分);+HCl(2分)
可能用到的相对原子质量:H—1、O—16、Mn—55。
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.跨越时间的长河,探寻古文化流传的化学精髓。下列有关古文化的叙述错误的是( )
A.《开宝本草》中记载“取钢煅作叶,……,于醋瓮中阴处埋之一百日,铁上衣生,铁华成矣。”说明铁具有和醋发生反应的性质
B.《天工开物》中记载“西川有火井(),……,一头插入井底,其上曲接,以口紧对釜脐,注卤水釜中,只见火意烘烘,水即滚沸。”说明天然气具有可燃性
C.《格物粗谈·果品》中记载“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”说明乙烷具有催熟的性质
D.《周易参同契》中记载“河上姹女(水银),灵而最神,得火则飞,……,将预制之(HgS),黄芽(硫黄)为根。”说明汞具有与硫反应的性质
2.下列有关物质结构或性质的描述中,错误的是( )
A.硬度:金刚石>碳化硅,是由于金刚石中C原子半径小于碳化硅中硅原子半径,C-C键键长比C-Si键键长短,键能大
B.稳定性:>,是因为分子间含有氢键
C.氯化钠晶体中每个周围紧邻且距离相等的共有12个
D.键角:>,是由于、中心原子孤电子对数不一样
3.下列实验方法及所选玻璃仪器(其他材质仪器任选)均正确的是( )
A.制备硝基苯,仪器为③⑩
B.除去苯中混有的少量苯酚:加入NaOH,然后过滤,仪器为①⑦⑨
C.分离乙醇和的混合液体,直接用蒸馏法,仪器为②③⑤⑥
D.使用酸性重铬酸钾标准溶液通过氧化滴定法测定某未知浓度的溶液的浓度,仪器为④⑦
4.中国茶文化历史悠久。茶叶中含多种茶多酚,其中一种结构如图。下列有关该物质的说法正确的是( )
A.分子式为
B.分子中有2个手性碳
C.不易溶于水,易被氧化
D.1 mol该物质可与10 mol NaOH反应
5.W、X、Y、Z、R为短周期主族元素,原子序数依次增大。W的某种原子核内无中子,X、Y、Z为同周期相邻元素,R的核电荷数是Z的两倍。是一种优良的消毒剂和氧化剂。下列有关说法正确的是( )
A.分子中所有原子都满足8电子稳定结构
B.不稳定易分解的主要原因是分子间氢键较弱
C.R的单质在过量的中完全燃烧,生成
D.W可分别与X、Y、Z形成两种及以上的化合物
6.室温下,下列实验过程和现象能验证相应实验结论的是( )
选项 实验过程和现象 实验结论
A 向溶液通入气体有黑色沉淀生成 酸性:
B 将某铁粉加稀硫酸溶解,再向溶解液中滴加几滴溶液,无明显现象 铁粉未发生变质
C 将相同大小的钠块和钙块放入相同体积的蒸馏水中,钙与水反应不如钠剧烈 金属活动性:
D 向的水溶液中滴加硝酸银溶液无明显现象 该配合物中的配位数是6
7.“84”消毒液与双氧水混合时发生反应:.已知为阿伏加德罗常数的值。下列说法正确的是( )
A.常温下,生成,转移的电子数为2
B.溶液含有的数为0.5
C.含的溶液中含有的键数为3
D.标准状况下,中含有的氢键数为
8.一种以纳米铜()为原料制备的工艺流程如下。
已知:为白色粉末,微溶于水,不溶于乙醇,在潮湿的空气中易被氧化。下列说法错误的是( )
A.“溶解”时X可以是热空气或
B.“还原”时氧化剂与还原剂的物质的量之比为
C.“过滤”用到的玻璃仪器有漏斗、烧杯、玻璃棒
D.为提高的纯度,可采用乙醇洗涤、真空干燥
9.一定条件下,在5L恒容密闭容器中进行反应,在0~2min内,NO的物质的量增加了0.6mol。下列说法错误的是( )
A.在0~1min内,用NO表示的平均速率v(NO)>0.06mol/(L·min)
B.在0~2min内,用表示的平均速率
C.其他条件不变,降低温度,v(正)增大,v(逆)减小
D.其他条件不变,升高温度,v(正)、v(逆)均增大
10.叔丁基溴在纯溶剂中会发生溶剂解,叔丁基溴在水中的溶剂解反应生成两种产物的机理分别为:
下列说法错误的是( )
A.两种机理的控速步骤是相同的
B.两种机理中都用到了孤对电子
C.把叔丁基溴换成叔丁基碘,产物比例不变
D.把换成,消去产物比例减小
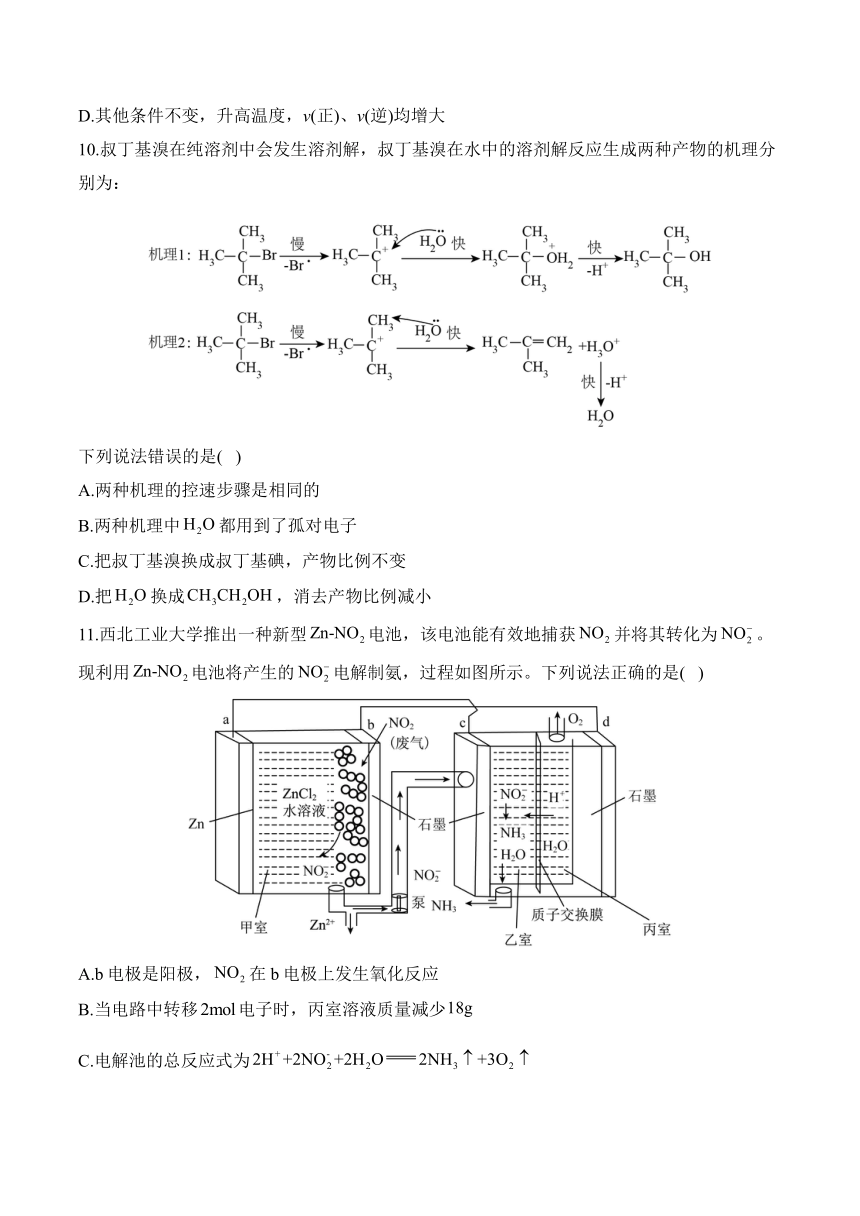
11.西北工业大学推出一种新型电池,该电池能有效地捕获并将其转化为。现利用电池将产生的电解制氨,过程如图所示。下列说法正确的是( )
A.b电极是阳极,在b电极上发生氧化反应
B.当电路中转移电子时,丙室溶液质量减少
C.电解池的总反应式为
D.为增强丙中水的导电性,可以加入一定量的固体
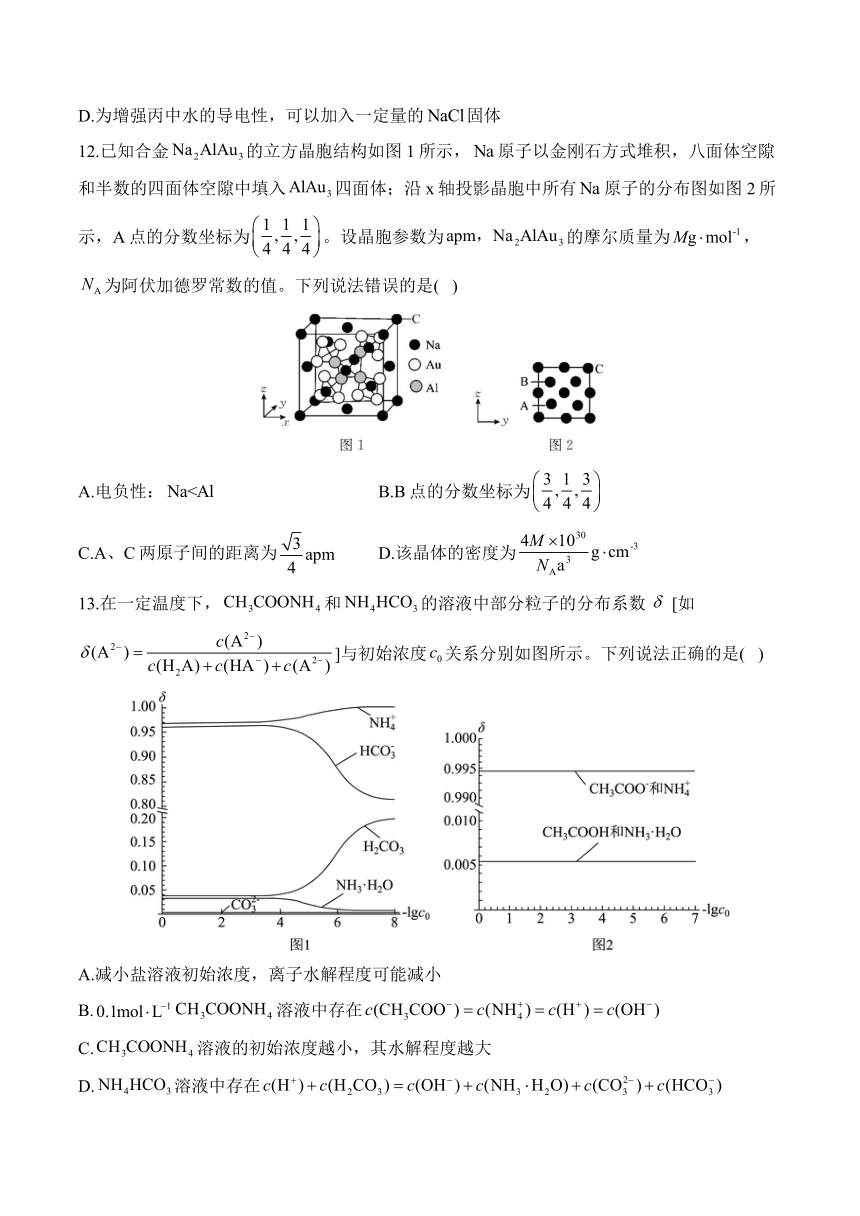
12.已知合金的立方晶胞结构如图1所示,原子以金刚石方式堆积,八面体空隙和半数的四面体空隙中填入四面体;沿x轴投影晶胞中所有原子的分布图如图2所示,A点的分数坐标为。设晶胞参数为的摩尔质量为,为阿伏加德罗常数的值。下列说法错误的是( )
A.电负性: B.B点的分数坐标为
C.A、C两原子间的距离为 D.该晶体的密度为
13.在一定温度下,和的溶液中部分粒子的分布系数[如]与初始浓度关系分别如图所示。下列说法正确的是( )
A.减小盐溶液初始浓度,离子水解程度可能减小
B.溶液中存在
C.溶液的初始浓度越小,其水解程度越大
D.溶液中存在
14.常温下,某溶液A中含有中的若干种,且各离子的物质的量浓度均为0.1,现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是( )
A.溶液A中存在
B.沉淀乙中只有
C.溶液A可能是由按物质的量之比为1:1:1混合而成的溶液
D.要确定A溶液中是否存在或中的一种,能通过检验来确定
二、非选择题:本大题共4小题,共58分。
15.(15分)工业利用软锰矿进行烟气脱硫并制备和的工艺流程如图所示。软锰矿的主要成分是,还含有少量FeO、、、MgO、ZnO、NiO、等物质。
已知:常温下,,。各金属离子开始沉淀和完全沉淀时的pH如表:
金属离子
开始沉淀时的pH 8.8 7.5 2.2 4.1 9.6 6.5 6.4
完全沉淀时的pH 10.8 9.5 3.5 5.4 11.6 8.5 8.4
回答下列问题:
(1)晶体为______________晶体,为测定其结构通常使用的仪器是_____________。
(2)若保持温度不变,“脱硫浸锰”时体系中和随反应时间的变化如图所示。
则导致溶液中和的变化产生明显差异的原因可能是____________________。
(3)“调pH”至5.5左右,则“滤渣2”的成分为_________________(填化学式)。
(4)已知“滤渣3”的主要成分为NiS和ZnS,则“除杂”后的溶液中_______。(当溶液中某离子的物质的量浓度小于或等于时,视作该离子已完全沉淀)
(5)“沉锰”时发生反应的离子方程式为______________________________________。
(6)锰含量测定:为测定产品中锰的含量,取ag样品于烧杯中,加水溶解,加入足量的稀硫酸,再滴加过量的溶液将锰元素转化为,充分反应后加热一段时间,冷却后将烧杯中的溶液配成250mL溶液。取出25.00mL溶液于锥形瓶中,用标准溶液滴定,到达滴定终点时,消耗溶液的体积为VmL。已知:在水溶液中不稳定,会逐渐分解为和。
①滴定终点的现象是____________________________________________。
②“充分反应后加热一段时间”的目的为__________________________________。
③该产品中锰的质量分数为_______(用含a、V的式子表示)。
16.(14分)利用可见光催化还原,将转化为增值化学原料HCOOH、HCHO、等),被认为是一种可持续的资源化有效途径。
(1)已知:
。
__________
(2)在一定温度下,将和通入某恒容密闭容器中,发生反应,测得不同时刻容器中的体积分数如表所示。
t/min 0 10 20 30 40 50
0.250 0.230 0.215 0.205 0.200 0.200
达到平衡时的转化率为____________________(保留1位小数)
(3)将的混合气体充入某密闭容器中,同时发生反应Ⅰ和反应Ⅱ.
反应Ⅰ:。
反应Ⅱ:。
在相同时间内,测得的平衡转化率随温度、压强的变化关系如图甲。
①压强、、由小到大的顺序为___________________;条件下,温度从之后,转化率变化的主要原因是________________________________。
②在一定温度下,向容积为2L的恒容密闭容器中充入和,仅发生反应Ⅱ,起始时容器内气体的总压强为8pkPa,若10min时实验测得的平衡分压为pkPa,则0~10min内,__________,该反应的____________。
(4)Bi与BiIn合金催化剂电化学还原生产HCOOH的催化机理及在催化剂表面还原过程各物质的相对能量变化,如图乙所示(带“*”表示物质处于吸附态)。
从图乙进行分析,两种催化剂中,效果更好的催化剂是_______________________,原因是_________________________________________。
17.(14分)某实验小组在完成铜与浓硫酸、浓硝酸的反应实验后,为了探究铜与浓盐酸的反应,设计了如下实验方案:
实验序号 试管①中试剂 实验现象
A 稀盐酸 无明显现象
B 浓盐酸 铜丝溶解,溶液由无色缓慢变黄最终变为浅蓝色
反应装置图如下:
已知:
物质
颜色 白色 无色 深蓝色 浅蓝色 无色 黄色
I.在实验过程中,甲同学发现铜丝溶解缓慢,溶液中有些许气泡冒出,于是用足量铜粉代替铜丝,重新进行实验。
II.同学们对变黄前的无色溶液的成分进行了讨论,认为其中含有,为了验证猜想,同学们进行了如下实验:
甲同学:将试管①中产生的气体通入试管②中吸收,发现气体通过试管②中足量氢氧化钠溶液后,试管③中仍然有气泡冒出;
乙同学:取试管①无色溶液少许加水稀释发现有白色沉淀生成,对白色沉淀过滤,充分洗涤,进行下列检测实验;
丙同学:取试管①无色溶液少许加入溶液,发现溶液由无色变为黄色,经检测,溶液中含有,放置一段时间后溶液逐渐变为绿色,最终溶液变为浅蓝色。
根据实验现象,回答下列问题:
(1)甲同学用铜粉代替铜丝的目的是____________________________。
(2)a.运用化学平衡原理解释试管①加水稀释后产生白色沉淀的原因____________________________________________。试管③中的气体是_______________填化学式。
b.乙同学实验中,第i步实验的离子方程式为______________________________________。
第ⅱ步深蓝色配离子的空间结构为_________________(填“平面正方形”或“正四面体”)。
c.写出丙同学实验中溶液由无色到浅蓝色的总反应离子方程式_____________________________________________________。
d.结合该实验推测王水溶金实验中(已知可与形成配离子),浓盐酸的作用是_____________________________________________。
18.(15分)一种昆虫信息素的部分合成过程如下(加料顺序、部分反应条件略):
(1)I的名称是_______________,I比Ⅳ沸点更高的原因是_________________________________。
(2)Ⅱ的同分异构体M不能与发生加成反应,且核磁共振氢谱的峰面积比为1:1,写出M的结构简式______________________________________。
(3)根据化合物V的结构特征,分析预测其可能的化学性质,完成下表。
序号 反应试剂、条件 反应形成的有机产物的结构简式 反应类型
a ___________ ___________
b 催化剂,加热 ___________ 加聚反应
(4)反应⑥中,Ⅶ与Y反应生成Ⅷ,原子利用率为100%,Y为___________(填化学式)。
(5)关于反应③的说法正确的有___________(填字母)。
A.反应过程中,有键和键的断裂
B.反应过程中,有三键和键的生成
C.反应物Ⅲ中,C原子的杂化方式有和
D.产物Ⅳ中存在手性碳原子
(6)以和为主要原料,利用反应⑤和反应⑧的原理合成化合物Z。
①最后一步反应中,有机反应物是_____________________和___________(写结构简式)。
②从甲苯出发,第一步反应的化学方程式为______________________________________(注明反应条件)。
答案以及解析
1.答案:C
2.答案:B
故选B。
3.答案:A
4.答案:B
5.答案:D
6.答案:D
7.答案:A
8.答案:B
9.答案:C
10.答案:D
11.答案:B
12.答案:C
13.答案:C
14.答案:D
15.答案:(1)共价(1分);X射线衍射仪(1分)
(2),催化与、反应,生成(1分)
(3)、(2分)
(4)16(2分)
(5)(2分)
(6)当滴入最后半滴标准溶液时,溶液褪色且半分钟内不恢复原色(2分);使溶液中过量的受热分解,以免影响后续实验[或除去分解产生的](2分);(或)(2分)
16.答案:(1)-44(2分)
(2)8.3%(2分)
(3)(2分);反应Ⅰ吸热,反应Ⅱ放热,温度从之后,转化率主要取决于反应Ⅰ(2分);0.025(2分);(2分)
(4)BiIn合金(催化剂);相对于Bi催化剂,BiIn合金催化剂对应的活化能更小(能够促进的吸附,增强对*OCHO中间体的吸附)(2分)
17.答案:(1)增加铜和盐酸的接触面积,加快反应速率(2分)
(2)加入蒸馏水后氯离子和浓度减小,使,,反应逆向移动,析出沉淀(2分);(2分);(2分);平面正方形;(2分)(2分);与形成配离子,增强的还原性(2分)
18.答案:(1)2-甲基-1-丙醇(1分);I中存在分子间氢键,与Ⅳ相比具有更强的分子间作用力(1分)
(2)(1分)
(3),催化剂,加热(1分);氧化反应(1分);(2分)
(4)(1分)
(5)AB(2分)
(6)(1分);(2分);+HCl(2分)
同课章节目录
