苏教版高中化学选择性必修2专题4分子空间结构与物质性质综合微评(四)课件(共31张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修2专题4分子空间结构与物质性质综合微评(四)课件(共31张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-12 00:00:00 | ||
图片预览










文档简介
(共31张PPT)
专题4 分子空间结构与物质性质
综合微评(四)
一、选择题(本题共14小题,每小题3分,共42分,每小题只有一个选项符合题意)
A. 分子中既有σ键又有π键
B. 所有原子在同一平面内
C. CF4与CH4都是正四面体结构
D. 0.1 mol SF5—CF3分子中含8 mol电子
解析:由分子的组成知,各原子均形成单键,即σ键,A错误;S和C原子形成的杂化 轨道构型均为立体结构,不是所有的原子都共面,B错误;CF4与CH4都是正四面体结 构,C正确;1个SF5—CF3分子所含电子数为94,则 0.1 mol SF5—CF3分子中含9.4 mol 电子,D错误。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. CCl2F2
B. CH3CH2OH
C.
D.
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. 用毛皮摩擦过的橡胶棒靠近细水流,水流方向发生偏转
B. 常温常压下,CO2为气体,CS2为液体
C. NH3易溶于水,难溶于CCl4
D. N2的沸点比CO的低
解析:用毛皮摩擦过的橡胶棒带电,水有极性,故水流方向发生变化,故与分子极性 有关,A不符合题意;CO2和CS2都是非极性分子,常温常压下,CO2为气体,CS2为 液体,原因是CS2相对分子质量更大,与极性无关,B符合题意;NH3是极性分子,水 是极性分子,根据相似相溶规则,NH3易溶于水,CCl4是非极性分子,根据相似相溶 规则,NH3难溶于CCl4,C不符合题意;氮气和CO的相对分子质量相同,极性越大范 德华力越大,N2的沸点比CO低是因为CO极性大,D不符合题意。故选B。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. NH3分子为三角锥形,N发生sp3杂化
B. 杂化轨道只适用于形成共价键
C. SCl2属于AB2型共价化合物,中心原子S采取sp杂化轨道成键
D. 价层电子对互斥模型中,π键电子对数也要计入中心原子的价层电子对数
解析:NH3分子为三角锥形,N发生sp3杂化,A正确;杂化轨道适用于形成共价键, 或者收纳孤电子对,故B错误;SCl2属于AB2型共价化合物,中心原子S采取sp3杂化轨 道成键,分子空间构型为V形,不是直线形,故C错误;价层电子对互斥模型中,σ键 和孤电子对计入中心原子的价层电子对数,而π键不计入,故D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. CS2在水中的溶解度很小,是由于其属于极性分子
B. SO2和NH3均易溶于水,原因之一是它们都是极性分子
C. CS2为非极性分子,所以在三种物质中熔沸点最低
D. NH3在水中溶解度很大只是由于NH3分子有极性
解析:CS2与二氧化碳相似,都是直线形分子,为非极性分子,而水是极性溶剂,根 据相似相溶规则,则二硫化碳在水中的溶解度不大,A错误;二氧化硫为V形分子, 氨气为三角锥形分子,都是极性分子,所以易溶于水,B正确;二硫化碳为非极性分 子,常温下为液体,但二氧化硫、氨气在常温下均为气体,所以二硫化碳的熔、沸点 最高,C错误;氨气在水中的溶解度大不仅仅是因为氨气分子有极性,还因为氨气与 水分子间能形成氢键,增大氨气的溶解度,D错误。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. 配位体是Cl-和H2O,配位数是6
B. 中心离子是Ti2+,配离子是[TiCl(H2O)5]2+
C. 内界和外界中的Cl-的数目比是1∶2
D. 1 mol [TiCl(H2O)5]Cl2·H2O与足量AgNO3溶液反应,产生2 mol AgCl
解析:配合物[TiCl(H2O)5]Cl2·H2O中,配位体是Cl-和H2O,配位数是1+5=6,A 不符合题意;配合物[TiCl(H2O)5]Cl2·H2O中,中心离子是Ti3+,内配离子是Cl-, 外配离子是Cl-,B符合题意;配合物[TiCl(H2O)5]Cl2·H2O中,内配离子Cl-数目为 1,外配离子Cl-数目为2,内界和外界中的Cl-的数目比是1∶2,C不符合题意;加入 足量AgNO3溶液,外界离子Cl-与Ag+反应,内配离子Cl-不与Ag+反应,1 mol [TiCl (H2O)5]Cl2·H2O与足量AgNO3溶液反应,产生2 mol AgCl,D不符合题意。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. 碳、氮原子的杂化类型相同
B. 氨基乙酸钠中心原子N原子的价层电子对数为4
C. 1 mol氨基乙酸钠分子中所含σ键为10 mol
D. 氮原子和与其成键的另外三个原子在同一平面内
解析:氨基乙酸钠分子中氮原子是sp3杂化,而碳原子是sp3、sp2杂化,A错误;氨基 乙酸钠中存在2个N—H键、1个C—N键,N原子上含有1对孤电子对,价层电子对数= 共价键单键数+孤电子对数,则N原子的价层电子对数为4,B正确;1 mol氨基乙酸 钠分子中有1 mol碳氧双键,有8 mol σ键,C错误;由于氮原子为sp3杂化,故相应的 四个原子形成的是三角锥形结构,不可能共平面,D错误。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. 分子中只有极性键
B. CH4分子中含有极性共价键,是极性分子
C. CO2分子中的化学键为非极性键
D. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
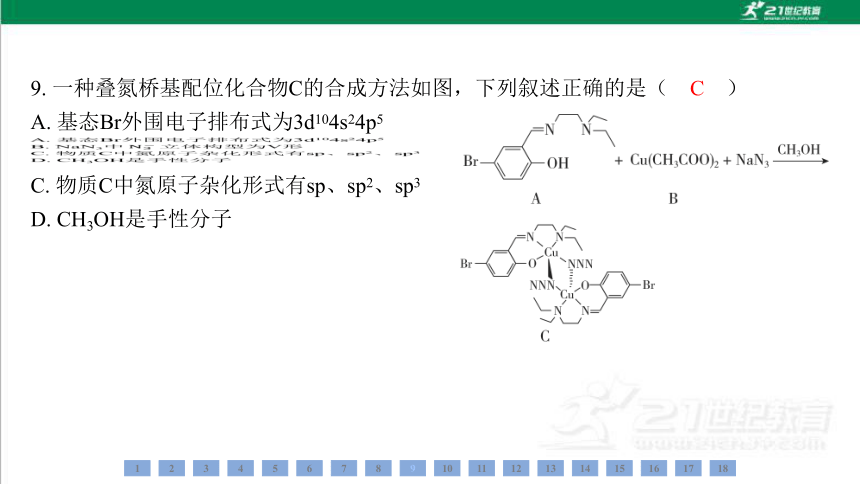
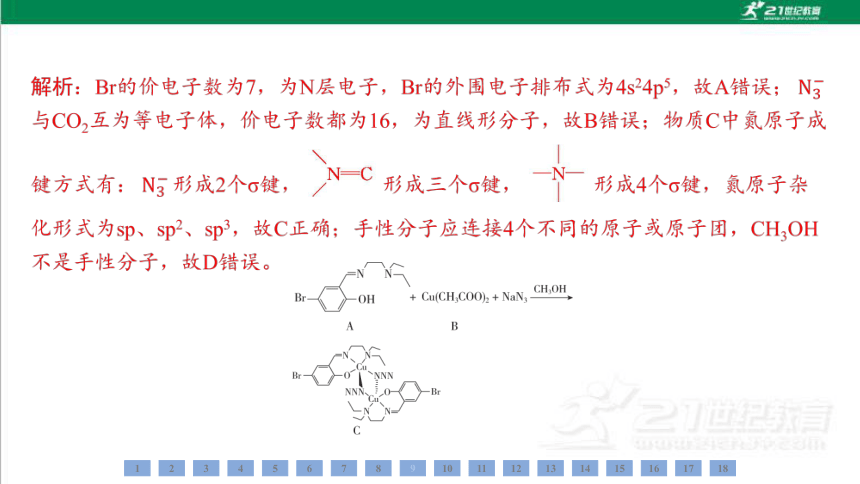
A. 基态Br外围电子排布式为3d104s24p5
C. 物质C中氮原子杂化形式有sp、sp2、sp3
D. CH3OH是手性分子
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
用该溶液做实验,溶液的颜色变化如下:
D
A. 由实验①可推知Δ H <0
B. 等物质的量的[Co(H2O)6]2+和[CoCl4]2-中σ键数之比为7∶2
C. 实验②是由于 c (H2O)增大,导致平衡逆向移动
D. 由实验③可知稳定性:[ZnCl4]2->[CoCl4]2-
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. 只存在极性共价键
B. S的杂化方式为sp3
C. SCN-中与Fe3+配位的原子是N
D. [Fe(SCN)(H2O)5]2+中H—O—H的键角大于配位前水分子中该键角
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. 向配合物[TiCl(H2O)5]Cl2·H2O的溶液中加入足量的AgNO3溶液,所有的Cl-均被 完全沉淀
B. 配合物Ni(CO)4常温下呈液态,易溶于CCl4、苯等有机溶剂
D. 配合物[Ag(NH3)2]OH的配位数为6
B. 斜方硫和单斜硫都易溶于CS2,是因为这两种物质的分子都属于非极性分子
C. PH3和H2O分子中均含有孤电子对,且PH3提供孤电子对的能力强于H2O
D. 键能O—H>S—H>Se—H>Te—H,因此水的沸点在同族氢化物中最高
B
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. 每个原子都达到8电子稳定结构
B. 键角(Cl—R—Cl)有90°、120°、180°几种
C. RCl5受热后会分解生成分子的空间结构呈三角锥形的RCl3
D. 分子中5个R—Cl键的键能不都相同
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
二、非选择题(本题共4小题,共58分)
15. (14分)(1)配位化学创始人维尔纳发现,取CoCl3·6NH3(黄色)、CoCl3·5NH3 (紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)四种化合物各1 mol,分别 溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3 mol、2 mol、1 mol和1 mol。
①请根据实验事实用配合物的形式写出它们的化学式。
[Co(NH3)6]Cl3
[Co(NH3)5(Cl)]Cl2
[Co(NH3)4(Cl)2]Cl
空间构型不同
6
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
空轨道
孤电子对
[Fe(SCN)]Cl2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析:(1)Fe为26号元素,位于元素周期表的第4周期、Ⅷ族。
第4周期、Ⅷ族
N
>C>Fe
直线形
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
6
加入硫酸后,溶液酸性增强,H+与邻二氮菲配位能力增强,使得Fe2+与邻二
氮菲配合物浓度降低,颜色变浅
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析:(4)①配合物Fe(CO) n 的中心原子价电子数与配位体提供的电子数之和为 18,则8+2 n =18,解得 n =5,Fe(CO)5中Fe与CO之间形成配位键,则Fe(CO)5 在一定条件下分解生成Fe和CO过程中,断裂的化学键只有配位键,由于反应生成 Fe,故形成了金属键;②CO的结构式C≡O,三键中存在1个σ键和两个π键,1 mol该 配合物中含有的π键数目为10 NA。
金属键
C≡O
10 NA
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
17. (15分)请根据所学知识,回答下列问题:
解析:(1)NH4NO3中存在N—H共价键和N—O共价键,铵根离子与硝酸根离子之间 存在离子键,故含有化学键的类型为离子键、共价键。
离子键、共价键
平面三角形
sp2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析:(3)能和硝酸银反应生成白色沉淀的是配合物中外界氯离子, n (AgNO3) =2 mol·L-1×0.05 L=0.1 mol,0.1 mol CrCl3·6H2O和0.1 mol硝酸银反应生成氯化银沉 淀,所以该配合物外界氯离子个数是1,则有2个氯离子是配位离子,该配合物的配位 数是6,所以有4个水分子是配体,则该配合物的化学式为[CrCl2(H2O)4]Cl·2H2O; 根据核外电子排布规律可以写出基态铬电子排布式为1s22s22p63s23p63d54s1,所以基态 铬(Cr)原子的价电子排布式是3d54s1。
[CrCl2(H2O)4]Cl·2H2O
3d54s1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
正四面体形
H>B>Li
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析:(5)丙酮(CH3 CH3)分子中甲基上的碳原子为sp3杂化,羰基上的碳原子 为sp2杂化;单键全为σ键,1个双键中含有1个π键和1个σ键,故1 mol丙酮中含有1 mol π键和9 mol σ键,含有的π键与σ键数目之比为1∶9。
解析:(6)第一电离能 I1(Zn)大于 I1(Cu),原因是Cu的价电子排布为3d104s1, 较易失电子。
sp3、sp2
1∶9
大于
Zn价电子排布为3d104s2,Cu价电子排布为3d104s1,Cu较易失电子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析:(1)基态Cr原子价层电子轨道表示式为 ;Cr 最外层电子数为1,同周期元素的基态原子最外层电子数为1的元素还有2种,分别是 K和Cu。
2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析:(3)同周期主族元素从左到右电负性依次增强,电负性O>N>C,4种元素中 H元素电负性最弱,所以电负性由大到小的顺序是O>N>C>H。
正四面
体形
7∶1
O>N>C>H
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析:(4)1 mol [Cr(NH3)3(H2O)2Cl]2+中3 mol NH3共含9 mol N—H σ键,2 mol H2O共含4 mol O—H σ键,三价铬离子提供空轨道与3 mol NH3形成3 mol配位键, 与2 mol H2O形成2 mol配位键,与1 mol Cl-形成1 mol配位键,所以σ键的数目为(9+ 4+3+2+1) NA=19 NA;基态N原子电子排布式为1s22s22p3,电子占据的最高能级为 2p,其电子云轮廓图为哑铃形。
19 NA
哑铃
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
sp3
小
于
H2O中O和NH3中
N均为sp3杂化,O有两对孤电子对,N有一对孤电子对,孤电子对越多,排斥力越
大,键角越小
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
专题4 分子空间结构与物质性质
综合微评(四)
一、选择题(本题共14小题,每小题3分,共42分,每小题只有一个选项符合题意)
A. 分子中既有σ键又有π键
B. 所有原子在同一平面内
C. CF4与CH4都是正四面体结构
D. 0.1 mol SF5—CF3分子中含8 mol电子
解析:由分子的组成知,各原子均形成单键,即σ键,A错误;S和C原子形成的杂化 轨道构型均为立体结构,不是所有的原子都共面,B错误;CF4与CH4都是正四面体结 构,C正确;1个SF5—CF3分子所含电子数为94,则 0.1 mol SF5—CF3分子中含9.4 mol 电子,D错误。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. CCl2F2
B. CH3CH2OH
C.
D.
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. 用毛皮摩擦过的橡胶棒靠近细水流,水流方向发生偏转
B. 常温常压下,CO2为气体,CS2为液体
C. NH3易溶于水,难溶于CCl4
D. N2的沸点比CO的低
解析:用毛皮摩擦过的橡胶棒带电,水有极性,故水流方向发生变化,故与分子极性 有关,A不符合题意;CO2和CS2都是非极性分子,常温常压下,CO2为气体,CS2为 液体,原因是CS2相对分子质量更大,与极性无关,B符合题意;NH3是极性分子,水 是极性分子,根据相似相溶规则,NH3易溶于水,CCl4是非极性分子,根据相似相溶 规则,NH3难溶于CCl4,C不符合题意;氮气和CO的相对分子质量相同,极性越大范 德华力越大,N2的沸点比CO低是因为CO极性大,D不符合题意。故选B。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. NH3分子为三角锥形,N发生sp3杂化
B. 杂化轨道只适用于形成共价键
C. SCl2属于AB2型共价化合物,中心原子S采取sp杂化轨道成键
D. 价层电子对互斥模型中,π键电子对数也要计入中心原子的价层电子对数
解析:NH3分子为三角锥形,N发生sp3杂化,A正确;杂化轨道适用于形成共价键, 或者收纳孤电子对,故B错误;SCl2属于AB2型共价化合物,中心原子S采取sp3杂化轨 道成键,分子空间构型为V形,不是直线形,故C错误;价层电子对互斥模型中,σ键 和孤电子对计入中心原子的价层电子对数,而π键不计入,故D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. CS2在水中的溶解度很小,是由于其属于极性分子
B. SO2和NH3均易溶于水,原因之一是它们都是极性分子
C. CS2为非极性分子,所以在三种物质中熔沸点最低
D. NH3在水中溶解度很大只是由于NH3分子有极性
解析:CS2与二氧化碳相似,都是直线形分子,为非极性分子,而水是极性溶剂,根 据相似相溶规则,则二硫化碳在水中的溶解度不大,A错误;二氧化硫为V形分子, 氨气为三角锥形分子,都是极性分子,所以易溶于水,B正确;二硫化碳为非极性分 子,常温下为液体,但二氧化硫、氨气在常温下均为气体,所以二硫化碳的熔、沸点 最高,C错误;氨气在水中的溶解度大不仅仅是因为氨气分子有极性,还因为氨气与 水分子间能形成氢键,增大氨气的溶解度,D错误。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. 配位体是Cl-和H2O,配位数是6
B. 中心离子是Ti2+,配离子是[TiCl(H2O)5]2+
C. 内界和外界中的Cl-的数目比是1∶2
D. 1 mol [TiCl(H2O)5]Cl2·H2O与足量AgNO3溶液反应,产生2 mol AgCl
解析:配合物[TiCl(H2O)5]Cl2·H2O中,配位体是Cl-和H2O,配位数是1+5=6,A 不符合题意;配合物[TiCl(H2O)5]Cl2·H2O中,中心离子是Ti3+,内配离子是Cl-, 外配离子是Cl-,B符合题意;配合物[TiCl(H2O)5]Cl2·H2O中,内配离子Cl-数目为 1,外配离子Cl-数目为2,内界和外界中的Cl-的数目比是1∶2,C不符合题意;加入 足量AgNO3溶液,外界离子Cl-与Ag+反应,内配离子Cl-不与Ag+反应,1 mol [TiCl (H2O)5]Cl2·H2O与足量AgNO3溶液反应,产生2 mol AgCl,D不符合题意。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. 碳、氮原子的杂化类型相同
B. 氨基乙酸钠中心原子N原子的价层电子对数为4
C. 1 mol氨基乙酸钠分子中所含σ键为10 mol
D. 氮原子和与其成键的另外三个原子在同一平面内
解析:氨基乙酸钠分子中氮原子是sp3杂化,而碳原子是sp3、sp2杂化,A错误;氨基 乙酸钠中存在2个N—H键、1个C—N键,N原子上含有1对孤电子对,价层电子对数= 共价键单键数+孤电子对数,则N原子的价层电子对数为4,B正确;1 mol氨基乙酸 钠分子中有1 mol碳氧双键,有8 mol σ键,C错误;由于氮原子为sp3杂化,故相应的 四个原子形成的是三角锥形结构,不可能共平面,D错误。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. 分子中只有极性键
B. CH4分子中含有极性共价键,是极性分子
C. CO2分子中的化学键为非极性键
D. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. 基态Br外围电子排布式为3d104s24p5
C. 物质C中氮原子杂化形式有sp、sp2、sp3
D. CH3OH是手性分子
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
用该溶液做实验,溶液的颜色变化如下:
D
A. 由实验①可推知Δ H <0
B. 等物质的量的[Co(H2O)6]2+和[CoCl4]2-中σ键数之比为7∶2
C. 实验②是由于 c (H2O)增大,导致平衡逆向移动
D. 由实验③可知稳定性:[ZnCl4]2->[CoCl4]2-
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. 只存在极性共价键
B. S的杂化方式为sp3
C. SCN-中与Fe3+配位的原子是N
D. [Fe(SCN)(H2O)5]2+中H—O—H的键角大于配位前水分子中该键角
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. 向配合物[TiCl(H2O)5]Cl2·H2O的溶液中加入足量的AgNO3溶液,所有的Cl-均被 完全沉淀
B. 配合物Ni(CO)4常温下呈液态,易溶于CCl4、苯等有机溶剂
D. 配合物[Ag(NH3)2]OH的配位数为6
B. 斜方硫和单斜硫都易溶于CS2,是因为这两种物质的分子都属于非极性分子
C. PH3和H2O分子中均含有孤电子对,且PH3提供孤电子对的能力强于H2O
D. 键能O—H>S—H>Se—H>Te—H,因此水的沸点在同族氢化物中最高
B
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
A. 每个原子都达到8电子稳定结构
B. 键角(Cl—R—Cl)有90°、120°、180°几种
C. RCl5受热后会分解生成分子的空间结构呈三角锥形的RCl3
D. 分子中5个R—Cl键的键能不都相同
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
二、非选择题(本题共4小题,共58分)
15. (14分)(1)配位化学创始人维尔纳发现,取CoCl3·6NH3(黄色)、CoCl3·5NH3 (紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)四种化合物各1 mol,分别 溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3 mol、2 mol、1 mol和1 mol。
①请根据实验事实用配合物的形式写出它们的化学式。
[Co(NH3)6]Cl3
[Co(NH3)5(Cl)]Cl2
[Co(NH3)4(Cl)2]Cl
空间构型不同
6
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
空轨道
孤电子对
[Fe(SCN)]Cl2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析:(1)Fe为26号元素,位于元素周期表的第4周期、Ⅷ族。
第4周期、Ⅷ族
N
>C>Fe
直线形
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
6
加入硫酸后,溶液酸性增强,H+与邻二氮菲配位能力增强,使得Fe2+与邻二
氮菲配合物浓度降低,颜色变浅
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析:(4)①配合物Fe(CO) n 的中心原子价电子数与配位体提供的电子数之和为 18,则8+2 n =18,解得 n =5,Fe(CO)5中Fe与CO之间形成配位键,则Fe(CO)5 在一定条件下分解生成Fe和CO过程中,断裂的化学键只有配位键,由于反应生成 Fe,故形成了金属键;②CO的结构式C≡O,三键中存在1个σ键和两个π键,1 mol该 配合物中含有的π键数目为10 NA。
金属键
C≡O
10 NA
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
17. (15分)请根据所学知识,回答下列问题:
解析:(1)NH4NO3中存在N—H共价键和N—O共价键,铵根离子与硝酸根离子之间 存在离子键,故含有化学键的类型为离子键、共价键。
离子键、共价键
平面三角形
sp2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析:(3)能和硝酸银反应生成白色沉淀的是配合物中外界氯离子, n (AgNO3) =2 mol·L-1×0.05 L=0.1 mol,0.1 mol CrCl3·6H2O和0.1 mol硝酸银反应生成氯化银沉 淀,所以该配合物外界氯离子个数是1,则有2个氯离子是配位离子,该配合物的配位 数是6,所以有4个水分子是配体,则该配合物的化学式为[CrCl2(H2O)4]Cl·2H2O; 根据核外电子排布规律可以写出基态铬电子排布式为1s22s22p63s23p63d54s1,所以基态 铬(Cr)原子的价电子排布式是3d54s1。
[CrCl2(H2O)4]Cl·2H2O
3d54s1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
正四面体形
H>B>Li
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析:(5)丙酮(CH3 CH3)分子中甲基上的碳原子为sp3杂化,羰基上的碳原子 为sp2杂化;单键全为σ键,1个双键中含有1个π键和1个σ键,故1 mol丙酮中含有1 mol π键和9 mol σ键,含有的π键与σ键数目之比为1∶9。
解析:(6)第一电离能 I1(Zn)大于 I1(Cu),原因是Cu的价电子排布为3d104s1, 较易失电子。
sp3、sp2
1∶9
大于
Zn价电子排布为3d104s2,Cu价电子排布为3d104s1,Cu较易失电子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析:(1)基态Cr原子价层电子轨道表示式为 ;Cr 最外层电子数为1,同周期元素的基态原子最外层电子数为1的元素还有2种,分别是 K和Cu。
2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析:(3)同周期主族元素从左到右电负性依次增强,电负性O>N>C,4种元素中 H元素电负性最弱,所以电负性由大到小的顺序是O>N>C>H。
正四面
体形
7∶1
O>N>C>H
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析:(4)1 mol [Cr(NH3)3(H2O)2Cl]2+中3 mol NH3共含9 mol N—H σ键,2 mol H2O共含4 mol O—H σ键,三价铬离子提供空轨道与3 mol NH3形成3 mol配位键, 与2 mol H2O形成2 mol配位键,与1 mol Cl-形成1 mol配位键,所以σ键的数目为(9+ 4+3+2+1) NA=19 NA;基态N原子电子排布式为1s22s22p3,电子占据的最高能级为 2p,其电子云轮廓图为哑铃形。
19 NA
哑铃
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
sp3
小
于
H2O中O和NH3中
N均为sp3杂化,O有两对孤电子对,N有一对孤电子对,孤电子对越多,排斥力越
大,键角越小
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
