苏教版高中化学选择性必修2专题1揭示物质结构的奥秘第一单元物质结构研究的内容课件(共42张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修2专题1揭示物质结构的奥秘第一单元物质结构研究的内容课件(共42张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-12 10:28:27 | ||
图片预览











文档简介
(共42张PPT)
专题1 揭示物质结构的奥秘
第一单元 物质结构研究的内容
学习目标:1.能描述常见物质的微观结构,分析物质结构与其性质之间的关系。2.能 从物质的微观结构出发解释或预测物质的宏观性质。3.认识物质结构研究对化学科学 发展的重要意义。
第*页
研习任务一 认识物质的特征结构
元素原子最外层电子排布的周期性
最外电子层
金属性
非金属性
静电作
用力
2. 从化学键认识化学反应
(2)氮气分子含有氮氮三键,通常情况下很稳定,难以参加化学反应。所以固氮时 需要改变条件,氮气在高温、高压、催化剂的情况下,能与氢气化合生成NH3。
失去1个H
失去1个H
氧化反应
问题 探讨
1. 假设你是一位化学科研工作者,在研究物质的特征结构时需要思考哪些问题?
提示:同一元素或不同种元素的原子之间为什么能彼此结合?为什么物质中直接相邻 原子之间的化学键类型不同?为什么原子、分子或离子可以构成不同的晶体?晶体中 的微粒间是通过怎样的相互作用结合的?为什么分子具有一定的空间构型?为什么有 机化合物有同分异构体现象?为什么有些元素能形成几种同素异形体?等等。
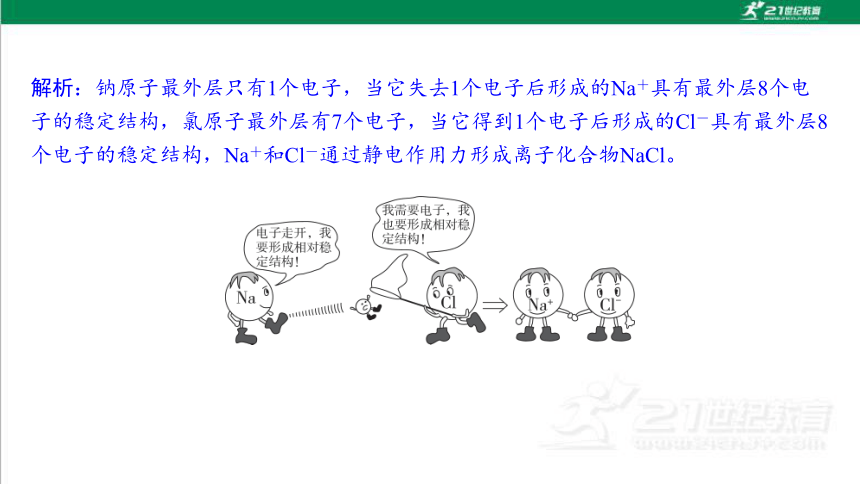
2. 用电子式表示NaCl的形成过程。
A. 除最外层外,原子各电子层上电子数均已达到2 n2个电子
B. 最外层只有一个电子的原子失去1个电子后,都变成稀有气体元素原子的电子层结 构
C. 金属元素与非金属元素结合形成的化合物都是离子化合物
D. 同主族元素中(稀有气体元素除外),一般原子半径越大,金属性越强
D
A. 钠原子易失去1个电子,氯原子易得到1个电子
B. 钠离子与钠原子有相似的化学性质
C. 钠原子与氯原子作用生成NaCl后,其稳定性增强
D. 氯化钠是离子化合物
B
解析:钠原子最外层只有1个电子,当它失去1个电子后形成的Na+具有最外层8个电 子的稳定结构,氯原子最外层有7个电子,当它得到1个电子后形成的Cl-具有最外层8 个电子的稳定结构,Na+和Cl-通过静电作用力形成离子化合物NaCl。
A. 碘升华
B. 酒精溶于水
C. 氢氧化钠晶体受热熔化
D. 一定条件下O3转化为O2
解析:碘升华,属于物理变化,没有化学键断裂和形成,故不选A;酒精溶于水,属 于物理变化,没有化学键断裂和形成,故不选B;氢氧化钠晶体受热熔化,属于物理 变化,氢氧化钠电离为自由移动的钠离子和氢氧根离子,有离子键断裂,没有化学键 形成,故不选C;O3转化成O2是化学变化,既有旧化学键断裂,又有新化学键形成, 故选D。
D
A. O4与O3、O2互为同分异构体
B. O4比O2活泼的根本原因是O4中的化学键比O2中的易断裂
C. 相同质量的O4与O3所含原子个数比为4∶3
D. O4的两种结构互为同分异构体
B
解析:O4是一种新的氧分子,故与O3、O2互为同素异形体,A项错误;O2能在自然界 稳定存在,化学性质较稳定,故O2中的化学键不如O4中的化学键更容易断裂,B项正 确;相同质量时,O4与O3中所含氧原子个数比为1∶1,C项错误;两者均为单质,不 属于同分异构体,D项错误。
第*页
研习任务二 揭示物质结构与性质的关系
教材 认知
物质的结构决定物质的性质,物质的性质反映物质的结构。
1. 同素异形体
(1)概念: 。
(2)性质:同素异形体的物理性质 ,化学性质 。同素异形体性质 不同的原因是组成它们的结构的微粒排列方式不同。
由同一种元素形成的不同单质
不同
相似
2. 磷的两种同素异形体——白磷和红磷
白磷晶体是由白磷分子(P4)组成的分子晶体,分子呈正四面体结构,分子中P—P键 键长是221 pm,键角∠PPP是60°,因其中的P—P键弯曲而具有较大的张力,其键能 较 ,易 ,所以白磷在常温、常压下就有很高的 。而红磷 的链状结构比较 ,室温下 氧气反应。
白磷分子的正四面体结构
小
断裂
反应活性
稳定
不与
3. 碳的五种同素异形体
问题 探讨
1. 你能列举物质结构决定物质性质的实例吗?
提示:元素原子结构决定元素的性质;不同微粒靠不同的作用力构成不同的晶体;同 分异构体等。
2. 为什么白磷比红磷活泼,氧气比氮气活泼?
提示:白磷分子是正四面体结构,键角小,结构不太稳定,红磷结构要比白磷复杂得 多,也稳定得多,所以性质上也比白磷稳定。氧气比氮气活泼可从原子结构和分子结 构两方面找原因,以分子结构因素为主。N2分子以共价三键结合,比O2的键能大得 多。N2分子不易打开,性质稳定,O2分子较易打开化学键,一经打开,O原子又比N 原子易得电子,所以氧气更活泼。
3. 为什么分子组成都是C2H6O的乙醇和二甲醚在性质上差异很大?
提示:因为它们的结构不同。
4. 碳的同素异形体(金刚石、石墨、C60和碳纳米管等)在性质和用途上有极大差异 的原因是什么?
提示:碳原子与碳原子之间的连接方式不同,导致了它们形成的物质性质不同。
应用 体验
A. 金刚石与碳纳米管互为同素异形体
B. N5与N2互为同素异形体
C. 14C的质子数为14
D. C原子半径比N原子半径大
解析:同素异形体是同种元素形成的不同单质。金刚石和碳纳米管、N5和N2都互为同 素异形体;14C的质子数为6;C原子半径大于N原子半径。
C
A. H2和D2互为同素异形体
C. CH3CH2OH和CH3—O—CH3互为同分异构体
D. 水和冰是同一种物质
解析:H2和D2是由氢元素的不同同位素形成的氢气单质,既不是同位素,也不是同素 异形体,故选A。
A
A. 不同雪花中含有的H2O分子数不同
B. 不同雪花中含有相同数目的水分子
C. 不同雪花的化学性质不同
D. 不同雪花中水分子的空间排列方式不同
解析:雪花均由水分子构成,其化学性质相同;由于水分子空间排列方式不同造成了 雪花的形状不同,世界上没有两片形状完全相同的雪花,说明不同雪花中水分子的空 间排列有差异。
D
A. 物质的结构反映物质的性质,物质的性质决定物质的结构
B. 物质的结构包括构成物质的微粒之间的相互作用,分子的构型、手性等
C. 物质的结构随着人们的认识或研究的程度经常发生一些小的变化
D. 物质的结构有宏观和微观两方面的认识,从宏观上说物质是由元素组成的,从微 观上说物质是由分子构成的
解析:物质的结构决定物质的性质,A项错误;物质的结构指的是构成物质的微粒、 微粒间的作用力及微粒的排列方式等,B项正确;物质的结构是自然存在的,只是人 们认识物质结构的过程在逐步深入,C项错误;从微观上说,构成物质的微粒有分 子,也有原子、离子等,D项错误。
B
(1)物质结构与性质关系的研究过程
(2)
第*页
课堂强研习 合作学习 精研重难
课时作业
A. 化学是在质子变化的层次上研究物质的一门基础学科
B. 化学学科的特征是从宏观和微观两个角度认识物质
C. 化学学科研究物质性质但不能创造出新物质
D. 化学学科表征物质的方法与物理学科完全相同
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 一氧化碳具有还原性,二氧化碳没有,是由于分子构成不同
B. 铁在空气中易生锈,铝在空气中抗腐蚀能力很强,是由于金属活动性顺序不同
C. 金刚石是无色透明的晶体,石墨是黑色的有金属光泽的细鳞片状固体,是由于碳 原子的排列方式不同
D. 铁块在空气中不能燃烧,纳米级铁粉在空气中可以自燃,是由于铁与空气的接触 面积不同
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 核聚变为放热反应
B. 聚变发电有利于减少碳排放量
C. 聚变发电,可使核能全部转化成电能
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 12C、13C、14C都属于碳的同素异形体
B. CaC2晶体中存在离子键和共价键
C. CH4的空间填充模型如图所示
D. 石墨烯属于芳香烃的一种
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. X的质子数为33
D. X的质量数为92
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 乙醇和丙三醇互为同系物
B. 35Cl和37Cl互为同位素
C. O2和O3互为同素异形体
D. 丙酮( )和环氧丙烷( )互为同分异构体
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:结构相似,组成上相差若干个CH2原子团的有机化合物为同系物,乙醇 (CH3CH2OH)是饱和一元醇,丙三醇是饱和三元醇,两者所含官能团数目不同,不 互为同系物,A错误;质子数相同、中子数不同的同种元素互为同位素,35Cl的质子 数为17,中子数为18,37Cl的质子数为17,中子数为20,两者质子数相同、中子数不 同,互为同位素,B正确;由同种元素组成的不同的单质互为同素异形体,O2和O3是 由氧元素组成的不同的单质,两者互为同素异形体,C正确;分子式相同、结构不同 的化合物互为同分异构体,丙酮和环氧丙烷的分子式相同、结构不同,两者互为同分 异构体,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. X的中子数为2
B. X、Y互为同位素
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 该物质的分子式为SN
B. 该物质的分子中只含共价键
C. 该物质是离子化合物
D. 该物质与化合物S2N2互为同素异形体
解析:A项,该化合物分子式为S4N4;C项,该物质中只含共价键,故不是离子化合 物;D项,同素异形体研究对象是单质。
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 它是制造飞机的理想材料
B. 它的主要组成元素是碳
C. 它的结构与石墨不同
D. 碳纤维复合材料为一种高分子化合物
解析:碳纤维显然主要是由碳元素组成,B正确,D错误;碳纤维具有“强度高、刚 度大、密度小、熔点高、化学稳定性好”的特点,A正确;由于碳纤维的物理性质不 同于石墨,所以它们的结构不同,C正确。
D
1
2
3
4
5
6
7
8
9
10
11
12
B. N60的发现开辟了能源世界的新天地,将来可能成为很好的火箭燃料
C
1
2
3
4
5
6
7
8
9
10
11
12
11. 有下列几组物质:
②石墨与富勒烯
③硝基丙烷(CH3CH2CH2NO2)与丙氨酸( )
④CH3CH2CH2CH3和
⑤天然气的主要成分与沼气的主要成分
⑥HF与HCl
1
2
3
4
5
6
7
8
9
10
11
12
对各组物质的性质异同点进行分析,请用数字序号回答问题:
(1)互为同素异形体的是 。
(2)互为同分异构体的是 。
(3)互为同位素的是 。
(4)属于同一化合物的是 。
②
③④
①
⑤
1
2
3
4
5
6
7
8
9
10
11
12
B. 钋元素的相对原子质量为210
C. 210Po比209Po原子核多一个中子
D. 研究表明,烟草中含有210Po和210Pb等,它们互为同位素
82
124
C
1
2
3
4
5
6
7
8
9
10
11
12
47.09 g
1
2
3
4
5
6
7
8
9
10
11
12
专题1 揭示物质结构的奥秘
第一单元 物质结构研究的内容
学习目标:1.能描述常见物质的微观结构,分析物质结构与其性质之间的关系。2.能 从物质的微观结构出发解释或预测物质的宏观性质。3.认识物质结构研究对化学科学 发展的重要意义。
第*页
研习任务一 认识物质的特征结构
元素原子最外层电子排布的周期性
最外电子层
金属性
非金属性
静电作
用力
2. 从化学键认识化学反应
(2)氮气分子含有氮氮三键,通常情况下很稳定,难以参加化学反应。所以固氮时 需要改变条件,氮气在高温、高压、催化剂的情况下,能与氢气化合生成NH3。
失去1个H
失去1个H
氧化反应
问题 探讨
1. 假设你是一位化学科研工作者,在研究物质的特征结构时需要思考哪些问题?
提示:同一元素或不同种元素的原子之间为什么能彼此结合?为什么物质中直接相邻 原子之间的化学键类型不同?为什么原子、分子或离子可以构成不同的晶体?晶体中 的微粒间是通过怎样的相互作用结合的?为什么分子具有一定的空间构型?为什么有 机化合物有同分异构体现象?为什么有些元素能形成几种同素异形体?等等。
2. 用电子式表示NaCl的形成过程。
A. 除最外层外,原子各电子层上电子数均已达到2 n2个电子
B. 最外层只有一个电子的原子失去1个电子后,都变成稀有气体元素原子的电子层结 构
C. 金属元素与非金属元素结合形成的化合物都是离子化合物
D. 同主族元素中(稀有气体元素除外),一般原子半径越大,金属性越强
D
A. 钠原子易失去1个电子,氯原子易得到1个电子
B. 钠离子与钠原子有相似的化学性质
C. 钠原子与氯原子作用生成NaCl后,其稳定性增强
D. 氯化钠是离子化合物
B
解析:钠原子最外层只有1个电子,当它失去1个电子后形成的Na+具有最外层8个电 子的稳定结构,氯原子最外层有7个电子,当它得到1个电子后形成的Cl-具有最外层8 个电子的稳定结构,Na+和Cl-通过静电作用力形成离子化合物NaCl。
A. 碘升华
B. 酒精溶于水
C. 氢氧化钠晶体受热熔化
D. 一定条件下O3转化为O2
解析:碘升华,属于物理变化,没有化学键断裂和形成,故不选A;酒精溶于水,属 于物理变化,没有化学键断裂和形成,故不选B;氢氧化钠晶体受热熔化,属于物理 变化,氢氧化钠电离为自由移动的钠离子和氢氧根离子,有离子键断裂,没有化学键 形成,故不选C;O3转化成O2是化学变化,既有旧化学键断裂,又有新化学键形成, 故选D。
D
A. O4与O3、O2互为同分异构体
B. O4比O2活泼的根本原因是O4中的化学键比O2中的易断裂
C. 相同质量的O4与O3所含原子个数比为4∶3
D. O4的两种结构互为同分异构体
B
解析:O4是一种新的氧分子,故与O3、O2互为同素异形体,A项错误;O2能在自然界 稳定存在,化学性质较稳定,故O2中的化学键不如O4中的化学键更容易断裂,B项正 确;相同质量时,O4与O3中所含氧原子个数比为1∶1,C项错误;两者均为单质,不 属于同分异构体,D项错误。
第*页
研习任务二 揭示物质结构与性质的关系
教材 认知
物质的结构决定物质的性质,物质的性质反映物质的结构。
1. 同素异形体
(1)概念: 。
(2)性质:同素异形体的物理性质 ,化学性质 。同素异形体性质 不同的原因是组成它们的结构的微粒排列方式不同。
由同一种元素形成的不同单质
不同
相似
2. 磷的两种同素异形体——白磷和红磷
白磷晶体是由白磷分子(P4)组成的分子晶体,分子呈正四面体结构,分子中P—P键 键长是221 pm,键角∠PPP是60°,因其中的P—P键弯曲而具有较大的张力,其键能 较 ,易 ,所以白磷在常温、常压下就有很高的 。而红磷 的链状结构比较 ,室温下 氧气反应。
白磷分子的正四面体结构
小
断裂
反应活性
稳定
不与
3. 碳的五种同素异形体
问题 探讨
1. 你能列举物质结构决定物质性质的实例吗?
提示:元素原子结构决定元素的性质;不同微粒靠不同的作用力构成不同的晶体;同 分异构体等。
2. 为什么白磷比红磷活泼,氧气比氮气活泼?
提示:白磷分子是正四面体结构,键角小,结构不太稳定,红磷结构要比白磷复杂得 多,也稳定得多,所以性质上也比白磷稳定。氧气比氮气活泼可从原子结构和分子结 构两方面找原因,以分子结构因素为主。N2分子以共价三键结合,比O2的键能大得 多。N2分子不易打开,性质稳定,O2分子较易打开化学键,一经打开,O原子又比N 原子易得电子,所以氧气更活泼。
3. 为什么分子组成都是C2H6O的乙醇和二甲醚在性质上差异很大?
提示:因为它们的结构不同。
4. 碳的同素异形体(金刚石、石墨、C60和碳纳米管等)在性质和用途上有极大差异 的原因是什么?
提示:碳原子与碳原子之间的连接方式不同,导致了它们形成的物质性质不同。
应用 体验
A. 金刚石与碳纳米管互为同素异形体
B. N5与N2互为同素异形体
C. 14C的质子数为14
D. C原子半径比N原子半径大
解析:同素异形体是同种元素形成的不同单质。金刚石和碳纳米管、N5和N2都互为同 素异形体;14C的质子数为6;C原子半径大于N原子半径。
C
A. H2和D2互为同素异形体
C. CH3CH2OH和CH3—O—CH3互为同分异构体
D. 水和冰是同一种物质
解析:H2和D2是由氢元素的不同同位素形成的氢气单质,既不是同位素,也不是同素 异形体,故选A。
A
A. 不同雪花中含有的H2O分子数不同
B. 不同雪花中含有相同数目的水分子
C. 不同雪花的化学性质不同
D. 不同雪花中水分子的空间排列方式不同
解析:雪花均由水分子构成,其化学性质相同;由于水分子空间排列方式不同造成了 雪花的形状不同,世界上没有两片形状完全相同的雪花,说明不同雪花中水分子的空 间排列有差异。
D
A. 物质的结构反映物质的性质,物质的性质决定物质的结构
B. 物质的结构包括构成物质的微粒之间的相互作用,分子的构型、手性等
C. 物质的结构随着人们的认识或研究的程度经常发生一些小的变化
D. 物质的结构有宏观和微观两方面的认识,从宏观上说物质是由元素组成的,从微 观上说物质是由分子构成的
解析:物质的结构决定物质的性质,A项错误;物质的结构指的是构成物质的微粒、 微粒间的作用力及微粒的排列方式等,B项正确;物质的结构是自然存在的,只是人 们认识物质结构的过程在逐步深入,C项错误;从微观上说,构成物质的微粒有分 子,也有原子、离子等,D项错误。
B
(1)物质结构与性质关系的研究过程
(2)
第*页
课堂强研习 合作学习 精研重难
课时作业
A. 化学是在质子变化的层次上研究物质的一门基础学科
B. 化学学科的特征是从宏观和微观两个角度认识物质
C. 化学学科研究物质性质但不能创造出新物质
D. 化学学科表征物质的方法与物理学科完全相同
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 一氧化碳具有还原性,二氧化碳没有,是由于分子构成不同
B. 铁在空气中易生锈,铝在空气中抗腐蚀能力很强,是由于金属活动性顺序不同
C. 金刚石是无色透明的晶体,石墨是黑色的有金属光泽的细鳞片状固体,是由于碳 原子的排列方式不同
D. 铁块在空气中不能燃烧,纳米级铁粉在空气中可以自燃,是由于铁与空气的接触 面积不同
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 核聚变为放热反应
B. 聚变发电有利于减少碳排放量
C. 聚变发电,可使核能全部转化成电能
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 12C、13C、14C都属于碳的同素异形体
B. CaC2晶体中存在离子键和共价键
C. CH4的空间填充模型如图所示
D. 石墨烯属于芳香烃的一种
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. X的质子数为33
D. X的质量数为92
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 乙醇和丙三醇互为同系物
B. 35Cl和37Cl互为同位素
C. O2和O3互为同素异形体
D. 丙酮( )和环氧丙烷( )互为同分异构体
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:结构相似,组成上相差若干个CH2原子团的有机化合物为同系物,乙醇 (CH3CH2OH)是饱和一元醇,丙三醇是饱和三元醇,两者所含官能团数目不同,不 互为同系物,A错误;质子数相同、中子数不同的同种元素互为同位素,35Cl的质子 数为17,中子数为18,37Cl的质子数为17,中子数为20,两者质子数相同、中子数不 同,互为同位素,B正确;由同种元素组成的不同的单质互为同素异形体,O2和O3是 由氧元素组成的不同的单质,两者互为同素异形体,C正确;分子式相同、结构不同 的化合物互为同分异构体,丙酮和环氧丙烷的分子式相同、结构不同,两者互为同分 异构体,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. X的中子数为2
B. X、Y互为同位素
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 该物质的分子式为SN
B. 该物质的分子中只含共价键
C. 该物质是离子化合物
D. 该物质与化合物S2N2互为同素异形体
解析:A项,该化合物分子式为S4N4;C项,该物质中只含共价键,故不是离子化合 物;D项,同素异形体研究对象是单质。
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 它是制造飞机的理想材料
B. 它的主要组成元素是碳
C. 它的结构与石墨不同
D. 碳纤维复合材料为一种高分子化合物
解析:碳纤维显然主要是由碳元素组成,B正确,D错误;碳纤维具有“强度高、刚 度大、密度小、熔点高、化学稳定性好”的特点,A正确;由于碳纤维的物理性质不 同于石墨,所以它们的结构不同,C正确。
D
1
2
3
4
5
6
7
8
9
10
11
12
B. N60的发现开辟了能源世界的新天地,将来可能成为很好的火箭燃料
C
1
2
3
4
5
6
7
8
9
10
11
12
11. 有下列几组物质:
②石墨与富勒烯
③硝基丙烷(CH3CH2CH2NO2)与丙氨酸( )
④CH3CH2CH2CH3和
⑤天然气的主要成分与沼气的主要成分
⑥HF与HCl
1
2
3
4
5
6
7
8
9
10
11
12
对各组物质的性质异同点进行分析,请用数字序号回答问题:
(1)互为同素异形体的是 。
(2)互为同分异构体的是 。
(3)互为同位素的是 。
(4)属于同一化合物的是 。
②
③④
①
⑤
1
2
3
4
5
6
7
8
9
10
11
12
B. 钋元素的相对原子质量为210
C. 210Po比209Po原子核多一个中子
D. 研究表明,烟草中含有210Po和210Pb等,它们互为同位素
82
124
C
1
2
3
4
5
6
7
8
9
10
11
12
47.09 g
1
2
3
4
5
6
7
8
9
10
11
12
