苏教版高中化学选择性必修2专题3微粒间作用力与物质性质微专题3晶体类型的判断、熔沸点的比较课件(共46张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修2专题3微粒间作用力与物质性质微专题3晶体类型的判断、熔沸点的比较课件(共46张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-12 10:35:31 | ||
图片预览








文档简介
(共46张PPT)
专题3 微粒间作用力与物质性质
微专题3 晶体类型的判断、熔沸点的比较
专题 精讲
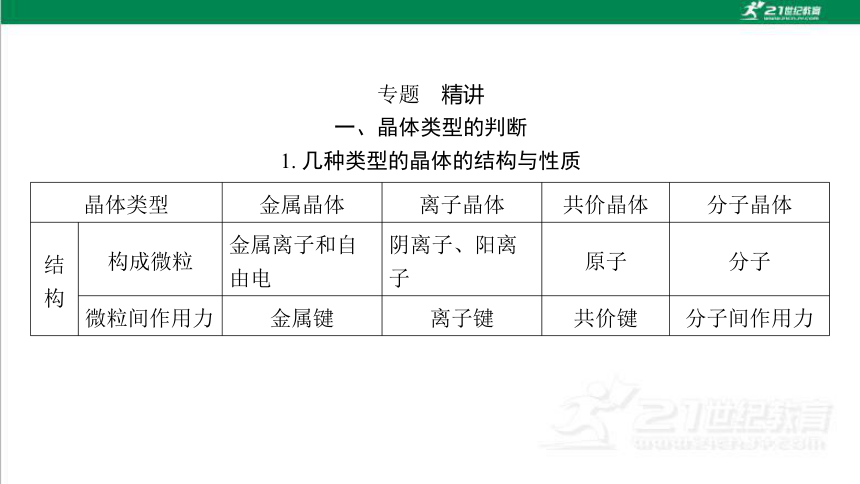
一、晶体类型的判断
1. 几种类型的晶体的结构与性质
晶体类型 金属晶体 离子晶体 共价晶体 分子晶体
结
构 构成微粒 金属离子和自 由电 阴离子、阳离 子 原子 分子
微粒间作用力 金属键 离子键 共价键 分子间作用力
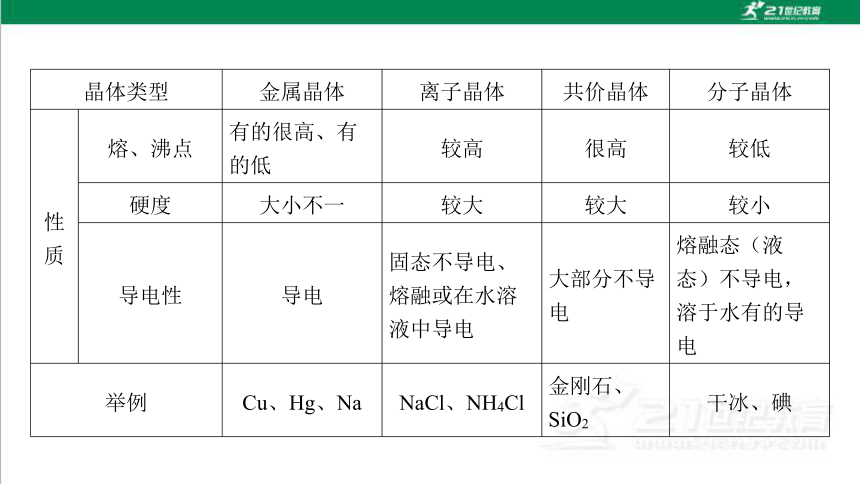
晶体类型 金属晶体 离子晶体 共价晶体 分子晶体
性
质 熔、沸点 有的很高、有 的低 较高 很高 较低
硬度 大小不一 较大 较大 较小
导电性 导电 固态不导电、 熔融或在水溶 液中导电 大部分不导 电 熔融态(液 态)不导电, 溶于水有的导 电
举例 Cu、Hg、Na NaCl、NH4Cl 金刚石、 SiO2 干冰、碘
2. 晶体类型的判断
(1)依据组成晶体的微粒和微粒间的相互作用判断四类晶体的构成微粒和微粒间作 用力如下:
晶体类型 离子晶体 共价晶体 分子晶体 金属晶体
构成微粒 阴、阳离子 原子 分子 金属阳离子、自由 电子
微粒间作用力 离子键 共价键 分子间作用力 金属键
②大多数非金属单质(除金刚石、石墨、晶体硅、硼等外)、非金属氢化物、 非金属氧化物(除SiO2等外)、几乎所有的酸和大多数有机物(除有机盐外) 均属于分子晶体。
③金属单质和合金属于金属晶体。
④金刚石、晶体硅、晶体硼、二氧化硅、碳化硅、BN、AlN、Si3N4、C3N4等属于共 价晶体。
(2)根据物质所属类别判断
①活泼金属氧化物(Na2O、CaO、Na2O2等)、强碱和绝大多数盐类属于离子晶体 (AlCl3、BeCl2等例外,它们属于分子晶体)。
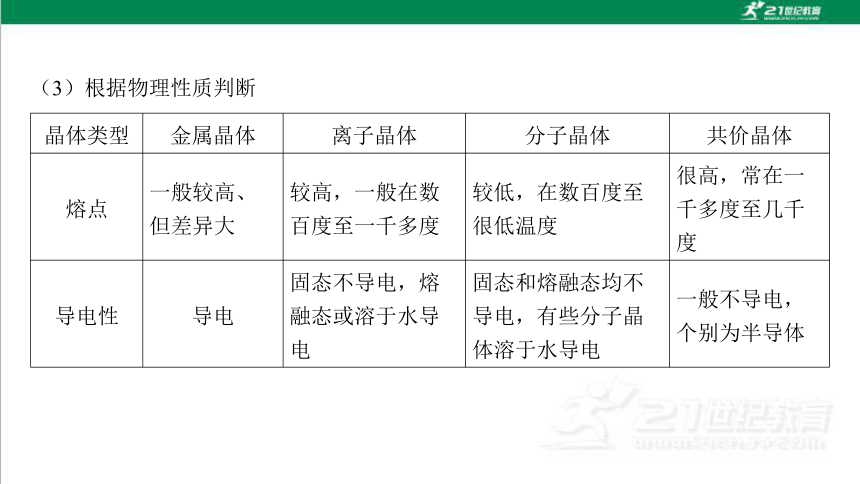
(3)根据物理性质判断
晶体类型 金属晶体 离子晶体 分子晶体 共价晶体
熔点 一般较高、 但差异大 较高,一般在数 百度至一千多度 较低,在数百度至 很低温度 很高,常在一 千多度至几千 度
导电性 导电 固态不导电,熔 融态或溶于水导 电 固态和熔融态均不 导电,有些分子晶 体溶于水导电 一般不导电, 个别为半导体
二、晶体熔、沸点的比较
1. 四种类型晶体的熔、沸点
(1)一般共价晶体的熔、沸点最高,分子晶体的熔、沸点最低。离子晶体和金属晶 体要根据物质构成粒子间的作用力大小判断,但一般介于上述两者之间。如SiO2> NaCl>干冰。
(2)有的离子晶体熔点很高,如MgO。
(3)有的金属晶体的熔点很高,如W、Cr等,有的金属晶体的熔点很低,如Hg、 Na、K等。
2. 离子晶体的熔、沸点
一般来说,化学组成、结构相似的晶体,离子所带电荷数越多、半径越小,离子键越 强,熔、沸点越高。如KF>KCl>KI;CaCl2>KCl。
3. 共价晶体的熔、沸点
共价晶体结构相似时,原子半径越小,键长越短,键能越大,熔、沸点越高。如金刚 石>碳化硅>晶体硅。
4. 金属晶体的熔、沸点
(1)金属晶体的核电荷数越多,原子半径越小,价电子数越多,则金属键越强, 熔、沸点越高。如Al>Mg>Na>K。
(2)一般来说,合金的熔、沸点比其各成分金属的低。
5. 分子晶体的熔、沸点
(1)对于分子晶体,组成和结构相似的分子,相对分子质量越大,分子间作用力越 大,晶体的熔、沸点越高。如CI4>CBr4>CCl4>CF4。
(2)组成相似且相对分子质量相近的物质,分子的电荷分布越不均匀,范德华力越 大,其熔、沸点就越高,如熔、沸点:CO>N2。
(3)在同分异构体中,一般来说,支链越多,熔、沸点就越低,如沸点:正戊烷> 异戊烷>新戊烷。
(4)分子间存在氢键的分子晶体,熔沸点反常升高。如:H2O>H2Se>H2S。
应用 体验
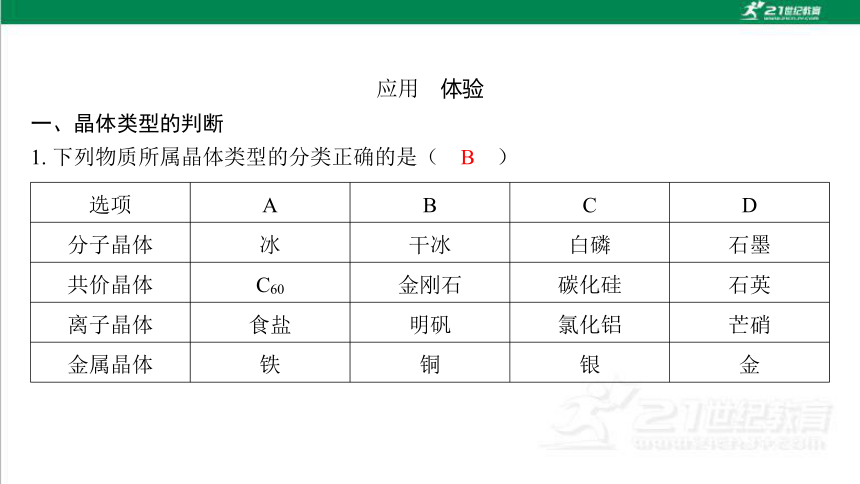
一、晶体类型的判断
选项 A B C D
分子晶体 冰 干冰 白磷 石墨
共价晶体 C60 金刚石 碳化硅 石英
离子晶体 食盐 明矾 氯化铝 芒硝
金属晶体 铁 铜 银 金
B
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体 氮 ⑥硫黄和碘
A. ③④⑥ B. ①②③
C. ④⑤⑥ D. ①③⑤
解析:SiO2和SO3都只含共价键,但是前者是共价晶体,后者是分子晶体,故① 错误;固体HCl是分子晶体,晶体硼是共价晶体,二者都只含共价键,故②错 误;CO2和SO2都是分子晶体,都只含共价键,故③正确;晶体硅和金刚石都属 于共价晶体,含共价键,故④正确;晶体氖和晶体氮都属于分子晶体,但是晶 体氖中不含共价键,晶体氮含共价键,故⑤错误;硫黄和碘都属于分子晶体, 二者都只含共价键,故⑥正确。
A
3. (1)分析下列物体的物理性质,判断其晶体类型。
①碳化铝为黄色晶体,熔点为2 200 ℃,熔融态不导电: 。
②五氟化钒为无色晶体,熔点为19.5 ℃,易溶于乙醇、氯仿、丙酮: 。
③溴化钾为无色晶体,熔融时或溶于水中都能导电: 。
共价晶体
分子晶体
离子晶体
解析:(1)①碳化铝的熔点很高,液态时不导电,说明该晶体是共价晶体;②五氟 化钒,熔点低,易溶于有机溶剂,说明该晶体为分子晶体;③熔融或溶于水中都能导 电,符合离子晶体的特征。
(2)溴化碘(IBr)是一种卤素互化物,具有很高的化学活性,有许多性质跟卤素单 质相似,它在常温、常压下是深红色固体,熔点41 ℃,沸点116 ℃,则固体溴化碘 是 晶体,含有 键。
解析:(2)溴化碘(IBr)熔、沸点较低,属于分子晶体,是由两种不同的非金属元 素组成的共价化合物,所含化学键为极性共价键。
分子
极性
4. (1)现有下列物质:①金刚石 ②干冰 ③晶体硅 ④二氧化硅晶体 ⑤氯化铵 晶体 ⑥氖晶体 ⑦金属锌。通过非极性键形成共价晶体的是 (填序号,下 同);属于分子晶体且分子为直线形的是 ;由单原子分子构成的分子晶体 是 ;含有极性键的离子晶体是 ;能导电且为金属晶体的是 。
(2)两种硼氢化物的熔点如下表所示:
硼氢化物 NaBH4 Al(BH4)3
熔点/℃ 400 -64.5
①③
②
⑥
⑤
⑦
硼氢化钠是离子晶体而硼氢化铝是分子晶体,离子晶体
的熔点高
(3)下表给出了三组物质的相关性质数据:
A组(沸点/℃) B组(沸点/℃) C组(晶格能/kJ·mol-1)
金刚石:4 827 CH3OH: T2 NaCl: a
石墨:4 830 CH3CH2CH2CH2OH:117.6 NaBr: b
碳化硅: T1 CH3CH2OCH2CH3:34.5 MgO: c
回答下列问题:
②判断B组中甲醇的沸点 T2的范围 (填字母)。
共价
小于
石墨中碳碳之间除σ键,
还存在大π键,石墨中碳碳键的键长小于金刚石,键能大于金刚石,沸点更高
b
a.>117.6 b.34.5~117.6 c .<34.5
③C组物质,其晶体中微粒之间的作用力名称是 。该组物质可能具有的性 质是 (填字母)。
A. 硬度小 B. 熔融状态能导电
C. 固体能导电 D. 熔点较低
离子键
B
二、晶体熔、沸点的比较
A. NH3、CH4、NaCl、Na
B. H2O、H2S、MgSO4、SO2
C. CH4、H2O、NaCl、SiO2
D. Li、Na、K、Rb、Cs
C
解析:氨气和甲烷都是分子晶体,但是氨气中含有氢键,熔、沸点较高,则沸点由低 到高的顺序:甲烷、氨气、Na、氯化钠,故A错误;水、硫化氢、二氧化硫都是分子 晶体,水中含有氢键,沸点较高,则沸点由低到高的顺序:硫化氢、二氧化硫、水、 硫酸镁,故B错误;水和甲烷都是分子晶体,但是水中含有氢键,沸点较高,氯化钠 是离子晶体、二氧化硅是共价晶体,则沸点由低到高的顺序:甲烷、水、氯化钠、二 氧化硅,故C正确;Li、Na、K、Rb、Cs均是碱金属,且位于同主族,从上到下沸点 依次降低,故D错误。
A. Si、SiC、金刚石的熔点依次降低
B. SiCl4、MgBr2、BN的熔点依次升高
C. F2、Cl2、Br2、I2的沸点依次升高
D. PH3、NH3、H2O的沸点依次升高
解析:Si、SiC、金刚石都是共价晶体,共价键越强熔点越高,共价键键长:C—C< Si—C<Si—Si,所以熔点:金刚石>SiC>Si,故A错误;一般来说,熔点为共价晶 体>离子晶体>分子晶体,则熔点:BN>MgBr2>SiCl4,故B正确;结构相似的分子 晶体,相对分子质量越大,沸点越高,所以F2、Cl2、Br2、I2的沸点依次升高,故C正 确;水和氨气分子间存在氢键,磷化氢分子间不存在氢键,常温下水为液体,氨气为 气体,所以PH3、NH3、H2O的沸点依次升高,故D正确。
A
A. CH4>C2H6>C3H8>C4H10
B. CBr4>CI4>CCl4>CF4
C. MgO>H2O>O2>N2
D. H2Se>H2S>H2O
解析:组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,则熔、沸点 为CH4<C2H6<C3H8<C4H10,CI4>CBr4>CCl4>CF4,故A、B错误;离子晶体的 熔、沸点高于分子晶体,水中含有氢键,熔、沸点比氮气、氧气的高,则熔、沸点为 MgO>H2O>O2>N2,故C正确;水分子间存在氢键,所以水的沸点最高,则熔、沸 点为H2O>H2Se>H2S,故D错误。
C
A. H2>N2>O2
B. NH3>AsH3>PH3
C. Cl2>Br2>I2
D. C(CH3)4>(CH3)2CHCH2CH3>CH3CH2CH2CH2CH3
解析:结构相似的分子晶体的熔点随相对分子质量的增大而升高,熔、沸点:H2<N2 <O2,Cl2<Br2<I2,故A、C错误;氨气分子间存在氢键,熔、沸点反常升高,熔、 沸点:NH3>AsH3>PH3,故B正确;相对分子质量相同的烃,支链越多熔、沸点越 低,C(CH3)4<(CH3)2CHCH2CH3<CH3CH2CH2CH2CH3,故D错误。
B
5. (1)NH3的沸点 (填“>”“=”或“<”)AsH3。
(3)As的卤化物的熔点如下:
物质 AsCl3 AsBr3 AsI3
熔点/K 256.8 304 413
>
钾的原子半径比铜的
大,价电子数比铜少,钾的金属键比铜的弱
As的卤化物组成和结构相似,相对分子质量逐渐增
大,分子间作用力逐渐增强,熔点逐渐升高
(4)一些氧化物的熔点如表所示:
氧化物 Li2O MgO P4O6 SO2
熔点/℃ 1 570 2 800 23.8 -75.5
Li2O、MgO为离子晶体,P4O6、SO2为分子
晶体;Mg2+所带电荷数比Li+的多,MgO中离子键比Li2O中离子键强。分子间作用力
为P4O6>SO2
金刚石>MgO>
冰>干冰
第*页
课时作业
A. Fe和Al B. 金刚石和石墨
C. CO2和SiO2 D. Na2O和SiC
解析:Fe和Al均为金属晶体,故A正确;金刚石为共价晶体,石墨为混合型晶体,故 B错误;CO2为分子晶体,SiO2为共价晶体,故C错误;Na2O为离子晶体,SiC为共价 晶体,故D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
A. CO2晶体是分子晶体,可推测固体SiO2是分子晶体
B. 冰融化时,分子中H—O键发生断裂
C. 离子晶体中只含有离子键,不含有共价键
D. CsCl晶体溶于水时,破坏了晶体中的离子键
解析:二氧化碳晶体是熔、沸点低的分子晶体,而二氧化硅是熔、沸点很高的共价晶 体,故A错误;水是分子晶体,冰融化时,只会破坏水分子间的氢键,分子中的氢氧 键不会发生断裂,故B错误;离子晶体中一定含有离子键,可能含有共价键,如氢氧 化钠是含有离子键和共价键的离子晶体,故C错误;氯化铯晶体溶于水时,能在溶液 中电离出自由移动的离子,晶体中的离子键被破坏,故D正确。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. 金属铜具有导电性
B. 氮气化学性质稳定
C. 金刚石硬度大
D. 硫单质常温为固体
解析:金属铜具有导电性,是因为金属中自由电子和金属阳离子形成金属键,金属的 导电性能用化学键解释,故A不选;氮分子内存在氮氮三键,键能大,所以氮气化学 性质稳定,能用化学键解释,故B不选;金刚石是共价晶体,碳原子间通过共价键结 合,所以金刚石硬度大,能用化学键解释,故C不选;硫单质常温为固体,是因为硫 分子间作用力大,与化学键无关,故D选。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. 熔点由高到低:Na>Mg>Al
B. 硬度由大到小:晶体硅>碳化硅>金刚石
C. 晶体熔点由低到高:KCl<CO2<SiO2
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:Na、Mg、Al晶体均为金属晶体,金属离子的电荷数越多、半径越小,其熔点 越高,则熔点由高到低为Al>Mg>Na,A错误;各晶体为共价晶体,共价键的键长 越短,共价键越强,硬度越大,键长:C—C<C—Si<Si—Si,则硬度:金刚石>碳 化硅>晶体硅,B错误;CO2、KCl、SiO2分别属于分子晶体、离子晶体、共价晶体, 一般情况下,熔点:分子晶体<离子晶体<共价晶体,故熔点:CO2<KCl<SiO2,C 错误;晶体为离子晶体,所带电荷数相同的离子,离子半径越小,晶格能越大,F、 Cl、Br、I的离子半径由小到大,则晶格能:NaF>NaCl>NaBr>NaI,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. 晶体中粒子呈周期性有序排列,有自范性,而非晶体中粒子排列相对无序,无自 范性
B. 含有金属阳离子的晶体不一定是离子晶体
C. 分子晶体中共价键的键能越大,该分子的熔、沸点越高
D. MgO和NaCl两种晶体中,MgO的晶格能较大,所以其熔点比较高
解析:晶体中粒子呈周期性有序排列,有自范性,而非晶体中粒子排列相对无序,无 自范性,A正确;含有金属阳离子的晶体不一定是离子晶体,有可能是金属晶体,B 正确;分子晶体中共价键的键能越大,其热稳定性越强,该分子的熔、沸点只与分子 间作用力大小有关,和共价键无关,C错误;MgO和NaCl两种晶体中,MgO的晶格能 较大,所以其熔点比较高,D正确。
C
1
2
3
4
5
6
7
8
9
10
11
12
选项 离子晶体 原子晶体 分子晶体 金属晶体
A Na2O2 石墨 Ar Hg
B 玻璃 金刚石 CH3CH2OH Ag
C CH3COONa SiC Mg
D Ba(OH)2 Si C60 NaH
解析:石墨是混合型晶体,不是原子晶体,故A错误;玻璃是混合物,不是晶体,晶 体是纯净物,故B错误;CH3COONa是盐,属于离子晶体,SiC是原子晶体,有机物 萘属于分子晶体,金属Mg属于金属晶体,故C正确;NaH属于离子晶体,不是金属晶 体,故D错误。
C
1
2
3
4
5
6
7
8
9
10
11
12
A. 金刚石和石墨的熔点肯定比球碳分子、管状碳分子的高
B. 球碳分子、管状碳分子和石墨互为同位素
C. 球碳分子、管状碳分子都能与O2发生反应
D. 金刚石属于共价晶体,球碳分子、管状碳分子属于分子晶体
B
1
2
3
4
5
6
7
8
9
10
11
12
解析:金刚石属于共价晶体,石墨属于混合晶体,球碳分子、管状碳分子属于分子晶 体,因此金刚石和石墨的熔点肯定要比球碳分子、管状碳分子的高,A正确;球碳分 子、管状碳分子和石墨都是碳元素形成的不同单质,所以均为碳的同素异形体,B错 误;球碳分子、管状碳分子都是碳元素形成的不同单质,都能和氧气发生氧化反应, C正确;金刚石属于共价晶体,球碳分子、管状碳分子都是分子晶体,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. 图中涉及了四种晶体类型
B. P4的熔点低于S8的原因是P—P键的键能较小
C. 硅晶体由非极性键形成空间网状结构
D. 金属越活泼,其单质熔点越高
C
1
2
3
4
5
6
7
8
9
10
11
12
解析:由图可知,第三周期元素形成的单质中,钠、镁、铝是金属晶体,硅是共价晶 体,磷、硫、氯、氩固体单质是分子晶体,共3种晶体类型,A错误;分子晶体的熔 点与共价键的键能无关,与分子间作用力大小有关,S8的相对分子质量大于P4,故P4 的熔点小于S8,B错误;硅晶体是由硅硅键形成空间网状结构,C正确;金属晶体的 熔点与金属键强弱有关,金属键强弱与金属离子所带电荷数、离子半径有关,钠、 镁、铝离子所带电荷数依次为1、2、3,离子半径依次减小,故金属键依次增强,熔 点依次升高,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. TiF4的熔点反常升高是由于氢键的作用
B. NaX随X-半径增大,离子键减弱
C. 四氯化钛中存在共价键和分子间作用力
D. 由图可看出F的电负性强于Cl、Br、I
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:TiF4中没有H原子,分子间不能形成氢键,故A错误;NaX属于离子晶体,X- 的半径越大,晶格能越小,离子键越弱,故NaX随X-半径增大,离子键减弱,故B正 确;四氯化钛熔点较低,说明四氯化钛是分子晶体,存在共价键和分子间作用力,故 C正确;TiF4的熔点反常升高是因为F的电负性很强,F-和Ti4+形成离子键,则TiF4是 离子晶体,熔、沸点较高,而TiCl4、TiBr4、TiI4熔点较低,说明它们是分子晶体,则 由图可看出F的电负性强于Cl、Br、I,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
11. (1)(2023·全国甲卷)图1所示的几种碳单质,它们互为 ,其中 属于共价晶体的是 ,C60间的作用力是 。
解析:(1)同一元素形成的不同单质之间互为同素异 形体。图1所示的几种碳单质,它们的组成元素均为碳 元素,因此,它们互为同素异形体;其中金刚石属于共 价晶体,石墨属于混合型晶体,C60属于分子晶体,碳 纳米管不属于共价晶体;C60间的作用力是范德华力。
同素异形体
金刚石
范德华力
1
2
3
4
5
6
7
8
9
10
11
12
(2)(2022·浙江1月选考)回答下列问题:
①两种有机物的相关数据如表:
物质 HCON(CH3)2 HCONH2
相对分子质量 73 45
沸点/℃ 153 220
HCON(CH3)2分子间只有一般的分子间作用力,HCONH2分子间存在氢
键,破坏一般的分子间作用力更容易,所以沸点低
1
2
3
4
5
6
7
8
9
10
11
12
②四种晶体的熔点数据如表:
物质 CF4 SiF4 BF3 AlF3
熔点/℃ -183 -90 -127 >1 000
CF4和SiF4都是分子晶
体,结构相似,分子间作用力相差较小,所以熔点相差较小;BF3通过分子间作用力
形成分子晶体,AlF3通过离子键形成离子晶体,破坏离子键需要能量较多,所以熔点
相差较大
1
2
3
4
5
6
7
8
9
10
11
12
解析:(2)①HCON(CH3)2分子间只有一般的分子 间作用力,HCONH2分子间存在氢键,破坏一般的分子 间作用力更容易,所以沸点低;②CF4和SiF4都是分子晶 体,结构相似,分子间作用力相差较小,所以熔点相差 较小;BF3通过分子间作用力形成分子晶体,AlF3通过 离子键形成离子晶体,破坏离子键需要能量较多,所以 熔点相差较大。
1
2
3
4
5
6
7
8
9
10
11
12
12. 现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3 550 ℃ Li:181 ℃ HF:-83 ℃ NaCl:801 ℃
硅晶体:1 410 ℃ Na:98 ℃ HCl:-115 ℃ KCl:776 ℃
硼晶体:2 300 ℃ K:64 ℃ HBr:-89 ℃ RbCl:718 ℃
二氧化硅:1 723 ℃ Rb:39 ℃ HI:-51 ℃ CsCl:645 ℃
1
2
3
4
5
6
7
8
9
10
11
12
据此回答下列问题:
(1)A组属于 晶体。
解析:(1)根据物质的组成和熔点可知,A组属于共价晶体,B组属于金属晶体,C 组属于分子晶体,D组属于离子晶体。
(2)B组晶体共同的物理性质是 (填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
解析:(2)B组为金属晶体,金属阳离子与自由电子之间通过金属键结合。
解析:(3)由于HF分子间存在氢键,导致HF的沸点比其他氢化物的高。
共价
①②③④
HF分子间能形成氢键,其熔化时需要消耗的能量更
多
1
2
3
4
5
6
7
8
9
10
11
12
(4)D组晶体可能具有的性质是 (填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
解析:(4)D组为离子晶体,根据离子晶体的性质判断。
解析:(5)离子晶体的离子键越强,物质的熔、沸点越高,据此分析解答。
②④
D组晶
体都为离子晶体, r (Na+)< r (K+)< r (Rb+)< r (Cs+),在离子所带电荷
数相同的情况下,半径越小,晶格能越大,熔点就越高
1
2
3
4
5
6
7
8
9
10
11
12
专题3 微粒间作用力与物质性质
微专题3 晶体类型的判断、熔沸点的比较
专题 精讲
一、晶体类型的判断
1. 几种类型的晶体的结构与性质
晶体类型 金属晶体 离子晶体 共价晶体 分子晶体
结
构 构成微粒 金属离子和自 由电 阴离子、阳离 子 原子 分子
微粒间作用力 金属键 离子键 共价键 分子间作用力
晶体类型 金属晶体 离子晶体 共价晶体 分子晶体
性
质 熔、沸点 有的很高、有 的低 较高 很高 较低
硬度 大小不一 较大 较大 较小
导电性 导电 固态不导电、 熔融或在水溶 液中导电 大部分不导 电 熔融态(液 态)不导电, 溶于水有的导 电
举例 Cu、Hg、Na NaCl、NH4Cl 金刚石、 SiO2 干冰、碘
2. 晶体类型的判断
(1)依据组成晶体的微粒和微粒间的相互作用判断四类晶体的构成微粒和微粒间作 用力如下:
晶体类型 离子晶体 共价晶体 分子晶体 金属晶体
构成微粒 阴、阳离子 原子 分子 金属阳离子、自由 电子
微粒间作用力 离子键 共价键 分子间作用力 金属键
②大多数非金属单质(除金刚石、石墨、晶体硅、硼等外)、非金属氢化物、 非金属氧化物(除SiO2等外)、几乎所有的酸和大多数有机物(除有机盐外) 均属于分子晶体。
③金属单质和合金属于金属晶体。
④金刚石、晶体硅、晶体硼、二氧化硅、碳化硅、BN、AlN、Si3N4、C3N4等属于共 价晶体。
(2)根据物质所属类别判断
①活泼金属氧化物(Na2O、CaO、Na2O2等)、强碱和绝大多数盐类属于离子晶体 (AlCl3、BeCl2等例外,它们属于分子晶体)。
(3)根据物理性质判断
晶体类型 金属晶体 离子晶体 分子晶体 共价晶体
熔点 一般较高、 但差异大 较高,一般在数 百度至一千多度 较低,在数百度至 很低温度 很高,常在一 千多度至几千 度
导电性 导电 固态不导电,熔 融态或溶于水导 电 固态和熔融态均不 导电,有些分子晶 体溶于水导电 一般不导电, 个别为半导体
二、晶体熔、沸点的比较
1. 四种类型晶体的熔、沸点
(1)一般共价晶体的熔、沸点最高,分子晶体的熔、沸点最低。离子晶体和金属晶 体要根据物质构成粒子间的作用力大小判断,但一般介于上述两者之间。如SiO2> NaCl>干冰。
(2)有的离子晶体熔点很高,如MgO。
(3)有的金属晶体的熔点很高,如W、Cr等,有的金属晶体的熔点很低,如Hg、 Na、K等。
2. 离子晶体的熔、沸点
一般来说,化学组成、结构相似的晶体,离子所带电荷数越多、半径越小,离子键越 强,熔、沸点越高。如KF>KCl>KI;CaCl2>KCl。
3. 共价晶体的熔、沸点
共价晶体结构相似时,原子半径越小,键长越短,键能越大,熔、沸点越高。如金刚 石>碳化硅>晶体硅。
4. 金属晶体的熔、沸点
(1)金属晶体的核电荷数越多,原子半径越小,价电子数越多,则金属键越强, 熔、沸点越高。如Al>Mg>Na>K。
(2)一般来说,合金的熔、沸点比其各成分金属的低。
5. 分子晶体的熔、沸点
(1)对于分子晶体,组成和结构相似的分子,相对分子质量越大,分子间作用力越 大,晶体的熔、沸点越高。如CI4>CBr4>CCl4>CF4。
(2)组成相似且相对分子质量相近的物质,分子的电荷分布越不均匀,范德华力越 大,其熔、沸点就越高,如熔、沸点:CO>N2。
(3)在同分异构体中,一般来说,支链越多,熔、沸点就越低,如沸点:正戊烷> 异戊烷>新戊烷。
(4)分子间存在氢键的分子晶体,熔沸点反常升高。如:H2O>H2Se>H2S。
应用 体验
一、晶体类型的判断
选项 A B C D
分子晶体 冰 干冰 白磷 石墨
共价晶体 C60 金刚石 碳化硅 石英
离子晶体 食盐 明矾 氯化铝 芒硝
金属晶体 铁 铜 银 金
B
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体 氮 ⑥硫黄和碘
A. ③④⑥ B. ①②③
C. ④⑤⑥ D. ①③⑤
解析:SiO2和SO3都只含共价键,但是前者是共价晶体,后者是分子晶体,故① 错误;固体HCl是分子晶体,晶体硼是共价晶体,二者都只含共价键,故②错 误;CO2和SO2都是分子晶体,都只含共价键,故③正确;晶体硅和金刚石都属 于共价晶体,含共价键,故④正确;晶体氖和晶体氮都属于分子晶体,但是晶 体氖中不含共价键,晶体氮含共价键,故⑤错误;硫黄和碘都属于分子晶体, 二者都只含共价键,故⑥正确。
A
3. (1)分析下列物体的物理性质,判断其晶体类型。
①碳化铝为黄色晶体,熔点为2 200 ℃,熔融态不导电: 。
②五氟化钒为无色晶体,熔点为19.5 ℃,易溶于乙醇、氯仿、丙酮: 。
③溴化钾为无色晶体,熔融时或溶于水中都能导电: 。
共价晶体
分子晶体
离子晶体
解析:(1)①碳化铝的熔点很高,液态时不导电,说明该晶体是共价晶体;②五氟 化钒,熔点低,易溶于有机溶剂,说明该晶体为分子晶体;③熔融或溶于水中都能导 电,符合离子晶体的特征。
(2)溴化碘(IBr)是一种卤素互化物,具有很高的化学活性,有许多性质跟卤素单 质相似,它在常温、常压下是深红色固体,熔点41 ℃,沸点116 ℃,则固体溴化碘 是 晶体,含有 键。
解析:(2)溴化碘(IBr)熔、沸点较低,属于分子晶体,是由两种不同的非金属元 素组成的共价化合物,所含化学键为极性共价键。
分子
极性
4. (1)现有下列物质:①金刚石 ②干冰 ③晶体硅 ④二氧化硅晶体 ⑤氯化铵 晶体 ⑥氖晶体 ⑦金属锌。通过非极性键形成共价晶体的是 (填序号,下 同);属于分子晶体且分子为直线形的是 ;由单原子分子构成的分子晶体 是 ;含有极性键的离子晶体是 ;能导电且为金属晶体的是 。
(2)两种硼氢化物的熔点如下表所示:
硼氢化物 NaBH4 Al(BH4)3
熔点/℃ 400 -64.5
①③
②
⑥
⑤
⑦
硼氢化钠是离子晶体而硼氢化铝是分子晶体,离子晶体
的熔点高
(3)下表给出了三组物质的相关性质数据:
A组(沸点/℃) B组(沸点/℃) C组(晶格能/kJ·mol-1)
金刚石:4 827 CH3OH: T2 NaCl: a
石墨:4 830 CH3CH2CH2CH2OH:117.6 NaBr: b
碳化硅: T1 CH3CH2OCH2CH3:34.5 MgO: c
回答下列问题:
②判断B组中甲醇的沸点 T2的范围 (填字母)。
共价
小于
石墨中碳碳之间除σ键,
还存在大π键,石墨中碳碳键的键长小于金刚石,键能大于金刚石,沸点更高
b
a.>117.6 b.34.5~117.6 c .<34.5
③C组物质,其晶体中微粒之间的作用力名称是 。该组物质可能具有的性 质是 (填字母)。
A. 硬度小 B. 熔融状态能导电
C. 固体能导电 D. 熔点较低
离子键
B
二、晶体熔、沸点的比较
A. NH3、CH4、NaCl、Na
B. H2O、H2S、MgSO4、SO2
C. CH4、H2O、NaCl、SiO2
D. Li、Na、K、Rb、Cs
C
解析:氨气和甲烷都是分子晶体,但是氨气中含有氢键,熔、沸点较高,则沸点由低 到高的顺序:甲烷、氨气、Na、氯化钠,故A错误;水、硫化氢、二氧化硫都是分子 晶体,水中含有氢键,沸点较高,则沸点由低到高的顺序:硫化氢、二氧化硫、水、 硫酸镁,故B错误;水和甲烷都是分子晶体,但是水中含有氢键,沸点较高,氯化钠 是离子晶体、二氧化硅是共价晶体,则沸点由低到高的顺序:甲烷、水、氯化钠、二 氧化硅,故C正确;Li、Na、K、Rb、Cs均是碱金属,且位于同主族,从上到下沸点 依次降低,故D错误。
A. Si、SiC、金刚石的熔点依次降低
B. SiCl4、MgBr2、BN的熔点依次升高
C. F2、Cl2、Br2、I2的沸点依次升高
D. PH3、NH3、H2O的沸点依次升高
解析:Si、SiC、金刚石都是共价晶体,共价键越强熔点越高,共价键键长:C—C< Si—C<Si—Si,所以熔点:金刚石>SiC>Si,故A错误;一般来说,熔点为共价晶 体>离子晶体>分子晶体,则熔点:BN>MgBr2>SiCl4,故B正确;结构相似的分子 晶体,相对分子质量越大,沸点越高,所以F2、Cl2、Br2、I2的沸点依次升高,故C正 确;水和氨气分子间存在氢键,磷化氢分子间不存在氢键,常温下水为液体,氨气为 气体,所以PH3、NH3、H2O的沸点依次升高,故D正确。
A
A. CH4>C2H6>C3H8>C4H10
B. CBr4>CI4>CCl4>CF4
C. MgO>H2O>O2>N2
D. H2Se>H2S>H2O
解析:组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,则熔、沸点 为CH4<C2H6<C3H8<C4H10,CI4>CBr4>CCl4>CF4,故A、B错误;离子晶体的 熔、沸点高于分子晶体,水中含有氢键,熔、沸点比氮气、氧气的高,则熔、沸点为 MgO>H2O>O2>N2,故C正确;水分子间存在氢键,所以水的沸点最高,则熔、沸 点为H2O>H2Se>H2S,故D错误。
C
A. H2>N2>O2
B. NH3>AsH3>PH3
C. Cl2>Br2>I2
D. C(CH3)4>(CH3)2CHCH2CH3>CH3CH2CH2CH2CH3
解析:结构相似的分子晶体的熔点随相对分子质量的增大而升高,熔、沸点:H2<N2 <O2,Cl2<Br2<I2,故A、C错误;氨气分子间存在氢键,熔、沸点反常升高,熔、 沸点:NH3>AsH3>PH3,故B正确;相对分子质量相同的烃,支链越多熔、沸点越 低,C(CH3)4<(CH3)2CHCH2CH3<CH3CH2CH2CH2CH3,故D错误。
B
5. (1)NH3的沸点 (填“>”“=”或“<”)AsH3。
(3)As的卤化物的熔点如下:
物质 AsCl3 AsBr3 AsI3
熔点/K 256.8 304 413
>
钾的原子半径比铜的
大,价电子数比铜少,钾的金属键比铜的弱
As的卤化物组成和结构相似,相对分子质量逐渐增
大,分子间作用力逐渐增强,熔点逐渐升高
(4)一些氧化物的熔点如表所示:
氧化物 Li2O MgO P4O6 SO2
熔点/℃ 1 570 2 800 23.8 -75.5
Li2O、MgO为离子晶体,P4O6、SO2为分子
晶体;Mg2+所带电荷数比Li+的多,MgO中离子键比Li2O中离子键强。分子间作用力
为P4O6>SO2
金刚石>MgO>
冰>干冰
第*页
课时作业
A. Fe和Al B. 金刚石和石墨
C. CO2和SiO2 D. Na2O和SiC
解析:Fe和Al均为金属晶体,故A正确;金刚石为共价晶体,石墨为混合型晶体,故 B错误;CO2为分子晶体,SiO2为共价晶体,故C错误;Na2O为离子晶体,SiC为共价 晶体,故D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
A. CO2晶体是分子晶体,可推测固体SiO2是分子晶体
B. 冰融化时,分子中H—O键发生断裂
C. 离子晶体中只含有离子键,不含有共价键
D. CsCl晶体溶于水时,破坏了晶体中的离子键
解析:二氧化碳晶体是熔、沸点低的分子晶体,而二氧化硅是熔、沸点很高的共价晶 体,故A错误;水是分子晶体,冰融化时,只会破坏水分子间的氢键,分子中的氢氧 键不会发生断裂,故B错误;离子晶体中一定含有离子键,可能含有共价键,如氢氧 化钠是含有离子键和共价键的离子晶体,故C错误;氯化铯晶体溶于水时,能在溶液 中电离出自由移动的离子,晶体中的离子键被破坏,故D正确。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. 金属铜具有导电性
B. 氮气化学性质稳定
C. 金刚石硬度大
D. 硫单质常温为固体
解析:金属铜具有导电性,是因为金属中自由电子和金属阳离子形成金属键,金属的 导电性能用化学键解释,故A不选;氮分子内存在氮氮三键,键能大,所以氮气化学 性质稳定,能用化学键解释,故B不选;金刚石是共价晶体,碳原子间通过共价键结 合,所以金刚石硬度大,能用化学键解释,故C不选;硫单质常温为固体,是因为硫 分子间作用力大,与化学键无关,故D选。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. 熔点由高到低:Na>Mg>Al
B. 硬度由大到小:晶体硅>碳化硅>金刚石
C. 晶体熔点由低到高:KCl<CO2<SiO2
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:Na、Mg、Al晶体均为金属晶体,金属离子的电荷数越多、半径越小,其熔点 越高,则熔点由高到低为Al>Mg>Na,A错误;各晶体为共价晶体,共价键的键长 越短,共价键越强,硬度越大,键长:C—C<C—Si<Si—Si,则硬度:金刚石>碳 化硅>晶体硅,B错误;CO2、KCl、SiO2分别属于分子晶体、离子晶体、共价晶体, 一般情况下,熔点:分子晶体<离子晶体<共价晶体,故熔点:CO2<KCl<SiO2,C 错误;晶体为离子晶体,所带电荷数相同的离子,离子半径越小,晶格能越大,F、 Cl、Br、I的离子半径由小到大,则晶格能:NaF>NaCl>NaBr>NaI,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. 晶体中粒子呈周期性有序排列,有自范性,而非晶体中粒子排列相对无序,无自 范性
B. 含有金属阳离子的晶体不一定是离子晶体
C. 分子晶体中共价键的键能越大,该分子的熔、沸点越高
D. MgO和NaCl两种晶体中,MgO的晶格能较大,所以其熔点比较高
解析:晶体中粒子呈周期性有序排列,有自范性,而非晶体中粒子排列相对无序,无 自范性,A正确;含有金属阳离子的晶体不一定是离子晶体,有可能是金属晶体,B 正确;分子晶体中共价键的键能越大,其热稳定性越强,该分子的熔、沸点只与分子 间作用力大小有关,和共价键无关,C错误;MgO和NaCl两种晶体中,MgO的晶格能 较大,所以其熔点比较高,D正确。
C
1
2
3
4
5
6
7
8
9
10
11
12
选项 离子晶体 原子晶体 分子晶体 金属晶体
A Na2O2 石墨 Ar Hg
B 玻璃 金刚石 CH3CH2OH Ag
C CH3COONa SiC Mg
D Ba(OH)2 Si C60 NaH
解析:石墨是混合型晶体,不是原子晶体,故A错误;玻璃是混合物,不是晶体,晶 体是纯净物,故B错误;CH3COONa是盐,属于离子晶体,SiC是原子晶体,有机物 萘属于分子晶体,金属Mg属于金属晶体,故C正确;NaH属于离子晶体,不是金属晶 体,故D错误。
C
1
2
3
4
5
6
7
8
9
10
11
12
A. 金刚石和石墨的熔点肯定比球碳分子、管状碳分子的高
B. 球碳分子、管状碳分子和石墨互为同位素
C. 球碳分子、管状碳分子都能与O2发生反应
D. 金刚石属于共价晶体,球碳分子、管状碳分子属于分子晶体
B
1
2
3
4
5
6
7
8
9
10
11
12
解析:金刚石属于共价晶体,石墨属于混合晶体,球碳分子、管状碳分子属于分子晶 体,因此金刚石和石墨的熔点肯定要比球碳分子、管状碳分子的高,A正确;球碳分 子、管状碳分子和石墨都是碳元素形成的不同单质,所以均为碳的同素异形体,B错 误;球碳分子、管状碳分子都是碳元素形成的不同单质,都能和氧气发生氧化反应, C正确;金刚石属于共价晶体,球碳分子、管状碳分子都是分子晶体,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. 图中涉及了四种晶体类型
B. P4的熔点低于S8的原因是P—P键的键能较小
C. 硅晶体由非极性键形成空间网状结构
D. 金属越活泼,其单质熔点越高
C
1
2
3
4
5
6
7
8
9
10
11
12
解析:由图可知,第三周期元素形成的单质中,钠、镁、铝是金属晶体,硅是共价晶 体,磷、硫、氯、氩固体单质是分子晶体,共3种晶体类型,A错误;分子晶体的熔 点与共价键的键能无关,与分子间作用力大小有关,S8的相对分子质量大于P4,故P4 的熔点小于S8,B错误;硅晶体是由硅硅键形成空间网状结构,C正确;金属晶体的 熔点与金属键强弱有关,金属键强弱与金属离子所带电荷数、离子半径有关,钠、 镁、铝离子所带电荷数依次为1、2、3,离子半径依次减小,故金属键依次增强,熔 点依次升高,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. TiF4的熔点反常升高是由于氢键的作用
B. NaX随X-半径增大,离子键减弱
C. 四氯化钛中存在共价键和分子间作用力
D. 由图可看出F的电负性强于Cl、Br、I
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:TiF4中没有H原子,分子间不能形成氢键,故A错误;NaX属于离子晶体,X- 的半径越大,晶格能越小,离子键越弱,故NaX随X-半径增大,离子键减弱,故B正 确;四氯化钛熔点较低,说明四氯化钛是分子晶体,存在共价键和分子间作用力,故 C正确;TiF4的熔点反常升高是因为F的电负性很强,F-和Ti4+形成离子键,则TiF4是 离子晶体,熔、沸点较高,而TiCl4、TiBr4、TiI4熔点较低,说明它们是分子晶体,则 由图可看出F的电负性强于Cl、Br、I,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
11. (1)(2023·全国甲卷)图1所示的几种碳单质,它们互为 ,其中 属于共价晶体的是 ,C60间的作用力是 。
解析:(1)同一元素形成的不同单质之间互为同素异 形体。图1所示的几种碳单质,它们的组成元素均为碳 元素,因此,它们互为同素异形体;其中金刚石属于共 价晶体,石墨属于混合型晶体,C60属于分子晶体,碳 纳米管不属于共价晶体;C60间的作用力是范德华力。
同素异形体
金刚石
范德华力
1
2
3
4
5
6
7
8
9
10
11
12
(2)(2022·浙江1月选考)回答下列问题:
①两种有机物的相关数据如表:
物质 HCON(CH3)2 HCONH2
相对分子质量 73 45
沸点/℃ 153 220
HCON(CH3)2分子间只有一般的分子间作用力,HCONH2分子间存在氢
键,破坏一般的分子间作用力更容易,所以沸点低
1
2
3
4
5
6
7
8
9
10
11
12
②四种晶体的熔点数据如表:
物质 CF4 SiF4 BF3 AlF3
熔点/℃ -183 -90 -127 >1 000
CF4和SiF4都是分子晶
体,结构相似,分子间作用力相差较小,所以熔点相差较小;BF3通过分子间作用力
形成分子晶体,AlF3通过离子键形成离子晶体,破坏离子键需要能量较多,所以熔点
相差较大
1
2
3
4
5
6
7
8
9
10
11
12
解析:(2)①HCON(CH3)2分子间只有一般的分子 间作用力,HCONH2分子间存在氢键,破坏一般的分子 间作用力更容易,所以沸点低;②CF4和SiF4都是分子晶 体,结构相似,分子间作用力相差较小,所以熔点相差 较小;BF3通过分子间作用力形成分子晶体,AlF3通过 离子键形成离子晶体,破坏离子键需要能量较多,所以 熔点相差较大。
1
2
3
4
5
6
7
8
9
10
11
12
12. 现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3 550 ℃ Li:181 ℃ HF:-83 ℃ NaCl:801 ℃
硅晶体:1 410 ℃ Na:98 ℃ HCl:-115 ℃ KCl:776 ℃
硼晶体:2 300 ℃ K:64 ℃ HBr:-89 ℃ RbCl:718 ℃
二氧化硅:1 723 ℃ Rb:39 ℃ HI:-51 ℃ CsCl:645 ℃
1
2
3
4
5
6
7
8
9
10
11
12
据此回答下列问题:
(1)A组属于 晶体。
解析:(1)根据物质的组成和熔点可知,A组属于共价晶体,B组属于金属晶体,C 组属于分子晶体,D组属于离子晶体。
(2)B组晶体共同的物理性质是 (填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
解析:(2)B组为金属晶体,金属阳离子与自由电子之间通过金属键结合。
解析:(3)由于HF分子间存在氢键,导致HF的沸点比其他氢化物的高。
共价
①②③④
HF分子间能形成氢键,其熔化时需要消耗的能量更
多
1
2
3
4
5
6
7
8
9
10
11
12
(4)D组晶体可能具有的性质是 (填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
解析:(4)D组为离子晶体,根据离子晶体的性质判断。
解析:(5)离子晶体的离子键越强,物质的熔、沸点越高,据此分析解答。
②④
D组晶
体都为离子晶体, r (Na+)< r (K+)< r (Rb+)< r (Cs+),在离子所带电荷
数相同的情况下,半径越小,晶格能越大,熔点就越高
1
2
3
4
5
6
7
8
9
10
11
12
