(考点集训)2025年化学中考一轮复习5:化学反应的定量关系课件(人教版)
文档属性
| 名称 | (考点集训)2025年化学中考一轮复习5:化学反应的定量关系课件(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-13 22:55:25 | ||
图片预览








文档简介
(共29张PPT)
中考一轮复习 教材同步复习
第五单元 化学反应的定量关系
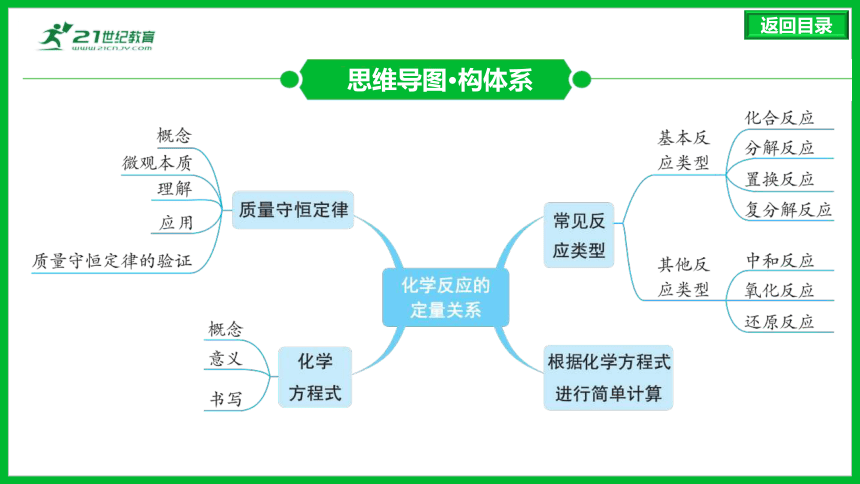
思维导图·构体系
知识精讲·夯基础
真题分点·明趋势
实验分阶·提能力
思维导图·构体系
1.概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
2.微观本质:化学反应的过程,就是参加反应的各物质(反应物)的原子重新组合生成新物质(生成物)的过程。化学反应前后,原子的种类、数目和质量不变,因此参加反应的各物质的质量总和一定等于生成的各物质的质量总和。
知识精讲·夯基础
质量守恒定律(近5年4考)
知识点1
3.理解
(1)6个“不变”
(2)2个“一定变”
(3)2个“可能变”
4.应用
(1)推断物质的元素组成。
(2)确定化学反应中某物质的化学式。
(3)解释反应前后物质的质量变化或计算某一物质的质量。(4)化学方程式的书写及判断。
(5)密闭容器中反应数据分析。
(6)微观反应示意图分析。
5.质量守恒定律的验证
判断下列说法的正误。
1.化学反应前后分子的总数一定相等。 ( )
2.随着铁制品的不断锈蚀,自然界中铁元素的含量不断减少。 ( )
3.10 g酒精和90 g水混合得到100 g溶液,遵守质量守恒定律。 ( )
4.某纯净物在氧气中完全燃烧,生成二氧化碳和水,说明该纯净物是由碳、氢、氧三种元素组成的。 ( )
5.2 g H2和32 g O2反应生成18 g H2O。 ( )
易错易混
×
×
×
×
√
1.概念:用化学式来表示化学反应的式子。
化学方程式(近5年5考)
知识点2
2.意义
意义
定性角度 表示________、________和反应条件 硫和氧气在点燃条件下反应生成二氧化硫
定量 角度 宏观 表示反应前后各物质之间的______关系 每32份质量的硫和32份质量的氧气完全反应,生成64份质量的二氧化硫
微观 表示各物质之间的粒子的相对数量关系 1个硫原子和1个氧分子反应生成1个二氧化硫分子
反应物
生成物
质量
3.书写
(1)原则
①以__________为基础,写出反应物、生成物和反应条件,体现化学反应中的物质转化关系。
②根据______________配平化学方程式,使等号两边各原子的种类与数目相等,体现化学反应的定量关系。
客观事实
质量守恒定律
(2)步骤(以电解水为例)
【特别提醒】如果反应物中无气体,生成物中有气体,则在气体物质的化学式右边要注“↑”号;对于溶液中的反应,如果反应物中无固体,生成物中有固体,则在固体物质的化学式右边要注“↓”号。
判断下列化学方程式书写是否正确。
1.铁丝在氧气中燃烧:3Fe+2O2Fe3O4。 ( )
2.医疗上用含氢氧化铝的药物治疗胃酸过多症:Al(OH)3+HCl AlCl3+ H2O。 ( )
3.实验室制取二氧化碳:CaCO3+2HClCaCl2+H2O+CO2。 ( )
4.实验室加热高锰酸钾制取氧气:2KMnO4 K2MnO4+MnO2+O2↑。 ( )
易错易混
×
×
×
×
1.基本反应类型
常见反应类型(近5年5考)
知识点3
基本反应类型 概念 表达式 特征
______反应 由两种或两种以上物质生成另一种物质的反应 A+B+…→M “多变一”
______反应 由一种反应物生成两种或两种以上其他物质的反应 M→A+B+… “一变多”
化合
分解
基本反应类型 概念 表达式 特征
______反应 由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应 A+BC→ AC+B “单换单”
________反应 由两种化合物互相交换成分,生成另外两种化合物的反应 AB+CD→ AD+CB “互交换,
价不变”
置换
复分解
2.其他反应类型:中和反应、氧化反应、还原反应等。
判断下列说法的正误。
1.置换反应一定有单质生成,有单质生成的反应一定属于置换反应。
( )
2.复分解反应中一定不存在化合价的改变。 ( )
3.中和反应属于复分解反应。 ( )
易错易混
×
√
√
兴趣小组对“化学反应前后物质的质量关系”进行探究,实验方案如下:
方案一:铜与氧气反应前后质量的测定(如图甲)。
方案二:铁与硫酸铜溶液反应前后质量的测定
(如图乙)。
方案三:盐酸与碳酸钠反应前后质量的测定
(如图丙)。
方案四:镁条燃烧前后质量的测定(如图丁)。
实验分阶·提能力
质量守恒定律的验证(近5年1考)
实验4
例
一阶 基础知识
【实验原理及现象】
(1)方案一中发生反应的化学方程式为_____________________,现象是____________________,反应结束后天平示数不变。
(2)方案二中发生反应的化学方程式为____________________________,现象是____________________________________________,反应结束后天平示数不变。
2Cu+O2 2CuO
固体由红色变为黑色
Fe+CuSO4 ===== FeSO4+Cu
铁丝表面析出红色物质,溶液由蓝色变为浅绿色
(3)方案三中发生反应的化学方程式为________________________________
_________,现象是__________,反应结束后天平指针______(填“向左”或“向右”)偏转。
(4)方案四中发生反应的化学方程式为_______________________,现象是__________________________________________________________。称量反应前后的物质质量,发现物质质量不相等。
Na2CO3+2HCl ===== 2NaCl+H2O
+CO2↑
产生气泡
向右
2Mg+O22MgO
镁条剧烈燃烧,发出耀眼的白光,放出大量的热,生成白色固体
【实验结论】
(5)方案一和方案二中,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
(6)方案三和方案四不能直接用于验证质量守恒定律,但化学反应本身遵守质量守恒定律。
二阶 质疑反思
(7)方案一中,气球的作用是________________________________________
________。
(8)方案三中,导致天平不平衡的原因是______________________________
_________________________________________________________。
形成密封装置;平衡装置内外压强,防止瓶
塞飞出
反应过程中生成的CO2气体逸散到
空气中,导致左盘质量减小,天平指针向右偏转,天平不平衡
(9)利用方案三中的实验装置,下列用于替代的试剂组合能用于直接验证质量守恒定律的是____(填字母)。
A.NaCl溶液和MgSO4溶液
B.水和硝酸铵固体
C.H2O2溶液和MnO2固体
D.NaOH溶液和CuSO4溶液
D
【归纳总结】
(1)试剂选择原则:试剂之间能发生化学反应,且反应现象明显。
(2)实验装置注意事项:有气体参与或生成的反应,需在密闭装置内进行。
(10)小明在方案二的实验过程中,还观察到铁丝表面产生少量气泡,老师提醒小明,硫酸铜溶液呈酸性,则该气体可能是_____________。
氢气(或H2)
三阶 改进创新
(11)如图是对方案三中实验装置的改进,你认为更合适的装置是____(填字母)。
B
1.口罩中的熔喷布具有过滤病毒的作用,Z是合成熔喷布的主要原料,由X制备Z的微观示意图如图。下列说法正确的是( )
A.X的化学式为C8H3
B.反应前后分子种类不变
C.Y、Z在O2中充分燃烧产物相同
D.反应前后原子个数不变
真题分点·明趋势
质量守恒定律的应用(微观反应示意图)(近5年5考)
命题点1
D
2.《天工开物》记载了锡的冶炼方法:入砂(指锡砂)数百斤,丛架木炭亦数百斤,鼓鞲(指鼓入空气)熔化,用铅少许,(锡)沛然流注。其反应原理为C+SnO2 Sn+CO2↑。
(1)炼锡时加入少许铅形成合金,产物更易熔化流出,原因是___________
_______________________________。
有关化学方程式的计算(近5年5考)
命题点2
锡与铅形成
合金后,熔点降低(表述合理即可)
(2)现有151 kg含SnO2 20%的锡砂,理论上可以炼出锡的质量是多少(写出计算过程)?
解:设理论上可以炼出锡的质量是x。
C + SnO2 Sn + CO2↑
151 119
151 kg×20% x
=
x=23.8 kg
答:理论上可以炼出锡的质量是23.8 kg。
3.碳酸锂(Li2CO3)是制备新能源汽车电池的重要原料。我国盐湖卤水中主要含有氯化锂、氯化钠、硫酸镁等溶质,一种以化学沉淀法从卤水中生产碳酸锂的工艺如图。回答下列问题:
(4)滤液2中含有LiCl,步骤④中生成Li2CO3
的反应类型是____________。
基本反应类型的判断(近5年5考)
命题点3
复分解反应
中考一轮复习 教材同步复习
第五单元 化学反应的定量关系
思维导图·构体系
知识精讲·夯基础
真题分点·明趋势
实验分阶·提能力
思维导图·构体系
1.概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
2.微观本质:化学反应的过程,就是参加反应的各物质(反应物)的原子重新组合生成新物质(生成物)的过程。化学反应前后,原子的种类、数目和质量不变,因此参加反应的各物质的质量总和一定等于生成的各物质的质量总和。
知识精讲·夯基础
质量守恒定律(近5年4考)
知识点1
3.理解
(1)6个“不变”
(2)2个“一定变”
(3)2个“可能变”
4.应用
(1)推断物质的元素组成。
(2)确定化学反应中某物质的化学式。
(3)解释反应前后物质的质量变化或计算某一物质的质量。(4)化学方程式的书写及判断。
(5)密闭容器中反应数据分析。
(6)微观反应示意图分析。
5.质量守恒定律的验证
判断下列说法的正误。
1.化学反应前后分子的总数一定相等。 ( )
2.随着铁制品的不断锈蚀,自然界中铁元素的含量不断减少。 ( )
3.10 g酒精和90 g水混合得到100 g溶液,遵守质量守恒定律。 ( )
4.某纯净物在氧气中完全燃烧,生成二氧化碳和水,说明该纯净物是由碳、氢、氧三种元素组成的。 ( )
5.2 g H2和32 g O2反应生成18 g H2O。 ( )
易错易混
×
×
×
×
√
1.概念:用化学式来表示化学反应的式子。
化学方程式(近5年5考)
知识点2
2.意义
意义
定性角度 表示________、________和反应条件 硫和氧气在点燃条件下反应生成二氧化硫
定量 角度 宏观 表示反应前后各物质之间的______关系 每32份质量的硫和32份质量的氧气完全反应,生成64份质量的二氧化硫
微观 表示各物质之间的粒子的相对数量关系 1个硫原子和1个氧分子反应生成1个二氧化硫分子
反应物
生成物
质量
3.书写
(1)原则
①以__________为基础,写出反应物、生成物和反应条件,体现化学反应中的物质转化关系。
②根据______________配平化学方程式,使等号两边各原子的种类与数目相等,体现化学反应的定量关系。
客观事实
质量守恒定律
(2)步骤(以电解水为例)
【特别提醒】如果反应物中无气体,生成物中有气体,则在气体物质的化学式右边要注“↑”号;对于溶液中的反应,如果反应物中无固体,生成物中有固体,则在固体物质的化学式右边要注“↓”号。
判断下列化学方程式书写是否正确。
1.铁丝在氧气中燃烧:3Fe+2O2Fe3O4。 ( )
2.医疗上用含氢氧化铝的药物治疗胃酸过多症:Al(OH)3+HCl AlCl3+ H2O。 ( )
3.实验室制取二氧化碳:CaCO3+2HClCaCl2+H2O+CO2。 ( )
4.实验室加热高锰酸钾制取氧气:2KMnO4 K2MnO4+MnO2+O2↑。 ( )
易错易混
×
×
×
×
1.基本反应类型
常见反应类型(近5年5考)
知识点3
基本反应类型 概念 表达式 特征
______反应 由两种或两种以上物质生成另一种物质的反应 A+B+…→M “多变一”
______反应 由一种反应物生成两种或两种以上其他物质的反应 M→A+B+… “一变多”
化合
分解
基本反应类型 概念 表达式 特征
______反应 由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应 A+BC→ AC+B “单换单”
________反应 由两种化合物互相交换成分,生成另外两种化合物的反应 AB+CD→ AD+CB “互交换,
价不变”
置换
复分解
2.其他反应类型:中和反应、氧化反应、还原反应等。
判断下列说法的正误。
1.置换反应一定有单质生成,有单质生成的反应一定属于置换反应。
( )
2.复分解反应中一定不存在化合价的改变。 ( )
3.中和反应属于复分解反应。 ( )
易错易混
×
√
√
兴趣小组对“化学反应前后物质的质量关系”进行探究,实验方案如下:
方案一:铜与氧气反应前后质量的测定(如图甲)。
方案二:铁与硫酸铜溶液反应前后质量的测定
(如图乙)。
方案三:盐酸与碳酸钠反应前后质量的测定
(如图丙)。
方案四:镁条燃烧前后质量的测定(如图丁)。
实验分阶·提能力
质量守恒定律的验证(近5年1考)
实验4
例
一阶 基础知识
【实验原理及现象】
(1)方案一中发生反应的化学方程式为_____________________,现象是____________________,反应结束后天平示数不变。
(2)方案二中发生反应的化学方程式为____________________________,现象是____________________________________________,反应结束后天平示数不变。
2Cu+O2 2CuO
固体由红色变为黑色
Fe+CuSO4 ===== FeSO4+Cu
铁丝表面析出红色物质,溶液由蓝色变为浅绿色
(3)方案三中发生反应的化学方程式为________________________________
_________,现象是__________,反应结束后天平指针______(填“向左”或“向右”)偏转。
(4)方案四中发生反应的化学方程式为_______________________,现象是__________________________________________________________。称量反应前后的物质质量,发现物质质量不相等。
Na2CO3+2HCl ===== 2NaCl+H2O
+CO2↑
产生气泡
向右
2Mg+O22MgO
镁条剧烈燃烧,发出耀眼的白光,放出大量的热,生成白色固体
【实验结论】
(5)方案一和方案二中,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
(6)方案三和方案四不能直接用于验证质量守恒定律,但化学反应本身遵守质量守恒定律。
二阶 质疑反思
(7)方案一中,气球的作用是________________________________________
________。
(8)方案三中,导致天平不平衡的原因是______________________________
_________________________________________________________。
形成密封装置;平衡装置内外压强,防止瓶
塞飞出
反应过程中生成的CO2气体逸散到
空气中,导致左盘质量减小,天平指针向右偏转,天平不平衡
(9)利用方案三中的实验装置,下列用于替代的试剂组合能用于直接验证质量守恒定律的是____(填字母)。
A.NaCl溶液和MgSO4溶液
B.水和硝酸铵固体
C.H2O2溶液和MnO2固体
D.NaOH溶液和CuSO4溶液
D
【归纳总结】
(1)试剂选择原则:试剂之间能发生化学反应,且反应现象明显。
(2)实验装置注意事项:有气体参与或生成的反应,需在密闭装置内进行。
(10)小明在方案二的实验过程中,还观察到铁丝表面产生少量气泡,老师提醒小明,硫酸铜溶液呈酸性,则该气体可能是_____________。
氢气(或H2)
三阶 改进创新
(11)如图是对方案三中实验装置的改进,你认为更合适的装置是____(填字母)。
B
1.口罩中的熔喷布具有过滤病毒的作用,Z是合成熔喷布的主要原料,由X制备Z的微观示意图如图。下列说法正确的是( )
A.X的化学式为C8H3
B.反应前后分子种类不变
C.Y、Z在O2中充分燃烧产物相同
D.反应前后原子个数不变
真题分点·明趋势
质量守恒定律的应用(微观反应示意图)(近5年5考)
命题点1
D
2.《天工开物》记载了锡的冶炼方法:入砂(指锡砂)数百斤,丛架木炭亦数百斤,鼓鞲(指鼓入空气)熔化,用铅少许,(锡)沛然流注。其反应原理为C+SnO2 Sn+CO2↑。
(1)炼锡时加入少许铅形成合金,产物更易熔化流出,原因是___________
_______________________________。
有关化学方程式的计算(近5年5考)
命题点2
锡与铅形成
合金后,熔点降低(表述合理即可)
(2)现有151 kg含SnO2 20%的锡砂,理论上可以炼出锡的质量是多少(写出计算过程)?
解:设理论上可以炼出锡的质量是x。
C + SnO2 Sn + CO2↑
151 119
151 kg×20% x
=
x=23.8 kg
答:理论上可以炼出锡的质量是23.8 kg。
3.碳酸锂(Li2CO3)是制备新能源汽车电池的重要原料。我国盐湖卤水中主要含有氯化锂、氯化钠、硫酸镁等溶质,一种以化学沉淀法从卤水中生产碳酸锂的工艺如图。回答下列问题:
(4)滤液2中含有LiCl,步骤④中生成Li2CO3
的反应类型是____________。
基本反应类型的判断(近5年5考)
命题点3
复分解反应
同课章节目录
