(考点集训)2025年化学中考一轮复习8:金属和金属材料课件(人教版)
文档属性
| 名称 | (考点集训)2025年化学中考一轮复习8:金属和金属材料课件(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-13 23:03:14 | ||
图片预览









文档简介
(共44张PPT)
中考一轮复习 教材同步复习
第八单元 金属和金属材料
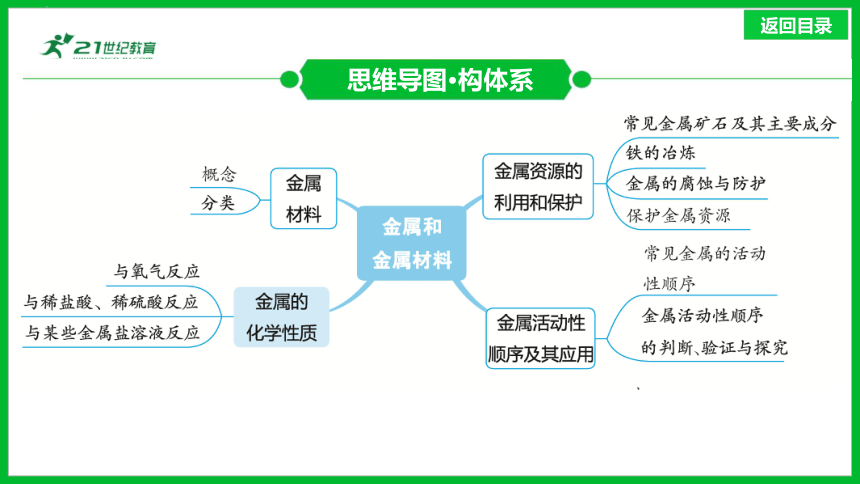
思维导图·构体系
知识精讲·夯基础
真题分点·明趋势
实验分阶·提能力
思维导图·构体系
1.概念:用纯金属或______等制成的材料。
知识精讲·夯基础
金属材料(近5年2考)
知识点1
合金
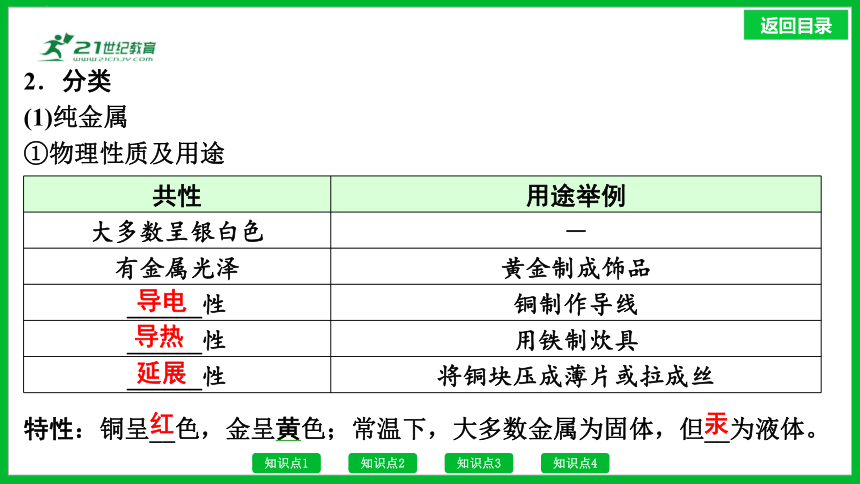
2.分类
(1)纯金属
①物理性质及用途
共性 用途举例
大多数呈银白色 -
有金属光泽 黄金制成饰品
______性 铜制作导线
______性 用铁制炊具
______性 将铜块压成薄片或拉成丝
特性:铜呈__色,金呈黄色;常温下,大多数金属为固体,但__为液体。
导电
导热
延展
红
汞
②金属之最
a.地壳中含量最高的金属元素——____。
b.人体中含量最高的金属元素——____。
c.目前世界年产量最高的金属——____。
d.导电性、导热性最好的金属——银。
e.熔点最高的金属——钨;熔点最低的金属——汞。
f.密度最小的金属——锂。
铝
钙
铁
(2)合金
①概念:在纯金属中加热熔合某些金属或非金属,制得具有金属特征的物质。
②性能(以比较黄铜片和铜片的硬度为例)
合金一般比组成它们的纯金属的强度和硬度更____,熔点更____,抗腐蚀性能更____。
铜片
大
大
低
好
③常见的合金
a.铁合金:主要包括生铁(含碳量为2%~4.3%)和钢(含碳量为0.03%~ 2%),它们性能不同的主要原因是________不同。
b.钛合金:与人体具有很好的相容性,可用来制造________;钛和钛合金被广泛用于火箭、导弹、航天器、船舶、化工设备、通信设备和医疗等。
含碳量
人造骨
判断下列说法的正误。
1.常温下,所有金属都是银白色固体。 ( )
2.因为银的导电性很强,所以通常用银作导线。 ( )
3.合金属于合成材料。 ( )
4.合金中至少含有一种金属。 ( )
5.制造合金的过程是熔合,熔合过程发生的是化学变化。 ( )
6.不锈钢属于混合物。 ( )
7.纯铁的抗腐蚀性能比不锈钢的好。 ( )
易错易混
×
×
×
√
×
√
×
1.与氧气反应
(1)通式:金属+氧气→金属氧化物(化合反应)。
(2)常见金属与氧气的反应
金属的化学性质(近5年5考)
知识点2
金属 条件 化学方程式 现象
镁 常温 _______________________ 露置在空气中的镁表面会逐渐变暗
点燃 ______________________ 剧烈燃烧,发出______________,放出大量的热,生成____色固体
2Mg+O2 ===== 2MgO
2Mg+O2 2MgO
耀眼的白光
白
金属 条件 化学方程式 现象
铝 常温 _________________________ 露置在空气中的铝表面会逐渐变暗[其表面生成一层致密的氧化铝(Al2O3)薄膜,从而阻止内部铝进一步被氧化,因此,铝具有很好的抗腐蚀性能]
4Al+3O2 ===== 2Al2O3
金属 条件 化学方程式 现象
铁 点燃 ________________________ 剧烈燃烧,__________,放出大量的热,生成____色固体
铜 加热 ______________________ 生成黑色固体
金 高温 不反应 无明显现象
总结:从上述金属与氧气的反应条件可以看出,镁、铝比较活泼,铁、铜次之,金最不活泼。
3Fe+2O2 Fe3O4
火星四射
黑
2Cu+O2 2CuO
2.与稀盐酸、稀硫酸反应
(1)反应条件:金属的活动性必须排在氢之前。
(2)通式:金属+酸盐+氢气(______反应)。
(3)常见金属与稀盐酸、稀硫酸的反应
金属 化学方程式 现象
与稀盐酸反应 与稀硫酸反应 镁 _______________________________ _______________________________ 产生气泡
置换
Mg +2HCl ===== MgCl2
+H2↑
Mg +H2SO4 ===== MgSO4+
H2↑
金属 化学方程式 现象
与稀盐酸反应 与稀硫酸反应 锌 ______________________________ __________________________________ 产生气泡
铁 ______________________________________ ___________________________________ 产生气泡,溶液由___色逐渐变为______ 色
铜 不反应 无明显现
Zn+2HCl ===== ZnCl2
+H2↑
Zn +H2SO4 =====
ZnSO4+H2↑
Fe+2HCl ===== FeCl2
+H2↑
Fe+H2SO4 =====
FeSO4+H2↑
无
浅绿
3.与某些金属盐溶液反应
(1)反应条件:金属单质的活动性强于金属盐溶液中金属的活动性。
(2)通式:金属+可溶性盐新金属+新盐(______反应)。
(3)常见金属与金属盐溶液的反应
金属与金属盐溶液 化学方程式 现象
Fe与CuSO4溶液 _______________________________ 铁表面有红色固体析出,溶液由____色变为______色
置换
Fe+CuSO4===== FeSO4+
Cu
蓝
浅绿
金属与金 属盐溶液 化学方程式 现象
Al与 CuSO4溶液 ________________________________________ 铝表面有红色固体析出,溶液由____色变为____色
Cu与 AgNO3溶液 ________________________________________ 铜表面有银白色固体析出,溶液由____色变为____色
Cu与 Al2(SO4)3溶液 不反应 无明显现象
2Al+3CuSO4 =====
Al2(SO4)3+3Cu
蓝
无
Cu+2AgNO3 =====
Cu(NO3)2+2Ag
无
蓝
判断下列说法的正误。
1.铁丝在氧气中燃烧生成Fe2O3。 ( )
2.可通过灼烧的方法鉴别真黄金和假黄金(铜锌合金)。 ( )
3.铝具有良好的抗腐蚀性能的原因是铝的化学性质不活泼。 ( )
4.铁和稀盐酸反应后溶液由无色变为黄色。 ( )
易错易混
×
√
×
×
5.与酸反应有气体生成的一定是氢前金属。 ( )
6.铝、锌都能与稀硫酸反应产生氢气,所以金属都能与稀硫酸反应产生氢气。 ( )
7.可用铁质容器盛放波尔多液。 ( )
×
×
×
常见金属的活动性顺序
金属活动性顺序及其应用(近5年3考)
知识点3
Mg
Zn
Cu
Ag
强
减弱
判断说法的正误:铝制品比铁制品耐腐蚀,说明铝的金属活动性比铁的弱。 ( )
易错易混
×
1.常见金属矿石及其主要成分
金属资源的利用和保护(近5年3考)
知识点4
名称 赤铁矿 磁铁矿 铝土矿 赤铜矿 金红石 软锰矿
主要成分 的化学式 _________ Fe3O4 Al2O3 Cu2O TiO2 MnO2
Fe2O3
2.铁的冶炼(高炉炼铁)
(1)原料:铁矿石、焦炭、石灰石和空气。
①焦炭的作用:提供热量;反应生成______,作还原剂。
②石灰石的作用:将矿石中的二氧化硅转变为炉渣。
③鼓入大量空气的目的:提供充足的氧气,促进焦炭充分燃烧,提高焦炭利用率。
CO
(2)方法及反应
a.C+O2CO2;b.CO2+C2CO;
c.______________________________。
3CO+Fe2O3 2Fe+3CO2
3.金属的腐蚀与防护
(1)金属的腐蚀
铁生锈的条件:铁与空气中的_____和_______同时接触。
【备考补充】铁锈的主要成分为Fe2O3·xH2O,呈红棕色。
氧气
水蒸气
(2)防止金属锈蚀的原理及方法
①原理:隔绝空气或水。
②方法:a.保持铁制品表面干燥,如用过的菜刀擦干净;b.在铁制品表面涂保护膜,如涂油、刷漆、电镀;c.改变内部组成,制成耐腐蚀的合金,如制成不锈钢。
(3)除锈方法
①物理方法:用砂纸打磨。
②化学方法:用盐酸或稀硫酸除去。用盐酸除铁锈的化学方程式为________________________________。
Fe2O3+6HCl ===== 2FeCl3+3H2O
4.保护金属资源
(1)意义:节约金属资源,节约能源;可以减少其对环境的危害。
(2)途径:防止金属腐蚀;回收利用废旧金属;有计划、合理地开采金属矿物;寻找金属的代用品等。
判断下列说法的正误。
1.铁的冶炼过程中主要利用的是一氧化碳的可燃性。 ( )
2.高炉炼铁最终得到的铁为纯净物。 ( )
3.铁在潮湿的空气中比在干燥的空气中更容易生锈。 ( )
4.经常用砂纸对铝制品表面进行打磨,会破坏其表面的氧化铝保护膜,加快铝制品锈蚀。 ( )
5.为除去铁制品表面的铁锈,可将其长时间浸泡在稀硫酸中。 ( )
6.严重锈蚀的金属材料没有回收价值。 ( )
易错易混
×
×
√
√
×
×
如图Ⅰ是探究铁生锈条件的实验装置,回答下列问题。
实验分阶·提能力
铁锈蚀条件的探究(近5年3考)
实验7
例
一阶 基础知识
【实验方法】
(1)该实验使用的方法是控制变量法。
【实验现象】
(2)甲实验中,铁钉生锈,且锈蚀最严重的部位是___(填“a”“b”或“c”)。
(3)乙实验中,铁钉________。
(4)丙实验中,铁钉________。
b
不生锈
不生锈
【实验分析】
(5)对比实验甲和乙,说明铁钉生锈需要与______________接触。
(6)对比实验甲和丙,说明铁钉生锈需要与____接触。
【实验结论】
(7)铁生锈的条件是与__________________同时接触。
空气(或氧气)
水
空气(或氧气)、水
二阶 质疑反思
(8)实验前,需用砂纸打磨铁钉,目的是____________________________。
(9)实验中所用的蒸馏水需经煮沸并迅速冷却,目的是__________________
______________________。
(10)实验乙中植物油的作用是__________________。
(11)实验丙中干燥剂的作用是______________________。
除去铁钉表面的氧化物和污物
除去水中溶解的氧
气,从而排除氧气的干扰
隔绝空气(或氧气)
吸收水蒸气,干燥空气
三阶 改进创新
(12)图Ⅱ是某兴趣小组设计的探究钢丝棉生锈条件的实验。
①一段时间后,可观察到钢丝棉1和钢丝棉3生锈,且钢丝棉1锈蚀更严重。通过对比二者的生锈情况,说明盐溶液能______(填“加快”或“减慢”)钢丝棉生锈。
②该装置的优点是_______________________________________________
_______。
加快
将不同条件下的物品放在同一装置中,增强了实验的
对比性
四阶 拓展延伸
(13)【课标新增·迁移应用】某同学根据铜绿的成分Cu2(OH)2CO3作出猜想:金属铜锈蚀的条件除有氧气和水外,还必须有二氧化碳。为证明“必须有二氧化碳”,需要进行如图Ⅲ所示实验中的____(填字母)。
A.①和②
B.②和③
C.③和④
D.①和④
D
(14)【课标新增·跨学科——物理】较长时间后,图Ⅳ中会观察到____(填“左”或“右”)边布包下降(实验开始前,杠杆已调至平衡)。
(15)【实验关联-空气中氧气含量的测定】图Ⅴ中,起始时试管内水面与烧杯内水面相平,之后水面缓慢上升。几天后水面最终处于约刻度______
处,原因是________________________________________。
左
4
铁锈蚀消耗氧气,且氧气约占空气总体积的
(16)【课标新增·数字化实验-氧气体积分数】为了研究溶液中不同离子对铁钉锈蚀速率的影响,同学们又设计如图Ⅵ实验,用传感器测定试管内氧气的体积分数变化如图Ⅶ所示。
①由图Ⅶ可知,溶液中N加快铁钉锈蚀的能力____(填“强”或“弱”)于Cl-。
②两条曲线都呈现“先陡后缓”的趋势,即锈蚀速率先快后慢,请分析原因:____________________________________________________________
______________________________。
弱
开始时,氧气浓度较高,锈蚀速率较快,随着反应的进行,氧气浓度
减小,锈蚀速率减慢(合理即可)
1.判断说法是否正确:青铜是一种金属材料。( )
真题分点·明趋势
金属材料(近5年2考)
命题点1
√
2.判断说法是否正确:锌片放入稀硫酸中产生氢气,则铜片放入稀硫酸中也产生氢气。 ( )
金属的化学性质(近5年5考)
命题点2
×
3.判断说法是否正确:根据“Cu与AgNO3溶液反应生成Ag和Cu(NO3)2”,可得出“Cu的金属活动性比Ag的强”。( )
金属活动性顺序的判断(近5年3考)
命题点3
√
4.判断说法是否正确:铁器在空气中易腐蚀,则铝制品在空气中也易腐蚀。 ( )
金属的锈蚀与防护(近5年3考)
命题点4
×
5.某兴趣小组进行铁锈蚀的实验探究。
【知识回顾】铁是一种化学性质较活泼的金属,常温下能与稀盐酸、氧气等物质反应。
(1)铁与稀盐酸反应的化学方程式是______________________________。
(2)铁锈的颜色是________。
Fe+2HCl ===== FeCl2+H2↑
红棕色
【实验探究】该小组利用如图装置对铁钉锈蚀的条件进行探究,一段时间后,在A和B中没有观察到明显现象,C和D中铁钉有锈蚀。
(3)B中将蒸馏水煮沸的目的是__________________________________。
(4)A、B、D对比,说明铁钉锈蚀需要的物质是__________;C中的铁钉比D中的锈蚀更严重,原因是________________________________。
除去水中溶解的氧气,防止干扰实验
水和氧气
C中铁钉接触的氧气量比D中的多
附加问:
【拓展探究】
(5)为进一步探究铁钉锈蚀过程中气态物质的变化,该小组按图E所示装置完成以下实验。恒温下,向锥形瓶中加入少量稀盐酸,同时测量锥形瓶内气体压强随时间的变化,直至反应完全。
①测量过程中要保持恒温,理由是
____________________________________。
②请在图F中绘制整个反应过程中锥形瓶内气体压强的变化趋势。
防止温度变化影响气体压强的数据测定
中考一轮复习 教材同步复习
第八单元 金属和金属材料
思维导图·构体系
知识精讲·夯基础
真题分点·明趋势
实验分阶·提能力
思维导图·构体系
1.概念:用纯金属或______等制成的材料。
知识精讲·夯基础
金属材料(近5年2考)
知识点1
合金
2.分类
(1)纯金属
①物理性质及用途
共性 用途举例
大多数呈银白色 -
有金属光泽 黄金制成饰品
______性 铜制作导线
______性 用铁制炊具
______性 将铜块压成薄片或拉成丝
特性:铜呈__色,金呈黄色;常温下,大多数金属为固体,但__为液体。
导电
导热
延展
红
汞
②金属之最
a.地壳中含量最高的金属元素——____。
b.人体中含量最高的金属元素——____。
c.目前世界年产量最高的金属——____。
d.导电性、导热性最好的金属——银。
e.熔点最高的金属——钨;熔点最低的金属——汞。
f.密度最小的金属——锂。
铝
钙
铁
(2)合金
①概念:在纯金属中加热熔合某些金属或非金属,制得具有金属特征的物质。
②性能(以比较黄铜片和铜片的硬度为例)
合金一般比组成它们的纯金属的强度和硬度更____,熔点更____,抗腐蚀性能更____。
铜片
大
大
低
好
③常见的合金
a.铁合金:主要包括生铁(含碳量为2%~4.3%)和钢(含碳量为0.03%~ 2%),它们性能不同的主要原因是________不同。
b.钛合金:与人体具有很好的相容性,可用来制造________;钛和钛合金被广泛用于火箭、导弹、航天器、船舶、化工设备、通信设备和医疗等。
含碳量
人造骨
判断下列说法的正误。
1.常温下,所有金属都是银白色固体。 ( )
2.因为银的导电性很强,所以通常用银作导线。 ( )
3.合金属于合成材料。 ( )
4.合金中至少含有一种金属。 ( )
5.制造合金的过程是熔合,熔合过程发生的是化学变化。 ( )
6.不锈钢属于混合物。 ( )
7.纯铁的抗腐蚀性能比不锈钢的好。 ( )
易错易混
×
×
×
√
×
√
×
1.与氧气反应
(1)通式:金属+氧气→金属氧化物(化合反应)。
(2)常见金属与氧气的反应
金属的化学性质(近5年5考)
知识点2
金属 条件 化学方程式 现象
镁 常温 _______________________ 露置在空气中的镁表面会逐渐变暗
点燃 ______________________ 剧烈燃烧,发出______________,放出大量的热,生成____色固体
2Mg+O2 ===== 2MgO
2Mg+O2 2MgO
耀眼的白光
白
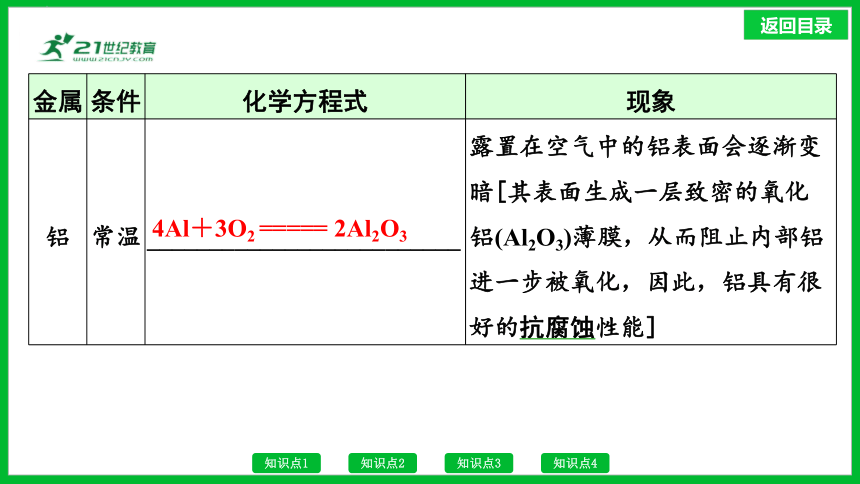
金属 条件 化学方程式 现象
铝 常温 _________________________ 露置在空气中的铝表面会逐渐变暗[其表面生成一层致密的氧化铝(Al2O3)薄膜,从而阻止内部铝进一步被氧化,因此,铝具有很好的抗腐蚀性能]
4Al+3O2 ===== 2Al2O3
金属 条件 化学方程式 现象
铁 点燃 ________________________ 剧烈燃烧,__________,放出大量的热,生成____色固体
铜 加热 ______________________ 生成黑色固体
金 高温 不反应 无明显现象
总结:从上述金属与氧气的反应条件可以看出,镁、铝比较活泼,铁、铜次之,金最不活泼。
3Fe+2O2 Fe3O4
火星四射
黑
2Cu+O2 2CuO
2.与稀盐酸、稀硫酸反应
(1)反应条件:金属的活动性必须排在氢之前。
(2)通式:金属+酸盐+氢气(______反应)。
(3)常见金属与稀盐酸、稀硫酸的反应
金属 化学方程式 现象
与稀盐酸反应 与稀硫酸反应 镁 _______________________________ _______________________________ 产生气泡
置换
Mg +2HCl ===== MgCl2
+H2↑
Mg +H2SO4 ===== MgSO4+
H2↑
金属 化学方程式 现象
与稀盐酸反应 与稀硫酸反应 锌 ______________________________ __________________________________ 产生气泡
铁 ______________________________________ ___________________________________ 产生气泡,溶液由___色逐渐变为______ 色
铜 不反应 无明显现
Zn+2HCl ===== ZnCl2
+H2↑
Zn +H2SO4 =====
ZnSO4+H2↑
Fe+2HCl ===== FeCl2
+H2↑
Fe+H2SO4 =====
FeSO4+H2↑
无
浅绿
3.与某些金属盐溶液反应
(1)反应条件:金属单质的活动性强于金属盐溶液中金属的活动性。
(2)通式:金属+可溶性盐新金属+新盐(______反应)。
(3)常见金属与金属盐溶液的反应
金属与金属盐溶液 化学方程式 现象
Fe与CuSO4溶液 _______________________________ 铁表面有红色固体析出,溶液由____色变为______色
置换
Fe+CuSO4===== FeSO4+
Cu
蓝
浅绿
金属与金 属盐溶液 化学方程式 现象
Al与 CuSO4溶液 ________________________________________ 铝表面有红色固体析出,溶液由____色变为____色
Cu与 AgNO3溶液 ________________________________________ 铜表面有银白色固体析出,溶液由____色变为____色
Cu与 Al2(SO4)3溶液 不反应 无明显现象
2Al+3CuSO4 =====
Al2(SO4)3+3Cu
蓝
无
Cu+2AgNO3 =====
Cu(NO3)2+2Ag
无
蓝
判断下列说法的正误。
1.铁丝在氧气中燃烧生成Fe2O3。 ( )
2.可通过灼烧的方法鉴别真黄金和假黄金(铜锌合金)。 ( )
3.铝具有良好的抗腐蚀性能的原因是铝的化学性质不活泼。 ( )
4.铁和稀盐酸反应后溶液由无色变为黄色。 ( )
易错易混
×
√
×
×
5.与酸反应有气体生成的一定是氢前金属。 ( )
6.铝、锌都能与稀硫酸反应产生氢气,所以金属都能与稀硫酸反应产生氢气。 ( )
7.可用铁质容器盛放波尔多液。 ( )
×
×
×
常见金属的活动性顺序
金属活动性顺序及其应用(近5年3考)
知识点3
Mg
Zn
Cu
Ag
强
减弱
判断说法的正误:铝制品比铁制品耐腐蚀,说明铝的金属活动性比铁的弱。 ( )
易错易混
×
1.常见金属矿石及其主要成分
金属资源的利用和保护(近5年3考)
知识点4
名称 赤铁矿 磁铁矿 铝土矿 赤铜矿 金红石 软锰矿
主要成分 的化学式 _________ Fe3O4 Al2O3 Cu2O TiO2 MnO2
Fe2O3
2.铁的冶炼(高炉炼铁)
(1)原料:铁矿石、焦炭、石灰石和空气。
①焦炭的作用:提供热量;反应生成______,作还原剂。
②石灰石的作用:将矿石中的二氧化硅转变为炉渣。
③鼓入大量空气的目的:提供充足的氧气,促进焦炭充分燃烧,提高焦炭利用率。
CO
(2)方法及反应
a.C+O2CO2;b.CO2+C2CO;
c.______________________________。
3CO+Fe2O3 2Fe+3CO2
3.金属的腐蚀与防护
(1)金属的腐蚀
铁生锈的条件:铁与空气中的_____和_______同时接触。
【备考补充】铁锈的主要成分为Fe2O3·xH2O,呈红棕色。
氧气
水蒸气
(2)防止金属锈蚀的原理及方法
①原理:隔绝空气或水。
②方法:a.保持铁制品表面干燥,如用过的菜刀擦干净;b.在铁制品表面涂保护膜,如涂油、刷漆、电镀;c.改变内部组成,制成耐腐蚀的合金,如制成不锈钢。
(3)除锈方法
①物理方法:用砂纸打磨。
②化学方法:用盐酸或稀硫酸除去。用盐酸除铁锈的化学方程式为________________________________。
Fe2O3+6HCl ===== 2FeCl3+3H2O
4.保护金属资源
(1)意义:节约金属资源,节约能源;可以减少其对环境的危害。
(2)途径:防止金属腐蚀;回收利用废旧金属;有计划、合理地开采金属矿物;寻找金属的代用品等。
判断下列说法的正误。
1.铁的冶炼过程中主要利用的是一氧化碳的可燃性。 ( )
2.高炉炼铁最终得到的铁为纯净物。 ( )
3.铁在潮湿的空气中比在干燥的空气中更容易生锈。 ( )
4.经常用砂纸对铝制品表面进行打磨,会破坏其表面的氧化铝保护膜,加快铝制品锈蚀。 ( )
5.为除去铁制品表面的铁锈,可将其长时间浸泡在稀硫酸中。 ( )
6.严重锈蚀的金属材料没有回收价值。 ( )
易错易混
×
×
√
√
×
×
如图Ⅰ是探究铁生锈条件的实验装置,回答下列问题。
实验分阶·提能力
铁锈蚀条件的探究(近5年3考)
实验7
例
一阶 基础知识
【实验方法】
(1)该实验使用的方法是控制变量法。
【实验现象】
(2)甲实验中,铁钉生锈,且锈蚀最严重的部位是___(填“a”“b”或“c”)。
(3)乙实验中,铁钉________。
(4)丙实验中,铁钉________。
b
不生锈
不生锈
【实验分析】
(5)对比实验甲和乙,说明铁钉生锈需要与______________接触。
(6)对比实验甲和丙,说明铁钉生锈需要与____接触。
【实验结论】
(7)铁生锈的条件是与__________________同时接触。
空气(或氧气)
水
空气(或氧气)、水
二阶 质疑反思
(8)实验前,需用砂纸打磨铁钉,目的是____________________________。
(9)实验中所用的蒸馏水需经煮沸并迅速冷却,目的是__________________
______________________。
(10)实验乙中植物油的作用是__________________。
(11)实验丙中干燥剂的作用是______________________。
除去铁钉表面的氧化物和污物
除去水中溶解的氧
气,从而排除氧气的干扰
隔绝空气(或氧气)
吸收水蒸气,干燥空气
三阶 改进创新
(12)图Ⅱ是某兴趣小组设计的探究钢丝棉生锈条件的实验。
①一段时间后,可观察到钢丝棉1和钢丝棉3生锈,且钢丝棉1锈蚀更严重。通过对比二者的生锈情况,说明盐溶液能______(填“加快”或“减慢”)钢丝棉生锈。
②该装置的优点是_______________________________________________
_______。
加快
将不同条件下的物品放在同一装置中,增强了实验的
对比性
四阶 拓展延伸
(13)【课标新增·迁移应用】某同学根据铜绿的成分Cu2(OH)2CO3作出猜想:金属铜锈蚀的条件除有氧气和水外,还必须有二氧化碳。为证明“必须有二氧化碳”,需要进行如图Ⅲ所示实验中的____(填字母)。
A.①和②
B.②和③
C.③和④
D.①和④
D
(14)【课标新增·跨学科——物理】较长时间后,图Ⅳ中会观察到____(填“左”或“右”)边布包下降(实验开始前,杠杆已调至平衡)。
(15)【实验关联-空气中氧气含量的测定】图Ⅴ中,起始时试管内水面与烧杯内水面相平,之后水面缓慢上升。几天后水面最终处于约刻度______
处,原因是________________________________________。
左
4
铁锈蚀消耗氧气,且氧气约占空气总体积的
(16)【课标新增·数字化实验-氧气体积分数】为了研究溶液中不同离子对铁钉锈蚀速率的影响,同学们又设计如图Ⅵ实验,用传感器测定试管内氧气的体积分数变化如图Ⅶ所示。
①由图Ⅶ可知,溶液中N加快铁钉锈蚀的能力____(填“强”或“弱”)于Cl-。
②两条曲线都呈现“先陡后缓”的趋势,即锈蚀速率先快后慢,请分析原因:____________________________________________________________
______________________________。
弱
开始时,氧气浓度较高,锈蚀速率较快,随着反应的进行,氧气浓度
减小,锈蚀速率减慢(合理即可)
1.判断说法是否正确:青铜是一种金属材料。( )
真题分点·明趋势
金属材料(近5年2考)
命题点1
√
2.判断说法是否正确:锌片放入稀硫酸中产生氢气,则铜片放入稀硫酸中也产生氢气。 ( )
金属的化学性质(近5年5考)
命题点2
×
3.判断说法是否正确:根据“Cu与AgNO3溶液反应生成Ag和Cu(NO3)2”,可得出“Cu的金属活动性比Ag的强”。( )
金属活动性顺序的判断(近5年3考)
命题点3
√
4.判断说法是否正确:铁器在空气中易腐蚀,则铝制品在空气中也易腐蚀。 ( )
金属的锈蚀与防护(近5年3考)
命题点4
×
5.某兴趣小组进行铁锈蚀的实验探究。
【知识回顾】铁是一种化学性质较活泼的金属,常温下能与稀盐酸、氧气等物质反应。
(1)铁与稀盐酸反应的化学方程式是______________________________。
(2)铁锈的颜色是________。
Fe+2HCl ===== FeCl2+H2↑
红棕色
【实验探究】该小组利用如图装置对铁钉锈蚀的条件进行探究,一段时间后,在A和B中没有观察到明显现象,C和D中铁钉有锈蚀。
(3)B中将蒸馏水煮沸的目的是__________________________________。
(4)A、B、D对比,说明铁钉锈蚀需要的物质是__________;C中的铁钉比D中的锈蚀更严重,原因是________________________________。
除去水中溶解的氧气,防止干扰实验
水和氧气
C中铁钉接触的氧气量比D中的多
附加问:
【拓展探究】
(5)为进一步探究铁钉锈蚀过程中气态物质的变化,该小组按图E所示装置完成以下实验。恒温下,向锥形瓶中加入少量稀盐酸,同时测量锥形瓶内气体压强随时间的变化,直至反应完全。
①测量过程中要保持恒温,理由是
____________________________________。
②请在图F中绘制整个反应过程中锥形瓶内气体压强的变化趋势。
防止温度变化影响气体压强的数据测定
同课章节目录
