(考点集训)2025年化学中考一轮复习9:溶液课件(人教版)
文档属性
| 名称 | (考点集训)2025年化学中考一轮复习9:溶液课件(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-13 23:05:56 | ||
图片预览









文档简介
(共54张PPT)
中考一轮复习 教材同步复习
第九单元 溶液
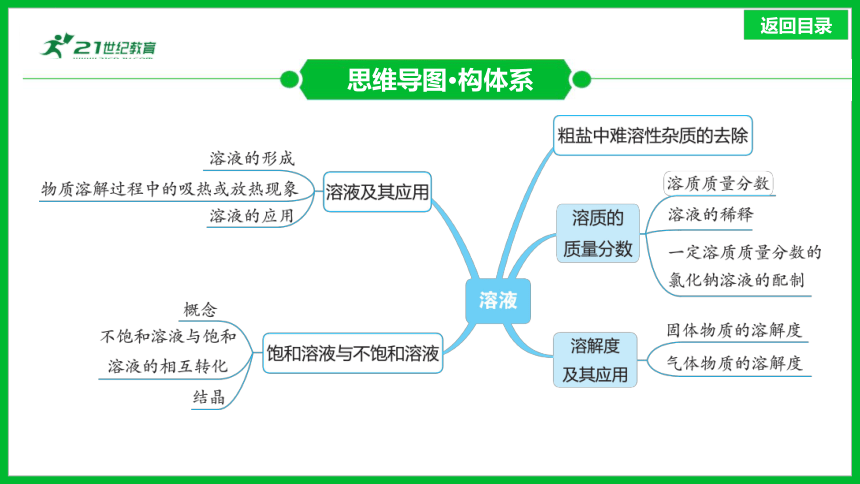
思维导图·构体系
知识精讲·夯基础
真题分点·明趋势
实验分阶·提能力
思维导图·构体系
1.溶液的形成
(1)概念:一种或几种物质分散到另一种物质里,形成的均一、稳定的混合物,叫作溶液。
(2)组成
知识精讲·夯基础
溶液及其应用(近5年1考)
知识点1
(3)特征
①________:溶液各部分的组成和性质完全相同。
②________:外界条件不发生改变时,溶液不分层、不析出固体。
(4)量的关系:溶液质量=溶质质量+溶剂质量。
均一性
稳定性
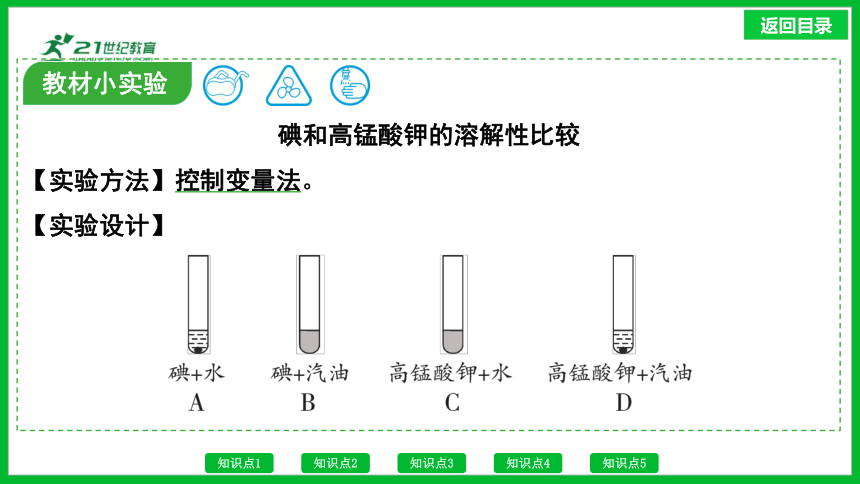
碘和高锰酸钾的溶解性比较
【实验方法】控制变量法。
【实验设计】
教材小实验
【实验现象】碘不溶于水,能溶于汽油;高锰酸钾能溶于水,不溶于汽油。
【实验分析】对比实验A、B(或实验C、D)中的现象,说明影响物质溶解性的因素是____________;对比实验A、C(或实验B、D)中的现象,说明影响物质溶解性的因素是____________。
溶剂的种类
溶质的种类
【实验结论】同一种物质在不同溶剂中的溶解性不同,不同种物质在同一溶剂中的溶解性也不同。
【反思交流】以上实验中除了要控制温度相同、加入的碘和高锰酸钾的质量相同以外,还要控制________________________。
加入水和汽油的体积相同
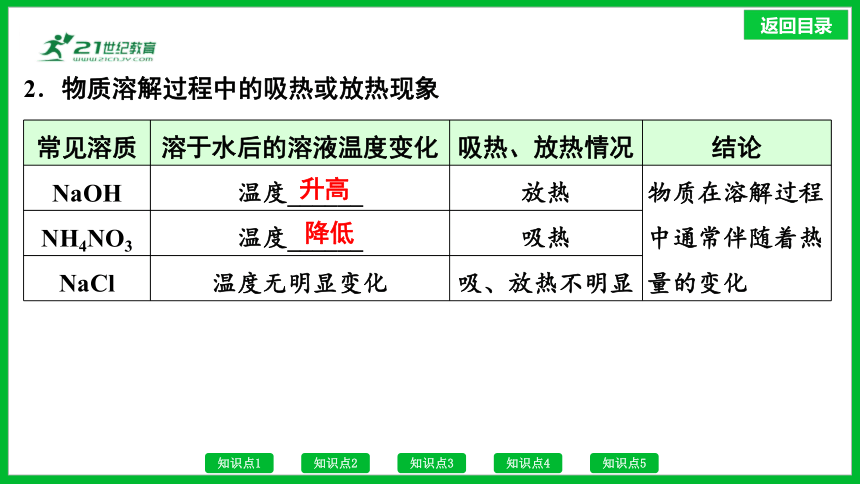
2.物质溶解过程中的吸热或放热现象
常见溶质 溶于水后的溶液温度变化 吸热、放热情况 结论
NaOH 温度______ 放热 物质在溶解过程中通常伴随着热量的变化
NH4NO3 温度______ 吸热 NaCl 温度无明显变化 吸、放热不明显 升高
降低
3.溶液的应用
(1)工业上:溶解固体反应物,加快化学反应的进行。
(2)生活上:人体和动植物的生理活动都是在溶液中进行的。
(3)医疗上:根据人体的生理需求配制溶液,如葡萄糖溶液。
(4)农业上:配制营养液,促进植物吸收。
判断下列说法的正误。
1.豆浆、可乐是常见的溶液。 ( )
2.形成溶液的溶质都是固态物质。 ( )
3.均一、稳定的液体一定是溶液。 ( )
4.溶液都是无色、透明的液体。 ( )
5.碘酒中的溶剂是水。 ( )
易错易混
×
×
×
×
×
6.玻璃杯中的蔗糖溶液下层比上层甜。 ( )
7.相同溶质在不同溶剂里的溶解性不同。 ( )
8.所有物质溶于水形成溶液都要吸收热量。 ( )
9.实验室中常将固体试剂配成溶液进行化学反应,可以增大化学反应速率。 ( )
×
√
×
√
1.概念:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫作这种溶质的______溶液;还能继续溶解溶质的溶液,叫作这种溶质的________溶液。
饱和溶液与不饱和溶液(近5年3考)
知识点2
【特别提醒】只有指明“在一定量溶剂里”和“在一定温度下”,溶液的“饱和”和“不饱和”才有确定的意义。
饱和
不饱和
2.不饱和溶液与饱和溶液的相互转化
(1)改变溶质或溶剂的量(适用于所有溶液)
不饱和溶液 饱和溶液
(2)改变温度(升温或降温取决于物质溶解度随温度变化的趋势)
上升型:不饱和溶液 饱和溶液
下降型:不饱和溶液 饱和溶液
蒸发溶剂
降低
升高
升高
降低
3.结晶
(1)概念:溶质从饱和溶液中以晶体的形式析出的过程。
(2)结晶方法
①______结晶:适用于溶解度受温度变化影响不大的物质,如海水晒盐。
②______结晶(或冷却热的饱和溶液):适用于溶解度随温度的升高而增大,且溶解度受温度变化影响较大的物质,如从KNO3溶液中得到硝酸钾。
蒸发
降温
判断下列说法的正误。
1.硝酸钾的饱和溶液可以继续溶解氯化钠固体。 ( )
2.有晶体析出的溶液一定是该物质的饱和溶液。 ( )
3.不饱和溶液降低温度后一定变为饱和溶液。 ( )
4.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液。 ( )
易错易混
√
√
×
×
1.固体物质的溶解度
(1)概念:表示在一定温度下,某固态物质在100 g溶剂里达到饱和状态时所溶解的质量。
(2)影响因素
溶解度及其应用(近5年5考)
知识点3
【归纳总结】温度对固体物质溶解度的影响:
(1)多数固体物质的溶解度随温度的升高而增大,如KNO3。
(2)少数固体物质的溶解度受温度变化的影响很小,如NaCl。
(3)极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2。
(3)固体物质溶解度与溶解性的关系(20 ℃)
2.气体物质的溶解度
(1)概念:是指该气体的压强为101 kPa和一定温度时,在1体积水里溶解达到饱和状态时的气体体积。
(2)影响因素
判断下列说法的正误。
1.搅拌可以增大固体物质的溶解度。 ( )
2.物质的溶解度都随温度的升高而增大。 ( )
3.夏天,鱼经常浮出水面是因为温度越高,氧气在水中的溶解度越小。
( )
易错易混
×
×
√
1.溶质质量分数
(1)概念:溶质质量与溶液质量之比。
(2)计算公式
①适用于所有溶液
溶质质量分数=×100%=×100%
②适用于饱和溶液
溶质质量分数=×100%(S为溶解度)
溶质的质量分数(近5年4考)
知识点4
2.溶液的稀释
(1)依据:溶液稀释前后,______的质量不会发生变化。
(2)计算公式
①浓溶液质量×浓溶液溶质的质量分数=稀溶液质量×稀溶液溶质的质量分数
②稀溶液质量=浓溶液质量+加入水的质量
3.一定溶质质量分数的氯化钠溶液的配制详见本册P75
判断下列说法的正误。
1.溶液的体积=溶质的体积+溶剂的体积。 ( )
2.20 ℃时,NaCl的溶解度为36 g,其饱和溶液的溶质质量分数为36%。 ( )
3.溶液析出晶体后,溶质质量分数可能不变。 ( )
4.在一定温度下,可以配制任意溶质质量分数的某溶液。 ( )
易错易混
×
×
√
×
一、配制质量分数为6%的氯化钠溶液
实验室配制50 g质量分数为6%的NaCl溶液,配制过程包括如下操作。请回答:
实验分阶·提能力
一定溶质质量分数的氯化钠溶液的配制(近5年4考)
实验8
例1
一阶 基础知识
【实验用品】
(1)该实验用品有天平、称量纸、烧杯、________、药匙、量筒、胶头滴管、空试剂瓶、空白标签;氯化钠、蒸馏水。
玻璃棒
【实验步骤】
(2)请完善表格中的内容。
计算 需要氯化钠的质量为___g,水的质量为____g
(体积为____mL,已知:ρ水=1 g/cm3)
称量 用天平称量所需质量的氯化钠[氯化钠放在天平的____(填“左”或“右”)盘称量],放入烧杯中
量取 用____(填“50”或“100”)mL量筒量取所需体积的水,倒入盛有氯化钠的烧杯中。读数时,视线与____________________________
______
3
47
47
左
50
量筒内液体凹液面的最低处保持
水平
溶解 用玻璃棒搅拌,使氯化钠溶解
装瓶并 贴标签 将配制好的溶液装入试剂瓶中,盖好瓶
塞并贴上标签
(标签上标明试剂名称和溶液中溶质的质
量分数,请补全标签内容),放入试剂柜
氯化钠溶液
6%
【计算公式】
①溶质质量=溶液质量×溶质质量分数;
②溶剂质量=溶液质量-溶质质量。
二阶 质疑反思
【误差分析】
(3)下列操作步骤会导致所配溶液溶质质量分数偏小的是____________(填序号)。
①氯化钠中含有杂质
②“左码右物”称量且使用了游码
③将称量的氯化钠倒入烧杯的过程中,一部分氯化钠撒落
④氯化钠倒入烧杯时,纸片上有少量残留
⑤量取水时俯视读数
⑥烧杯中原来有少量的水
⑦砝码生锈或沾有污渍
⑧量取的水没有完全转移到烧杯中
⑨溶液配制完成后,在装瓶过程中有部分液体洒出
①②③④⑥
实验过程中影响溶质质量分数的原因
(设m1为溶质质量,m2为溶剂质量,则溶液的质量为m1+m2)
构建模型
小
大
小
大
小
大
二、配制质量分数为3%的氯化钠溶液
用已配制好的质量分数为6%的氯化钠溶液(密度约为1.04 g/cm3),配制50 g质量分数为3%的氯化钠溶液。
例2
一阶 基础知识
【实验用品】
(1)该实验用品有烧杯、玻璃棒、量筒、胶头滴管、空试剂瓶、空白标签;蒸馏水、6%的氯化钠溶液。
【实验步骤】
(2)请完善表格中的内容。
计算 配制50 g质量分数为3%的氯化钠溶液,需要质量分数为6%的氯化钠溶液的质量为____g
(体积约为______mL,保留一位小数),水的质量为____g(体积为____mL,已知:ρ水=1 g/cm3)
量取 用量筒分别量取所需体积的氯化钠溶液和水,倒入烧杯中
混匀 用玻璃棒搅拌,使液体混合均匀
装瓶并 贴标签 将配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签,放入试剂柜
25
24.0
25
25
【计算公式】
①浓溶液的质量=;
②所需水的质量=稀溶液的质量-浓溶液的质量。
二阶 质疑反思
【误差分析】
(3)下列操作会导致所配溶液溶质质量分数偏大的是______(填序号)。
①量取水时仰视读数 ②量取浓溶液时仰视读数
③量取水时俯视读数 ④烧杯中原来有少量的水
⑤在稀释时有部分浓溶液溅出 ⑥量取浓溶液时俯视读数
②③
海水晒盐得到的粗盐中常含有难溶性杂质,如图是某实验小组进行粗盐提纯的实验:
粗盐中难溶性杂质的去除(近5年1考)
实验9
例
一阶 基础知识
【实验原理】
(1)该实验利用氯化钠和泥沙的________不同,对混合物进行分离提纯。
【实验用品】
(2)实验中需要用到的玻璃仪器有烧杯、玻璃棒和______。
溶解性
漏斗
【实验步骤】
(3)请完善表格中的内容。
称量 用托盘天平称取一定量粗盐,记为m1 g
溶解 向称取的粗盐中加水溶解,并用玻璃棒搅拌,直至粗盐不再溶解,称取剩余粗盐的质量,记为m2 g
过滤 用玻璃棒将粗盐水______至过滤器中过滤
蒸发 当蒸发皿中出现__________时,停止加热。利用
蒸发皿的余热使滤液蒸干
引流
较多固体
计算 产率
二阶 质疑反思
(4)经上述实验操作后,所得精盐是________(填“纯净物”或“混合物”)。
(5)该实验中有关玻璃棒的用途,说法错误的是____(填字母)。
A.溶解时搅拌,加快粗盐溶解
B.过滤时搅拌,加快过滤速率
C.蒸发时搅拌,防止因局部温度过高,造成液滴飞溅
(6)经过滤后所得的滤液仍浑浊,则可能的原因是______________________
__________________________________________________(写1点)。
混合物
B
滤纸破损(或过滤时液面
高于滤纸边缘,或承接滤液的烧杯不干净等,合理即可)
【误差分析】
(7)下列操作步骤会导致精盐产率偏高的是______(填序号)。
①粗盐没有充分溶解
②过滤时有滤液损失
③蒸发时液体溅出
④转移蒸发皿中的固体时,固体撒落
⑤过滤时液面高于滤纸边缘
⑥蒸发时未充分蒸干
⑤⑥
实验过程中影响产率的原因
构建模型
小
大
【备考补充】
粗盐中可溶性杂质的去除
海水晒盐得到的粗盐中不仅含有难溶性杂质,还含有可溶性杂质(主要为CaCl2、MgCl2、Na2SO4)。如图为得到精盐设计的除杂流程。
例
【流程分析】
(1)操作Ⅰ的名称是______;操作Ⅱ的名称是______。
(2)步骤①的目的是除去__________,反应的化学方程式为______________
_______________________;
步骤②的目的是除去_________,反应的化学方程式为_________________
______________________;
过滤
蒸发
Na2SO4
Na2SO4+BaCl2
===== BaSO4↓+2NaCl
MgCl2
2NaOH+MgCl2
====Mg(OH)2↓+2NaCl
步骤③的目的是除去________________________,反应的化学方程式为_____________________________________________________________________________;
步骤④的目的是除去____________________________,反应的化学方程式为______________________________________________________________
_________。
CaCl2和过量的BaCl2
Na2CO3+CaCl2 ===== CaCO3↓+2NaCl和Na2CO3+BaCl2 ===== BaCO3↓
+2NaCl
过量的NaOH和过量的Na2CO3
NaOH+HCl ===== NaCl+H2O和Na2CO3+2HCl ===== 2NaCl+H2O+
CO2↑
(3)加入的除杂试剂除上述流程图中的先后顺序外,还可以选择的加入顺序有______________(用字母表示)。
A.过量的碳酸钠溶液
B.过量的氢氧化钠溶液
C.过量的氯化钡溶液
BCA、CAB
1.判断说法是否正确:“将水溶性颜料溶于水球,水球呈美丽的蓝色”的解释是“颜料溶于水形成溶液”。 ( )
真题分点·明趋势
溶液的形成(近5年1考)
命题点1
√
2.煤化工废水中含有NaCl、Na2SO4、NaNO3,这三种盐的溶解度曲线如图所示。下列有关说法正确的是( )
A.与NaNO3相比,NaCl更适合通过饱和溶液降温
结晶得到
B.a1 ℃时,NaNO3的饱和溶液,溶质的质量分数
为80%
C.a2 ℃时,NaCl和Na2SO4的饱和溶液,溶质质量分数相等
D.40 ℃时,Na2SO4的饱和溶液,升温到60 ℃变为不饱和溶液
溶解度及其应用(近5年5考)
命题点2
C
3.已知KNO3在20 ℃、30 ℃时的溶解度分别为31.6 g、45.8 g,某同学按如图所示步骤进行实验,下列说法正确的是( )
A.Ⅰ中KNO3的质量分数为10.0%
B.Ⅱ中溶液是30 ℃时KNO3的不饱
和溶液
C.Ⅱ中KNO3的质量分数是Ⅰ中的2倍
D.Ⅲ中有KNO3晶体析出
B
4.(3)氯化钠的溶解度曲线如图所示。假设冬子的竹筒中有358 g氯化钠,10 ℃时最少需用_______g水溶解。
1 000
5.完成“一定溶质质量分数的氯化钠溶液的配制”和“粗盐中难溶性杂质的去除”两个实验,都必须用到的仪器是( )
一定溶质质量分数的溶液的配制(近5年4考)
命题点3
A
6.某同学配制100 g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是( )
A.用托盘天平称葡萄糖时,砝码放在左盘
B.转移葡萄糖时,纸上有少量残留
C.用量筒量取水时,俯视液面
D.配好溶液装入试剂瓶时,有少量洒出
C
7.20 ℃时,NaCl的溶解度为36 g。配制此温度下20 g质量分数为5%的NaCl溶液,下列说法正确的是( )
A.配制该溶液需要5 g NaCl
B.该溶液为饱和溶液
C.将该溶液长时间敞口放置,最终有晶体析出
D.配溶液时,量取所需体积的水倒入烧杯,有少量水洒出,则所配溶液浓度小于5%
C
8.(2)从盐水中重新得到食盐固体,
需进行操作的名称是______。
粗盐中难溶性杂质的去除(近5年1考)
命题点4
蒸发
中考一轮复习 教材同步复习
第九单元 溶液
思维导图·构体系
知识精讲·夯基础
真题分点·明趋势
实验分阶·提能力
思维导图·构体系
1.溶液的形成
(1)概念:一种或几种物质分散到另一种物质里,形成的均一、稳定的混合物,叫作溶液。
(2)组成
知识精讲·夯基础
溶液及其应用(近5年1考)
知识点1
(3)特征
①________:溶液各部分的组成和性质完全相同。
②________:外界条件不发生改变时,溶液不分层、不析出固体。
(4)量的关系:溶液质量=溶质质量+溶剂质量。
均一性
稳定性
碘和高锰酸钾的溶解性比较
【实验方法】控制变量法。
【实验设计】
教材小实验
【实验现象】碘不溶于水,能溶于汽油;高锰酸钾能溶于水,不溶于汽油。
【实验分析】对比实验A、B(或实验C、D)中的现象,说明影响物质溶解性的因素是____________;对比实验A、C(或实验B、D)中的现象,说明影响物质溶解性的因素是____________。
溶剂的种类
溶质的种类
【实验结论】同一种物质在不同溶剂中的溶解性不同,不同种物质在同一溶剂中的溶解性也不同。
【反思交流】以上实验中除了要控制温度相同、加入的碘和高锰酸钾的质量相同以外,还要控制________________________。
加入水和汽油的体积相同
2.物质溶解过程中的吸热或放热现象
常见溶质 溶于水后的溶液温度变化 吸热、放热情况 结论
NaOH 温度______ 放热 物质在溶解过程中通常伴随着热量的变化
NH4NO3 温度______ 吸热 NaCl 温度无明显变化 吸、放热不明显 升高
降低
3.溶液的应用
(1)工业上:溶解固体反应物,加快化学反应的进行。
(2)生活上:人体和动植物的生理活动都是在溶液中进行的。
(3)医疗上:根据人体的生理需求配制溶液,如葡萄糖溶液。
(4)农业上:配制营养液,促进植物吸收。
判断下列说法的正误。
1.豆浆、可乐是常见的溶液。 ( )
2.形成溶液的溶质都是固态物质。 ( )
3.均一、稳定的液体一定是溶液。 ( )
4.溶液都是无色、透明的液体。 ( )
5.碘酒中的溶剂是水。 ( )
易错易混
×
×
×
×
×
6.玻璃杯中的蔗糖溶液下层比上层甜。 ( )
7.相同溶质在不同溶剂里的溶解性不同。 ( )
8.所有物质溶于水形成溶液都要吸收热量。 ( )
9.实验室中常将固体试剂配成溶液进行化学反应,可以增大化学反应速率。 ( )
×
√
×
√
1.概念:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫作这种溶质的______溶液;还能继续溶解溶质的溶液,叫作这种溶质的________溶液。
饱和溶液与不饱和溶液(近5年3考)
知识点2
【特别提醒】只有指明“在一定量溶剂里”和“在一定温度下”,溶液的“饱和”和“不饱和”才有确定的意义。
饱和
不饱和
2.不饱和溶液与饱和溶液的相互转化
(1)改变溶质或溶剂的量(适用于所有溶液)
不饱和溶液 饱和溶液
(2)改变温度(升温或降温取决于物质溶解度随温度变化的趋势)
上升型:不饱和溶液 饱和溶液
下降型:不饱和溶液 饱和溶液
蒸发溶剂
降低
升高
升高
降低
3.结晶
(1)概念:溶质从饱和溶液中以晶体的形式析出的过程。
(2)结晶方法
①______结晶:适用于溶解度受温度变化影响不大的物质,如海水晒盐。
②______结晶(或冷却热的饱和溶液):适用于溶解度随温度的升高而增大,且溶解度受温度变化影响较大的物质,如从KNO3溶液中得到硝酸钾。
蒸发
降温
判断下列说法的正误。
1.硝酸钾的饱和溶液可以继续溶解氯化钠固体。 ( )
2.有晶体析出的溶液一定是该物质的饱和溶液。 ( )
3.不饱和溶液降低温度后一定变为饱和溶液。 ( )
4.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液。 ( )
易错易混
√
√
×
×
1.固体物质的溶解度
(1)概念:表示在一定温度下,某固态物质在100 g溶剂里达到饱和状态时所溶解的质量。
(2)影响因素
溶解度及其应用(近5年5考)
知识点3
【归纳总结】温度对固体物质溶解度的影响:
(1)多数固体物质的溶解度随温度的升高而增大,如KNO3。
(2)少数固体物质的溶解度受温度变化的影响很小,如NaCl。
(3)极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2。
(3)固体物质溶解度与溶解性的关系(20 ℃)
2.气体物质的溶解度
(1)概念:是指该气体的压强为101 kPa和一定温度时,在1体积水里溶解达到饱和状态时的气体体积。
(2)影响因素
判断下列说法的正误。
1.搅拌可以增大固体物质的溶解度。 ( )
2.物质的溶解度都随温度的升高而增大。 ( )
3.夏天,鱼经常浮出水面是因为温度越高,氧气在水中的溶解度越小。
( )
易错易混
×
×
√
1.溶质质量分数
(1)概念:溶质质量与溶液质量之比。
(2)计算公式
①适用于所有溶液
溶质质量分数=×100%=×100%
②适用于饱和溶液
溶质质量分数=×100%(S为溶解度)
溶质的质量分数(近5年4考)
知识点4
2.溶液的稀释
(1)依据:溶液稀释前后,______的质量不会发生变化。
(2)计算公式
①浓溶液质量×浓溶液溶质的质量分数=稀溶液质量×稀溶液溶质的质量分数
②稀溶液质量=浓溶液质量+加入水的质量
3.一定溶质质量分数的氯化钠溶液的配制详见本册P75
判断下列说法的正误。
1.溶液的体积=溶质的体积+溶剂的体积。 ( )
2.20 ℃时,NaCl的溶解度为36 g,其饱和溶液的溶质质量分数为36%。 ( )
3.溶液析出晶体后,溶质质量分数可能不变。 ( )
4.在一定温度下,可以配制任意溶质质量分数的某溶液。 ( )
易错易混
×
×
√
×
一、配制质量分数为6%的氯化钠溶液
实验室配制50 g质量分数为6%的NaCl溶液,配制过程包括如下操作。请回答:
实验分阶·提能力
一定溶质质量分数的氯化钠溶液的配制(近5年4考)
实验8
例1
一阶 基础知识
【实验用品】
(1)该实验用品有天平、称量纸、烧杯、________、药匙、量筒、胶头滴管、空试剂瓶、空白标签;氯化钠、蒸馏水。
玻璃棒
【实验步骤】
(2)请完善表格中的内容。
计算 需要氯化钠的质量为___g,水的质量为____g
(体积为____mL,已知:ρ水=1 g/cm3)
称量 用天平称量所需质量的氯化钠[氯化钠放在天平的____(填“左”或“右”)盘称量],放入烧杯中
量取 用____(填“50”或“100”)mL量筒量取所需体积的水,倒入盛有氯化钠的烧杯中。读数时,视线与____________________________
______
3
47
47
左
50
量筒内液体凹液面的最低处保持
水平
溶解 用玻璃棒搅拌,使氯化钠溶解
装瓶并 贴标签 将配制好的溶液装入试剂瓶中,盖好瓶
塞并贴上标签
(标签上标明试剂名称和溶液中溶质的质
量分数,请补全标签内容),放入试剂柜
氯化钠溶液
6%
【计算公式】
①溶质质量=溶液质量×溶质质量分数;
②溶剂质量=溶液质量-溶质质量。
二阶 质疑反思
【误差分析】
(3)下列操作步骤会导致所配溶液溶质质量分数偏小的是____________(填序号)。
①氯化钠中含有杂质
②“左码右物”称量且使用了游码
③将称量的氯化钠倒入烧杯的过程中,一部分氯化钠撒落
④氯化钠倒入烧杯时,纸片上有少量残留
⑤量取水时俯视读数
⑥烧杯中原来有少量的水
⑦砝码生锈或沾有污渍
⑧量取的水没有完全转移到烧杯中
⑨溶液配制完成后,在装瓶过程中有部分液体洒出
①②③④⑥
实验过程中影响溶质质量分数的原因
(设m1为溶质质量,m2为溶剂质量,则溶液的质量为m1+m2)
构建模型
小
大
小
大
小
大
二、配制质量分数为3%的氯化钠溶液
用已配制好的质量分数为6%的氯化钠溶液(密度约为1.04 g/cm3),配制50 g质量分数为3%的氯化钠溶液。
例2
一阶 基础知识
【实验用品】
(1)该实验用品有烧杯、玻璃棒、量筒、胶头滴管、空试剂瓶、空白标签;蒸馏水、6%的氯化钠溶液。
【实验步骤】
(2)请完善表格中的内容。
计算 配制50 g质量分数为3%的氯化钠溶液,需要质量分数为6%的氯化钠溶液的质量为____g
(体积约为______mL,保留一位小数),水的质量为____g(体积为____mL,已知:ρ水=1 g/cm3)
量取 用量筒分别量取所需体积的氯化钠溶液和水,倒入烧杯中
混匀 用玻璃棒搅拌,使液体混合均匀
装瓶并 贴标签 将配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签,放入试剂柜
25
24.0
25
25
【计算公式】
①浓溶液的质量=;
②所需水的质量=稀溶液的质量-浓溶液的质量。
二阶 质疑反思
【误差分析】
(3)下列操作会导致所配溶液溶质质量分数偏大的是______(填序号)。
①量取水时仰视读数 ②量取浓溶液时仰视读数
③量取水时俯视读数 ④烧杯中原来有少量的水
⑤在稀释时有部分浓溶液溅出 ⑥量取浓溶液时俯视读数
②③
海水晒盐得到的粗盐中常含有难溶性杂质,如图是某实验小组进行粗盐提纯的实验:
粗盐中难溶性杂质的去除(近5年1考)
实验9
例
一阶 基础知识
【实验原理】
(1)该实验利用氯化钠和泥沙的________不同,对混合物进行分离提纯。
【实验用品】
(2)实验中需要用到的玻璃仪器有烧杯、玻璃棒和______。
溶解性
漏斗
【实验步骤】
(3)请完善表格中的内容。
称量 用托盘天平称取一定量粗盐,记为m1 g
溶解 向称取的粗盐中加水溶解,并用玻璃棒搅拌,直至粗盐不再溶解,称取剩余粗盐的质量,记为m2 g
过滤 用玻璃棒将粗盐水______至过滤器中过滤
蒸发 当蒸发皿中出现__________时,停止加热。利用
蒸发皿的余热使滤液蒸干
引流
较多固体
计算 产率
二阶 质疑反思
(4)经上述实验操作后,所得精盐是________(填“纯净物”或“混合物”)。
(5)该实验中有关玻璃棒的用途,说法错误的是____(填字母)。
A.溶解时搅拌,加快粗盐溶解
B.过滤时搅拌,加快过滤速率
C.蒸发时搅拌,防止因局部温度过高,造成液滴飞溅
(6)经过滤后所得的滤液仍浑浊,则可能的原因是______________________
__________________________________________________(写1点)。
混合物
B
滤纸破损(或过滤时液面
高于滤纸边缘,或承接滤液的烧杯不干净等,合理即可)
【误差分析】
(7)下列操作步骤会导致精盐产率偏高的是______(填序号)。
①粗盐没有充分溶解
②过滤时有滤液损失
③蒸发时液体溅出
④转移蒸发皿中的固体时,固体撒落
⑤过滤时液面高于滤纸边缘
⑥蒸发时未充分蒸干
⑤⑥
实验过程中影响产率的原因
构建模型
小
大
【备考补充】
粗盐中可溶性杂质的去除
海水晒盐得到的粗盐中不仅含有难溶性杂质,还含有可溶性杂质(主要为CaCl2、MgCl2、Na2SO4)。如图为得到精盐设计的除杂流程。
例
【流程分析】
(1)操作Ⅰ的名称是______;操作Ⅱ的名称是______。
(2)步骤①的目的是除去__________,反应的化学方程式为______________
_______________________;
步骤②的目的是除去_________,反应的化学方程式为_________________
______________________;
过滤
蒸发
Na2SO4
Na2SO4+BaCl2
===== BaSO4↓+2NaCl
MgCl2
2NaOH+MgCl2
====Mg(OH)2↓+2NaCl
步骤③的目的是除去________________________,反应的化学方程式为_____________________________________________________________________________;
步骤④的目的是除去____________________________,反应的化学方程式为______________________________________________________________
_________。
CaCl2和过量的BaCl2
Na2CO3+CaCl2 ===== CaCO3↓+2NaCl和Na2CO3+BaCl2 ===== BaCO3↓
+2NaCl
过量的NaOH和过量的Na2CO3
NaOH+HCl ===== NaCl+H2O和Na2CO3+2HCl ===== 2NaCl+H2O+
CO2↑
(3)加入的除杂试剂除上述流程图中的先后顺序外,还可以选择的加入顺序有______________(用字母表示)。
A.过量的碳酸钠溶液
B.过量的氢氧化钠溶液
C.过量的氯化钡溶液
BCA、CAB
1.判断说法是否正确:“将水溶性颜料溶于水球,水球呈美丽的蓝色”的解释是“颜料溶于水形成溶液”。 ( )
真题分点·明趋势
溶液的形成(近5年1考)
命题点1
√
2.煤化工废水中含有NaCl、Na2SO4、NaNO3,这三种盐的溶解度曲线如图所示。下列有关说法正确的是( )
A.与NaNO3相比,NaCl更适合通过饱和溶液降温
结晶得到
B.a1 ℃时,NaNO3的饱和溶液,溶质的质量分数
为80%
C.a2 ℃时,NaCl和Na2SO4的饱和溶液,溶质质量分数相等
D.40 ℃时,Na2SO4的饱和溶液,升温到60 ℃变为不饱和溶液
溶解度及其应用(近5年5考)
命题点2
C
3.已知KNO3在20 ℃、30 ℃时的溶解度分别为31.6 g、45.8 g,某同学按如图所示步骤进行实验,下列说法正确的是( )
A.Ⅰ中KNO3的质量分数为10.0%
B.Ⅱ中溶液是30 ℃时KNO3的不饱
和溶液
C.Ⅱ中KNO3的质量分数是Ⅰ中的2倍
D.Ⅲ中有KNO3晶体析出
B
4.(3)氯化钠的溶解度曲线如图所示。假设冬子的竹筒中有358 g氯化钠,10 ℃时最少需用_______g水溶解。
1 000
5.完成“一定溶质质量分数的氯化钠溶液的配制”和“粗盐中难溶性杂质的去除”两个实验,都必须用到的仪器是( )
一定溶质质量分数的溶液的配制(近5年4考)
命题点3
A
6.某同学配制100 g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是( )
A.用托盘天平称葡萄糖时,砝码放在左盘
B.转移葡萄糖时,纸上有少量残留
C.用量筒量取水时,俯视液面
D.配好溶液装入试剂瓶时,有少量洒出
C
7.20 ℃时,NaCl的溶解度为36 g。配制此温度下20 g质量分数为5%的NaCl溶液,下列说法正确的是( )
A.配制该溶液需要5 g NaCl
B.该溶液为饱和溶液
C.将该溶液长时间敞口放置,最终有晶体析出
D.配溶液时,量取所需体积的水倒入烧杯,有少量水洒出,则所配溶液浓度小于5%
C
8.(2)从盐水中重新得到食盐固体,
需进行操作的名称是______。
粗盐中难溶性杂质的去除(近5年1考)
命题点4
蒸发
同课章节目录
