(考点集训)2025年化学中考一轮复习10:课时1 溶液的酸碱性 常见的酸和碱课件(人教版)
文档属性
| 名称 | (考点集训)2025年化学中考一轮复习10:课时1 溶液的酸碱性 常见的酸和碱课件(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 859.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-13 23:06:46 | ||
图片预览










文档简介
(共50张PPT)
中考一轮复习 教材同步复习
第十单元 常见的酸、碱、盐
课时1 溶液的酸碱性 常见的酸和碱
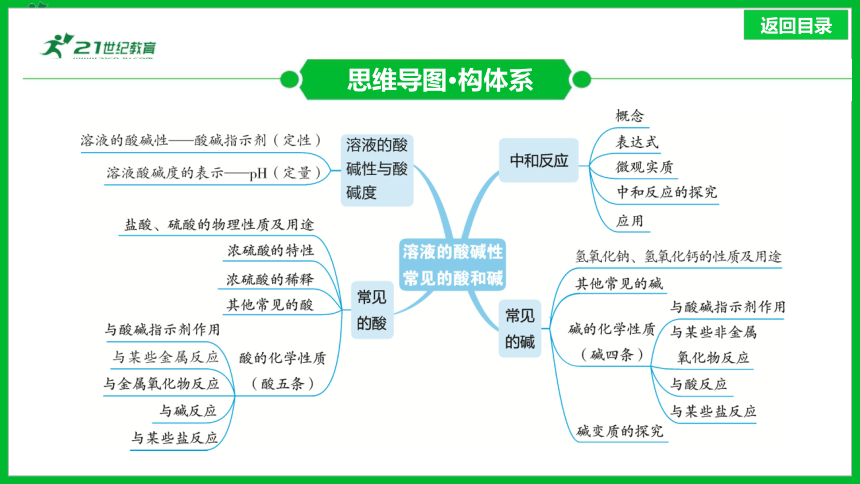
思维导图·构体系
知识精讲·夯基础
真题分点·明趋势
实验分阶·提能力
思维导图·构体系
1.溶液的酸碱性——酸碱指示剂(定性)
知识精讲·夯基础
溶液的酸碱性与酸碱度(近5年5考)
知识点1
酸碱指示剂 酸性溶液 中性溶液 碱性溶液
紫色石蕊溶液 红色 紫色 蓝色
无色酚酞溶液 无色 无色 红色
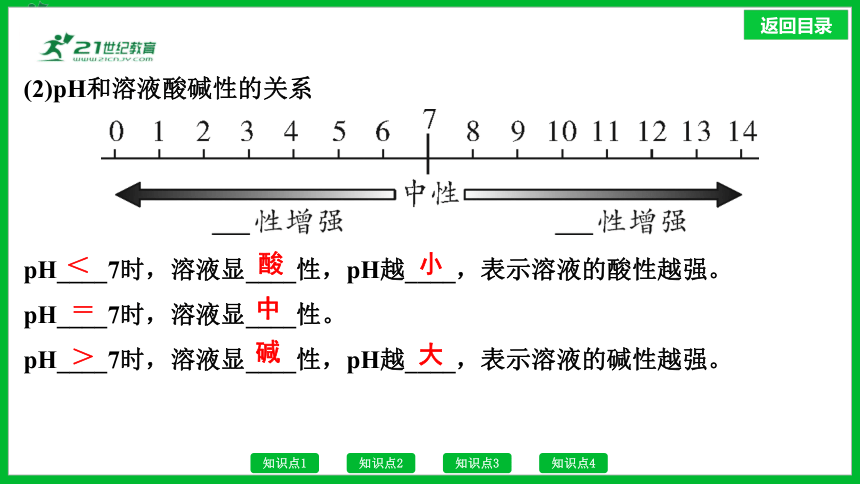
2.溶液酸碱度的表示——pH(定量)
(1)pH的范围:通常为0~14。
【特别提醒】pH试纸一般只能粗略测定溶液的酸碱度,且测得的数值为整数;若要较准确地测定溶液的pH,则可使用酸度计(pH计)。
(2)pH和溶液酸碱性的关系
pH____7时,溶液显____性,pH越____,表示溶液的酸性越强。
pH____7时,溶液显____性。
pH____7时,溶液显____性,pH越____,表示溶液的碱性越强。
<
酸
小
=
中
>
碱
大
(3)溶液酸碱度的应用
①测定人体内或排出液体的pH,可以帮助人们了解身体的健康状况。
②在化工生产中,许多反应都必须在一定pH范围的溶液里进行。
③在农业生产中,农作物一般适宜在pH=7或接近7的土壤中生长;pH<4的酸性土壤或pH>8的碱性土壤,一般需要经过改良才适于种植。
④正常雨水的pH≈5.6,酸雨的pH<5.6,随时监测雨水的pH,了解空气的污染情况。(2023.5B)
【备考补充】稀释酸性或碱性溶液时,溶液pH的变化曲线及分析
判断下列说法的正误。
1.碱溶液一定呈碱性,呈碱性的溶液一定是碱溶液。 ( )
2.指示剂在不同溶液中显示不同颜色的过程发生了化学变化。 ( )
3.滴加无色酚酞溶液,不变色的溶液一定是酸溶液。 ( )
4.能使紫色石蕊溶液变蓝的溶液一定是碱溶液。 ( )
5. Cu(OH)2能使酚酞溶液变红。 ( )
6.用pH试纸可精确测定某雨水的pH为5.6。 ( )
7.测定溶液pH时,若先用水将pH试纸润湿,则测定结果一定偏大。( )
易错易混
×
√
×
×
×
×
×
1.盐酸、硫酸的物理性质及用途
常见的酸(近5年5考)
知识点2
名称(化学式) 盐酸(_____________) 硫酸(__________)
颜色、状态 无色的液体 浓硫酸为无色、黏稠的油状液体
打开试剂瓶 瓶盖后的现象 瓶口出现白雾(浓盐酸易挥发) 无明显现象
溶质为HCl
H2SO4
气味 有刺激性气味 无气味
用途 ①用于金属表面除锈、制造药物等;②人体胃液中含有盐酸,可帮助消化 用于生产化肥、农药、火药、染料及冶炼金属、精炼石油和金属除锈等
2.浓硫酸的特性
(1)______性:在实验室中常用它作干燥剂。
(2)强烈的腐蚀性:它能夺取纸张、木材、布料、皮肤(都由含碳、氢、氧等元素的化合物组成)里的水分,生成黑色的炭。
【备考补充】脱水作用:浓硫酸能将物质中的氢、氧按水的组成比脱去,这种作用通常叫作脱水作用。
吸水
3.浓硫酸的稀释详见本册P8
4.其他常见的酸:硝酸(HNO3)、醋酸(CH3COOH)、碳酸(H2CO3)等。
5.酸的化学性质(酸五条)
化学性质 举例 化学方程式 现象
与酸碱指 示剂作用 - 能使紫色石蕊溶液变____,不能使无色酚酞溶液变色
红
化学性质 举例 化学方程式 现象
与某些金属反应(酸+某些金属→盐+氢气,置换反应) 稀盐酸与铁反应:___________ _________________________ 有______产生,溶液由无色变为______色
稀硫酸与锌反应:___________ ___________________ 有______产生
2HCl+
Fe ===== FeCl2+H2↑
气泡
浅绿
H2SO4+
Zn===== ZnSO4+H2↑
气泡
化学性质 举例 化学方程式 现象
与金属氧化物反应(酸+金属氧化物→盐+水,复分解反应) 稀盐酸与氧化铁反应: ____________________________________ 红棕色固体逐渐溶解,溶液由无色变为____色
稀硫酸与氧化铜反应: ____________________________________ 黑色固体逐渐溶解,溶液由无色变为____色
6HCl+Fe2O3 ===== 2FeCl3
+3H2O
黄
H2SO4+CuO ===== CuSO4
+H2O
蓝
化学性质 举例 化学方程式 现象
与碱反应(酸+碱→盐+水,复分解反应) 稀盐酸与氢氧化钠溶液反应: ______________________________ 无明显现象
与某些盐反应(酸+盐→新酸+新盐,复分解反应) 稀盐酸与碳酸钙反应: __________________________________________ 有______产生
HCl+NaOH ===== NaCl+H2O
2HCl+CaCO3 ===== CaCl2+H2O
+CO2↑
气泡
【归纳总结】
(1)酸具有相似化学性质的原因是酸溶液中都含有________________。
(2)不同的酸具有独特的个性,原因是不同的酸中________(即酸根离子)不同。如HCl+AgNO3 ===== AgCl↓+HNO3,H2SO4+BaCl2===== BaSO4↓+2HCl,二者均能观察到产生__________。
氢离子(或H+)
阴离子
白色沉淀
判断下列说法的正误。
1.酸中一定含有氢元素,但含有氢元素的物质不一定是酸。 ( )
2.酸的水溶液显酸性,所以酸性溶液一定是酸溶液。 ( )
3.浓硫酸可用于干燥所有气体。 ( )
4.长时间敞口放置在空气中的浓盐酸和浓硫酸,溶质质量分数均会变小。 ( )
易错易混
√
×
×
√
5.将铜丝插入稀硫酸中,能观察到产生气泡。 ( )
6.为除去铁钉表面的铁锈,可将铁钉长时间放置在盛有稀硫酸的烧杯中。 ( )
7.稀盐酸和氢氧化铝能发生中和反应。 ( )
8.酸与盐一定能发生复分解反应。 ( )
×
×
√
×
1.氢氧化钠、氢氧化钙的性质及用途
常见的碱(近5年5考)
知识点3
名称(化学式) 氢氧化钠(_________) 氢氧化钙[____________]
俗名 苛性钠(2022.9A)、火碱、______ ________、消石灰
颜色、状态 白色固体 白色粉末状固体
溶解性 ____溶于水,溶解时放出大量的热 ____溶于水(其水溶液俗称石灰水;当石灰水中存在较多未溶解的熟石灰时,就称为石灰乳或石灰浆)
NaOH
Ca(OH)2
烧碱
熟石灰
易
微
吸水性 易吸收水分而潮解 无
腐蚀性 有强烈的腐蚀性 有腐蚀性
用途 ①广泛应用于制肥皂,以及石油、造纸、纺织和印染等工业;②生活中可用来去除油污;③实验室中可用作某些气体的干燥剂 ①作建筑材料;②农业上用________ 与硫酸铜溶液等配制成具有杀菌作用的波尔多液;③改良____性土壤;④在实验室中常用澄清石灰水检验二氧化碳
石灰乳
酸
2.其他常见的碱:氢氧化钾(KOH)等。
3.碱的化学性质(碱四条)
化学性质 举例 化学方程式 现象
与酸碱指 示剂作用 - 能使紫色石蕊溶液变____,使无色酚酞溶液变____
蓝
红
化学性质 举例 化学方程式 现象
与某些非金属氧化物反应(碱+非金属氧化物→盐+水) 氢氧化钠溶液与二氧化碳反应: __________________________________ (吸收二氧化碳) 无明显现象
氢氧化钙溶液与二氧化碳反应: _____________________________________ (检验二氧化碳) 有__________产生
2NaOH+CO2 ===== Na2CO3+H2O
Ca(OH)2+CO2 ===== CaCO3↓+H2O
白色沉淀
化学性质 举例 化学方程式 现象
与酸反应(碱+酸→盐+水,复分解反应) 氢氧化钠溶液和稀硫酸反应: _____________________________________ 无明显现象
氢氧化钙溶液和稀盐酸反应: _____________________________________ 无明显现象
2NaOH+H2SO4 ===== Na2SO4+2H2O
Ca(OH)2+2HCl ===== CaCl2+2H2O
化学性质 举例 化学方程式 现象
与某些盐反应(可溶性碱+可溶性盐→新碱+新盐,复分解反应) 氢氧化钠溶液与硫酸铜溶液反应: ______________________________________________ 有__________生成
氢氧化钙溶液与碳酸钠溶液反应: ______________________________________________ 有__________
生成
2NaOH+CuSO4 ===== Cu(OH)2↓+
Na2SO4
蓝色沉淀
Ca(OH)2+Na2CO3 ===== CaCO3↓+
2NaOH
白色沉淀
【归纳总结】
(1)碱具有相似化学性质的原因是碱溶液中都含有____________________。
(2)不同的碱具有独特的个性,原因是不同的碱中阳离子不同。
氢氧根离子(或OH-)
【归纳总结】常见试剂露置于空气中一段时间的总质量变化及原因分析
试剂名称 试剂总质量变化 原因分析
浓盐酸 ______ 具有挥发性
浓硫酸 ______ 具有吸水性
浓氨水 减小 具有挥发性
__________固体 ______ 易吸收空气中的水分而潮解,且能与空气中的二氧化碳反应
氢氧化钙固体 能与空气中的二氧化碳反应
生石灰 增大 易与空气中的水蒸气反应
减小
增大
氢氧化钠
增大
判断下列说法的正误。
1.氢氧化钠显碱性,可用于改良酸性土壤。 ( )
2.碱能与某些非金属氧化物反应,所以碱能吸收一氧化碳气体。 ( )
3.烧碱变质的过程中,其溶液的pH逐渐增大。 ( )
4.除去烧碱溶液中混有的少量纯碱,可以滴加适量氢氧化钙溶液,过滤。 ( )
易错易混
×
×
×
√
1.概念:酸与碱作用生成盐和水的反应。
2.表达式:酸+碱→盐+水。
3.微观实质:酸中的________________和碱中的_____________________
结合生成_________________。
中和反应(近5年4考)
知识点4
H+(或氢离子)
OH-(或氢氧根离子)
H2O(或水分子)
4.应用
(1)服用含有碱性物质的药物中和过多的胃酸。
(2)涂抹含碱性物质的溶液,减轻蜂或蚂蚁叮咬后出现的肿、痛或瘙痒等症状。
(3)处理工厂废水,如用熟石灰中和含有硫酸的废水,用硫酸中和碱性废水。
(4)调节土壤的酸碱性,如用熟石灰中和酸性土壤。
判断下列说法的正误。
1.用含碳酸氢钠的药物治疗胃酸过多症是利用了中和反应的原理。
( )
2.中和反应一定有盐和水生成,则有盐和水生成的反应一定是中和反应。 ( )
易错易混
×
×
化学兴趣小组同学利用稀氢氧化钠溶液和稀盐酸进行如图所示中和反应的实验。
实验分阶·提能力
中和反应的探究(近5年1考)
实验10
例
一阶 基础知识
【实验操作及现象】
(1)向烧杯中加入5 mL稀氢氧化钠溶液,滴入几滴酚酞溶液,溶液变为____色。然后用滴管慢慢滴入稀盐酸,并不断搅拌溶液,直至溶液颜色恰好变成无色为止。
红
【实验分析】
(2)滴加稀盐酸的过程中溶液颜色变成无色,说明氢氧化钠与滴入的稀盐酸发生了中和反应。
【实验结论】
(3)氢氧化钠溶液能与稀盐酸发生反应,反应的化学方程式为____________
_____________________。
NaOH+HCl
==== NaCl+H2O
二阶 质疑反思
(4)该实验中一般不选紫色石蕊溶液作指示剂,原因是紫色石蕊溶液在碱性溶液中显___色,在中性溶液中显___色,两种颜色之间没有明显界线。
(5)若将稀盐酸滴入氢氧化钠溶液中观察到有少量气泡产生,原因可能是________________。
(6)实验前忘记加入酚酞溶液,实验过程中再加酚酞溶液,发现溶液未变色,______(填“能”或“不能”)证明恰好完全反应,理由是___________
_________________________________。
蓝
紫
氢氧化钠已变质
不能
酚酞在酸性
溶液中也不变色,可能稀盐酸已过量
三阶 改进创新
(7)【微型装置】利用如图Ⅰ实验装置探究氢氧化钠溶液和稀盐酸能否发生反应的优点是________________________________(写1点)。
Ⅰ
节约试剂(或操作简单,合理即可)
四阶 拓展延伸
(8)【课标新增·作图】氢氧化钠溶液与稀盐酸反应的微观过程模拟示意图如图Ⅱ,请将框内补画完整并回答问题。
该0反应的实质是_________________________________________________
_____________________________________。
氢氧化钠溶液中的氢氧根离子(或OH-)与稀盐酸中的氢
离子(或H+)结合生成水分子(或H2O)
(9)【课标新增·数字化实验-pH】实验过程中用pH传感器测得pH变化如图Ⅲ。
①A点pH____(填“>”“<”或“=”,下同)7,此时的溶
液呈____(填“酸”“碱”或“中”,下同)性,溶液
中的溶质是_________(填化学式,不考虑酚酞,下同)。
②B点pH____7,此时的溶液呈____性,溶液中的溶质是________。
③C点pH____7,此时的溶液呈___性,溶液中的溶质是_____________。
>
碱
NaOH
=
中
NaCl
<
酸
NaCl、HCl
(10)【课标新增·数字化实验-温度】分别取等体积的氢氧化钠溶液、稀盐酸、水,按如表进行实验,测定溶液温度随时间变化的曲线如图Ⅳ。
烧杯 烧杯中原有的物质 逐滴滴入的物质
甲 40%氢氧化钠溶液 4%稀盐酸
乙 40%氢氧化钠溶液 水
丙 4%稀盐酸 水
①图Ⅳ中,曲线上P点表示的含义是______________________________。
②对比甲、乙、丙三条曲线,可以得到酸碱中和反应是______(填“放热”或“吸热”)反应。
③证明中和反应有热量放出的证据是________________________________
__________________________。
氢氧化钠和稀盐酸恰好完全反应
放热
丙中温度无明显变化,甲、乙中温度
升高,且甲中比乙中放热多
(11)【课标新增·设计实验方案】某小组在做氢氧化钠溶液和稀盐酸发生中和反应的实验时,忘记滴加酚酞溶液,再次滴加酚酞溶液后,溶液为无色。同学们对该反应后溶液中溶质的成分进行了如下探究。
猜想一:NaCl、NaOH;猜想二:NaCl;猜想三:_______________。
NaCl、HCl
同学们经过讨论后认为猜想一不正确,其理由是______________________
_________________________________________。为了验证其他猜想,小组同学设计了如下实验方案。
实验操作 实验现象 实验结论
方案1:取少量反应后的溶液于试管中,滴加紫色石蕊溶液 溶液显____色 猜想三
正确
方案2: ___________________________ _____________________ ________________________ 滴入酚酞溶液后,溶液为
无色,说明溶液不呈碱性,不含NaOH
红
取少量反应后的溶液于试管中,
加入镁条(合理即可)
产生气泡(与前一空
对应)
1.判断如下劳动项目所涉及的化学知识是否正确:( )
真题分点·明趋势
溶液酸碱性及pH(近5年5考)
命题点1
×
劳动项目 化学知识
用食醋去除热水瓶内壁的水垢 食醋的pH>7
2.某实验小组用如图所示装置进行微型实验。按下列表中选项加入试剂,实验时滴入甲,浸有丙的棉花不变红的是( )
选项 甲 乙 丙
A 浓氨水 - 无色酚酞溶液
B 石灰水 碳酸钠 无色酚酞溶液
C 稀盐酸 石灰石 紫色石蕊溶液
D 浓盐酸 锌粒 紫色石蕊溶液
B
3.查阅资料:茶树最适宜生长在pH为5.0~5.5的土壤中。
(4)农业上常用白云石粉改良土壤酸碱性。为研究白云石粉掩埋深度对土壤酸碱性的影响,该小组在同一块土地的三个不同区域开展实验。50天后,测得等量白云石粉掩埋深度与土壤pH的关系如
图所示。根据图中信息,你认为茶农将白云石粉掩
埋的最适宜深度是____(填字母)。
A.0~10 cm B.10~20 cm C.20~30 cm
B
4.硫酸是实验室常用的化学试剂。下列有关硫酸的说法,
错误的是( )
A稀硫酸和锌反应制取氢气
B.含硫酸的废液可用熟石灰中和处理
C.稀硫酸的密度比水的小
D.蘸取浓硫酸的木棍会变黑
常见酸的性质及用途(近5年5考)
命题点2
C
5.判断说法是否正确:氢氧化钠能使酚酞溶液变红,则氢氧化钙也能使酚酞溶液变红。 ( )
常见碱的性质及用途(近5年5考)
命题点3
√
6.中和反应在生产、生活中应用广泛。下列应用的主要原理不涉
及中和反应的是( )
A.生石灰用于加热即热食品
B.氢氧化铝用于治疗胃酸过多症
C.熟石灰用于改良酸性土壤
D.硼酸用于处理皮肤上沾有的碱
中和反应(近5年4考)
命题点4
A
7.(3)牛牛同学认为将适量熟石灰加入土壤,可中和其酸性。写出熟石灰与酸(以硫酸为例)反应的化学方程式:_____________________________________。
H2SO4+Ca(OH)2 ===== CaSO4+2H2O
中考一轮复习 教材同步复习
第十单元 常见的酸、碱、盐
课时1 溶液的酸碱性 常见的酸和碱
思维导图·构体系
知识精讲·夯基础
真题分点·明趋势
实验分阶·提能力
思维导图·构体系
1.溶液的酸碱性——酸碱指示剂(定性)
知识精讲·夯基础
溶液的酸碱性与酸碱度(近5年5考)
知识点1
酸碱指示剂 酸性溶液 中性溶液 碱性溶液
紫色石蕊溶液 红色 紫色 蓝色
无色酚酞溶液 无色 无色 红色
2.溶液酸碱度的表示——pH(定量)
(1)pH的范围:通常为0~14。
【特别提醒】pH试纸一般只能粗略测定溶液的酸碱度,且测得的数值为整数;若要较准确地测定溶液的pH,则可使用酸度计(pH计)。
(2)pH和溶液酸碱性的关系
pH____7时,溶液显____性,pH越____,表示溶液的酸性越强。
pH____7时,溶液显____性。
pH____7时,溶液显____性,pH越____,表示溶液的碱性越强。
<
酸
小
=
中
>
碱
大
(3)溶液酸碱度的应用
①测定人体内或排出液体的pH,可以帮助人们了解身体的健康状况。
②在化工生产中,许多反应都必须在一定pH范围的溶液里进行。
③在农业生产中,农作物一般适宜在pH=7或接近7的土壤中生长;pH<4的酸性土壤或pH>8的碱性土壤,一般需要经过改良才适于种植。
④正常雨水的pH≈5.6,酸雨的pH<5.6,随时监测雨水的pH,了解空气的污染情况。(2023.5B)
【备考补充】稀释酸性或碱性溶液时,溶液pH的变化曲线及分析
判断下列说法的正误。
1.碱溶液一定呈碱性,呈碱性的溶液一定是碱溶液。 ( )
2.指示剂在不同溶液中显示不同颜色的过程发生了化学变化。 ( )
3.滴加无色酚酞溶液,不变色的溶液一定是酸溶液。 ( )
4.能使紫色石蕊溶液变蓝的溶液一定是碱溶液。 ( )
5. Cu(OH)2能使酚酞溶液变红。 ( )
6.用pH试纸可精确测定某雨水的pH为5.6。 ( )
7.测定溶液pH时,若先用水将pH试纸润湿,则测定结果一定偏大。( )
易错易混
×
√
×
×
×
×
×
1.盐酸、硫酸的物理性质及用途
常见的酸(近5年5考)
知识点2
名称(化学式) 盐酸(_____________) 硫酸(__________)
颜色、状态 无色的液体 浓硫酸为无色、黏稠的油状液体
打开试剂瓶 瓶盖后的现象 瓶口出现白雾(浓盐酸易挥发) 无明显现象
溶质为HCl
H2SO4
气味 有刺激性气味 无气味
用途 ①用于金属表面除锈、制造药物等;②人体胃液中含有盐酸,可帮助消化 用于生产化肥、农药、火药、染料及冶炼金属、精炼石油和金属除锈等
2.浓硫酸的特性
(1)______性:在实验室中常用它作干燥剂。
(2)强烈的腐蚀性:它能夺取纸张、木材、布料、皮肤(都由含碳、氢、氧等元素的化合物组成)里的水分,生成黑色的炭。
【备考补充】脱水作用:浓硫酸能将物质中的氢、氧按水的组成比脱去,这种作用通常叫作脱水作用。
吸水
3.浓硫酸的稀释详见本册P8
4.其他常见的酸:硝酸(HNO3)、醋酸(CH3COOH)、碳酸(H2CO3)等。
5.酸的化学性质(酸五条)
化学性质 举例 化学方程式 现象
与酸碱指 示剂作用 - 能使紫色石蕊溶液变____,不能使无色酚酞溶液变色
红
化学性质 举例 化学方程式 现象
与某些金属反应(酸+某些金属→盐+氢气,置换反应) 稀盐酸与铁反应:___________ _________________________ 有______产生,溶液由无色变为______色
稀硫酸与锌反应:___________ ___________________ 有______产生
2HCl+
Fe ===== FeCl2+H2↑
气泡
浅绿
H2SO4+
Zn===== ZnSO4+H2↑
气泡
化学性质 举例 化学方程式 现象
与金属氧化物反应(酸+金属氧化物→盐+水,复分解反应) 稀盐酸与氧化铁反应: ____________________________________ 红棕色固体逐渐溶解,溶液由无色变为____色
稀硫酸与氧化铜反应: ____________________________________ 黑色固体逐渐溶解,溶液由无色变为____色
6HCl+Fe2O3 ===== 2FeCl3
+3H2O
黄
H2SO4+CuO ===== CuSO4
+H2O
蓝
化学性质 举例 化学方程式 现象
与碱反应(酸+碱→盐+水,复分解反应) 稀盐酸与氢氧化钠溶液反应: ______________________________ 无明显现象
与某些盐反应(酸+盐→新酸+新盐,复分解反应) 稀盐酸与碳酸钙反应: __________________________________________ 有______产生
HCl+NaOH ===== NaCl+H2O
2HCl+CaCO3 ===== CaCl2+H2O
+CO2↑
气泡
【归纳总结】
(1)酸具有相似化学性质的原因是酸溶液中都含有________________。
(2)不同的酸具有独特的个性,原因是不同的酸中________(即酸根离子)不同。如HCl+AgNO3 ===== AgCl↓+HNO3,H2SO4+BaCl2===== BaSO4↓+2HCl,二者均能观察到产生__________。
氢离子(或H+)
阴离子
白色沉淀
判断下列说法的正误。
1.酸中一定含有氢元素,但含有氢元素的物质不一定是酸。 ( )
2.酸的水溶液显酸性,所以酸性溶液一定是酸溶液。 ( )
3.浓硫酸可用于干燥所有气体。 ( )
4.长时间敞口放置在空气中的浓盐酸和浓硫酸,溶质质量分数均会变小。 ( )
易错易混
√
×
×
√
5.将铜丝插入稀硫酸中,能观察到产生气泡。 ( )
6.为除去铁钉表面的铁锈,可将铁钉长时间放置在盛有稀硫酸的烧杯中。 ( )
7.稀盐酸和氢氧化铝能发生中和反应。 ( )
8.酸与盐一定能发生复分解反应。 ( )
×
×
√
×
1.氢氧化钠、氢氧化钙的性质及用途
常见的碱(近5年5考)
知识点3
名称(化学式) 氢氧化钠(_________) 氢氧化钙[____________]
俗名 苛性钠(2022.9A)、火碱、______ ________、消石灰
颜色、状态 白色固体 白色粉末状固体
溶解性 ____溶于水,溶解时放出大量的热 ____溶于水(其水溶液俗称石灰水;当石灰水中存在较多未溶解的熟石灰时,就称为石灰乳或石灰浆)
NaOH
Ca(OH)2
烧碱
熟石灰
易
微
吸水性 易吸收水分而潮解 无
腐蚀性 有强烈的腐蚀性 有腐蚀性
用途 ①广泛应用于制肥皂,以及石油、造纸、纺织和印染等工业;②生活中可用来去除油污;③实验室中可用作某些气体的干燥剂 ①作建筑材料;②农业上用________ 与硫酸铜溶液等配制成具有杀菌作用的波尔多液;③改良____性土壤;④在实验室中常用澄清石灰水检验二氧化碳
石灰乳
酸
2.其他常见的碱:氢氧化钾(KOH)等。
3.碱的化学性质(碱四条)
化学性质 举例 化学方程式 现象
与酸碱指 示剂作用 - 能使紫色石蕊溶液变____,使无色酚酞溶液变____
蓝
红
化学性质 举例 化学方程式 现象
与某些非金属氧化物反应(碱+非金属氧化物→盐+水) 氢氧化钠溶液与二氧化碳反应: __________________________________ (吸收二氧化碳) 无明显现象
氢氧化钙溶液与二氧化碳反应: _____________________________________ (检验二氧化碳) 有__________产生
2NaOH+CO2 ===== Na2CO3+H2O
Ca(OH)2+CO2 ===== CaCO3↓+H2O
白色沉淀
化学性质 举例 化学方程式 现象
与酸反应(碱+酸→盐+水,复分解反应) 氢氧化钠溶液和稀硫酸反应: _____________________________________ 无明显现象
氢氧化钙溶液和稀盐酸反应: _____________________________________ 无明显现象
2NaOH+H2SO4 ===== Na2SO4+2H2O
Ca(OH)2+2HCl ===== CaCl2+2H2O
化学性质 举例 化学方程式 现象
与某些盐反应(可溶性碱+可溶性盐→新碱+新盐,复分解反应) 氢氧化钠溶液与硫酸铜溶液反应: ______________________________________________ 有__________生成
氢氧化钙溶液与碳酸钠溶液反应: ______________________________________________ 有__________
生成
2NaOH+CuSO4 ===== Cu(OH)2↓+
Na2SO4
蓝色沉淀
Ca(OH)2+Na2CO3 ===== CaCO3↓+
2NaOH
白色沉淀
【归纳总结】
(1)碱具有相似化学性质的原因是碱溶液中都含有____________________。
(2)不同的碱具有独特的个性,原因是不同的碱中阳离子不同。
氢氧根离子(或OH-)
【归纳总结】常见试剂露置于空气中一段时间的总质量变化及原因分析
试剂名称 试剂总质量变化 原因分析
浓盐酸 ______ 具有挥发性
浓硫酸 ______ 具有吸水性
浓氨水 减小 具有挥发性
__________固体 ______ 易吸收空气中的水分而潮解,且能与空气中的二氧化碳反应
氢氧化钙固体 能与空气中的二氧化碳反应
生石灰 增大 易与空气中的水蒸气反应
减小
增大
氢氧化钠
增大
判断下列说法的正误。
1.氢氧化钠显碱性,可用于改良酸性土壤。 ( )
2.碱能与某些非金属氧化物反应,所以碱能吸收一氧化碳气体。 ( )
3.烧碱变质的过程中,其溶液的pH逐渐增大。 ( )
4.除去烧碱溶液中混有的少量纯碱,可以滴加适量氢氧化钙溶液,过滤。 ( )
易错易混
×
×
×
√
1.概念:酸与碱作用生成盐和水的反应。
2.表达式:酸+碱→盐+水。
3.微观实质:酸中的________________和碱中的_____________________
结合生成_________________。
中和反应(近5年4考)
知识点4
H+(或氢离子)
OH-(或氢氧根离子)
H2O(或水分子)
4.应用
(1)服用含有碱性物质的药物中和过多的胃酸。
(2)涂抹含碱性物质的溶液,减轻蜂或蚂蚁叮咬后出现的肿、痛或瘙痒等症状。
(3)处理工厂废水,如用熟石灰中和含有硫酸的废水,用硫酸中和碱性废水。
(4)调节土壤的酸碱性,如用熟石灰中和酸性土壤。
判断下列说法的正误。
1.用含碳酸氢钠的药物治疗胃酸过多症是利用了中和反应的原理。
( )
2.中和反应一定有盐和水生成,则有盐和水生成的反应一定是中和反应。 ( )
易错易混
×
×
化学兴趣小组同学利用稀氢氧化钠溶液和稀盐酸进行如图所示中和反应的实验。
实验分阶·提能力
中和反应的探究(近5年1考)
实验10
例
一阶 基础知识
【实验操作及现象】
(1)向烧杯中加入5 mL稀氢氧化钠溶液,滴入几滴酚酞溶液,溶液变为____色。然后用滴管慢慢滴入稀盐酸,并不断搅拌溶液,直至溶液颜色恰好变成无色为止。
红
【实验分析】
(2)滴加稀盐酸的过程中溶液颜色变成无色,说明氢氧化钠与滴入的稀盐酸发生了中和反应。
【实验结论】
(3)氢氧化钠溶液能与稀盐酸发生反应,反应的化学方程式为____________
_____________________。
NaOH+HCl
==== NaCl+H2O
二阶 质疑反思
(4)该实验中一般不选紫色石蕊溶液作指示剂,原因是紫色石蕊溶液在碱性溶液中显___色,在中性溶液中显___色,两种颜色之间没有明显界线。
(5)若将稀盐酸滴入氢氧化钠溶液中观察到有少量气泡产生,原因可能是________________。
(6)实验前忘记加入酚酞溶液,实验过程中再加酚酞溶液,发现溶液未变色,______(填“能”或“不能”)证明恰好完全反应,理由是___________
_________________________________。
蓝
紫
氢氧化钠已变质
不能
酚酞在酸性
溶液中也不变色,可能稀盐酸已过量
三阶 改进创新
(7)【微型装置】利用如图Ⅰ实验装置探究氢氧化钠溶液和稀盐酸能否发生反应的优点是________________________________(写1点)。
Ⅰ
节约试剂(或操作简单,合理即可)
四阶 拓展延伸
(8)【课标新增·作图】氢氧化钠溶液与稀盐酸反应的微观过程模拟示意图如图Ⅱ,请将框内补画完整并回答问题。
该0反应的实质是_________________________________________________
_____________________________________。
氢氧化钠溶液中的氢氧根离子(或OH-)与稀盐酸中的氢
离子(或H+)结合生成水分子(或H2O)
(9)【课标新增·数字化实验-pH】实验过程中用pH传感器测得pH变化如图Ⅲ。
①A点pH____(填“>”“<”或“=”,下同)7,此时的溶
液呈____(填“酸”“碱”或“中”,下同)性,溶液
中的溶质是_________(填化学式,不考虑酚酞,下同)。
②B点pH____7,此时的溶液呈____性,溶液中的溶质是________。
③C点pH____7,此时的溶液呈___性,溶液中的溶质是_____________。
>
碱
NaOH
=
中
NaCl
<
酸
NaCl、HCl
(10)【课标新增·数字化实验-温度】分别取等体积的氢氧化钠溶液、稀盐酸、水,按如表进行实验,测定溶液温度随时间变化的曲线如图Ⅳ。
烧杯 烧杯中原有的物质 逐滴滴入的物质
甲 40%氢氧化钠溶液 4%稀盐酸
乙 40%氢氧化钠溶液 水
丙 4%稀盐酸 水
①图Ⅳ中,曲线上P点表示的含义是______________________________。
②对比甲、乙、丙三条曲线,可以得到酸碱中和反应是______(填“放热”或“吸热”)反应。
③证明中和反应有热量放出的证据是________________________________
__________________________。
氢氧化钠和稀盐酸恰好完全反应
放热
丙中温度无明显变化,甲、乙中温度
升高,且甲中比乙中放热多
(11)【课标新增·设计实验方案】某小组在做氢氧化钠溶液和稀盐酸发生中和反应的实验时,忘记滴加酚酞溶液,再次滴加酚酞溶液后,溶液为无色。同学们对该反应后溶液中溶质的成分进行了如下探究。
猜想一:NaCl、NaOH;猜想二:NaCl;猜想三:_______________。
NaCl、HCl
同学们经过讨论后认为猜想一不正确,其理由是______________________
_________________________________________。为了验证其他猜想,小组同学设计了如下实验方案。
实验操作 实验现象 实验结论
方案1:取少量反应后的溶液于试管中,滴加紫色石蕊溶液 溶液显____色 猜想三
正确
方案2: ___________________________ _____________________ ________________________ 滴入酚酞溶液后,溶液为
无色,说明溶液不呈碱性,不含NaOH
红
取少量反应后的溶液于试管中,
加入镁条(合理即可)
产生气泡(与前一空
对应)
1.判断如下劳动项目所涉及的化学知识是否正确:( )
真题分点·明趋势
溶液酸碱性及pH(近5年5考)
命题点1
×
劳动项目 化学知识
用食醋去除热水瓶内壁的水垢 食醋的pH>7
2.某实验小组用如图所示装置进行微型实验。按下列表中选项加入试剂,实验时滴入甲,浸有丙的棉花不变红的是( )
选项 甲 乙 丙
A 浓氨水 - 无色酚酞溶液
B 石灰水 碳酸钠 无色酚酞溶液
C 稀盐酸 石灰石 紫色石蕊溶液
D 浓盐酸 锌粒 紫色石蕊溶液
B
3.查阅资料:茶树最适宜生长在pH为5.0~5.5的土壤中。
(4)农业上常用白云石粉改良土壤酸碱性。为研究白云石粉掩埋深度对土壤酸碱性的影响,该小组在同一块土地的三个不同区域开展实验。50天后,测得等量白云石粉掩埋深度与土壤pH的关系如
图所示。根据图中信息,你认为茶农将白云石粉掩
埋的最适宜深度是____(填字母)。
A.0~10 cm B.10~20 cm C.20~30 cm
B
4.硫酸是实验室常用的化学试剂。下列有关硫酸的说法,
错误的是( )
A稀硫酸和锌反应制取氢气
B.含硫酸的废液可用熟石灰中和处理
C.稀硫酸的密度比水的小
D.蘸取浓硫酸的木棍会变黑
常见酸的性质及用途(近5年5考)
命题点2
C
5.判断说法是否正确:氢氧化钠能使酚酞溶液变红,则氢氧化钙也能使酚酞溶液变红。 ( )
常见碱的性质及用途(近5年5考)
命题点3
√
6.中和反应在生产、生活中应用广泛。下列应用的主要原理不涉
及中和反应的是( )
A.生石灰用于加热即热食品
B.氢氧化铝用于治疗胃酸过多症
C.熟石灰用于改良酸性土壤
D.硼酸用于处理皮肤上沾有的碱
中和反应(近5年4考)
命题点4
A
7.(3)牛牛同学认为将适量熟石灰加入土壤,可中和其酸性。写出熟石灰与酸(以硫酸为例)反应的化学方程式:_____________________________________。
H2SO4+Ca(OH)2 ===== CaSO4+2H2O
同课章节目录
