人教版高中化学必修二 4.1开发利用金属矿物和海水资源 课件 (共27张PPT)
文档属性
| 名称 | 人教版高中化学必修二 4.1开发利用金属矿物和海水资源 课件 (共27张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 902.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-07 23:56:41 | ||
图片预览








文档简介
课件27张PPT。第四章 化学与自然资源的开发利用 第一节 开发利用金属矿物和海水资源 假如你是一个原始人,打到一只兔子 你会考虑怎样吃? 点火烧烤 火焰烤过的有些石头上有发亮的物质—— 铜历史上金属被发现和冶炼利用的顺序Au、Ag、Cu、Fe、Al、Ti原因:越活泼的金属越难冶炼,
熔点越高的金属越难冶炼。随着社会生产力和科学的发展,
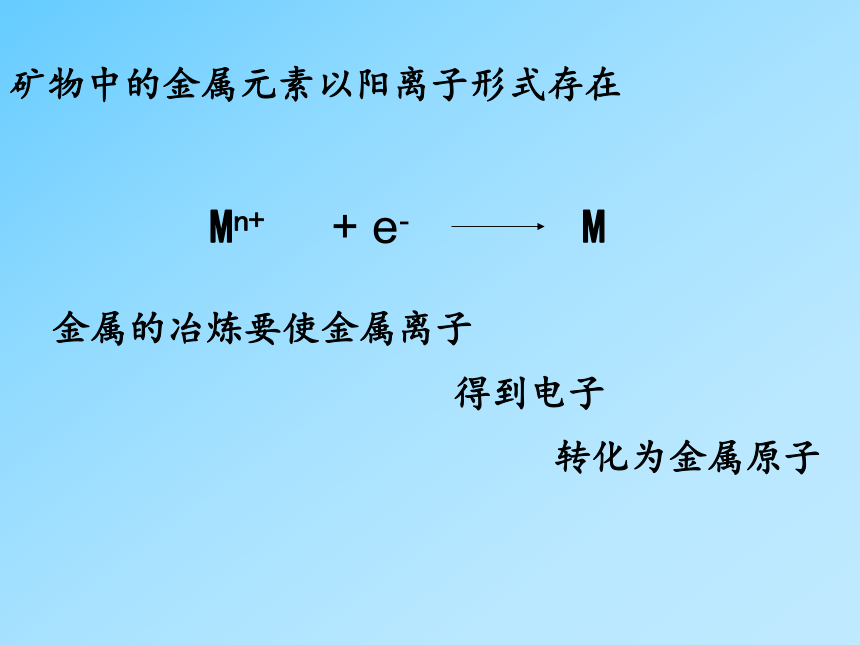
难冶炼的金属才被冶炼出来古代现代Fe2O3Cu3[CO3]2(OH)2 CaF2矿物中的金属元素以什么形态存在?矿物中的金属元素以阳离子形式存在Mn+M+ e-金属的冶炼要使金属离子得到电子转化为金属原子不活泼的金属 第一节 开发利用金属矿物和海水资源一、金属矿物的开发利用你应该还记得金属活动顺序表吧K、Ca、Na、Mg、Al、 Zn、Fe、Sn、Pb、(H)、Cu、 Hg、Ag、Pt、Au 非常活泼的金属 一般的金属 哪些金属容易冶炼?哪些难? 不活泼的金属采用加热分解法,又叫做:热分解法Hg、Ag、Pt、Au你认为热分解反应方程式有什么特点?得到对应的单质Au+2Cl2↑非常活泼的金属的冶炼 使它们由化合物转化为单质难易:K、Ca、Na、Mg、Al、 很困难 通常冶炼方法: 热电解法 高温下熔融金属化合物然后进行电解 --最强力的还原手段 2NaCl(熔融)2NaCl2↑+2Al2O3(熔融)4Al+3O2↑电解NaCl溶液 与电解熔融NaCl 不同 常温高温NaOH、H2、Cl2Na、Cl2产物:原因:水溶液中H+比Na+先电解出来一般的金属 Zn、Fe、Sn、Pb、(H)、Cu、 由化合物转化为单质难易:比较容易通常冶炼方法:热还原法加热或者高温下与还原剂反应常用还原剂: C、CO、H2、活泼金属,如Na、Al成本:低高炼铁高炉铝热反应 P89实验4-1 反应物: 铝粉、 氧化铁 吸热反应还是放热反应: 放热反应 高温下铝(粉)作还原剂 反应现象:镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。1、镁条的作用是什么?
2、氯酸钾的作用是什么?铝热 剂结论:铝也是还原剂,在一定的条件下与某些金属氧化物反应,把其中的金属还原成单质。所以一些活泼的金属也可作还原剂。问题其它铝热反应 应用:
(1)焊接钢轨,
(2)冶炼金属。小结:冶金的一般方法:可见,越活泼的金属越难冶炼K、Ca、Na、Mg、AlZn、Fe、Sn、Pb(H)、CuHg、Ag强————————————→弱弱————————————→强电解法热还原法热分
解法Pt、 Au物理提取法自然资源与可持续发展 自然资源定义: 一定时间、地点的条件下能够产生经济价值的以提高人类当前和将来福利的自然环境因素和条件的总称。 可持续发展: 尽可能地延长现有资源的可使用年限,
保护好自然环境,
使子孙后代也能够继续发展和安居乐业。 是指满足当前需要而又不剥削子孙后代
满足其需要之能力的发展 金属矿物资源有限合理利用矿物资源有效使用金属产品、材料途径:提高金属矿物的利用率减少金属的使用量加强金属资源的回收和再利用使用其他材料代替金属材料总结:1、金属矿物中提取金属的过程叫做冶炼2、不同活动性的金属冶炼方式不同非常活泼一般活泼不活泼电解法热还原法热分解法3、合理利用矿物资源,坚持可持续发展战略练习:1、无色气体A与红热的炭反应,得到另一种无色气体B,B与灼热的氧化铜反应,又得到A,则A、B分别是______,______。2、铝热剂中铝作________。COCO23、根据下表回答,工业生产电解镁应该选择
_______作原料,
原因是_______________________________。还原剂MgCl2MgCl2的熔点低,电解工艺设备相对简单,成本低4、下列各种冶炼方法中,可以制得相应金属的是( )
A、加热氧化铝 B、加热碳酸钙
C、电解熔融氯化钠
D、氯化钠与铝粉高温共热
5、根据金属在金属活动顺序表中的位置
及性质,推测制取下列金属最适宜的方法:
①Na ②Zn
③Hg ④Au
C电解法热还原法热分解法物理提取法8、100多年前,为了表彰门捷列夫对化学的杰出贡献,英国皇家学会不惜重金制作了一个比黄金还要贵重的奖杯——铝杯,赠送给门捷列夫。
思考:为什么人类使用铁器比使用铜器晚?使用铝 制品又比使用铁制品晚?答:金属越活泼,冶炼难度越大,发现得通常越晚。7、铝能用来冶炼难熔金属(如Fe 、V、Mn等),这是因为铝有( )
A.两性 B.良好导电性
C.熔点低 D还原性,在反应中放出大量热D
熔点越高的金属越难冶炼。随着社会生产力和科学的发展,
难冶炼的金属才被冶炼出来古代现代Fe2O3Cu3[CO3]2(OH)2 CaF2矿物中的金属元素以什么形态存在?矿物中的金属元素以阳离子形式存在Mn+M+ e-金属的冶炼要使金属离子得到电子转化为金属原子不活泼的金属 第一节 开发利用金属矿物和海水资源一、金属矿物的开发利用你应该还记得金属活动顺序表吧K、Ca、Na、Mg、Al、 Zn、Fe、Sn、Pb、(H)、Cu、 Hg、Ag、Pt、Au 非常活泼的金属 一般的金属 哪些金属容易冶炼?哪些难? 不活泼的金属采用加热分解法,又叫做:热分解法Hg、Ag、Pt、Au你认为热分解反应方程式有什么特点?得到对应的单质Au+2Cl2↑非常活泼的金属的冶炼 使它们由化合物转化为单质难易:K、Ca、Na、Mg、Al、 很困难 通常冶炼方法: 热电解法 高温下熔融金属化合物然后进行电解 --最强力的还原手段 2NaCl(熔融)2NaCl2↑+2Al2O3(熔融)4Al+3O2↑电解NaCl溶液 与电解熔融NaCl 不同 常温高温NaOH、H2、Cl2Na、Cl2产物:原因:水溶液中H+比Na+先电解出来一般的金属 Zn、Fe、Sn、Pb、(H)、Cu、 由化合物转化为单质难易:比较容易通常冶炼方法:热还原法加热或者高温下与还原剂反应常用还原剂: C、CO、H2、活泼金属,如Na、Al成本:低高炼铁高炉铝热反应 P89实验4-1 反应物: 铝粉、 氧化铁 吸热反应还是放热反应: 放热反应 高温下铝(粉)作还原剂 反应现象:镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。1、镁条的作用是什么?
2、氯酸钾的作用是什么?铝热 剂结论:铝也是还原剂,在一定的条件下与某些金属氧化物反应,把其中的金属还原成单质。所以一些活泼的金属也可作还原剂。问题其它铝热反应 应用:
(1)焊接钢轨,
(2)冶炼金属。小结:冶金的一般方法:可见,越活泼的金属越难冶炼K、Ca、Na、Mg、AlZn、Fe、Sn、Pb(H)、CuHg、Ag强————————————→弱弱————————————→强电解法热还原法热分
解法Pt、 Au物理提取法自然资源与可持续发展 自然资源定义: 一定时间、地点的条件下能够产生经济价值的以提高人类当前和将来福利的自然环境因素和条件的总称。 可持续发展: 尽可能地延长现有资源的可使用年限,
保护好自然环境,
使子孙后代也能够继续发展和安居乐业。 是指满足当前需要而又不剥削子孙后代
满足其需要之能力的发展 金属矿物资源有限合理利用矿物资源有效使用金属产品、材料途径:提高金属矿物的利用率减少金属的使用量加强金属资源的回收和再利用使用其他材料代替金属材料总结:1、金属矿物中提取金属的过程叫做冶炼2、不同活动性的金属冶炼方式不同非常活泼一般活泼不活泼电解法热还原法热分解法3、合理利用矿物资源,坚持可持续发展战略练习:1、无色气体A与红热的炭反应,得到另一种无色气体B,B与灼热的氧化铜反应,又得到A,则A、B分别是______,______。2、铝热剂中铝作________。COCO23、根据下表回答,工业生产电解镁应该选择
_______作原料,
原因是_______________________________。还原剂MgCl2MgCl2的熔点低,电解工艺设备相对简单,成本低4、下列各种冶炼方法中,可以制得相应金属的是( )
A、加热氧化铝 B、加热碳酸钙
C、电解熔融氯化钠
D、氯化钠与铝粉高温共热
5、根据金属在金属活动顺序表中的位置
及性质,推测制取下列金属最适宜的方法:
①Na ②Zn
③Hg ④Au
C电解法热还原法热分解法物理提取法8、100多年前,为了表彰门捷列夫对化学的杰出贡献,英国皇家学会不惜重金制作了一个比黄金还要贵重的奖杯——铝杯,赠送给门捷列夫。
思考:为什么人类使用铁器比使用铜器晚?使用铝 制品又比使用铁制品晚?答:金属越活泼,冶炼难度越大,发现得通常越晚。7、铝能用来冶炼难熔金属(如Fe 、V、Mn等),这是因为铝有( )
A.两性 B.良好导电性
C.熔点低 D还原性,在反应中放出大量热D
