河南省信阳市固始县永和高级中学固始县信合外国语高级中学2025届高三下学期二模联考 化学试题(含答案)
文档属性
| 名称 | 河南省信阳市固始县永和高级中学固始县信合外国语高级中学2025届高三下学期二模联考 化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-12 21:25:39 | ||
图片预览



文档简介
2025届固始县永和高中、外国语高中二模联考
高三化学试题卷
注意事项:
考试时间75分钟,满分100分。考生应首先阅读答题卡上的文字信息,然后在答题卡上作答,在试题卷上作答无效。交卷时只交答题卡。
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Si-28
一、选择题(共14小题,每小题3分,共42分。每小题只有一个选项符合题意。)
1.2023 年 10月31日8时11分, “神舟十六号”载人飞船返回舱在东风着陆场成功着陆,标志着此次载人飞行任务取得圆满成功。“神舟十六号”返回舱所用下列构件主要由有机合成材料制造的是
A.陶瓷雷达密封环 B.聚酰胺国旗
C.单晶硅太阳能电池板 D.新型铝基碳化硅舱体内壳层
2.下列图示或化学用语正确的是
A.中O的杂化轨道表示式:
B.用电子式表示的形成过程:
C.基态砷原子的核外电子排布式:
D.的电子式:
3.用NA表示阿伏加德罗常数的值。下列说法正确的是
A.1 mol H2O2中含有极性共价键的数目为3NA
B.25℃1 L pH=1的H3PO4溶液中H+数目为0.1NA
C.20 g H218O含有的中子数为12NA
D.足量铁粉与1 L14 mol/L浓硝酸加热充分反应转移电子数目为7NA
4.苯甲酸是一种食品防腐剂,微溶于冷水,易溶于热水。某同学设计实验提纯某粗苯甲酸样品(其中含有少量泥沙等难溶于水的杂质),下列操作未涉及的是
A.甲:加热溶解 B.乙:冷却结晶
C.丙:萃取后分液 D.丁:趁热过滤
5.下列说法正确的是
A.Fe分别与、蒸气反应均生成亚铁盐
B.向溶液中分别通入、,均无沉淀生成
C.常温下,Al分别与稀盐酸、稀硝酸反应均能制取氢气
D.加热条件下,Cu分别与浓硫酸、稀硫酸反应均可制备硫酸铜
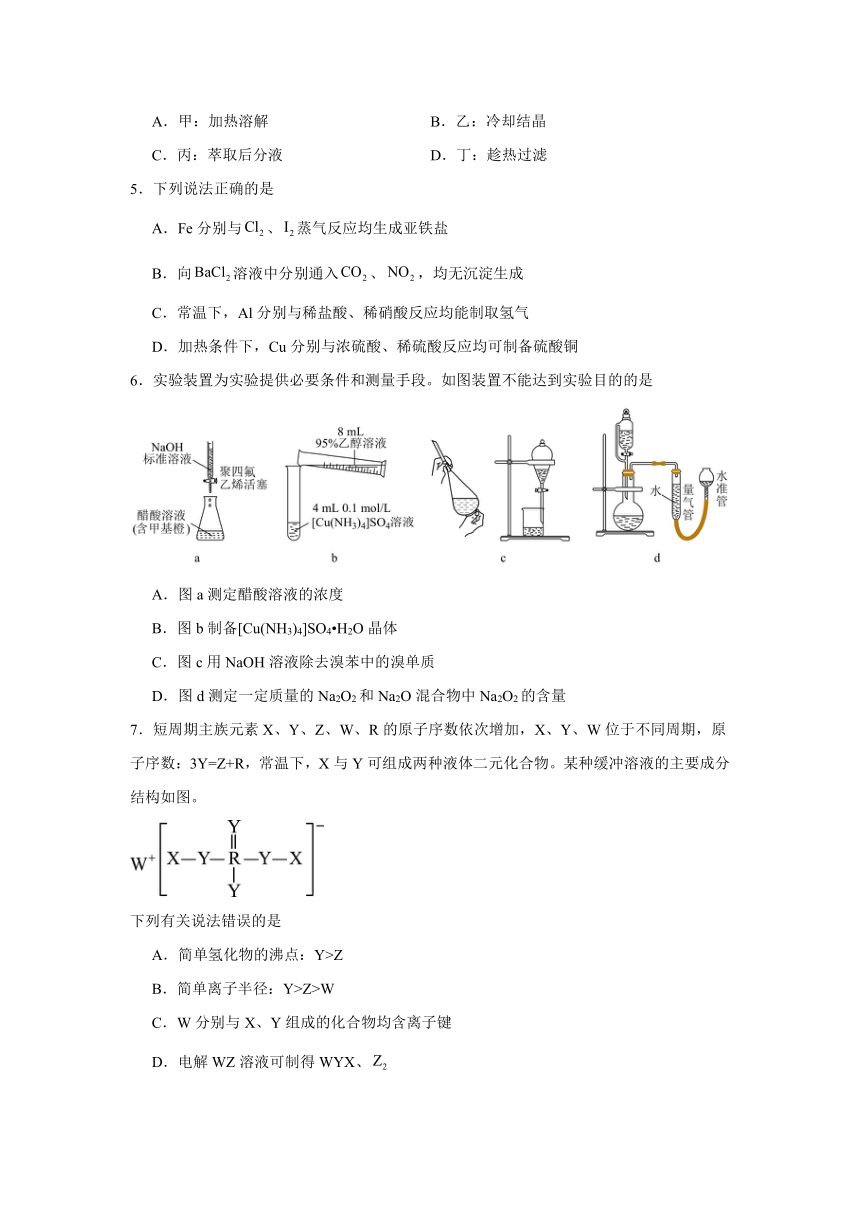
6.实验装置为实验提供必要条件和测量手段。如图装置不能达到实验目的的是
A.图a测定醋酸溶液的浓度
B.图b制备[Cu(NH3)4]SO4 H2O晶体
C.图c用NaOH溶液除去溴苯中的溴单质
D.图d测定一定质量的Na2O2和Na2O混合物中Na2O2的含量
7.短周期主族元素X、Y、Z、W、R的原子序数依次增加,X、Y、W位于不同周期,原子序数:3Y=Z+R,常温下,X与Y可组成两种液体二元化合物。某种缓冲溶液的主要成分结构如图。
下列有关说法错误的是
A.简单氢化物的沸点:Y>Z
B.简单离子半径:Y>Z>W
C.W分别与X、Y组成的化合物均含离子键
D.电解WZ溶液可制得WYX、
8.离子液体中X、Y、Z、W为原子序数依次增大的短周期元素,基态Y原子的s能级电子数是p能级的2倍,基态W原子的电子总数是其最高能级电子数的2倍,是10电子微粒。下列说法正确的是
A.简单氢化物的键角:Y<Z B.第一电离能:Y<W<Z
C.与的空间结构相同 D.难溶于水
9.下列离子方程式错误的是
A.去除废水中的
B.补铁剂中滴加溶液:
C.向次氯酸钙溶液通入足量二氧化碳:
D.加入热水中:
10.对下列事实的解释错误的是
选项 事实 解释
A 的沸点较低 存在分子内氢键
B 可发生反应: 中N的一个杂化轨道上有未成对电子,易两分子结合形成键
C 与加成的主要产物是 中的电负性较大,使双键电子云向中心碳原子偏移;中带正电性的易连在带负电性中心碳原子上
D 利用“杯酚”可分离和 超分子具有自组装的特征
A.A B.B C.C D.D
11.一种新型的葡萄糖辅助Cu(Ⅰ)/Cu(Ⅱ)氧化还原耦合制氢系统工作原理如图所示。下列说法错误的是
A.M极为电源负极 B.P极的电极反应式为
C.电解过程中Q极发生氧化反应 D.理论上消耗18g葡萄糖,可制得0.2mol
12.含的溶液中发生反应的反应机理如图所示。下列说法正确的是
A.由图可知不能氧化
B.反应过程中包含三个基元反应
C.若不加,该反应的化学反应速率更大
D.和不能大量共存
13.钒作为一种重要的战略性资源,在高科技尖端科学与军工领域有着广泛的用途。钒主要制成钒铁,用作钢铁合金,它具有能细化钢铁基体晶粒的作用,可从其氧化物中提取。如图是某种钒的氧化物晶体的立方晶胞。已知:该晶体的密度为,为阿伏加德罗常数的值。下列说法错误的是
A.V位于元素周期表的第VB族
B.该氧化物的化学式为
C.若点原子的分数坐标为,则点原子的分数坐标为
D.晶胞中距离最近的两个钒原子的核间距为
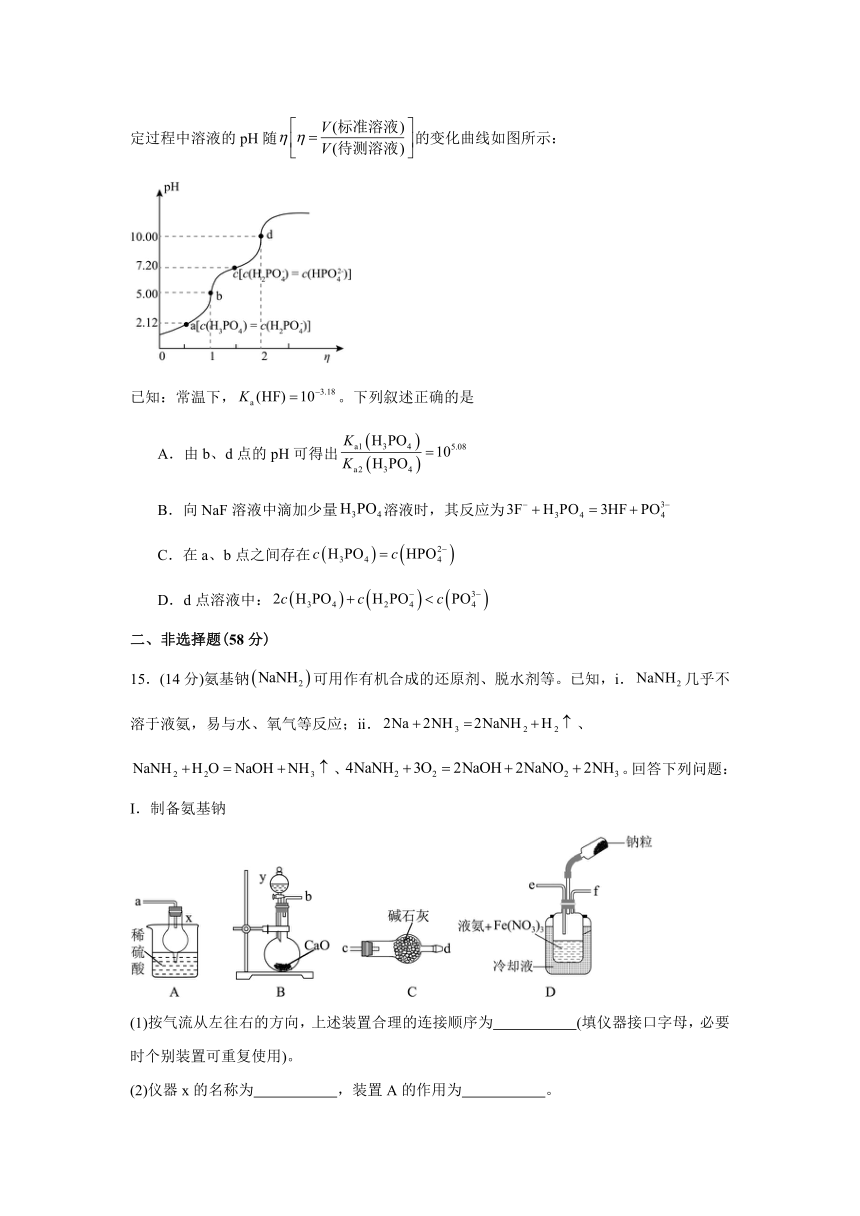
14.常温下,用标准溶液滴定待测溶液,滴定过程中溶液的pH随的变化曲线如图所示:
已知:常温下,。下列叙述正确的是
A.由b、d点的pH可得出
B.向NaF溶液中滴加少量溶液时,其反应为
C.在a、b点之间存在
D.d点溶液中:
二、非选择题(58分)
15.(14分)氨基钠可用作有机合成的还原剂、脱水剂等。已知,i.几乎不溶于液氨,易与水、氧气等反应;ii.、、。回答下列问题:
I.制备氨基钠
(1)按气流从左往右的方向,上述装置合理的连接顺序为 (填仪器接口字母,必要时个别装置可重复使用)。
(2)仪器x的名称为 ,装置A的作用为 。
(3)装置B中制备的化学方程式为 。
(4)的作用是 ,若装置D中生成1.12L(标准状况下),则消耗 gNa。
(5)反应前装置D中需通入氨气排尽体系中空气,设计方案判断密闭体系中空气是否排尽: 。
II.氨基钠产品质量分数测定
称量2.0g氨基钠产品,溶于水配成500mL溶液;量取25mL溶液,加热除去,冷却至室温后,滴入2滴酚酞试液,用的HCl标准溶液进行滴定,记下达到滴定终点所消耗HCl标准溶液的体积,重复上述实验4次,滴定结果如下表。
实验数据 滴定次数
1 2 3 4
V(产品)/mL 25.00 25.00 25.00 25.00
V[HCl(标准溶液)]/mL 25.75 25.00 25.05 24.95
(6)氨基钠的质量分数为 %(保留三位有效数字)。
16.(14分)铬广泛应用于冶金、化工、铸铁、耐火及高精端科技等领域。工业上以碳素铬铁(铁铬合金)为原料,利用电解法制取金属铬的工艺流程如图所示:
已知:铁铵矾晶体的化学式为。
回答下列问题:
(1)“溶解”前,粉碎碳素铬铁的目的是 。
(2)“溶解”步骤中,需加热到105℃,写出铬与浓硫酸反应的化学方程式: ;碳素铬铁过量时会产生,阳极液()进入到“溶解”步骤中,与发生反应的离子方程式为 。
(3)若铬铵矾晶体为二十四水结晶水合物,属于复盐,其中铬的化合价为+3价,则铬铵矾晶体的化学式为 。
(4)若以惰性电极进行“电解”,Cr3+在阳极放电的电极反应式为 ,当外电路有0.6mol电子转移,则在阴极上生成铬的质量为 g。
(5)Cr单质的晶胞结构如图所示。已知晶体密度为,为阿伏加德罗常数的值,则Cr原子的半径为 nm(用含有、的代数式表示)。
17.(15分)我国科学家成功利用光伏发电,将电解水获得的与反应合成甲醇,再由甲醇经若干酶促反应合成淀粉。该研究成果已在国际学术期刊《科学》上发表。回答下列问题:
(1)人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示。
反应的 (用含、、、的代数式表示)。
(2)有学者结合实验和计算机模拟结果,得出的一种反应历程如图所示,其中吸附在催化剂表面的物种用“·”标注,TS1、TS2、TS3、TS4均为过渡态。决速步骤对应的化学方程式为 ;TS3对应的步骤适合在 (填“高温”或“低温”)条件下进行。
(3)在密闭容器中充入一定量的和,发生反应 ,在催化剂作用下单位时间内的转化率与温度、催化剂的关系如图所示。
①a点时,的生成速率 (填“>”“<”或“=”,下同)的消耗速率;催化效率:Cat2 Cat1。
②b点之后的转化率降低,可能的原因是 。
(4)已知催化加氢的主要反应如下:
反应Ⅰ.
反应Ⅱ.
①230℃时,将和按物质的量之比为1:3混合通入恒温刚性密闭容器中,在催化剂作用下同时发生反应Ⅰ和反应Ⅱ,容器内压强随时间的变化如下表所示。
时间/min 0 20 40 60 80
压强/MPa
平衡时,则该温度下反应Ⅰ的化学平衡常数 (用含的代数式表示)。
②二氧化碳催化加氢合成甲醇反应往往伴随副反应Ⅱ。一定温度和压强条件下,为了提高反应速率和甲醇选择性,应当 。
18.(15分)磺胺嘧啶为预防、治疗脑膜炎球菌性脑膜球菌性脑膜炎(流行性脑膜炎)的首选用药,合成路线如下:
回答下列问题:
(1)C的名称为 ;H中所含官能团有碳碳双键、 。
(2)F的结构简式为 ,由B生成C的反应类型为 。
(3)G→H可以看作为两步反应完成,其中第二步为氧化反应,试写出第一步反应的化学方程式: 。
(4)化合物K是H的同系物,最大质荷比为99,满足下列条件的K的同分异构体有 种(不考虑立体异构)。
a.红外光谱显示有结构
b.氨基与碳碳双键相连
其中核磁共振氢谱有3组峰,且峰面积之比为6∶2∶1的结构简式为 (写一种)。
(5)已知:。对氨基苯甲酰-丙氨酸是重要的医药中间体,结构简式为:,试以甲苯和-丙氨酸()为原料,设计对氨基苯甲酰-丙氨酸的合成路线(无机试剂任选): 。
2025届固始县永和高中、外国语高中二模联考
高三化学参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 B A B C B A D B A D
题号 11 12 13 14
答案 D D D A
15.(1)bcdefcda (1分)
(2) 球形干燥管(2分) 吸收,防止污染空气(2分)
(3)(2分)
(4) 催化剂 (1分) 2.3(2分)
(5)向装置A的烧杯中加水至漏斗颈浸没,通入,如烧杯中出现气泡,则空气尚未排尽,如未出现气泡,则说明空气已排尽(2分)
(6)97.5(2分)
16.(1)增大接触面积,加快反应速率,使反应更充分(2分)
(2) (2分) (2分)
(3)[或](2分)
(4) (2分) 10.4(2分)
(5)(2分)
17.(1)(2分)
(2) (或) (2分) 低温(1分)
(3) > (2分) > (2分) 温度升高,平衡向逆反应方向移动(或催化剂活性降低;或温度升高反应左移与催化剂活性降低共同作用)(2分)
(4) (2分) 选择适宜的催化剂(2分)
18.(1) 苯胺(2分) 醛基(2分)
(2) (NH2) 2C=NH (2分) 还原反应(2分)
(3)HC≡CCH2OH+HN(C2H5)2(C2H5)2NCH=CHCH2OH(2分)
(4) 26 (1分) (2分)
(5)+(2分)
高三化学试题卷
注意事项:
考试时间75分钟,满分100分。考生应首先阅读答题卡上的文字信息,然后在答题卡上作答,在试题卷上作答无效。交卷时只交答题卡。
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Si-28
一、选择题(共14小题,每小题3分,共42分。每小题只有一个选项符合题意。)
1.2023 年 10月31日8时11分, “神舟十六号”载人飞船返回舱在东风着陆场成功着陆,标志着此次载人飞行任务取得圆满成功。“神舟十六号”返回舱所用下列构件主要由有机合成材料制造的是
A.陶瓷雷达密封环 B.聚酰胺国旗
C.单晶硅太阳能电池板 D.新型铝基碳化硅舱体内壳层
2.下列图示或化学用语正确的是
A.中O的杂化轨道表示式:
B.用电子式表示的形成过程:
C.基态砷原子的核外电子排布式:
D.的电子式:
3.用NA表示阿伏加德罗常数的值。下列说法正确的是
A.1 mol H2O2中含有极性共价键的数目为3NA
B.25℃1 L pH=1的H3PO4溶液中H+数目为0.1NA
C.20 g H218O含有的中子数为12NA
D.足量铁粉与1 L14 mol/L浓硝酸加热充分反应转移电子数目为7NA
4.苯甲酸是一种食品防腐剂,微溶于冷水,易溶于热水。某同学设计实验提纯某粗苯甲酸样品(其中含有少量泥沙等难溶于水的杂质),下列操作未涉及的是
A.甲:加热溶解 B.乙:冷却结晶
C.丙:萃取后分液 D.丁:趁热过滤
5.下列说法正确的是
A.Fe分别与、蒸气反应均生成亚铁盐
B.向溶液中分别通入、,均无沉淀生成
C.常温下,Al分别与稀盐酸、稀硝酸反应均能制取氢气
D.加热条件下,Cu分别与浓硫酸、稀硫酸反应均可制备硫酸铜
6.实验装置为实验提供必要条件和测量手段。如图装置不能达到实验目的的是
A.图a测定醋酸溶液的浓度
B.图b制备[Cu(NH3)4]SO4 H2O晶体
C.图c用NaOH溶液除去溴苯中的溴单质
D.图d测定一定质量的Na2O2和Na2O混合物中Na2O2的含量
7.短周期主族元素X、Y、Z、W、R的原子序数依次增加,X、Y、W位于不同周期,原子序数:3Y=Z+R,常温下,X与Y可组成两种液体二元化合物。某种缓冲溶液的主要成分结构如图。
下列有关说法错误的是
A.简单氢化物的沸点:Y>Z
B.简单离子半径:Y>Z>W
C.W分别与X、Y组成的化合物均含离子键
D.电解WZ溶液可制得WYX、
8.离子液体中X、Y、Z、W为原子序数依次增大的短周期元素,基态Y原子的s能级电子数是p能级的2倍,基态W原子的电子总数是其最高能级电子数的2倍,是10电子微粒。下列说法正确的是
A.简单氢化物的键角:Y<Z B.第一电离能:Y<W<Z
C.与的空间结构相同 D.难溶于水
9.下列离子方程式错误的是
A.去除废水中的
B.补铁剂中滴加溶液:
C.向次氯酸钙溶液通入足量二氧化碳:
D.加入热水中:
10.对下列事实的解释错误的是
选项 事实 解释
A 的沸点较低 存在分子内氢键
B 可发生反应: 中N的一个杂化轨道上有未成对电子,易两分子结合形成键
C 与加成的主要产物是 中的电负性较大,使双键电子云向中心碳原子偏移;中带正电性的易连在带负电性中心碳原子上
D 利用“杯酚”可分离和 超分子具有自组装的特征
A.A B.B C.C D.D
11.一种新型的葡萄糖辅助Cu(Ⅰ)/Cu(Ⅱ)氧化还原耦合制氢系统工作原理如图所示。下列说法错误的是
A.M极为电源负极 B.P极的电极反应式为
C.电解过程中Q极发生氧化反应 D.理论上消耗18g葡萄糖,可制得0.2mol
12.含的溶液中发生反应的反应机理如图所示。下列说法正确的是
A.由图可知不能氧化
B.反应过程中包含三个基元反应
C.若不加,该反应的化学反应速率更大
D.和不能大量共存
13.钒作为一种重要的战略性资源,在高科技尖端科学与军工领域有着广泛的用途。钒主要制成钒铁,用作钢铁合金,它具有能细化钢铁基体晶粒的作用,可从其氧化物中提取。如图是某种钒的氧化物晶体的立方晶胞。已知:该晶体的密度为,为阿伏加德罗常数的值。下列说法错误的是
A.V位于元素周期表的第VB族
B.该氧化物的化学式为
C.若点原子的分数坐标为,则点原子的分数坐标为
D.晶胞中距离最近的两个钒原子的核间距为
14.常温下,用标准溶液滴定待测溶液,滴定过程中溶液的pH随的变化曲线如图所示:
已知:常温下,。下列叙述正确的是
A.由b、d点的pH可得出
B.向NaF溶液中滴加少量溶液时,其反应为
C.在a、b点之间存在
D.d点溶液中:
二、非选择题(58分)
15.(14分)氨基钠可用作有机合成的还原剂、脱水剂等。已知,i.几乎不溶于液氨,易与水、氧气等反应;ii.、、。回答下列问题:
I.制备氨基钠
(1)按气流从左往右的方向,上述装置合理的连接顺序为 (填仪器接口字母,必要时个别装置可重复使用)。
(2)仪器x的名称为 ,装置A的作用为 。
(3)装置B中制备的化学方程式为 。
(4)的作用是 ,若装置D中生成1.12L(标准状况下),则消耗 gNa。
(5)反应前装置D中需通入氨气排尽体系中空气,设计方案判断密闭体系中空气是否排尽: 。
II.氨基钠产品质量分数测定
称量2.0g氨基钠产品,溶于水配成500mL溶液;量取25mL溶液,加热除去,冷却至室温后,滴入2滴酚酞试液,用的HCl标准溶液进行滴定,记下达到滴定终点所消耗HCl标准溶液的体积,重复上述实验4次,滴定结果如下表。
实验数据 滴定次数
1 2 3 4
V(产品)/mL 25.00 25.00 25.00 25.00
V[HCl(标准溶液)]/mL 25.75 25.00 25.05 24.95
(6)氨基钠的质量分数为 %(保留三位有效数字)。
16.(14分)铬广泛应用于冶金、化工、铸铁、耐火及高精端科技等领域。工业上以碳素铬铁(铁铬合金)为原料,利用电解法制取金属铬的工艺流程如图所示:
已知:铁铵矾晶体的化学式为。
回答下列问题:
(1)“溶解”前,粉碎碳素铬铁的目的是 。
(2)“溶解”步骤中,需加热到105℃,写出铬与浓硫酸反应的化学方程式: ;碳素铬铁过量时会产生,阳极液()进入到“溶解”步骤中,与发生反应的离子方程式为 。
(3)若铬铵矾晶体为二十四水结晶水合物,属于复盐,其中铬的化合价为+3价,则铬铵矾晶体的化学式为 。
(4)若以惰性电极进行“电解”,Cr3+在阳极放电的电极反应式为 ,当外电路有0.6mol电子转移,则在阴极上生成铬的质量为 g。
(5)Cr单质的晶胞结构如图所示。已知晶体密度为,为阿伏加德罗常数的值,则Cr原子的半径为 nm(用含有、的代数式表示)。
17.(15分)我国科学家成功利用光伏发电,将电解水获得的与反应合成甲醇,再由甲醇经若干酶促反应合成淀粉。该研究成果已在国际学术期刊《科学》上发表。回答下列问题:
(1)人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示。
反应的 (用含、、、的代数式表示)。
(2)有学者结合实验和计算机模拟结果,得出的一种反应历程如图所示,其中吸附在催化剂表面的物种用“·”标注,TS1、TS2、TS3、TS4均为过渡态。决速步骤对应的化学方程式为 ;TS3对应的步骤适合在 (填“高温”或“低温”)条件下进行。
(3)在密闭容器中充入一定量的和,发生反应 ,在催化剂作用下单位时间内的转化率与温度、催化剂的关系如图所示。
①a点时,的生成速率 (填“>”“<”或“=”,下同)的消耗速率;催化效率:Cat2 Cat1。
②b点之后的转化率降低,可能的原因是 。
(4)已知催化加氢的主要反应如下:
反应Ⅰ.
反应Ⅱ.
①230℃时,将和按物质的量之比为1:3混合通入恒温刚性密闭容器中,在催化剂作用下同时发生反应Ⅰ和反应Ⅱ,容器内压强随时间的变化如下表所示。
时间/min 0 20 40 60 80
压强/MPa
平衡时,则该温度下反应Ⅰ的化学平衡常数 (用含的代数式表示)。
②二氧化碳催化加氢合成甲醇反应往往伴随副反应Ⅱ。一定温度和压强条件下,为了提高反应速率和甲醇选择性,应当 。
18.(15分)磺胺嘧啶为预防、治疗脑膜炎球菌性脑膜球菌性脑膜炎(流行性脑膜炎)的首选用药,合成路线如下:
回答下列问题:
(1)C的名称为 ;H中所含官能团有碳碳双键、 。
(2)F的结构简式为 ,由B生成C的反应类型为 。
(3)G→H可以看作为两步反应完成,其中第二步为氧化反应,试写出第一步反应的化学方程式: 。
(4)化合物K是H的同系物,最大质荷比为99,满足下列条件的K的同分异构体有 种(不考虑立体异构)。
a.红外光谱显示有结构
b.氨基与碳碳双键相连
其中核磁共振氢谱有3组峰,且峰面积之比为6∶2∶1的结构简式为 (写一种)。
(5)已知:。对氨基苯甲酰-丙氨酸是重要的医药中间体,结构简式为:,试以甲苯和-丙氨酸()为原料,设计对氨基苯甲酰-丙氨酸的合成路线(无机试剂任选): 。
2025届固始县永和高中、外国语高中二模联考
高三化学参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 B A B C B A D B A D
题号 11 12 13 14
答案 D D D A
15.(1)bcdefcda (1分)
(2) 球形干燥管(2分) 吸收,防止污染空气(2分)
(3)(2分)
(4) 催化剂 (1分) 2.3(2分)
(5)向装置A的烧杯中加水至漏斗颈浸没,通入,如烧杯中出现气泡,则空气尚未排尽,如未出现气泡,则说明空气已排尽(2分)
(6)97.5(2分)
16.(1)增大接触面积,加快反应速率,使反应更充分(2分)
(2) (2分) (2分)
(3)[或](2分)
(4) (2分) 10.4(2分)
(5)(2分)
17.(1)(2分)
(2) (或) (2分) 低温(1分)
(3) > (2分) > (2分) 温度升高,平衡向逆反应方向移动(或催化剂活性降低;或温度升高反应左移与催化剂活性降低共同作用)(2分)
(4) (2分) 选择适宜的催化剂(2分)
18.(1) 苯胺(2分) 醛基(2分)
(2) (NH2) 2C=NH (2分) 还原反应(2分)
(3)HC≡CCH2OH+HN(C2H5)2(C2H5)2NCH=CHCH2OH(2分)
(4) 26 (1分) (2分)
(5)+(2分)
同课章节目录
