天津市2024-2025学年度高二上学期期末考试化学试题(含答案)
文档属性
| 名称 | 天津市2024-2025学年度高二上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-29 15:55:05 | ||
图片预览

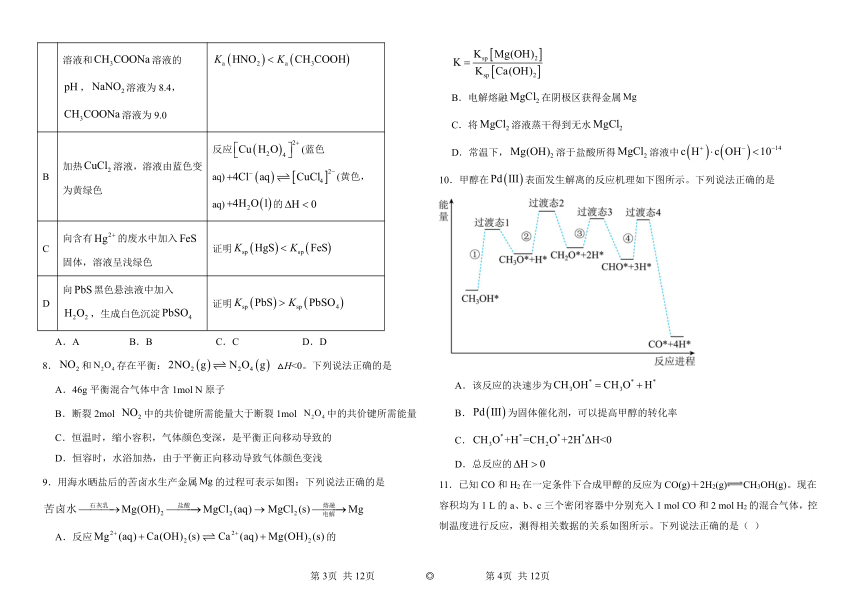
文档简介
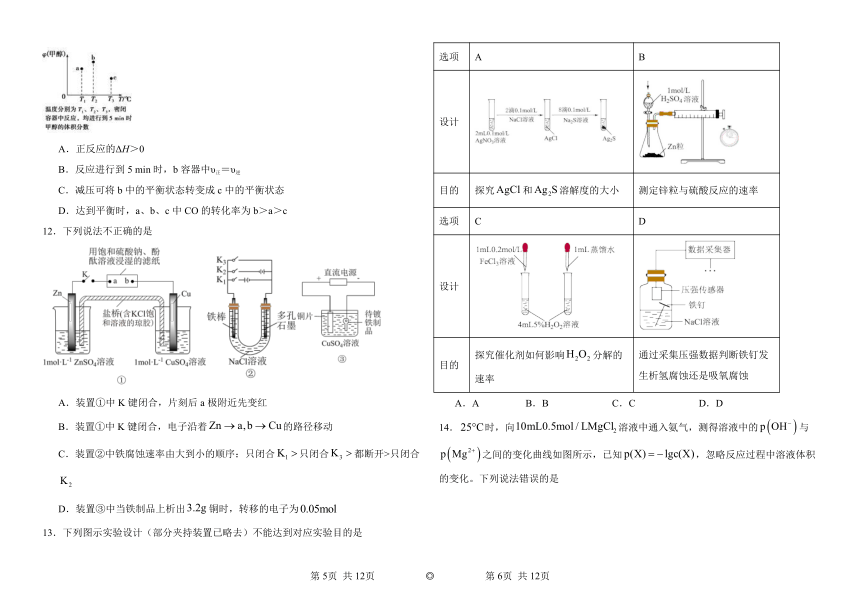
天津市2024-2025学年度高二上学期期末考试
化学试题
本卷满分100分;时间:75分钟
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
一、单选题(本题共14小题,每题3分,共42分)
1.化学与生活、生产、科技息息相关。下列说法错误的是
A.“嫦娥五号”使用的太阳能电池,可将化学能转变成电能
B.含氟牙膏可以有效防止龋齿
C.草木灰和铵态氮肥不可以混合施用
D.在船舶的外壳安装若干锌块防止船体腐蚀是牺牲阳极法
2.化学用语是学习化学的工具。下列化学用语表述错误的是
A.和核内中子数之比为1:2
B.基态铬原子的简化电子排布式:
C.激发态H原子的轨道表示式:
D.可表示原子、阳离子以及阴离子
3.NA是阿伏加德罗常数的值。下列说法正确的是
A.1L0.1mol·L-1的Na2CO3溶液中,阴离子数为0.1NA
B.室温下,100mlpH=1的硫酸中,离子数为0.02NA
C.一定条件下,1molN2与足量的H2反应,生成NH3分子数为2NA
D.电解精炼铜,若阴极获得纯铜6.4g,外电路中通过的电子数为0.2NA
4.下列离子方程式书写正确的是
A.的水解:
B.向悬浊液中加入溶液:
C.将滴饱和溶液加入沸水中,继续煮沸至液体呈红褐色:
D.铅酸蓄电池放电时的负极反应:
5.下列事实其中与盐类水解有关的是
①可溶性铝盐、铁盐作净水剂;②水溶液呈酸性;③铵态氮肥不能与草木灰混合施用;④加热能使纯碱溶液去污能力增强
A.全部 B.①③④ C.②④ D.①②③
6.室温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入甲基橙呈红色的溶液:、、、
B.0.1mol/L 溶液:、、、
C.澄清透明溶液:、、、
D.由水电离出的的溶液:、、、
7.下列实验操作、现象及结论均正确的是
选项 实验操作及现象 结论
A 常温下,测定等浓度的溶液和溶液的,溶液为8.4,溶液为9.0 电离平衡常数:
B 加热溶液,溶液由蓝色变为黄绿色 反应(蓝色aq)(黄色,aq)的
C 向含有的废水中加入固体,溶液呈浅绿色 证明
D 向黑色悬浊液中加入,生成白色沉淀 证明
A.A B.B C.C D.D
8.和存在平衡: △H<0。下列说法正确的是
A.46g平衡混合气体中含1mol N原子
B.断裂2mol 中的共价键所需能量大于断裂1mol 中的共价键所需能量
C.恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的
D.恒容时,水浴加热,由于平衡正向移动导致气体颜色变浅
9.用海水晒盐后的苦卤水生产金属的过程可表示如图:下列说法正确的是
A.反应的
B.电解熔融在阴极区获得金属
C.将溶液蒸干得到无水
D.常温下,溶于盐酸所得溶液中
10.甲醇在表面发生解离的反应机理如下图所示。下列说法正确的是
A.该反应的决速步为
B.为固体催化剂,可以提高甲醇的转化率
C.
D.总反应的
11.已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是( )
A.正反应的ΔH>0
B.反应进行到5 min时,b容器中υ正=υ逆
C.减压可将b中的平衡状态转变成c中的平衡状态
D.达到平衡时,a、b、c中CO的转化率为b>a>c
12.下列说法不正确的是
A.装置①中K键闭合,片刻后a极附近先变红
B.装置①中K键闭合,电子沿着的路径移动
C.装置②中铁腐蚀速率由大到小的顺序:只闭合只闭合都断开>只闭合
D.装置③中当铁制品上析出铜时,转移的电子为
13.下列图示实验设计(部分夹持装置已略去)不能达到对应实验目的是
选项 A B
设计
目的 探究和溶解度的大小 测定锌粒与硫酸反应的速率
选项 C D
设计
目的 探究催化剂如何影响分解的速率 通过采集压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
A.A B.B C.C D.D
14.时,向溶液中通入氨气,测得溶液中的与之间的变化曲线如图所示,已知,忽略反应过程中溶液体积的变化。下列说法错误的是
A.a点溶液满足: B.b点溶液中有沉淀产生
C.c点溶液满足: D.
二、非选择题(本题共4个小题,58分)
15.如图为元素周期表的一部分,请参照元素在元素周期表中的位置,回答下列问题:
(1)元素①的一种核素为氘是核聚变反应的主要原料,下列有关叙述正确的是_______。
A.的中子数为2 B.的核电荷数为1
C.是自然界中最轻的原子 D.是氢元素的一种同素异形体
(2)元素②基态原子的电子排布式为 ;其电子占据的最高能级共有 个原子轨道,其电子云轮廓图的形状是 ;元素⑧基态原子的价层电子排布式为 。
(3)元素⑤在周期表中的位置是 ,其基态原子价层电子轨道表示式为 ,该元素对应基态原子的电子在原子核外有 个空间运动状态。
(4)元素⑦位于元素周期表 区,其基态原子的简化电子排布式为 。
(5)元素②③④的原子对键合电子吸引能力由大到小的顺序为 (填元素符号),分子中键角为 ,1个分子中键:键 。
(6)元素⑥的正一价阳离子和正二价阳离子相比较,离子半径较大的是 (填离子符号)。
16.电化学知识在生产、生活中应用广泛,请按照要求回答下列问题:
(1)用如图所示装置和药品进行制作简单燃料电池的实验。
①闭合,接通直流电源进行电解一段时间,观察到电极附近的现象为 。电极的电极反应式为 。
②上述电解过程进行后,打开,闭合。写出电极的电极反应式 。
③下列说法中,正确的是 (填字母序号)。
a.通过调节、可以实现化学能和电能的相互转化
b.若将溶液替换为稀硫酸,闭合后,电极反应不变
(2)铅酸蓄电池充放电的电池反应式为:,该电池放电时的正极反应式为 。充电时,外接电源负极与 (填“”或“”)连接,溶液的会 。(填“增大”、“减小”或“不变”)
(3)某同学设计了如图所示装置,可探究氯碱工业原理和粗铜的精炼原理。
①甲装置中负极的电极反应式为 。
②乙装置中电极的电极反应式为 。
③乙中的把电解槽隔成了阴极室和阳极室,为 (填“阴”或“阳”)离子交换膜,它只允许溶液中的 通过(填写下列微粒的编号)。
① ② ③ ④ ⑤ ⑥
④若在标准状况下,有氧气参加反应,丙装置中阴极析出铜的质量为 g。
17.I.溶液的变化往往直接影响到研究工作的成效,所以配制缓冲溶液是不可或缺的关键步骤。“缓冲溶液”是指由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的相对稳定。
(1)下列溶液中,能组成缓冲溶液的是_______。
A.和 B.和
C. D.和
(2)已知:常温下,。将和等体积混合后,溶液中 (填“>”、“<”或“=”)。氯化铵溶液的水解平衡常数 (保留2位有效数字)。
(3)若想要配制合适的缓冲溶液,需往第(2)题溶液中继续加入 (填化学式);若刚好调节为7,则溶液中 (填“>”、“<”或“=”)。
Ⅱ.磷酸盐缓冲液(简称)是生物学上常用于细胞培养的缓冲液,主要成分为磷酸二氢钠和磷酸氢二钠。是一种三元酸,下图为某浓度溶液中各种微粒的物质的量分数随的变化曲线。
(4)用溶液对上述溶液进行滴定,用 作为指示剂,当溶液呈浅粉色时停止滴定,溶液中的溶质为 和 (填化学式)。
(5)从图上可知,磷酸氢二钠溶液呈 性(填“酸”、“碱”或“中”),用相关原理解释其原因是 ;当时溶液中 。
18.水溶液中的离子反应和平衡与生命活动、日常生活、工农业生产等息息相关,请根据水溶液中的离子反应与平衡知识及下表数据回答下列问题:
时部分弱酸的电离平衡常数
化学式
电离常数
(1)溶液和溶液中, (填“>”“<”或“=”)。
(2)向溶液中加入下列物质,能促进水解的是______(填字母)。
A. B. C. D.
(3)常温下已知某浓度的水溶液:
①该溶液中由水电离出的浓度为 。
②该溶液中各离子浓度由大到小顺序为 。
③将少量通入溶液,反应的离子方程式为 。
(4)某学习小组用的溶液来测定未知物质的量浓度的盐酸:
①用标准的溶液滴定待测的盐酸时,选择酚酞作指示剂,达到滴定终点的标志为: 。
②某同学在滴定时进行了以下操作,其中会使所测盐酸的浓度偏高的是 (填字母)。
A.滴定前用蒸馏水冲洗盛放待测盐酸的锥形瓶
B.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
C.检查碱式滴定管活塞不漏水后,未润洗直接加入标准碱液
D.盛放标准碱液的滴定管在滴定前尖嘴处有气泡,滴定后气泡消失
E.读取溶液体积时,开始仰视读数,滴定结束时俯视读数
③常温下,将溶液滴入溶液中,测得溶液的变化曲线如图所示:
则点溶液中: (填“>”“<”或“=”),点溶液中 。
(5)现有含和的混合溶液,其中,用碳酸钠调节溶液的为 可使恰好沉淀完全(离子浓度),此时 (填“有”或“无”)沉淀生成。(已知,此温度下,,,假设溶液体积不变)
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案
A
C
D
B
B
6.C
7.C
8.A
9.B
10.A
11.C
12.D
13.A
14.C
15.(1)B
(2) 3 哑铃形
(3) 第四周期第VⅢ族 15
(4) p
(5)
(6)
16.(1) 有气泡产生,电极附近溶液变红色
(2) Pb 减小
(3) 阳 ③⑤ 12.8
17.(1)BD
(2) <
(3) =
(4) 酚酞
(5) 碱 的水解程度大于其电离程度
18.(1)<
(2)D
(3)
(4) 当滴入半滴溶液时,锥形瓶内溶液颜色由无色刚好变为粉红色,且半分钟内不变色 <
(5) 无
答案第1页,共2页
答案第1页,共2页
化学试题
本卷满分100分;时间:75分钟
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
一、单选题(本题共14小题,每题3分,共42分)
1.化学与生活、生产、科技息息相关。下列说法错误的是
A.“嫦娥五号”使用的太阳能电池,可将化学能转变成电能
B.含氟牙膏可以有效防止龋齿
C.草木灰和铵态氮肥不可以混合施用
D.在船舶的外壳安装若干锌块防止船体腐蚀是牺牲阳极法
2.化学用语是学习化学的工具。下列化学用语表述错误的是
A.和核内中子数之比为1:2
B.基态铬原子的简化电子排布式:
C.激发态H原子的轨道表示式:
D.可表示原子、阳离子以及阴离子
3.NA是阿伏加德罗常数的值。下列说法正确的是
A.1L0.1mol·L-1的Na2CO3溶液中,阴离子数为0.1NA
B.室温下,100mlpH=1的硫酸中,离子数为0.02NA
C.一定条件下,1molN2与足量的H2反应,生成NH3分子数为2NA
D.电解精炼铜,若阴极获得纯铜6.4g,外电路中通过的电子数为0.2NA
4.下列离子方程式书写正确的是
A.的水解:
B.向悬浊液中加入溶液:
C.将滴饱和溶液加入沸水中,继续煮沸至液体呈红褐色:
D.铅酸蓄电池放电时的负极反应:
5.下列事实其中与盐类水解有关的是
①可溶性铝盐、铁盐作净水剂;②水溶液呈酸性;③铵态氮肥不能与草木灰混合施用;④加热能使纯碱溶液去污能力增强
A.全部 B.①③④ C.②④ D.①②③
6.室温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入甲基橙呈红色的溶液:、、、
B.0.1mol/L 溶液:、、、
C.澄清透明溶液:、、、
D.由水电离出的的溶液:、、、
7.下列实验操作、现象及结论均正确的是
选项 实验操作及现象 结论
A 常温下,测定等浓度的溶液和溶液的,溶液为8.4,溶液为9.0 电离平衡常数:
B 加热溶液,溶液由蓝色变为黄绿色 反应(蓝色aq)(黄色,aq)的
C 向含有的废水中加入固体,溶液呈浅绿色 证明
D 向黑色悬浊液中加入,生成白色沉淀 证明
A.A B.B C.C D.D
8.和存在平衡: △H<0。下列说法正确的是
A.46g平衡混合气体中含1mol N原子
B.断裂2mol 中的共价键所需能量大于断裂1mol 中的共价键所需能量
C.恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的
D.恒容时,水浴加热,由于平衡正向移动导致气体颜色变浅
9.用海水晒盐后的苦卤水生产金属的过程可表示如图:下列说法正确的是
A.反应的
B.电解熔融在阴极区获得金属
C.将溶液蒸干得到无水
D.常温下,溶于盐酸所得溶液中
10.甲醇在表面发生解离的反应机理如下图所示。下列说法正确的是
A.该反应的决速步为
B.为固体催化剂,可以提高甲醇的转化率
C.
D.总反应的
11.已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是( )
A.正反应的ΔH>0
B.反应进行到5 min时,b容器中υ正=υ逆
C.减压可将b中的平衡状态转变成c中的平衡状态
D.达到平衡时,a、b、c中CO的转化率为b>a>c
12.下列说法不正确的是
A.装置①中K键闭合,片刻后a极附近先变红
B.装置①中K键闭合,电子沿着的路径移动
C.装置②中铁腐蚀速率由大到小的顺序:只闭合只闭合都断开>只闭合
D.装置③中当铁制品上析出铜时,转移的电子为
13.下列图示实验设计(部分夹持装置已略去)不能达到对应实验目的是
选项 A B
设计
目的 探究和溶解度的大小 测定锌粒与硫酸反应的速率
选项 C D
设计
目的 探究催化剂如何影响分解的速率 通过采集压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
A.A B.B C.C D.D
14.时,向溶液中通入氨气,测得溶液中的与之间的变化曲线如图所示,已知,忽略反应过程中溶液体积的变化。下列说法错误的是
A.a点溶液满足: B.b点溶液中有沉淀产生
C.c点溶液满足: D.
二、非选择题(本题共4个小题,58分)
15.如图为元素周期表的一部分,请参照元素在元素周期表中的位置,回答下列问题:
(1)元素①的一种核素为氘是核聚变反应的主要原料,下列有关叙述正确的是_______。
A.的中子数为2 B.的核电荷数为1
C.是自然界中最轻的原子 D.是氢元素的一种同素异形体
(2)元素②基态原子的电子排布式为 ;其电子占据的最高能级共有 个原子轨道,其电子云轮廓图的形状是 ;元素⑧基态原子的价层电子排布式为 。
(3)元素⑤在周期表中的位置是 ,其基态原子价层电子轨道表示式为 ,该元素对应基态原子的电子在原子核外有 个空间运动状态。
(4)元素⑦位于元素周期表 区,其基态原子的简化电子排布式为 。
(5)元素②③④的原子对键合电子吸引能力由大到小的顺序为 (填元素符号),分子中键角为 ,1个分子中键:键 。
(6)元素⑥的正一价阳离子和正二价阳离子相比较,离子半径较大的是 (填离子符号)。
16.电化学知识在生产、生活中应用广泛,请按照要求回答下列问题:
(1)用如图所示装置和药品进行制作简单燃料电池的实验。
①闭合,接通直流电源进行电解一段时间,观察到电极附近的现象为 。电极的电极反应式为 。
②上述电解过程进行后,打开,闭合。写出电极的电极反应式 。
③下列说法中,正确的是 (填字母序号)。
a.通过调节、可以实现化学能和电能的相互转化
b.若将溶液替换为稀硫酸,闭合后,电极反应不变
(2)铅酸蓄电池充放电的电池反应式为:,该电池放电时的正极反应式为 。充电时,外接电源负极与 (填“”或“”)连接,溶液的会 。(填“增大”、“减小”或“不变”)
(3)某同学设计了如图所示装置,可探究氯碱工业原理和粗铜的精炼原理。
①甲装置中负极的电极反应式为 。
②乙装置中电极的电极反应式为 。
③乙中的把电解槽隔成了阴极室和阳极室,为 (填“阴”或“阳”)离子交换膜,它只允许溶液中的 通过(填写下列微粒的编号)。
① ② ③ ④ ⑤ ⑥
④若在标准状况下,有氧气参加反应,丙装置中阴极析出铜的质量为 g。
17.I.溶液的变化往往直接影响到研究工作的成效,所以配制缓冲溶液是不可或缺的关键步骤。“缓冲溶液”是指由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的相对稳定。
(1)下列溶液中,能组成缓冲溶液的是_______。
A.和 B.和
C. D.和
(2)已知:常温下,。将和等体积混合后,溶液中 (填“>”、“<”或“=”)。氯化铵溶液的水解平衡常数 (保留2位有效数字)。
(3)若想要配制合适的缓冲溶液,需往第(2)题溶液中继续加入 (填化学式);若刚好调节为7,则溶液中 (填“>”、“<”或“=”)。
Ⅱ.磷酸盐缓冲液(简称)是生物学上常用于细胞培养的缓冲液,主要成分为磷酸二氢钠和磷酸氢二钠。是一种三元酸,下图为某浓度溶液中各种微粒的物质的量分数随的变化曲线。
(4)用溶液对上述溶液进行滴定,用 作为指示剂,当溶液呈浅粉色时停止滴定,溶液中的溶质为 和 (填化学式)。
(5)从图上可知,磷酸氢二钠溶液呈 性(填“酸”、“碱”或“中”),用相关原理解释其原因是 ;当时溶液中 。
18.水溶液中的离子反应和平衡与生命活动、日常生活、工农业生产等息息相关,请根据水溶液中的离子反应与平衡知识及下表数据回答下列问题:
时部分弱酸的电离平衡常数
化学式
电离常数
(1)溶液和溶液中, (填“>”“<”或“=”)。
(2)向溶液中加入下列物质,能促进水解的是______(填字母)。
A. B. C. D.
(3)常温下已知某浓度的水溶液:
①该溶液中由水电离出的浓度为 。
②该溶液中各离子浓度由大到小顺序为 。
③将少量通入溶液,反应的离子方程式为 。
(4)某学习小组用的溶液来测定未知物质的量浓度的盐酸:
①用标准的溶液滴定待测的盐酸时,选择酚酞作指示剂,达到滴定终点的标志为: 。
②某同学在滴定时进行了以下操作,其中会使所测盐酸的浓度偏高的是 (填字母)。
A.滴定前用蒸馏水冲洗盛放待测盐酸的锥形瓶
B.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
C.检查碱式滴定管活塞不漏水后,未润洗直接加入标准碱液
D.盛放标准碱液的滴定管在滴定前尖嘴处有气泡,滴定后气泡消失
E.读取溶液体积时,开始仰视读数,滴定结束时俯视读数
③常温下,将溶液滴入溶液中,测得溶液的变化曲线如图所示:
则点溶液中: (填“>”“<”或“=”),点溶液中 。
(5)现有含和的混合溶液,其中,用碳酸钠调节溶液的为 可使恰好沉淀完全(离子浓度),此时 (填“有”或“无”)沉淀生成。(已知,此温度下,,,假设溶液体积不变)
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案
A
C
D
B
B
6.C
7.C
8.A
9.B
10.A
11.C
12.D
13.A
14.C
15.(1)B
(2) 3 哑铃形
(3) 第四周期第VⅢ族 15
(4) p
(5)
(6)
16.(1) 有气泡产生,电极附近溶液变红色
(2) Pb 减小
(3) 阳 ③⑤ 12.8
17.(1)BD
(2) <
(3) =
(4) 酚酞
(5) 碱 的水解程度大于其电离程度
18.(1)<
(2)D
(3)
(4) 当滴入半滴溶液时,锥形瓶内溶液颜色由无色刚好变为粉红色,且半分钟内不变色 <
(5) 无
答案第1页,共2页
答案第1页,共2页
同课章节目录
