2.2 分子的空间结构 同步练习(含答案)2024-2025学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2 分子的空间结构 同步练习(含答案)2024-2025学年高二化学人教版(2019)选择性必修2 |
|
|
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-13 23:34:39 | ||
图片预览



文档简介
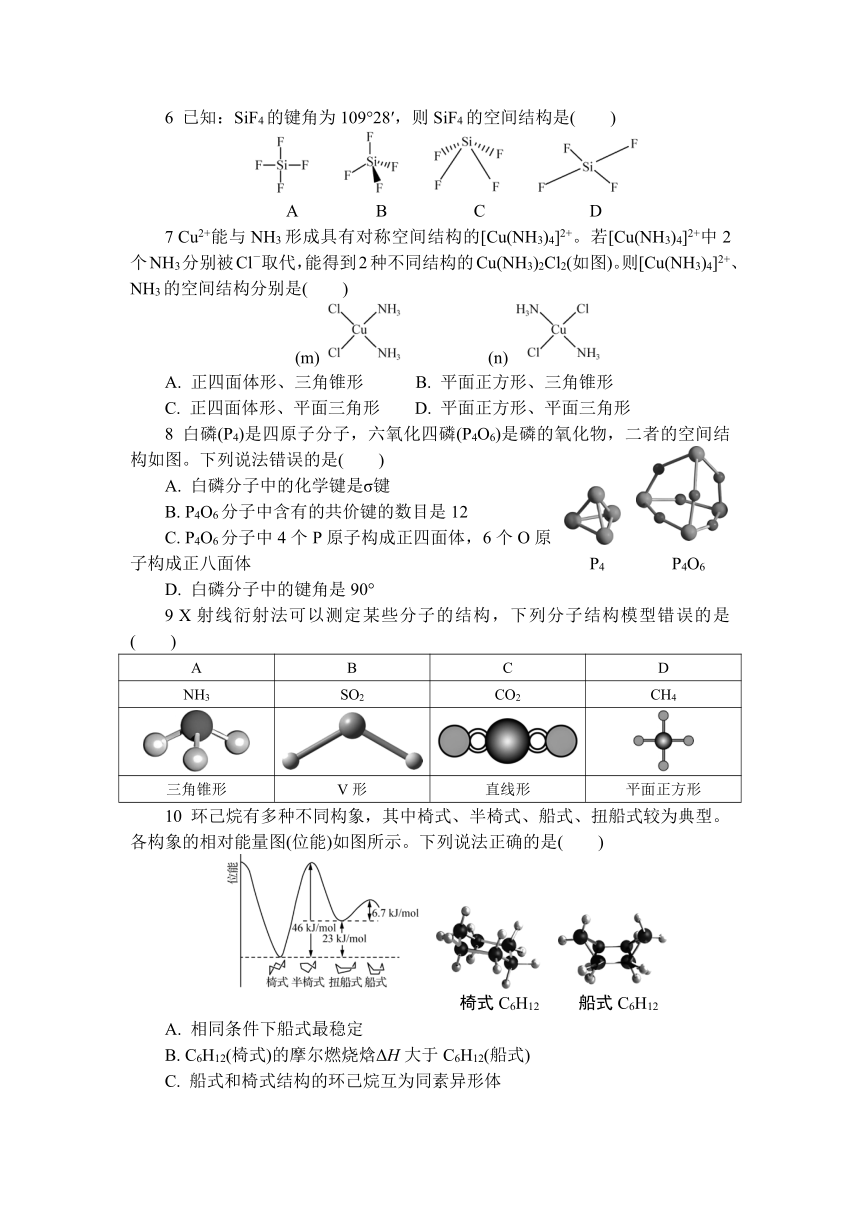
第二节 分子的空间结构
课时1 多样的分子空间结构
1 可以准确判断有机物分子中含有官能团种类的分析方法是( )
A. 核磁共振氢谱 B. 质谱 C. 红外光谱 D. 紫外光谱
2 下列说法不正确的是( )
A. 利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
B. 用X射线衍射测定乙酸晶体,每个晶胞中含有4个乙酸分子
C. 红外光谱可以测定未知物分子中所含有的化学键或官能团,以此判断物质的结构
D. 质谱仪是通过分析最小的碎片离子测出分子的相对质量
3 某有机物A用质谱仪测定的结果如图1所示,核磁共振氢谱示意图如图2所示,则A的结构简式可能为( )
图1 图2
A. CH3CH2OH B. CH3OCH3 C. HCOOH D. CH3CH2COOH
4 光学分析法是融合物理学和化学实验技术的一类重要仪器分析方法。在青蒿素分子结构(相对分子质量282)测定中,使用下列方法不能得到对应结论的是( )
选项 分析方法 结论
A 质谱 相对分子质量为282
B 红外光谱 分子中含有酯基
C 核磁共振氢谱 分子中含有过氧基
D X射线衍射 测定分子结构
5 依据分子的球棍模型进行判断,下列分子的空间结构名称错误的是( )
A B C D
CH4 HCHO BF3 H2O
正四面体形 平面三角形 平面三角形 平面三角形
6 已知:SiF4的键角为109°28′,则SiF4的空间结构是( )
A B C D
7 Cu2+能与NH3形成具有对称空间结构的[Cu(NH3)4]2+。若[Cu(NH3)4]2+中2个NH3分别被Cl-取代,能得到2种不同结构的Cu(NH3)2Cl2(如图)。则[Cu(NH3)4]2+、NH3的空间结构分别是( )
(m) (n)
A. 正四面体形、三角锥形 B. 平面正方形、三角锥形
C. 正四面体形、平面三角形 D. 平面正方形、平面三角形
8 白磷(P4)是四原子分子,六氧化四磷(P4O6)是磷的氧化物,二者的空间结构如图。下列说法错误的是( )
A. 白磷分子中的化学键是σ键
B. P4O6分子中含有的共价键的数目是12
C. P4O6分子中4个P原子构成正四面体,6个O原子构成正八面体 P4 P4O6
D. 白磷分子中的键角是90°
9 X射线衍射法可以测定某些分子的结构,下列分子结构模型错误的是( )
A B C D
NH3 SO2 CO2 CH4
三角锥形 V形 直线形 平面正方形
10 环己烷有多种不同构象,其中椅式、半椅式、船式、扭船式较为典型。各构象的相对能量图(位能)如图所示。下列说法正确的是( )
椅式C6H12 船式C6H12
A. 相同条件下船式最稳定
B. C6H12(椅式)的摩尔燃烧焓ΔH大于C6H12(船式)
C. 船式和椅式结构的环己烷互为同素异形体
D. 扭船式结构转化为椅式结构吸收能量
11 SF6分子中的6个F原子构成的空间结构为正八面体(如图),则SF6分子中含有σ键的数目及SF6二氯代物种数分别是( )
A. 6、2 B. 6、4
C. 14、2 D. 14、4
12 观察下列模型并结合表中有关信息判断,下列有关说法正确的是( )
B结构单元 P4分子 S8 HCN
结构模型示意图
备注 熔点2 300 ℃ — 易溶于CS2 —
A. 键能:B—B>C—C B. P4分子中P—P的数目为6
C. 固态硫S8由S构成 D. HCN的结构式为
13 (南京调研)(1) 硫化氢(H2S)分子中,两个H—S的夹角接近90°,说明H2S分子的空间结构为________。
(2) 二硫化碳(CS2)分子中,两个C===S的夹角是180°,说明CS2分子的空间结构为___________________。
(3) 下列能说明CH4分子不是平面四边形,而是正四面体结构的是________(填字母)。
a. 两个键之间的夹角为109°28′
b. C—H为极性共价键
c. 4个C—H的键能、键长都相等
d. 二氯甲烷(CH2Cl2)只有一种(不存在同分异构体)
14 (2024无锡江阴期末)有机化合物苯佐卡因是一种医用常见麻醉剂,可用于小面积轻度创面的镇痛。
(1) 苯佐卡因的质谱图如图1所示,则苯佐卡因的相对分子质量为________。
图1 图2
(2) 苯佐卡因的分子式为C9H11NO2,红外光谱如图2所示,且该物质的核磁共振氢谱有5个峰,其面积之比为3∶2∶2∶2∶2,则该物质的结构简式为__________。
课时2 分子空间结构的理论解释
1 下列微粒中,中心原子含有孤电子对的是( )
A. SiH4 B. H2O C. CH4 D. NH
2 (2025无锡开学考)下列分子或离子中采用sp3杂化,但是V形结构的是( )
A. NH3 B. H2S C. BeCl2 D. NO
3 (2025扬州阶段检测)根据价层电子对互斥模型,判断下列分子或离子的空间结构正确的是( )
编号 分子式 价层电子对互斥模型 分子或离子的空间结构
① NCl3 四面体形 三角锥形
② HCHO 平面三角形 三角锥形
③ SO2 平面三角形 平面三角形
④ NH 正四面体形 正四面体形
A. ①② B. ①④ C. ②④ D. ②③
4 (长春外国语学校期末)下列说法正确的是( )
A. NCl3分子呈平面三角形,这与氮原子采取sp2杂化密切相关
B. sp3杂化轨道是由中心原子的任意1个s轨道和3个p轨道混合形成的4个sp3杂化轨道
C. 中心原子采取sp3杂化的分子,其空间结构可能是四面体形或三角锥形或V形
D. AB3型分子的空间结构一定是平面三角形
5 (2025泰州开学考)下列化学用语或图示表达正确的是( )
A. H2S分子的球棍模型:
B. NH3的VSEPR模型:
C. 基态24Cr原子价层电子轨道表示式:
D. 2pz电子云轮廓图:
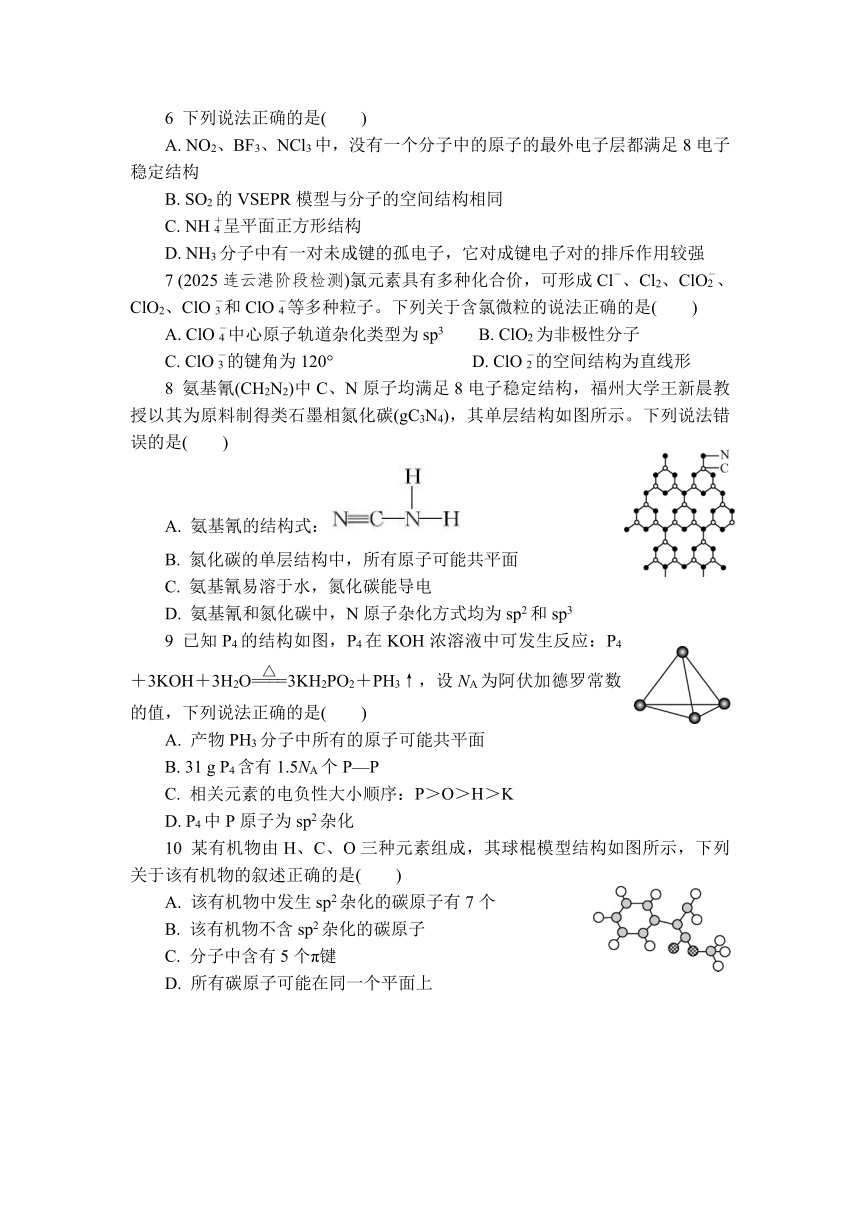
6 下列说法正确的是( )
A. NO2、BF3、NCl3中,没有一个分子中的原子的最外电子层都满足8电子稳定结构
B. SO2的VSEPR模型与分子的空间结构相同
C. NH呈平面正方形结构
D. NH3分子中有一对未成键的孤电子,它对成键电子对的排斥作用较强
7 (2025连云港阶段检测)氯元素具有多种化合价,可形成Cl-、Cl2、ClO、ClO2、ClO和ClO等多种粒子。下列关于含氯微粒的说法正确的是( )
A. ClO中心原子轨道杂化类型为sp3 B. ClO2为非极性分子
C. ClO的键角为120° D. ClO的空间结构为直线形
8 氨基氰(CH2N2)中C、N原子均满足8电子稳定结构,福州大学王新晨教授以其为原料制得类石墨相氮化碳(gC3N4),其单层结构如图所示。下列说法错误的是( )
A. 氨基氰的结构式:
B. 氮化碳的单层结构中,所有原子可能共平面
C. 氨基氰易溶于水,氮化碳能导电
D. 氨基氰和氮化碳中,N原子杂化方式均为sp2和sp3
9 已知P4的结构如图,P4在KOH浓溶液中可发生反应:P4+3KOH+3H2O3KH2PO2+PH3↑,设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 产物PH3分子中所有的原子可能共平面
B. 31 g P4含有1.5NA个P—P
C. 相关元素的电负性大小顺序:P>O>H>K
D. P4中P原子为sp2杂化
10 某有机物由H、C、O三种元素组成,其球棍模型结构如图所示,下列关于该有机物的叙述正确的是( )
A. 该有机物中发生sp2杂化的碳原子有7个
B. 该有机物不含sp2杂化的碳原子
C. 分子中含有5个π键
D. 所有碳原子可能在同一个平面上
11 已知在CH4分子中,C—H间的键角为109°28′,NH3分子中,N—H间的键角为107°,H2O分子中,O—H间的键角为105°,下列说法正确的是( )
A. 孤电子对与成键电子对间的斥力大于成键电子对与成键电子对间的斥力
B. 孤电子对与成键电子对间的斥力小于成键电子对与成键电子对间的斥力
C. 孤电子对与成键电子对间的斥力等于成键电子对与成键电子对间的斥力
D. 题干中的数据不能说明孤电子对与成键电子对间的斥力和成键电子对与成键电子对间的斥力之间的大小关系
12 根据价层电子对互斥模型填空。
(1) OF2中,中心原子上的σ键电子对数为________,孤电子对数为________,价层电子对数为________,中心原子的杂化方式为__________杂化,VSEPR模型为____________,分子的空间结构为____________。
(2) BF3分子中,中心原子上的σ键电子对数为________,孤电子对数为________,价层电子对数为________,中心原子的杂化方式为________杂化,VSEPR模型为____________,分子的空间结构为____________。
(3) SO中,中心原子上的σ键电子对数为________,孤电子对数为________,价层电子对数为________,中心原子的杂化方式为________杂化,VSEPR模型为____________,分子的空间结构为____________。
13 回答下列问题。
(1) 图1为S8的结构,其硫原子的杂化轨道类型为____________。
图1 图2 图3
(2) 气态三氧化硫以单分子形式存在,其分子的空间结构为______________;固体三氧化硫中存在如图2所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(3) COCl2分子中所有原子均满足8电子结构,COCl2分子中σ键和π键的个数之比为________,中心原子的杂化轨道类型为____________。
(4) As4O6的分子结构如图3所示,其中As原子的杂化轨道类型为________。
(5) AlH中,Al原子的杂化轨道类型为________。
(6) 在空气中灼烧Ag2S生成Ag和SO2,SO2的键角________(填“>”“<”或“=”)H2O的键角。
(7) 以CO2为原料催化加氢可以制备CH4、CH3OH、C2H4等有机物,ZnO/ZrO2为我国科学家发明的二氧化碳加氢的一种催化剂。
①基态Zn原子的轨道表示式为____________________________,其核外电子运动状态有________种。
②碳元素除了可以形成CO、CO2还可以形成C2O3(结构式为)。C2O3中碳原子的杂化轨道类型为________。CO分子中σ键和π键个数比为________。
第二节 分子的空间结构
课时1 多样的分子空间结构
1. C
2. D 不同元素原子的吸收光谱或发射光谱不同,利用原子光谱上的特征谱线来鉴定元素,称为光谱分析,A正确;X射线衍射是测定微观结构的方法,可以测得乙酸晶体每个晶胞中含有4个乙酸分子,B正确;红外光谱可以测定未知物中所含各种化学键或官能团,以此判断物质的结构,C正确;质谱仪是通过分析最大的碎片离子测出分子的相对质量,D错误。
3. A 由图1可知,有机物A的相对分子质量为46,由图2可知,有机物A的核磁共振氢谱中有3组峰,含有三类氢原子,则CH3CH2OH符合题意,故选A。
4. C 过氧基是化学键,需要用红外光谱测定,核磁共振氢谱测的是氢原子种数和个数比,C错误。
5. D 由球棍模型知,H2O分子的空间结构名称为V形,D错误。
6. B SiF4的键角为109°28′,说明其空间结构与CH4相似,为正四面体形。故选B。
7. B NH3的空间填充模型为 ,则其空间结构为三角锥形,C、D错误;[Cu(NH3)4]2+中2个NH3分别被Cl-取代,能得到2种不同结构的Cu(NH3)2Cl2,说明[Cu(NH3)4]2+的空间结构为平面正方形,A错误。故选B。
8. D 白磷是正四面体形分子,每个面都是正三角形,故白磷分子中的键角是60°,D错误。
9. D CH4的空间填充模型为 ,球棍模型为 ,则其空间结构为正四面体形,D错误。
10. B 能量越低越稳定,则相同条件下椅式最稳定,A错误;由图可知,船式C6H12的位能高于椅式C6H12,等物质的量时,船式C6H12完全燃烧放热多,但ΔH是负值,放热越多,摩尔燃烧焓ΔH越小,故C6H12(椅式)的摩尔燃烧焓ΔH大于C6H12(船式),B正确;同素异形体的研究对象是单质,C错误;由图可知,扭船式C6H12的位能高于椅式C6H12,则扭船式结构转化为椅式结构需要释放能量,D错误。
11. A SF6分子的球棍模型为 ,则SF6分子中含有的S—F的数目为6;SF6为正八面体形分子,则 2个氯原子可以位于相邻的顶点或相对的顶点,二氯代物种数为2。故选A。
12. B 原子半径B>C,故键长B—B>C—C,键长越长,键能越小,故键能B—B13. (1) V形 (2) 直线形 (3) ad
14. (1) 165 (2)
课时2 分子空间结构的理论解释
1. B
2. B 氨气分子的中心原子N的价层电子对数=3+×(5-3×1)=3+1=4,采用sp3杂化,有1个孤电子对,空间结构为三角锥形,A错误;硫化氢分子的中心原子S的价层电子对数=2+×(6-2×1)=2+2=4,采用sp3杂化,有2个孤电子对,空间结构为V形,B正确;二氯化铍分子的中心原子Be的价层电子对数=2+×(2-2×1)=2,采用sp杂化,空间结构为直线形,C错误;硝酸根中心原子N的价层电子对数=3+×(5+1-2×3)=3,采用sp2杂化,空间结构为平面三角形,D错误。
3. B NCl3分子中中心N原子的价层电子对数为4,价层电子对互斥模型为四面体形,含有1个孤电子对,分子的空间结构为三角锥形,①正确;甲醛(HCHO)分子中中心C原子的价层电子对数为3(有1个双键),价层电子对互斥模型为平面三角形,没有孤电子对,分子的空间结构为平面三角形,②错误;SO2分子中心原子S的价层电子对数3,含有1个孤电子对,价层电子对互斥模型为平面三角形,分子的空间结构为V形,③错误;NH中中心N原子的价层电子对数为4,价层电子对互斥模型为正四面体形,没有孤电子对,离子的空间结构为正四面体形,④正确。
4. C
5. D H2S分子的空间结构是V形,其球棍模型为,A错误;NH3价层电子对数=3+×(5-3×1)=4,有1个孤电子对,VSEPR模型为四面体形,即,B错误; 基态24Cr原子价层电子排布式为3d54s1,则其轨道表示式为,C错误;已知p能级上的电子云轮廓图即原子轨道为三个垂直的呈哑铃形的轨道,故2pz电子云轮廓图为,D正确。
6. D
7. A ClO中心原子价层电子对数为4+×(7+1-4×2)=4,中心原子轨道杂化类型为sp3,A正确;ClO2为V形结构,正负电荷中心不重合,为极性分子,B错误;ClO中心原子价层电子对数为3+×(7+1-3×2)=4,且含有1个孤电子对,空间结构为三角锥形,键角小于120°,C错误;ClO中心原子价层电子对数为2+×(7+1-2×2)=4,且含有2个孤电子对,空间结构为V形,D错误。
8. D 氨基氰(CH2N2)中C、N原子均满足8电子稳定结构,N原子形成3个共价键、C原子形成4个共价键,则该分子的结构式为,A正确;类比石墨结构可知,氮化碳的单层结构中,所有原子可能共平面,B正确;氨基氰易与水形成氢键,则易溶于水,类比石墨能导电,则氮化碳也能导电,C正确;氨基氰的结构式为,碳氮三键中N原子采取sp杂化、氨基中N原子采取sp3杂化,D错误。
9. B PH3中P原子的价层电子对数为4,分子空间结构为三角锥形,所有原子不可能共平面,A错误;1 mol P4中含6 mol P—P,31 g P4的物质的量为0.25 mol,含P—P数目为1.5NA,B正确;同周期从左往右电负性逐渐增强,同主族从上往下电负性减弱,故电负性O>P>H>K,C错误;根据P4的空间结构,P4中P原子为sp3杂化,D错误。
10. D 11. A
12. (1) 2 2 4 sp3 四面体形 V形
(2) 3 0 3 sp2 平面三角形 平面三角形
(3) 4 0 4 sp3 正四面体形 正四面体形
13. (1) sp3 (2) 平面三角形 sp3 (3) 3∶1 sp2
(4) sp3 (5) sp3 (6) >
(7) ① 30 ②sp2 1∶2
解析:(6) SO2含有的孤电子对数==1,为sp2杂化,分子空间结构为V形,H2O含有的孤电子对数==2,为sp3杂化,分子空间结构为V形,水分子中O原子含有2个孤电子对,故键角SO2>H2O。(7) ①Zn是30号元素,价电子排布式为3d104s2,轨道表示式为,有多少个电子就有多少种运动状态,故其核外电子运动状态有30种。②根据C2O3结构式可知,C2O3中碳原子形成一个碳氧双键,杂化轨道类型为sp2,CO和N2互为等电子体,从键的形成结构看,其中1个是σ键,2个是π键,则σ键和π键个数之比为1∶2。
课时1 多样的分子空间结构
1 可以准确判断有机物分子中含有官能团种类的分析方法是( )
A. 核磁共振氢谱 B. 质谱 C. 红外光谱 D. 紫外光谱
2 下列说法不正确的是( )
A. 利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
B. 用X射线衍射测定乙酸晶体,每个晶胞中含有4个乙酸分子
C. 红外光谱可以测定未知物分子中所含有的化学键或官能团,以此判断物质的结构
D. 质谱仪是通过分析最小的碎片离子测出分子的相对质量
3 某有机物A用质谱仪测定的结果如图1所示,核磁共振氢谱示意图如图2所示,则A的结构简式可能为( )
图1 图2
A. CH3CH2OH B. CH3OCH3 C. HCOOH D. CH3CH2COOH
4 光学分析法是融合物理学和化学实验技术的一类重要仪器分析方法。在青蒿素分子结构(相对分子质量282)测定中,使用下列方法不能得到对应结论的是( )
选项 分析方法 结论
A 质谱 相对分子质量为282
B 红外光谱 分子中含有酯基
C 核磁共振氢谱 分子中含有过氧基
D X射线衍射 测定分子结构
5 依据分子的球棍模型进行判断,下列分子的空间结构名称错误的是( )
A B C D
CH4 HCHO BF3 H2O
正四面体形 平面三角形 平面三角形 平面三角形
6 已知:SiF4的键角为109°28′,则SiF4的空间结构是( )
A B C D
7 Cu2+能与NH3形成具有对称空间结构的[Cu(NH3)4]2+。若[Cu(NH3)4]2+中2个NH3分别被Cl-取代,能得到2种不同结构的Cu(NH3)2Cl2(如图)。则[Cu(NH3)4]2+、NH3的空间结构分别是( )
(m) (n)
A. 正四面体形、三角锥形 B. 平面正方形、三角锥形
C. 正四面体形、平面三角形 D. 平面正方形、平面三角形
8 白磷(P4)是四原子分子,六氧化四磷(P4O6)是磷的氧化物,二者的空间结构如图。下列说法错误的是( )
A. 白磷分子中的化学键是σ键
B. P4O6分子中含有的共价键的数目是12
C. P4O6分子中4个P原子构成正四面体,6个O原子构成正八面体 P4 P4O6
D. 白磷分子中的键角是90°
9 X射线衍射法可以测定某些分子的结构,下列分子结构模型错误的是( )
A B C D
NH3 SO2 CO2 CH4
三角锥形 V形 直线形 平面正方形
10 环己烷有多种不同构象,其中椅式、半椅式、船式、扭船式较为典型。各构象的相对能量图(位能)如图所示。下列说法正确的是( )
椅式C6H12 船式C6H12
A. 相同条件下船式最稳定
B. C6H12(椅式)的摩尔燃烧焓ΔH大于C6H12(船式)
C. 船式和椅式结构的环己烷互为同素异形体
D. 扭船式结构转化为椅式结构吸收能量
11 SF6分子中的6个F原子构成的空间结构为正八面体(如图),则SF6分子中含有σ键的数目及SF6二氯代物种数分别是( )
A. 6、2 B. 6、4
C. 14、2 D. 14、4
12 观察下列模型并结合表中有关信息判断,下列有关说法正确的是( )
B结构单元 P4分子 S8 HCN
结构模型示意图
备注 熔点2 300 ℃ — 易溶于CS2 —
A. 键能:B—B>C—C B. P4分子中P—P的数目为6
C. 固态硫S8由S构成 D. HCN的结构式为
13 (南京调研)(1) 硫化氢(H2S)分子中,两个H—S的夹角接近90°,说明H2S分子的空间结构为________。
(2) 二硫化碳(CS2)分子中,两个C===S的夹角是180°,说明CS2分子的空间结构为___________________。
(3) 下列能说明CH4分子不是平面四边形,而是正四面体结构的是________(填字母)。
a. 两个键之间的夹角为109°28′
b. C—H为极性共价键
c. 4个C—H的键能、键长都相等
d. 二氯甲烷(CH2Cl2)只有一种(不存在同分异构体)
14 (2024无锡江阴期末)有机化合物苯佐卡因是一种医用常见麻醉剂,可用于小面积轻度创面的镇痛。
(1) 苯佐卡因的质谱图如图1所示,则苯佐卡因的相对分子质量为________。
图1 图2
(2) 苯佐卡因的分子式为C9H11NO2,红外光谱如图2所示,且该物质的核磁共振氢谱有5个峰,其面积之比为3∶2∶2∶2∶2,则该物质的结构简式为__________。
课时2 分子空间结构的理论解释
1 下列微粒中,中心原子含有孤电子对的是( )
A. SiH4 B. H2O C. CH4 D. NH
2 (2025无锡开学考)下列分子或离子中采用sp3杂化,但是V形结构的是( )
A. NH3 B. H2S C. BeCl2 D. NO
3 (2025扬州阶段检测)根据价层电子对互斥模型,判断下列分子或离子的空间结构正确的是( )
编号 分子式 价层电子对互斥模型 分子或离子的空间结构
① NCl3 四面体形 三角锥形
② HCHO 平面三角形 三角锥形
③ SO2 平面三角形 平面三角形
④ NH 正四面体形 正四面体形
A. ①② B. ①④ C. ②④ D. ②③
4 (长春外国语学校期末)下列说法正确的是( )
A. NCl3分子呈平面三角形,这与氮原子采取sp2杂化密切相关
B. sp3杂化轨道是由中心原子的任意1个s轨道和3个p轨道混合形成的4个sp3杂化轨道
C. 中心原子采取sp3杂化的分子,其空间结构可能是四面体形或三角锥形或V形
D. AB3型分子的空间结构一定是平面三角形
5 (2025泰州开学考)下列化学用语或图示表达正确的是( )
A. H2S分子的球棍模型:
B. NH3的VSEPR模型:
C. 基态24Cr原子价层电子轨道表示式:
D. 2pz电子云轮廓图:
6 下列说法正确的是( )
A. NO2、BF3、NCl3中,没有一个分子中的原子的最外电子层都满足8电子稳定结构
B. SO2的VSEPR模型与分子的空间结构相同
C. NH呈平面正方形结构
D. NH3分子中有一对未成键的孤电子,它对成键电子对的排斥作用较强
7 (2025连云港阶段检测)氯元素具有多种化合价,可形成Cl-、Cl2、ClO、ClO2、ClO和ClO等多种粒子。下列关于含氯微粒的说法正确的是( )
A. ClO中心原子轨道杂化类型为sp3 B. ClO2为非极性分子
C. ClO的键角为120° D. ClO的空间结构为直线形
8 氨基氰(CH2N2)中C、N原子均满足8电子稳定结构,福州大学王新晨教授以其为原料制得类石墨相氮化碳(gC3N4),其单层结构如图所示。下列说法错误的是( )
A. 氨基氰的结构式:
B. 氮化碳的单层结构中,所有原子可能共平面
C. 氨基氰易溶于水,氮化碳能导电
D. 氨基氰和氮化碳中,N原子杂化方式均为sp2和sp3
9 已知P4的结构如图,P4在KOH浓溶液中可发生反应:P4+3KOH+3H2O3KH2PO2+PH3↑,设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 产物PH3分子中所有的原子可能共平面
B. 31 g P4含有1.5NA个P—P
C. 相关元素的电负性大小顺序:P>O>H>K
D. P4中P原子为sp2杂化
10 某有机物由H、C、O三种元素组成,其球棍模型结构如图所示,下列关于该有机物的叙述正确的是( )
A. 该有机物中发生sp2杂化的碳原子有7个
B. 该有机物不含sp2杂化的碳原子
C. 分子中含有5个π键
D. 所有碳原子可能在同一个平面上
11 已知在CH4分子中,C—H间的键角为109°28′,NH3分子中,N—H间的键角为107°,H2O分子中,O—H间的键角为105°,下列说法正确的是( )
A. 孤电子对与成键电子对间的斥力大于成键电子对与成键电子对间的斥力
B. 孤电子对与成键电子对间的斥力小于成键电子对与成键电子对间的斥力
C. 孤电子对与成键电子对间的斥力等于成键电子对与成键电子对间的斥力
D. 题干中的数据不能说明孤电子对与成键电子对间的斥力和成键电子对与成键电子对间的斥力之间的大小关系
12 根据价层电子对互斥模型填空。
(1) OF2中,中心原子上的σ键电子对数为________,孤电子对数为________,价层电子对数为________,中心原子的杂化方式为__________杂化,VSEPR模型为____________,分子的空间结构为____________。
(2) BF3分子中,中心原子上的σ键电子对数为________,孤电子对数为________,价层电子对数为________,中心原子的杂化方式为________杂化,VSEPR模型为____________,分子的空间结构为____________。
(3) SO中,中心原子上的σ键电子对数为________,孤电子对数为________,价层电子对数为________,中心原子的杂化方式为________杂化,VSEPR模型为____________,分子的空间结构为____________。
13 回答下列问题。
(1) 图1为S8的结构,其硫原子的杂化轨道类型为____________。
图1 图2 图3
(2) 气态三氧化硫以单分子形式存在,其分子的空间结构为______________;固体三氧化硫中存在如图2所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(3) COCl2分子中所有原子均满足8电子结构,COCl2分子中σ键和π键的个数之比为________,中心原子的杂化轨道类型为____________。
(4) As4O6的分子结构如图3所示,其中As原子的杂化轨道类型为________。
(5) AlH中,Al原子的杂化轨道类型为________。
(6) 在空气中灼烧Ag2S生成Ag和SO2,SO2的键角________(填“>”“<”或“=”)H2O的键角。
(7) 以CO2为原料催化加氢可以制备CH4、CH3OH、C2H4等有机物,ZnO/ZrO2为我国科学家发明的二氧化碳加氢的一种催化剂。
①基态Zn原子的轨道表示式为____________________________,其核外电子运动状态有________种。
②碳元素除了可以形成CO、CO2还可以形成C2O3(结构式为)。C2O3中碳原子的杂化轨道类型为________。CO分子中σ键和π键个数比为________。
第二节 分子的空间结构
课时1 多样的分子空间结构
1. C
2. D 不同元素原子的吸收光谱或发射光谱不同,利用原子光谱上的特征谱线来鉴定元素,称为光谱分析,A正确;X射线衍射是测定微观结构的方法,可以测得乙酸晶体每个晶胞中含有4个乙酸分子,B正确;红外光谱可以测定未知物中所含各种化学键或官能团,以此判断物质的结构,C正确;质谱仪是通过分析最大的碎片离子测出分子的相对质量,D错误。
3. A 由图1可知,有机物A的相对分子质量为46,由图2可知,有机物A的核磁共振氢谱中有3组峰,含有三类氢原子,则CH3CH2OH符合题意,故选A。
4. C 过氧基是化学键,需要用红外光谱测定,核磁共振氢谱测的是氢原子种数和个数比,C错误。
5. D 由球棍模型知,H2O分子的空间结构名称为V形,D错误。
6. B SiF4的键角为109°28′,说明其空间结构与CH4相似,为正四面体形。故选B。
7. B NH3的空间填充模型为 ,则其空间结构为三角锥形,C、D错误;[Cu(NH3)4]2+中2个NH3分别被Cl-取代,能得到2种不同结构的Cu(NH3)2Cl2,说明[Cu(NH3)4]2+的空间结构为平面正方形,A错误。故选B。
8. D 白磷是正四面体形分子,每个面都是正三角形,故白磷分子中的键角是60°,D错误。
9. D CH4的空间填充模型为 ,球棍模型为 ,则其空间结构为正四面体形,D错误。
10. B 能量越低越稳定,则相同条件下椅式最稳定,A错误;由图可知,船式C6H12的位能高于椅式C6H12,等物质的量时,船式C6H12完全燃烧放热多,但ΔH是负值,放热越多,摩尔燃烧焓ΔH越小,故C6H12(椅式)的摩尔燃烧焓ΔH大于C6H12(船式),B正确;同素异形体的研究对象是单质,C错误;由图可知,扭船式C6H12的位能高于椅式C6H12,则扭船式结构转化为椅式结构需要释放能量,D错误。
11. A SF6分子的球棍模型为 ,则SF6分子中含有的S—F的数目为6;SF6为正八面体形分子,则 2个氯原子可以位于相邻的顶点或相对的顶点,二氯代物种数为2。故选A。
12. B 原子半径B>C,故键长B—B>C—C,键长越长,键能越小,故键能B—B
14. (1) 165 (2)
课时2 分子空间结构的理论解释
1. B
2. B 氨气分子的中心原子N的价层电子对数=3+×(5-3×1)=3+1=4,采用sp3杂化,有1个孤电子对,空间结构为三角锥形,A错误;硫化氢分子的中心原子S的价层电子对数=2+×(6-2×1)=2+2=4,采用sp3杂化,有2个孤电子对,空间结构为V形,B正确;二氯化铍分子的中心原子Be的价层电子对数=2+×(2-2×1)=2,采用sp杂化,空间结构为直线形,C错误;硝酸根中心原子N的价层电子对数=3+×(5+1-2×3)=3,采用sp2杂化,空间结构为平面三角形,D错误。
3. B NCl3分子中中心N原子的价层电子对数为4,价层电子对互斥模型为四面体形,含有1个孤电子对,分子的空间结构为三角锥形,①正确;甲醛(HCHO)分子中中心C原子的价层电子对数为3(有1个双键),价层电子对互斥模型为平面三角形,没有孤电子对,分子的空间结构为平面三角形,②错误;SO2分子中心原子S的价层电子对数3,含有1个孤电子对,价层电子对互斥模型为平面三角形,分子的空间结构为V形,③错误;NH中中心N原子的价层电子对数为4,价层电子对互斥模型为正四面体形,没有孤电子对,离子的空间结构为正四面体形,④正确。
4. C
5. D H2S分子的空间结构是V形,其球棍模型为,A错误;NH3价层电子对数=3+×(5-3×1)=4,有1个孤电子对,VSEPR模型为四面体形,即,B错误; 基态24Cr原子价层电子排布式为3d54s1,则其轨道表示式为,C错误;已知p能级上的电子云轮廓图即原子轨道为三个垂直的呈哑铃形的轨道,故2pz电子云轮廓图为,D正确。
6. D
7. A ClO中心原子价层电子对数为4+×(7+1-4×2)=4,中心原子轨道杂化类型为sp3,A正确;ClO2为V形结构,正负电荷中心不重合,为极性分子,B错误;ClO中心原子价层电子对数为3+×(7+1-3×2)=4,且含有1个孤电子对,空间结构为三角锥形,键角小于120°,C错误;ClO中心原子价层电子对数为2+×(7+1-2×2)=4,且含有2个孤电子对,空间结构为V形,D错误。
8. D 氨基氰(CH2N2)中C、N原子均满足8电子稳定结构,N原子形成3个共价键、C原子形成4个共价键,则该分子的结构式为,A正确;类比石墨结构可知,氮化碳的单层结构中,所有原子可能共平面,B正确;氨基氰易与水形成氢键,则易溶于水,类比石墨能导电,则氮化碳也能导电,C正确;氨基氰的结构式为,碳氮三键中N原子采取sp杂化、氨基中N原子采取sp3杂化,D错误。
9. B PH3中P原子的价层电子对数为4,分子空间结构为三角锥形,所有原子不可能共平面,A错误;1 mol P4中含6 mol P—P,31 g P4的物质的量为0.25 mol,含P—P数目为1.5NA,B正确;同周期从左往右电负性逐渐增强,同主族从上往下电负性减弱,故电负性O>P>H>K,C错误;根据P4的空间结构,P4中P原子为sp3杂化,D错误。
10. D 11. A
12. (1) 2 2 4 sp3 四面体形 V形
(2) 3 0 3 sp2 平面三角形 平面三角形
(3) 4 0 4 sp3 正四面体形 正四面体形
13. (1) sp3 (2) 平面三角形 sp3 (3) 3∶1 sp2
(4) sp3 (5) sp3 (6) >
(7) ① 30 ②sp2 1∶2
解析:(6) SO2含有的孤电子对数==1,为sp2杂化,分子空间结构为V形,H2O含有的孤电子对数==2,为sp3杂化,分子空间结构为V形,水分子中O原子含有2个孤电子对,故键角SO2>H2O。(7) ①Zn是30号元素,价电子排布式为3d104s2,轨道表示式为,有多少个电子就有多少种运动状态,故其核外电子运动状态有30种。②根据C2O3结构式可知,C2O3中碳原子形成一个碳氧双键,杂化轨道类型为sp2,CO和N2互为等电子体,从键的形成结构看,其中1个是σ键,2个是π键,则σ键和π键个数之比为1∶2。
