人教版高中化学选修4 第三章:水溶液中的离子平衡 复习课件 (共22张PPT)
文档属性
| 名称 | 人教版高中化学选修4 第三章:水溶液中的离子平衡 复习课件 (共22张PPT) | 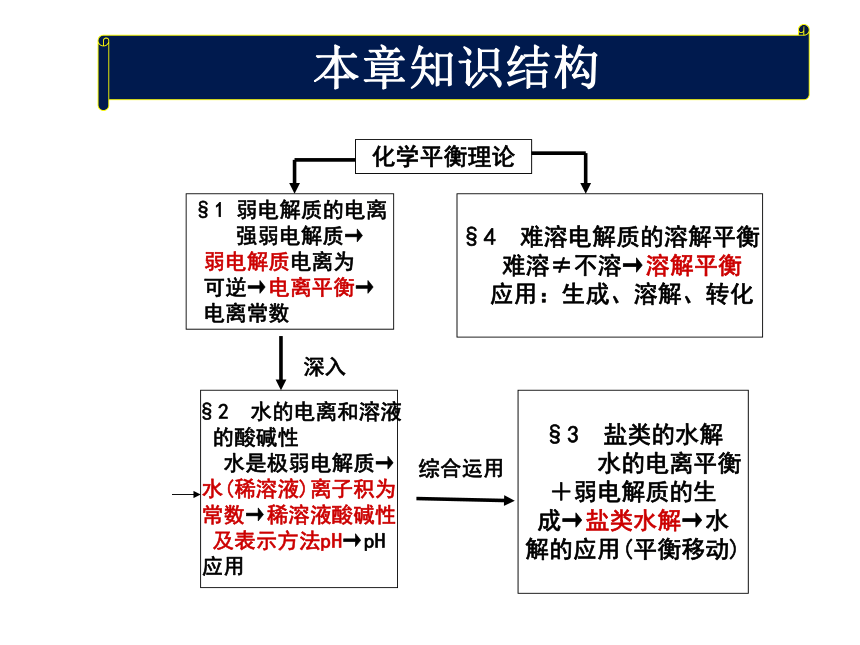 | |
| 格式 | zip | ||
| 文件大小 | 205.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-08 00:18:30 | ||
图片预览






文档简介
课件22张PPT。化学平衡理论§1 弱电解质的电离
强弱电解质→
弱电解质电离为
可逆→电离平衡→
电离常数 §4 难溶电解质的溶解平衡
难溶≠不溶→溶解平衡
应用:生成、溶解、转化 §2 水的电离和溶液
的酸碱性
水是极弱电解质→
水(稀溶液)离子积为
常数→稀溶液酸碱性
及表示方法pH→pH
应用 §3 盐类的水解
水的电离平衡
+弱电解质的生
成→盐类水解→水
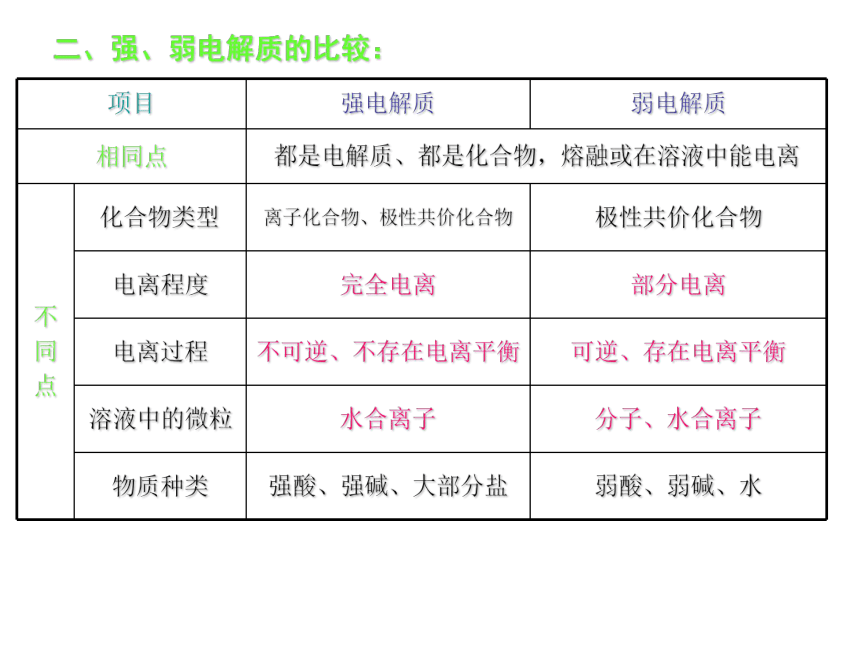
解的应用(平衡移动)深入综合运用本章知识结构一、电解质、非电解质二、强、弱电解质的比较:第三章重要知识点第二节
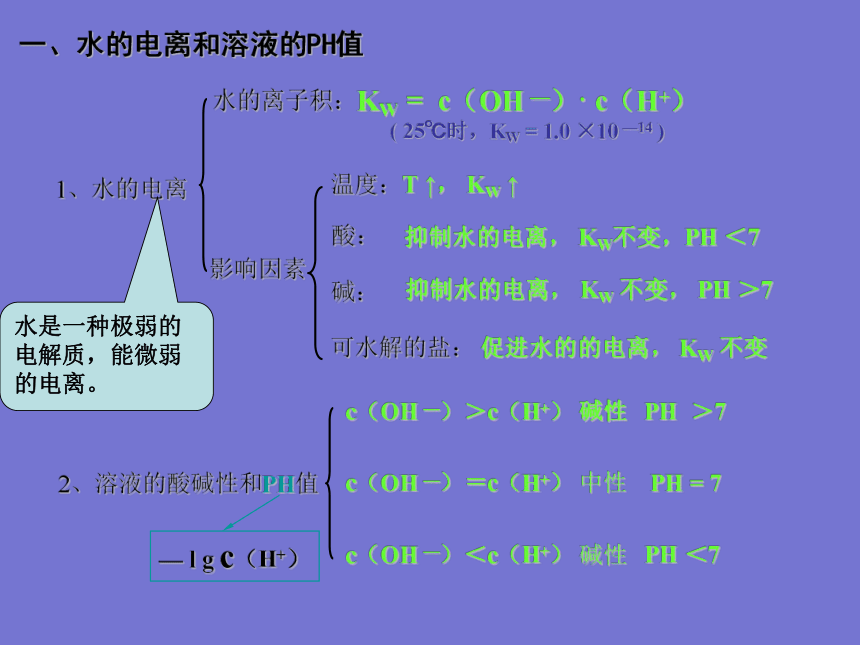
1、水的离子积常数Kw。
2、影响水的电离平衡的因素。
3、有关PH值的简单计算。
4、中和滴定。一、水的电离和溶液的PH值1、水的电离水的离子积:影响因素KW = c(OH —)· c(H+)
( 25℃时,KW = 1.0 ×10 —14 )2、溶液的酸碱性和PH值水是一种极弱的电解质,能微弱的电离。
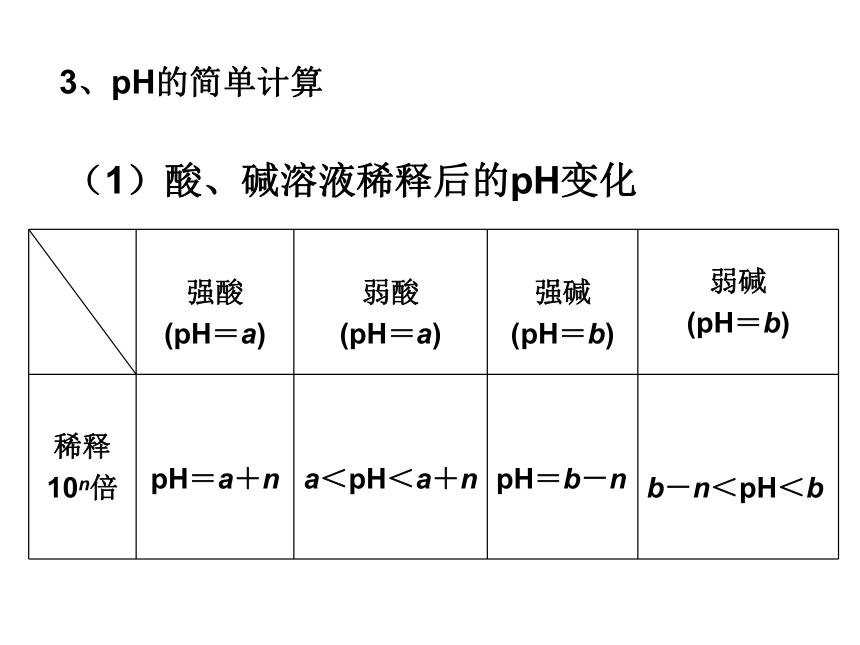
(1)酸、碱溶液稀释后的pH变化3、pH的简单计算特别提醒
①“无限稀释7为限”,无论稀释多大倍数,酸溶液不显碱性,碱溶液不显酸性,无限稀释时,溶液pH接近于7。
②c(H+)与c(OH-)的相对大小是判定溶液酸碱性的唯一标准,而根据溶液pH与7的相对大小来判断时,要看溶液的温度是否是常温(25 ℃)。(2).同强相混混合算
a.强酸与强酸混合求pH
b.强碱与强碱混合求pHC.酸过量:
先求c(H+)余=
再求pH=-lg[c(H+)余]。
D.碱过量:
先求c(OH-)余=
再求c(H+)= ,然后求pH。
3、中和滴定实验1)查漏(用自来水)
滴定管是否漏水、旋塞转动是否灵活
2)洗涤
滴定管:先用自来水冲洗→再用蒸馏水清洗2~3次→然后用待装液润洗
锥形瓶:自来水冲洗→蒸馏水清洗2~3次(不能用待盛液润洗)3)装液[滴定管中加入液体的操作] 量取一定体积未知浓度待测液于锥形瓶操作:向滴定管中装液→挤气泡→调液面→记下起始读数→放液→记录终点读数→滴入指示剂
滴定管中装入标准液→挤气泡→调液面→记下起始读数
4)滴定
右手持锥形瓶颈部,向同一方向作圆周运动,而不是前后振动
. 左手控制活塞(或玻璃球)
滴加速度先快后慢
视线注视锥形瓶中颜色变化
.滴定终点达到后,半分钟颜色不变,再读数
.复滴2~3次
四、中和滴定指示剂的选择及误差分析“恰好完全中和”与“溶液呈中性”两句话的区别恰好完全中和,PH﹤7溶液呈中性,碱肯定过量HCl + NH3·H2O = NH4Cl + H2O1mol 1mol 1mol第三章重要知识点第三节
1、盐类水解的本质
2、水解方程式书写
3、影响水解平衡移动的因素
4、溶液中粒子浓度大小的比较
一、盐类水解1、实质:2、规律:3、影响因素谁弱谁水解,都弱都水解,谁强显谁性,两弱具体定。盐电离出来的离子与水电离出来的H + 或OH — 结合,从而使
水的电离平衡发生移动的过程。①混施化肥(N、P、K三元素不能变成↑和↓)
②泡沫灭火剂(用硫酸铝和小苏打为原料,双水解)
③FeCl3溶液止血剂(血浆为胶体,电解质溶液使胶体凝聚)
④明矾净水(Al3+水解成氢氧化铝胶体,胶体具有很大的表面积,吸附水中悬浮物而聚沉)
⑥判断溶液酸碱性(强者显性)
⑦比较盐溶液离子浓度的大小
⑧判断离子共存(双水解的离子产生沉淀和气体的不能大量共存)
⑨配制盐溶液(加对应的酸防止水解)4、溶液中粒子浓度大小的比较⑴.多元弱酸溶液,根据多步电离分析,如H3PO4溶液中,c (H+) > c (H2PO4-) > c (HPO4 2-) > c (PO4 3-)。
⑵.多元弱酸的正盐溶液根据弱酸根的分步水解分析,如在Na2CO3溶液中,
c (Na+) > c (CO3 2-) > c (OH-) > c (HCO3 -)。
⑶.不同溶液中同一离子浓度的比较,要看溶液中其他离子对它的影响。如在相同物质的量浓度的下列各溶液中①NH4Cl ②CH3COONH4 ③NH4HSO4 , c (NH4+)由大到小的顺序是③>①>②
⑷.混合溶液中各离子浓度的比较,要进行综合分析,如电离因素、水解因素等。其方法思路是:首先确定溶液中电解质的种类然后再分析电解质电离程度和盐类水解程度的大小。当遇到弱酸与其强碱盐共存时,或者多元弱酸酸式盐(H2PO4- 、 HCO3 -),要注意考虑电离与水解程度的相对大小。5、溶液中的守恒关系⑴、电荷守恒规律:
电解质溶液中,不论存在多少种离子,溶液总是呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数,也就是所谓的电荷守恒规律。如NaHCO3溶液中存在着Na+、H+、 HCO3 -、 CO3 2- 、OH-,但存在如下关系:
c (Na+) + c (H+) = c (HCO3 -) +c (OH-) + 2c (CO3 2-)⑵、物料守恒规律:
电解质溶液中,由于某些离子能够水解或电离,离子种类增多了,但某些关键性的原子总是守恒的,如Na2S溶液中,S2-能水解,故S元素以S2-、HS-、H2S三种形式存在,它们之间有如下守恒关系:
c (Na+) = 2[c (S2-) + c (HS-) + c (H2S)]⑶、质子守恒规律:
任何溶液中,由水电离产生的c (H+)=c (OH-)
在电解质溶液中,由于某些离子发生水解,结合了水电离出来的H+或OH-;
使溶液中c (H+)≠c (OH-),但由水电离产生的H+或OH-守恒;如Na2S溶液中,S2-离子能结合H+ 促进水解,所以溶液中:
c (H+)<c (OH-),此时:c (OH-)H 2O =c (OH-)
c (H+) H 2O =c (H+)+ c (HS-) + 2c (H2S),
故c (OH-)=c (H+)+ c (HS-) + 2c (H2S),第三章重要知识点第四节
1、难溶电解质的溶解平衡
2、沉淀反应的应用
3、溶度积和溶度积规则
1、沉淀溶解平衡:
(1)概念:在一定条件下,当难溶电解质的溶解速率与溶液中的有关离子或分子重新生成沉淀的速率相等时,此时溶液中存在的溶解和沉淀间的动态平衡,称为沉淀溶解平衡。溶解平衡时的溶液是饱和溶液。
(2)特征:逆、等、动、定、变
(3)影响因素: ①内因:电解质本身的性质 a、绝对不溶的电解质是没有的。
b、同是难溶电解质,溶解度差别也很大。
c、易溶电解质做溶质时只要是饱和溶液也可存在溶解平衡。②外因: a.浓度:加水,平衡向溶解方向移动。
b.温度:升温,多数平衡向溶解方向移动。
c.同离子效应:在电解质A的饱和溶液中,加 入含有相同离 子的强电解质时,A的溶解平衡会被抑制。2.溶度积和溶度积规则:(1)、溶度积(Ksp):在一定温度下,在难溶电解质的饱和溶液中,各离子浓度
幂之乘积为一常数.3、沉淀反应的应用:(2)、表达式:(MmAn的饱和溶液) Ksp=[c(Mn+)]m · [c(Am-)]n(3)、溶度积规则:离子积Qc=c(Mn+)m · c(Am-)n
Qc > Ksp,溶液处于过饱和溶液状态,生成沉淀.
Qc = Ksp,沉淀和溶解达到平衡,溶液为饱和溶液.
Qc < Ksp,溶液未达饱和,沉淀发生溶解.(1)、沉淀的生成:反应生成沉淀使溶液中某些离子浓度变得更小。(2)、沉淀的溶解:(3)、沉淀的转化:溶解度小的沉淀转化为溶解度更小的沉淀。两者差别越大,转化越容易。这类反应发生的特点:难溶电解质的溶解度小于0.01g,离子反应生成难溶电解质,离子浓度小于1×10-5mol/L时,认为反应完全,但溶液中还有相应的离子。沉淀的转化的实质就是沉淀溶解平衡的移 动
强弱电解质→
弱电解质电离为
可逆→电离平衡→
电离常数 §4 难溶电解质的溶解平衡
难溶≠不溶→溶解平衡
应用:生成、溶解、转化 §2 水的电离和溶液
的酸碱性
水是极弱电解质→
水(稀溶液)离子积为
常数→稀溶液酸碱性
及表示方法pH→pH
应用 §3 盐类的水解
水的电离平衡
+弱电解质的生
成→盐类水解→水
解的应用(平衡移动)深入综合运用本章知识结构一、电解质、非电解质二、强、弱电解质的比较:第三章重要知识点第二节
1、水的离子积常数Kw。
2、影响水的电离平衡的因素。
3、有关PH值的简单计算。
4、中和滴定。一、水的电离和溶液的PH值1、水的电离水的离子积:影响因素KW = c(OH —)· c(H+)
( 25℃时,KW = 1.0 ×10 —14 )2、溶液的酸碱性和PH值水是一种极弱的电解质,能微弱的电离。
(1)酸、碱溶液稀释后的pH变化3、pH的简单计算特别提醒
①“无限稀释7为限”,无论稀释多大倍数,酸溶液不显碱性,碱溶液不显酸性,无限稀释时,溶液pH接近于7。
②c(H+)与c(OH-)的相对大小是判定溶液酸碱性的唯一标准,而根据溶液pH与7的相对大小来判断时,要看溶液的温度是否是常温(25 ℃)。(2).同强相混混合算
a.强酸与强酸混合求pH
b.强碱与强碱混合求pHC.酸过量:
先求c(H+)余=
再求pH=-lg[c(H+)余]。
D.碱过量:
先求c(OH-)余=
再求c(H+)= ,然后求pH。
3、中和滴定实验1)查漏(用自来水)
滴定管是否漏水、旋塞转动是否灵活
2)洗涤
滴定管:先用自来水冲洗→再用蒸馏水清洗2~3次→然后用待装液润洗
锥形瓶:自来水冲洗→蒸馏水清洗2~3次(不能用待盛液润洗)3)装液[滴定管中加入液体的操作] 量取一定体积未知浓度待测液于锥形瓶操作:向滴定管中装液→挤气泡→调液面→记下起始读数→放液→记录终点读数→滴入指示剂
滴定管中装入标准液→挤气泡→调液面→记下起始读数
4)滴定
右手持锥形瓶颈部,向同一方向作圆周运动,而不是前后振动
. 左手控制活塞(或玻璃球)
滴加速度先快后慢
视线注视锥形瓶中颜色变化
.滴定终点达到后,半分钟颜色不变,再读数
.复滴2~3次
四、中和滴定指示剂的选择及误差分析“恰好完全中和”与“溶液呈中性”两句话的区别恰好完全中和,PH﹤7溶液呈中性,碱肯定过量HCl + NH3·H2O = NH4Cl + H2O1mol 1mol 1mol第三章重要知识点第三节
1、盐类水解的本质
2、水解方程式书写
3、影响水解平衡移动的因素
4、溶液中粒子浓度大小的比较
一、盐类水解1、实质:2、规律:3、影响因素谁弱谁水解,都弱都水解,谁强显谁性,两弱具体定。盐电离出来的离子与水电离出来的H + 或OH — 结合,从而使
水的电离平衡发生移动的过程。①混施化肥(N、P、K三元素不能变成↑和↓)
②泡沫灭火剂(用硫酸铝和小苏打为原料,双水解)
③FeCl3溶液止血剂(血浆为胶体,电解质溶液使胶体凝聚)
④明矾净水(Al3+水解成氢氧化铝胶体,胶体具有很大的表面积,吸附水中悬浮物而聚沉)
⑥判断溶液酸碱性(强者显性)
⑦比较盐溶液离子浓度的大小
⑧判断离子共存(双水解的离子产生沉淀和气体的不能大量共存)
⑨配制盐溶液(加对应的酸防止水解)4、溶液中粒子浓度大小的比较⑴.多元弱酸溶液,根据多步电离分析,如H3PO4溶液中,c (H+) > c (H2PO4-) > c (HPO4 2-) > c (PO4 3-)。
⑵.多元弱酸的正盐溶液根据弱酸根的分步水解分析,如在Na2CO3溶液中,
c (Na+) > c (CO3 2-) > c (OH-) > c (HCO3 -)。
⑶.不同溶液中同一离子浓度的比较,要看溶液中其他离子对它的影响。如在相同物质的量浓度的下列各溶液中①NH4Cl ②CH3COONH4 ③NH4HSO4 , c (NH4+)由大到小的顺序是③>①>②
⑷.混合溶液中各离子浓度的比较,要进行综合分析,如电离因素、水解因素等。其方法思路是:首先确定溶液中电解质的种类然后再分析电解质电离程度和盐类水解程度的大小。当遇到弱酸与其强碱盐共存时,或者多元弱酸酸式盐(H2PO4- 、 HCO3 -),要注意考虑电离与水解程度的相对大小。5、溶液中的守恒关系⑴、电荷守恒规律:
电解质溶液中,不论存在多少种离子,溶液总是呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数,也就是所谓的电荷守恒规律。如NaHCO3溶液中存在着Na+、H+、 HCO3 -、 CO3 2- 、OH-,但存在如下关系:
c (Na+) + c (H+) = c (HCO3 -) +c (OH-) + 2c (CO3 2-)⑵、物料守恒规律:
电解质溶液中,由于某些离子能够水解或电离,离子种类增多了,但某些关键性的原子总是守恒的,如Na2S溶液中,S2-能水解,故S元素以S2-、HS-、H2S三种形式存在,它们之间有如下守恒关系:
c (Na+) = 2[c (S2-) + c (HS-) + c (H2S)]⑶、质子守恒规律:
任何溶液中,由水电离产生的c (H+)=c (OH-)
在电解质溶液中,由于某些离子发生水解,结合了水电离出来的H+或OH-;
使溶液中c (H+)≠c (OH-),但由水电离产生的H+或OH-守恒;如Na2S溶液中,S2-离子能结合H+ 促进水解,所以溶液中:
c (H+)<c (OH-),此时:c (OH-)H 2O =c (OH-)
c (H+) H 2O =c (H+)+ c (HS-) + 2c (H2S),
故c (OH-)=c (H+)+ c (HS-) + 2c (H2S),第三章重要知识点第四节
1、难溶电解质的溶解平衡
2、沉淀反应的应用
3、溶度积和溶度积规则
1、沉淀溶解平衡:
(1)概念:在一定条件下,当难溶电解质的溶解速率与溶液中的有关离子或分子重新生成沉淀的速率相等时,此时溶液中存在的溶解和沉淀间的动态平衡,称为沉淀溶解平衡。溶解平衡时的溶液是饱和溶液。
(2)特征:逆、等、动、定、变
(3)影响因素: ①内因:电解质本身的性质 a、绝对不溶的电解质是没有的。
b、同是难溶电解质,溶解度差别也很大。
c、易溶电解质做溶质时只要是饱和溶液也可存在溶解平衡。②外因: a.浓度:加水,平衡向溶解方向移动。
b.温度:升温,多数平衡向溶解方向移动。
c.同离子效应:在电解质A的饱和溶液中,加 入含有相同离 子的强电解质时,A的溶解平衡会被抑制。2.溶度积和溶度积规则:(1)、溶度积(Ksp):在一定温度下,在难溶电解质的饱和溶液中,各离子浓度
幂之乘积为一常数.3、沉淀反应的应用:(2)、表达式:(MmAn的饱和溶液) Ksp=[c(Mn+)]m · [c(Am-)]n(3)、溶度积规则:离子积Qc=c(Mn+)m · c(Am-)n
Qc > Ksp,溶液处于过饱和溶液状态,生成沉淀.
Qc = Ksp,沉淀和溶解达到平衡,溶液为饱和溶液.
Qc < Ksp,溶液未达饱和,沉淀发生溶解.(1)、沉淀的生成:反应生成沉淀使溶液中某些离子浓度变得更小。(2)、沉淀的溶解:(3)、沉淀的转化:溶解度小的沉淀转化为溶解度更小的沉淀。两者差别越大,转化越容易。这类反应发生的特点:难溶电解质的溶解度小于0.01g,离子反应生成难溶电解质,离子浓度小于1×10-5mol/L时,认为反应完全,但溶液中还有相应的离子。沉淀的转化的实质就是沉淀溶解平衡的移 动
