人教版高中化学选修4 第四章:电化学基础(复习课件) (共25张PPT)
文档属性
| 名称 | 人教版高中化学选修4 第四章:电化学基础(复习课件) (共25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 305.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-08 00:19:26 | ||
图片预览




文档简介
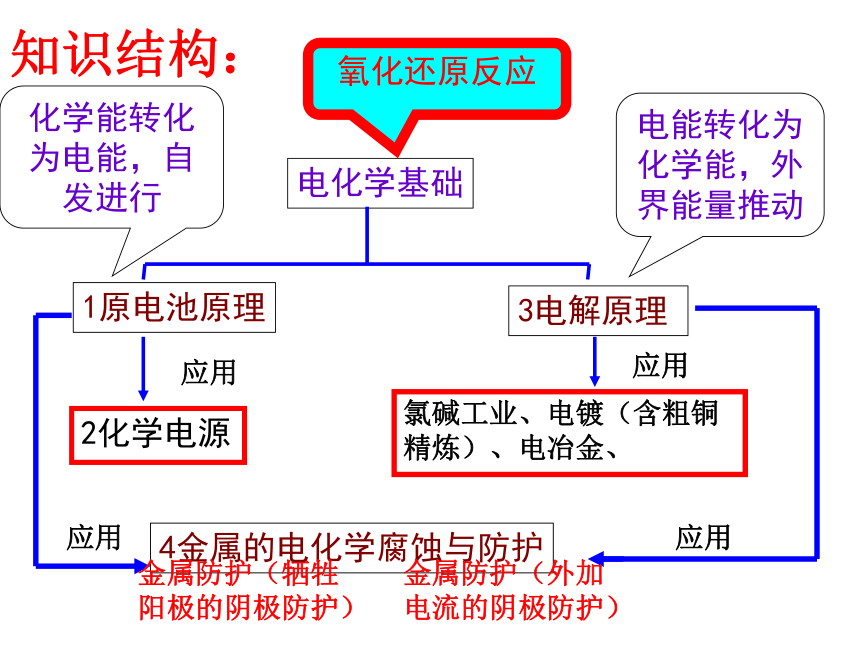
课件25张PPT。电化学基础第四章 复习1原电池原理2化学电源4金属的电化学腐蚀与防护电化学基础3电解原理氧化还原反应化学能转化为电能,自发进行电能转化为化学能,外界能量推动知识结构:氯碱工业、电镀(含粗铜精炼)、电冶金、金属防护(外加
电流的阴极防护)金属防护(牺牲
阳极的阴极防护)要解决的问题:思考后自由回答
1. 原电池的工作原理及构成条件?
2. 原电池电极如何判断?
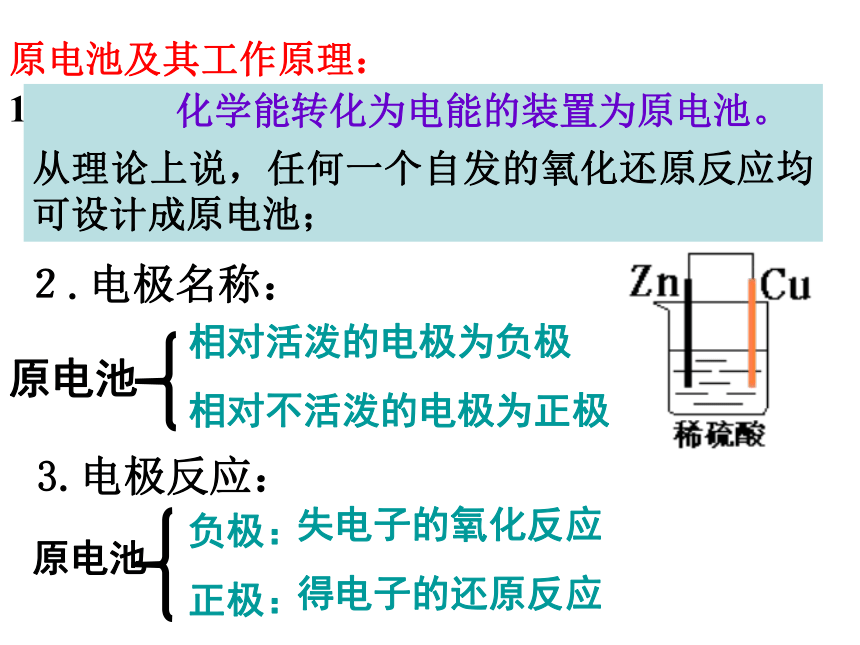
一、原电池原理提示可由电子(流)的流向、反应类型、电解质溶液中离子的移向等方面判断。原电池及其工作原理:1.定义: 化学能转化为电能的装置为原电池。
从理论上说,任何一个自发的氧化还原反应均可设计成原电池;2.电极名称:相对活泼的电极为负极
相对不活泼的电极为正极3.电极反应:负极:
正极:失电子的氧化反应
得电子的还原反应4. 原电池的形成条件(4)形成闭合回路。
(两电极用导线连接,或接触。)(1)能自发地发生的氧化还原反应:
①电极和电解质溶液
②两电极上分别有还原剂和氧化剂(燃料电池)(2)电解质溶液:
参与电极反应或构成内电路(3)两导体作电极:
①活动性不同的金属(或一种金属和一种非金属导
体石墨),与电解质溶液反应的活泼金属为负极。
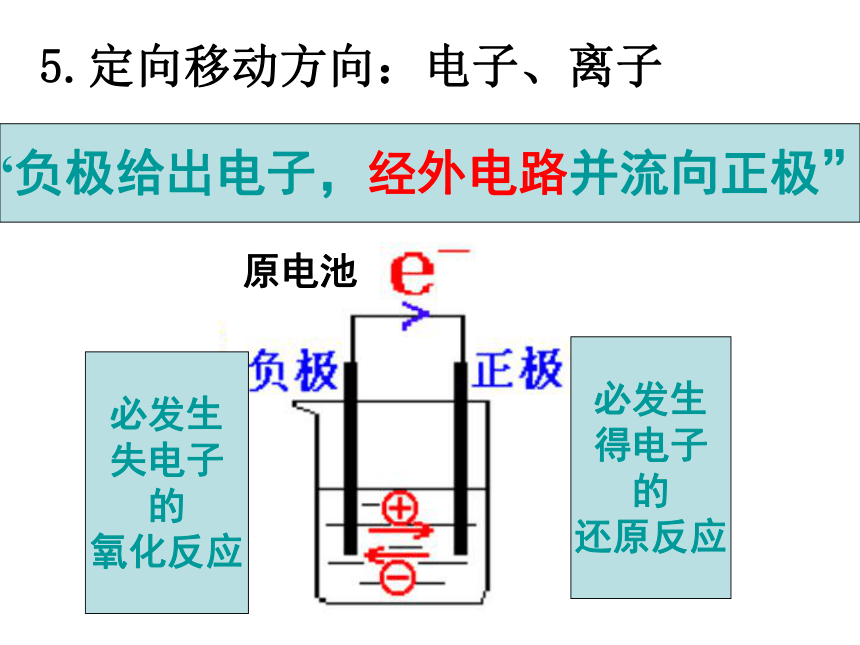
②两不活泼的导体-石墨或Pt等。(燃料电池电极)5.定向移动方向:电子、离子原电池“负极给出电子,经外电路并流向正极”必发生
失电子
的
氧化反应必发生
得电子
的
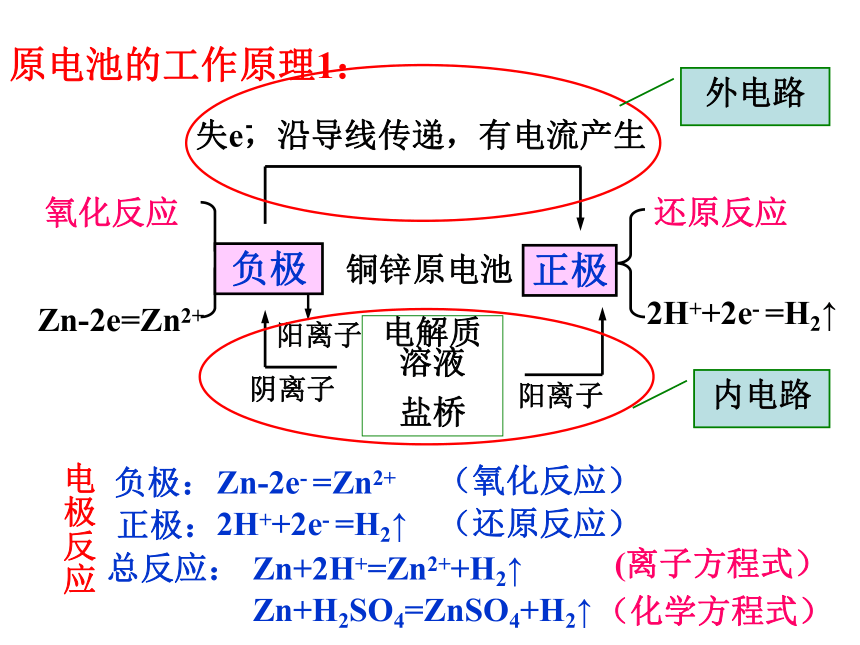
还原反应氧化反应Zn-2e=Zn2+ 铜锌原电池电解质溶液
盐桥失e,沿导线传递,有电流产生还原反应2H++2e- =H2↑阴离子阳离子总反应:负极正极 2H++2e- =H2↑Zn-2e- =Zn2+Zn+2H+=Zn2++H2↑Zn+H2SO4=ZnSO4+H2↑(离子方程式)(化学方程式)电极反应正极:负极:(氧化反应)(还原反应)阳离子外电路内电路原电池的工作原理1:-(2)盐桥的作用是什么?
(双液)原电池的工作原理2(有关概念)(1)盐桥中装有饱和的KCl溶液和琼脂制成的
胶冻,胶冻的作用是防止管中溶液流出 盐桥的作用:
(1)形成闭合回路。
(2)平衡电荷。(3)双液原电池的优点:
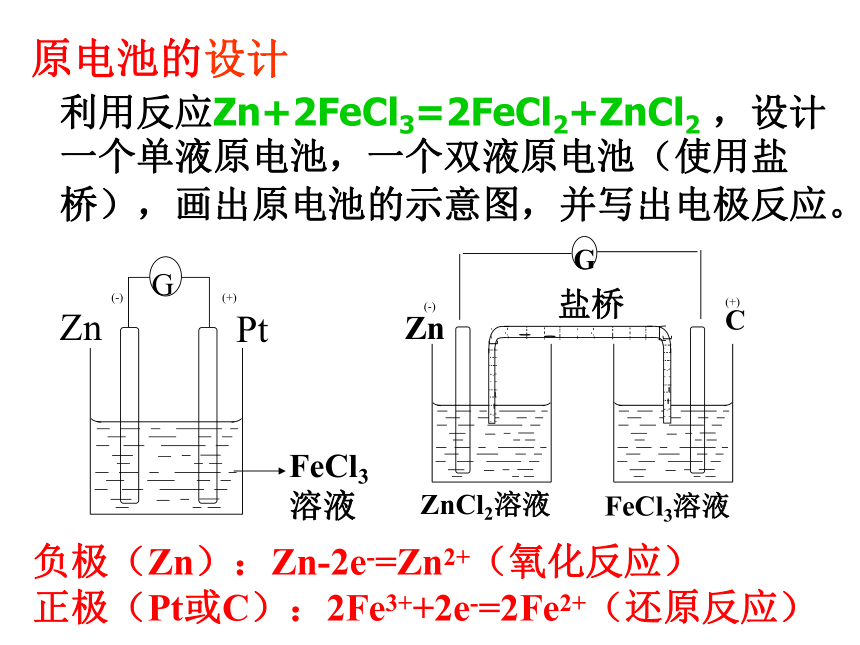
能产生持续、稳定的电流。利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设计一个单液原电池,一个双液原电池(使用盐桥),画出原电池的示意图,并写出电极反应。 (+)(-)负极(Zn):Zn-2e-=Zn2+(氧化反应)
正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)(+)(-)原电池的设计Zn+2OH--2e- = Zn(OH)2 2MnO2+2H2O+2e-=2MnO(OH)+2OH- Zn + 2MnO2 +2H2O= Zn(OH)2+ 2MnO(OH)负极:正极:总反应: 二、化学电源
1. 碱性锌锰电池2. 铅蓄电池 PbO2 + 4H+ + SO42- + 2e - = PbSO4 + 2H2OPb + PbO2 + 2H2SO4 =2PbSO4 + 2H2O总反应式为:Pb + SO42- -2e - = PbSO4负极:正极:放电当向外提供0.5mol电子时,消耗硫酸的物质的量为 0.5mol电解液 H2O3. 氢氧燃料电池2e-2e-氢气氧气H+ OH-A 负极 正极O2H2H2O2H2 + 4OH- — 4e- = 4H2OO2 + 2H2O + 4e- = 4OH-总反应式:2H2 + O2 =2H2O碱性燃料电池负极:正极:2H2 - 4e- = 4H+O2 +4e- + 4H+ = 2H2O 总反应式:2H2 +O2 = 2H2O酸性负极:正极:三、金属的腐蚀和防护1.概念2.实质3.分类
总:金属腐蚀快慢规律
4.金属的防护(3种法)2H++ 2e- = H2 ↑Fe- 2e- = Fe2+Fe + 2H+ = Fe2+ + H2↑练习:写出析氢腐蚀的电极反应式:负极:正极:电池反应:当钢铁处于酸性环境中析氢腐蚀和吸氧腐蚀都属于电化学腐蚀。请你根据原电池原理,写出钢铁吸氧腐蚀的电极反应式及电池反应方程式。2Fe - 4e- = 2Fe2+O2 + 2H2O + 4e- = 4OH-2Fe+ O2+2H2O =2Fe(OH)24Fe(OH)2 +O2 + 2H2O = 4 Fe(OH)3
2Fe(OH)3=Fe2O3·xH2O+(3-x) H2O进一步反应:负极:正极:电池反应:(2)析氢腐蚀与吸氧腐蚀(以Fe为例)电极反应负
极正
极总反应式水膜酸性较强水膜酸性很弱
或中性Fe-2e- =Fe2+2H++2e- =H2↑O2+2H2O+4e- =4OH-Fe+2H+=Fe2++H2↑2Fe+O2+2H2O=
2Fe(OH)21. 将锌片和铜片用导线连接置于稀硫酸溶液中,下列各叙述正确性的是( )
A.锌片做负极,锌发生还原反应
B.铜片做正极,铜得电子
C.溶液中的PH值增大
D.锌片、铜片同时有气泡冒出,说明锌片不纯2. 把a、b、c三种金属片浸泡在稀H2SO4中。若a、b相连时,a为负极;b、c相连时,c 为负极;a、c相连时,c上有气泡冒出。 则这三种金属的活动性顺序( )
A. a>b>c; B. a>c>b
C. c>a>b; D.b>a>cCDB达标练习3. 下列哪几个装置能形成原电池?ABCDEFMN CuSO4√√√√4. 在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
(A)正极附近的SO42 -离子浓度逐渐增大
(B)电子通过导线由铜片流向锌片
(C)正极有O2逸出
(D)铜片上有H2逸出
D5、判断右边原电池的
正、负极,并写出电极反应式。FeCl3溶液负极:Cu -2e- =Cu 2+
正极:2Fe3+ +2e -=2Fe2+-+Cu CMg AlA—稀硫酸溶液NaOH溶液-(稀硫酸)负极:Mg -2e-=Mg2+
正极:2H++2e-=H2↑(NaOH溶液)
负极:2Al+8OH- -6e- =2AlO2-+4H2O
2Al+2OH-+2H2O=2AlO2-+3H2↑正极:6H2O+6e- =3H2↑+6OH-6.宇宙飞船上使用的氢氧燃料电池,其电池反应为2H2+O2=2H2O,电解质溶液为KOH,反应保持在高温下,使H2O蒸发,正确叙述正确的是:( ) A.H2为正极反应物,O2为负极反应物 B.电极反应(正极):
O2+2H2O+4e- = 4OH- C.电极反应(负极):
2H2+4OH- + 4e- = 4H2O D.负极发生氧化反应,正极发生还原反应 BD 6. [2012·福建理综化学卷9] 将右图所示实验装置的K闭合,下列判断正确的A. 电极上发生还原反应 B.电子沿Zn a b Cu路径流动 C.片刻后甲池中c(SO42—)增大 D.片刻后可观察到滤纸b点变红色
电流的阴极防护)金属防护(牺牲
阳极的阴极防护)要解决的问题:思考后自由回答
1. 原电池的工作原理及构成条件?
2. 原电池电极如何判断?
一、原电池原理提示可由电子(流)的流向、反应类型、电解质溶液中离子的移向等方面判断。原电池及其工作原理:1.定义: 化学能转化为电能的装置为原电池。
从理论上说,任何一个自发的氧化还原反应均可设计成原电池;2.电极名称:相对活泼的电极为负极
相对不活泼的电极为正极3.电极反应:负极:
正极:失电子的氧化反应
得电子的还原反应4. 原电池的形成条件(4)形成闭合回路。
(两电极用导线连接,或接触。)(1)能自发地发生的氧化还原反应:
①电极和电解质溶液
②两电极上分别有还原剂和氧化剂(燃料电池)(2)电解质溶液:
参与电极反应或构成内电路(3)两导体作电极:
①活动性不同的金属(或一种金属和一种非金属导
体石墨),与电解质溶液反应的活泼金属为负极。
②两不活泼的导体-石墨或Pt等。(燃料电池电极)5.定向移动方向:电子、离子原电池“负极给出电子,经外电路并流向正极”必发生
失电子
的
氧化反应必发生
得电子
的
还原反应氧化反应Zn-2e=Zn2+ 铜锌原电池电解质溶液
盐桥失e,沿导线传递,有电流产生还原反应2H++2e- =H2↑阴离子阳离子总反应:负极正极 2H++2e- =H2↑Zn-2e- =Zn2+Zn+2H+=Zn2++H2↑Zn+H2SO4=ZnSO4+H2↑(离子方程式)(化学方程式)电极反应正极:负极:(氧化反应)(还原反应)阳离子外电路内电路原电池的工作原理1:-(2)盐桥的作用是什么?
(双液)原电池的工作原理2(有关概念)(1)盐桥中装有饱和的KCl溶液和琼脂制成的
胶冻,胶冻的作用是防止管中溶液流出 盐桥的作用:
(1)形成闭合回路。
(2)平衡电荷。(3)双液原电池的优点:
能产生持续、稳定的电流。利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设计一个单液原电池,一个双液原电池(使用盐桥),画出原电池的示意图,并写出电极反应。 (+)(-)负极(Zn):Zn-2e-=Zn2+(氧化反应)
正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)(+)(-)原电池的设计Zn+2OH--2e- = Zn(OH)2 2MnO2+2H2O+2e-=2MnO(OH)+2OH- Zn + 2MnO2 +2H2O= Zn(OH)2+ 2MnO(OH)负极:正极:总反应: 二、化学电源
1. 碱性锌锰电池2. 铅蓄电池 PbO2 + 4H+ + SO42- + 2e - = PbSO4 + 2H2OPb + PbO2 + 2H2SO4 =2PbSO4 + 2H2O总反应式为:Pb + SO42- -2e - = PbSO4负极:正极:放电当向外提供0.5mol电子时,消耗硫酸的物质的量为 0.5mol电解液 H2O3. 氢氧燃料电池2e-2e-氢气氧气H+ OH-A 负极 正极O2H2H2O2H2 + 4OH- — 4e- = 4H2OO2 + 2H2O + 4e- = 4OH-总反应式:2H2 + O2 =2H2O碱性燃料电池负极:正极:2H2 - 4e- = 4H+O2 +4e- + 4H+ = 2H2O 总反应式:2H2 +O2 = 2H2O酸性负极:正极:三、金属的腐蚀和防护1.概念2.实质3.分类
总:金属腐蚀快慢规律
4.金属的防护(3种法)2H++ 2e- = H2 ↑Fe- 2e- = Fe2+Fe + 2H+ = Fe2+ + H2↑练习:写出析氢腐蚀的电极反应式:负极:正极:电池反应:当钢铁处于酸性环境中析氢腐蚀和吸氧腐蚀都属于电化学腐蚀。请你根据原电池原理,写出钢铁吸氧腐蚀的电极反应式及电池反应方程式。2Fe - 4e- = 2Fe2+O2 + 2H2O + 4e- = 4OH-2Fe+ O2+2H2O =2Fe(OH)24Fe(OH)2 +O2 + 2H2O = 4 Fe(OH)3
2Fe(OH)3=Fe2O3·xH2O+(3-x) H2O进一步反应:负极:正极:电池反应:(2)析氢腐蚀与吸氧腐蚀(以Fe为例)电极反应负
极正
极总反应式水膜酸性较强水膜酸性很弱
或中性Fe-2e- =Fe2+2H++2e- =H2↑O2+2H2O+4e- =4OH-Fe+2H+=Fe2++H2↑2Fe+O2+2H2O=
2Fe(OH)21. 将锌片和铜片用导线连接置于稀硫酸溶液中,下列各叙述正确性的是( )
A.锌片做负极,锌发生还原反应
B.铜片做正极,铜得电子
C.溶液中的PH值增大
D.锌片、铜片同时有气泡冒出,说明锌片不纯2. 把a、b、c三种金属片浸泡在稀H2SO4中。若a、b相连时,a为负极;b、c相连时,c 为负极;a、c相连时,c上有气泡冒出。 则这三种金属的活动性顺序( )
A. a>b>c; B. a>c>b
C. c>a>b; D.b>a>cCDB达标练习3. 下列哪几个装置能形成原电池?ABCDEFMN CuSO4√√√√4. 在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
(A)正极附近的SO42 -离子浓度逐渐增大
(B)电子通过导线由铜片流向锌片
(C)正极有O2逸出
(D)铜片上有H2逸出
D5、判断右边原电池的
正、负极,并写出电极反应式。FeCl3溶液负极:Cu -2e- =Cu 2+
正极:2Fe3+ +2e -=2Fe2+-+Cu CMg AlA—稀硫酸溶液NaOH溶液-(稀硫酸)负极:Mg -2e-=Mg2+
正极:2H++2e-=H2↑(NaOH溶液)
负极:2Al+8OH- -6e- =2AlO2-+4H2O
2Al+2OH-+2H2O=2AlO2-+3H2↑正极:6H2O+6e- =3H2↑+6OH-6.宇宙飞船上使用的氢氧燃料电池,其电池反应为2H2+O2=2H2O,电解质溶液为KOH,反应保持在高温下,使H2O蒸发,正确叙述正确的是:( ) A.H2为正极反应物,O2为负极反应物 B.电极反应(正极):
O2+2H2O+4e- = 4OH- C.电极反应(负极):
2H2+4OH- + 4e- = 4H2O D.负极发生氧化反应,正极发生还原反应 BD 6. [2012·福建理综化学卷9] 将右图所示实验装置的K闭合,下列判断正确的A. 电极上发生还原反应 B.电子沿Zn a b Cu路径流动 C.片刻后甲池中c(SO42—)增大 D.片刻后可观察到滤纸b点变红色
