8.1 课题2海水资源的开发利用 同步练习(含答案)2024-2025学年高一化学人教版(2019)必修2
文档属性
| 名称 | 8.1 课题2海水资源的开发利用 同步练习(含答案)2024-2025学年高一化学人教版(2019)必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 772.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-13 22:56:27 | ||
图片预览


文档简介
课题2 海水资源的开发利用
1 下列说法不正确的是( )
A. 海洋是一个未完全开发的巨大化学资源宝库
B. 海水中金元素的储存量很大,但它的富集程度却很低
C. 从海水中可以提取铀和重水等核原料
D. 海水中的溴、氟等元素均为微量元素,但仍有提取的价值
2 碘是人体不可缺少的微量元素,采用离子交换法从卤水(富含I-)中提取碘的工艺流程如下。下列说法错误的是( )
A. “氧化1”的主要离子方程式为2I-+Cl2===2Cl-+I2
B. 离子交换树脂的作用是富集碘元素
C. 理论上参加反应的n(Cl2)∶n(Na2SO3)=1∶1
D. “吹碘”鼓入热空气是利用了I2易升华的性质
3 利用高分子吸附树脂吸附I2来提取卤水中碘(以I-形式存在)的工艺流程如下。下列说法正确的是( )
A. 步骤⑤的离子方程式:ClO+6I-+3H2O===Cl-+3I2+6OH-
B. 步骤②中应通入过量Cl2,以充分氧化I-
C. 步骤④的作用是将吸附的I2氧化而脱离高分子树脂
D. 经过步骤①~④,所得溶液中I-的物质的量浓度增大
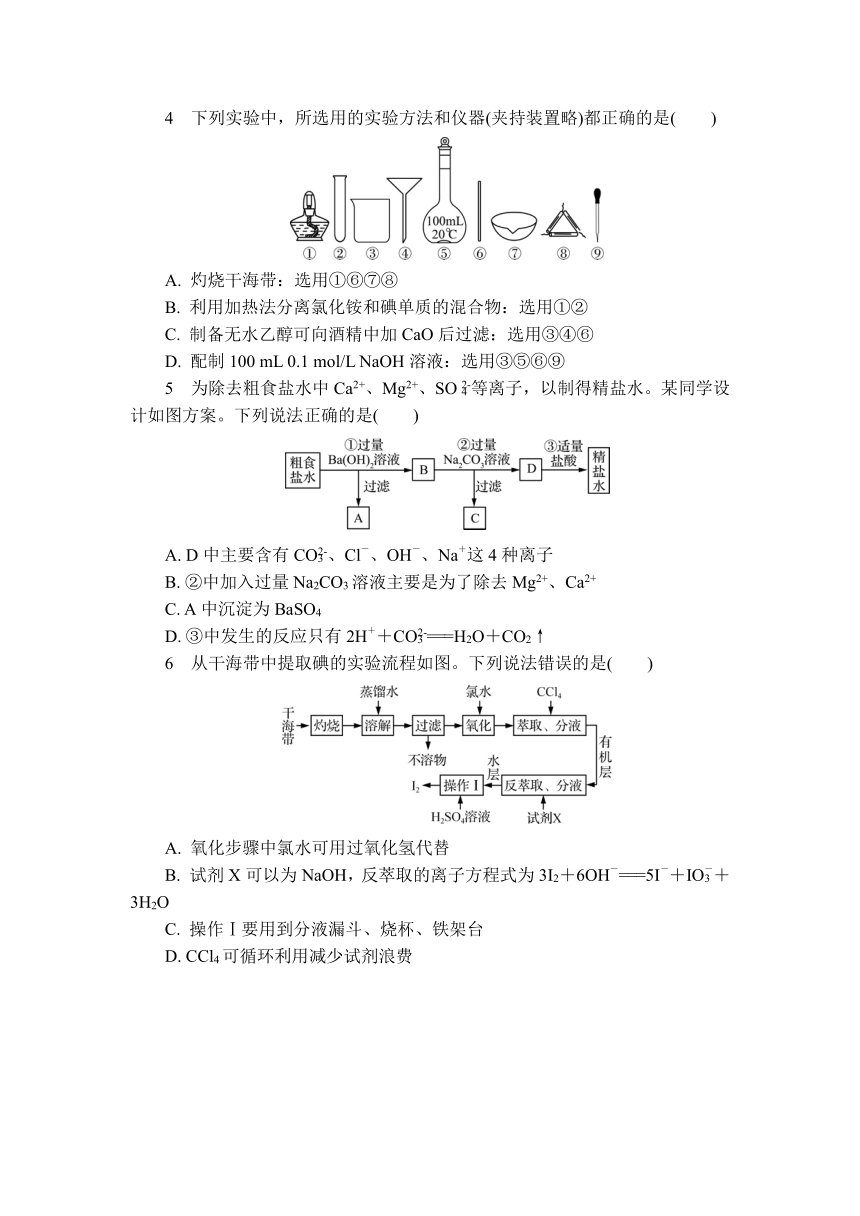
4 下列实验中,所选用的实验方法和仪器(夹持装置略)都正确的是( )
A. 灼烧干海带:选用①⑥⑦⑧
B. 利用加热法分离氯化铵和碘单质的混合物:选用①②
C. 制备无水乙醇可向酒精中加CaO后过滤:选用③④⑥
D. 配制100 mL 0.1 mol/L NaOH溶液:选用③⑤⑥⑨
5 为除去粗食盐水中Ca2+、Mg2+、SO等离子,以制得精盐水。某同学设计如图方案。下列说法正确的是( )
A. D中主要含有CO、Cl-、OH-、Na+这4种离子
B. ②中加入过量Na2CO3溶液主要是为了除去Mg2+、Ca2+
C. A中沉淀为BaSO4
D. ③中发生的反应只有2H++CO===H2O+CO2↑
6 从干海带中提取碘的实验流程如图。下列说法错误的是( )
A. 氧化步骤中氯水可用过氧化氢代替
B. 试剂X可以为NaOH,反萃取的离子方程式为3I2+6OH-===5I-+IO+3H2O
C. 操作Ⅰ要用到分液漏斗、烧杯、铁架台
D. CCl4可循环利用减少试剂浪费
7 海水是巨大的资源宝库,对海水资源综合利用的主要工艺如图所示。下列说法错误的是( )
A. 从成本角度考虑,适合选用熟石灰作沉镁试剂
B. “一系列操作”中包含灼烧、电解
C. 热空气吹出利用了Br2易挥发的物理性质
D. 亚硫酸吸收过程发生反应的离子方程式为Br2+H2SO3+H2O===SO+
4H++2Br-
8 海洋是一座巨大的化学资源宝库,下图所示为从海水中提取若干种化学物质的流程图。下列说法正确的是( )
A. 粗盐中含有Ca2+、Mg2+、SO杂质,①中制得精盐加入的除杂试剂顺序只能是NaOH→BaCl2→Na2CO3→过滤后加盐酸
B. ②中将Mg(OH)2放在蒸发皿中分解,再电解可获得Mg
C. ④中发生反应的离子方程式是SO2+Br2+2H2O===4H++SO+2Br-
D. ①②③④⑤中均发生氧化还原反应
9 人类的生产、生活离不开化学。
(1) 从海水中提取溴的工业流程如图:
①步骤Ⅰ中发生反应的离子方程式为__________________________________
______________________________________________________________________。
②已知步骤Ⅰ中已获得游离态的溴,通过步骤Ⅱ在吸收塔中得到化合态的溴,其目的是______________________________________________________________
______________________________________________________________________。
③吹出塔中通入热空气吹出Br2,利用了Br2的________(填字母,下同);吸收塔中吸收Br2,利用了Br2的________。
a. 氧化性 b. 还原性
c. 挥发性 d. 腐蚀性
(2) 海带中含有丰富的碘元素,某化学研究性学习小组用如图流程从海水中提取碘:
①由海带转化成海带灰,需要的主要仪器是________、________(分别填字母和仪器名称)。
a b c d
②若过程Ⅰ用H2O2溶液(稀硫酸酸化)完成碘元素的转化,则反应的离子方程式为__________________________________________________________________。
③过程 Ⅱ 中可以选用的溶剂是________(填字母)。
a. 乙醇 b. CCl4 c. 水 d. 苯
10 含碘的盐可以治疗甲状腺肿大,为了消除碘缺乏病,我国政府规定在食用盐中添加KIO3。某厂生产碘酸钾(KIO3)的工艺流程如图所示。回答下列问题。
(1) KIO3中I的化合价为________,试剂X是________(填化学式)。
(2) “氧化1”中发生反应的离子方程式为_____________________________
______________________________。氧化性:Cl2________(填“强于”或“弱于”)I2。系列操作2包括蒸发浓缩、____________、过滤、乙醇洗涤、干燥等。
(3) 在“氧化2”中,1 mol KClO3得到6 mol电子,则制备1 mol KH (IO3)2至少需要________g KClO3(结果保留一位小数)。
(4) 测定产品纯度:称取w g产品溶于蒸馏水,滴加适量稀硫酸,加入V mL c mol/L KI溶液,恰好完全反应,发生的反应为IO+5I-+6H+===3I2+3H2O。在该反应中氧化产物和还原产物的质量之比为_____________,产品中碘元素质量分数为________(用含w、c、V的代数式表示)。
课题2 海水资源的开发利用
1. D 2. A
3. D 卤水是被酸化的,故步骤⑤“氧化”是在酸性条件下进行的,反应的离子方程式为ClO+6I-+6H+===3I2+Cl-+3H2O,A错误;步骤②中通入的Cl2不宜过量太多,以防止Cl2将I2继续氧化,B错误;向树脂中加入Na2SO3溶液的目的是将吸附的I2还原而脱离高分子树脂,C错误;步骤①~④的目的是富集I元素,经过步骤①~④,所得溶液中I-的物质的量浓度增大,D正确。
4. D
5. A ②中加入过量Na2CO3溶液主要是为了除去Ba2+、Ca2+,B错误;A中沉淀主要为Mg(OH)2、BaSO4,C错误;D溶液中的CO、OH-均能与盐酸反应,发生的反应有2H++CO===H2O+CO2↑、H++OH-===H2O,D错误。
6. C 7. B 8. C
9. (1) ①Cl2+2Br-===Br2+2Cl- ②富集溴元素 ③c a
(2) ①b 坩埚 ②H2O2+2I-+2H+===I2+2H2O ③bd
10. (1) +5 KOH (2) 2I-+2H++H2O2===I2+2H2O 强于 冷却结晶 (3) 204.2 (4) 5∶1 %
解析:(3) 由得失电子守恒知,在“氧化2”中,1 mol KClO3得到6 mol电子,5n(KClO3)~3n[KH(IO3)2],制备1 mol KH(IO3)2至少需要的KClO3的质量= g=204.2 g 。(4) 发生的反应为IO+5I-+6H+===3I2+3H2O,氧化产物和还原产物的质量之比为5∶1,w g产品中含有的n(KIO3)=cV×10-3 mol,产品中碘元素质量分数=×100%=%。
1 下列说法不正确的是( )
A. 海洋是一个未完全开发的巨大化学资源宝库
B. 海水中金元素的储存量很大,但它的富集程度却很低
C. 从海水中可以提取铀和重水等核原料
D. 海水中的溴、氟等元素均为微量元素,但仍有提取的价值
2 碘是人体不可缺少的微量元素,采用离子交换法从卤水(富含I-)中提取碘的工艺流程如下。下列说法错误的是( )
A. “氧化1”的主要离子方程式为2I-+Cl2===2Cl-+I2
B. 离子交换树脂的作用是富集碘元素
C. 理论上参加反应的n(Cl2)∶n(Na2SO3)=1∶1
D. “吹碘”鼓入热空气是利用了I2易升华的性质
3 利用高分子吸附树脂吸附I2来提取卤水中碘(以I-形式存在)的工艺流程如下。下列说法正确的是( )
A. 步骤⑤的离子方程式:ClO+6I-+3H2O===Cl-+3I2+6OH-
B. 步骤②中应通入过量Cl2,以充分氧化I-
C. 步骤④的作用是将吸附的I2氧化而脱离高分子树脂
D. 经过步骤①~④,所得溶液中I-的物质的量浓度增大
4 下列实验中,所选用的实验方法和仪器(夹持装置略)都正确的是( )
A. 灼烧干海带:选用①⑥⑦⑧
B. 利用加热法分离氯化铵和碘单质的混合物:选用①②
C. 制备无水乙醇可向酒精中加CaO后过滤:选用③④⑥
D. 配制100 mL 0.1 mol/L NaOH溶液:选用③⑤⑥⑨
5 为除去粗食盐水中Ca2+、Mg2+、SO等离子,以制得精盐水。某同学设计如图方案。下列说法正确的是( )
A. D中主要含有CO、Cl-、OH-、Na+这4种离子
B. ②中加入过量Na2CO3溶液主要是为了除去Mg2+、Ca2+
C. A中沉淀为BaSO4
D. ③中发生的反应只有2H++CO===H2O+CO2↑
6 从干海带中提取碘的实验流程如图。下列说法错误的是( )
A. 氧化步骤中氯水可用过氧化氢代替
B. 试剂X可以为NaOH,反萃取的离子方程式为3I2+6OH-===5I-+IO+3H2O
C. 操作Ⅰ要用到分液漏斗、烧杯、铁架台
D. CCl4可循环利用减少试剂浪费
7 海水是巨大的资源宝库,对海水资源综合利用的主要工艺如图所示。下列说法错误的是( )
A. 从成本角度考虑,适合选用熟石灰作沉镁试剂
B. “一系列操作”中包含灼烧、电解
C. 热空气吹出利用了Br2易挥发的物理性质
D. 亚硫酸吸收过程发生反应的离子方程式为Br2+H2SO3+H2O===SO+
4H++2Br-
8 海洋是一座巨大的化学资源宝库,下图所示为从海水中提取若干种化学物质的流程图。下列说法正确的是( )
A. 粗盐中含有Ca2+、Mg2+、SO杂质,①中制得精盐加入的除杂试剂顺序只能是NaOH→BaCl2→Na2CO3→过滤后加盐酸
B. ②中将Mg(OH)2放在蒸发皿中分解,再电解可获得Mg
C. ④中发生反应的离子方程式是SO2+Br2+2H2O===4H++SO+2Br-
D. ①②③④⑤中均发生氧化还原反应
9 人类的生产、生活离不开化学。
(1) 从海水中提取溴的工业流程如图:
①步骤Ⅰ中发生反应的离子方程式为__________________________________
______________________________________________________________________。
②已知步骤Ⅰ中已获得游离态的溴,通过步骤Ⅱ在吸收塔中得到化合态的溴,其目的是______________________________________________________________
______________________________________________________________________。
③吹出塔中通入热空气吹出Br2,利用了Br2的________(填字母,下同);吸收塔中吸收Br2,利用了Br2的________。
a. 氧化性 b. 还原性
c. 挥发性 d. 腐蚀性
(2) 海带中含有丰富的碘元素,某化学研究性学习小组用如图流程从海水中提取碘:
①由海带转化成海带灰,需要的主要仪器是________、________(分别填字母和仪器名称)。
a b c d
②若过程Ⅰ用H2O2溶液(稀硫酸酸化)完成碘元素的转化,则反应的离子方程式为__________________________________________________________________。
③过程 Ⅱ 中可以选用的溶剂是________(填字母)。
a. 乙醇 b. CCl4 c. 水 d. 苯
10 含碘的盐可以治疗甲状腺肿大,为了消除碘缺乏病,我国政府规定在食用盐中添加KIO3。某厂生产碘酸钾(KIO3)的工艺流程如图所示。回答下列问题。
(1) KIO3中I的化合价为________,试剂X是________(填化学式)。
(2) “氧化1”中发生反应的离子方程式为_____________________________
______________________________。氧化性:Cl2________(填“强于”或“弱于”)I2。系列操作2包括蒸发浓缩、____________、过滤、乙醇洗涤、干燥等。
(3) 在“氧化2”中,1 mol KClO3得到6 mol电子,则制备1 mol KH (IO3)2至少需要________g KClO3(结果保留一位小数)。
(4) 测定产品纯度:称取w g产品溶于蒸馏水,滴加适量稀硫酸,加入V mL c mol/L KI溶液,恰好完全反应,发生的反应为IO+5I-+6H+===3I2+3H2O。在该反应中氧化产物和还原产物的质量之比为_____________,产品中碘元素质量分数为________(用含w、c、V的代数式表示)。
课题2 海水资源的开发利用
1. D 2. A
3. D 卤水是被酸化的,故步骤⑤“氧化”是在酸性条件下进行的,反应的离子方程式为ClO+6I-+6H+===3I2+Cl-+3H2O,A错误;步骤②中通入的Cl2不宜过量太多,以防止Cl2将I2继续氧化,B错误;向树脂中加入Na2SO3溶液的目的是将吸附的I2还原而脱离高分子树脂,C错误;步骤①~④的目的是富集I元素,经过步骤①~④,所得溶液中I-的物质的量浓度增大,D正确。
4. D
5. A ②中加入过量Na2CO3溶液主要是为了除去Ba2+、Ca2+,B错误;A中沉淀主要为Mg(OH)2、BaSO4,C错误;D溶液中的CO、OH-均能与盐酸反应,发生的反应有2H++CO===H2O+CO2↑、H++OH-===H2O,D错误。
6. C 7. B 8. C
9. (1) ①Cl2+2Br-===Br2+2Cl- ②富集溴元素 ③c a
(2) ①b 坩埚 ②H2O2+2I-+2H+===I2+2H2O ③bd
10. (1) +5 KOH (2) 2I-+2H++H2O2===I2+2H2O 强于 冷却结晶 (3) 204.2 (4) 5∶1 %
解析:(3) 由得失电子守恒知,在“氧化2”中,1 mol KClO3得到6 mol电子,5n(KClO3)~3n[KH(IO3)2],制备1 mol KH(IO3)2至少需要的KClO3的质量= g=204.2 g 。(4) 发生的反应为IO+5I-+6H+===3I2+3H2O,氧化产物和还原产物的质量之比为5∶1,w g产品中含有的n(KIO3)=cV×10-3 mol,产品中碘元素质量分数=×100%=%。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
