2025年甘肃省武威市凉州区新华、古城九年制学校中考二模化学试卷(含答案)
文档属性
| 名称 | 2025年甘肃省武威市凉州区新华、古城九年制学校中考二模化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 341.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-14 19:00:41 | ||
图片预览


文档简介
2024-2025学年第二学期九年级第二次模拟考试试卷
化学
可能用到的相对原子质量:H-1;C-12;O-16;Cl-35.5
一、选择题(共20分,每小题2分)
1.下列传统工艺涉及化学变化的是( )
A.粮食酿酒 B.玉器打磨 C.雕梁画栋 D.手工剪纸
2.空气中含量最多的气体是( )
A.氮气 B.氧气 C.二氧化碳 D.水蒸气
3.镓被誉为“电子工业脊梁”。镓元素在元素周期表中的信息如图所示,下列说法错误的是( )
A.镓的原子序数为31 B.镓的元素符号为
C.镓原子的中子数为31 D.镓元素的相对原子质量为69.72
4.下列符号能表示两个氮分子的是( )
A.2N B.2N2 C.2N2O D.N2
5.下列叙述正确的是( )
A.在化合物中,非金属元素只能显负价
B.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳
C.在反应2A+B=2C中,24gA完全反应生成40gC,C的相对分子质量为40,则B的相对分子质量为16
D.SO2、CO2、H2O2中氧元素的化合价相同
6.下列用途中,属于干冰的用途是( )
A.供给呼吸 B.作燃料 C.人工降雨 D.冶炼金属
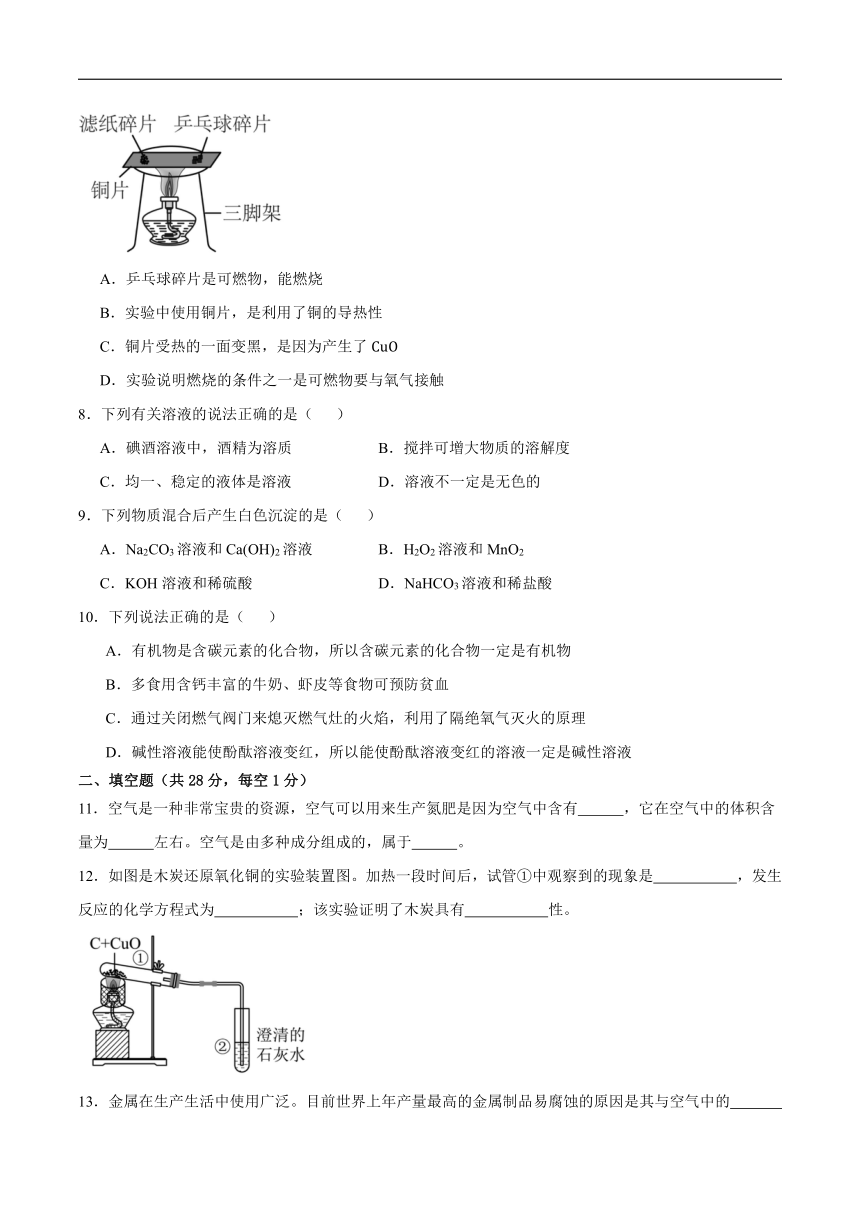
7.如图,把同样大小的滤纸碎片和乒乓球碎片分开放在一块薄铜片的两侧,加热铜片的中部。下列说法不正确的是( )
A.乒乓球碎片是可燃物,能燃烧
B.实验中使用铜片,是利用了铜的导热性
C.铜片受热的一面变黑,是因为产生了
D.实验说明燃烧的条件之一是可燃物要与氧气接触
8.下列有关溶液的说法正确的是( )
A.碘酒溶液中,酒精为溶质 B.搅拌可增大物质的溶解度
C.均一、稳定的液体是溶液 D.溶液不一定是无色的
9.下列物质混合后产生白色沉淀的是( )
A.Na2CO3溶液和Ca(OH)2溶液 B.H2O2溶液和MnO2
C.KOH溶液和稀硫酸 D.NaHCO3溶液和稀盐酸
10.下列说法正确的是( )
A.有机物是含碳元素的化合物,所以含碳元素的化合物一定是有机物
B.多食用含钙丰富的牛奶、虾皮等食物可预防贫血
C.通过关闭燃气阀门来熄灭燃气灶的火焰,利用了隔绝氧气灭火的原理
D.碱性溶液能使酚酞溶液变红,所以能使酚酞溶液变红的溶液一定是碱性溶液
二、填空题(共28分,每空1分)
11.空气是一种非常宝贵的资源,空气可以用来生产氮肥是因为空气中含有 ,它在空气中的体积含量为 左右。空气是由多种成分组成的,属于 。
12.如图是木炭还原氧化铜的实验装置图。加热一段时间后,试管①中观察到的现象是 ,发生反应的化学方程式为 ;该实验证明了木炭具有 性。
13.金属在生产生活中使用广泛。目前世界上年产量最高的金属制品易腐蚀的原因是其与空气中的 同时接触:铝制品耐腐蚀的原因是 ;用盐酸除铁锈的化学方程式为 。
14.地壳中含量最多的元素是 ;天然气主要成分的化学式是 。
15.某固体混合物由硫化钾和亚硫酸钾两种物质组成,亚硫酸钾中硫元素的化合价为 ;已知该固体混合物中氧元素的质量分数为12%,则该固体混合物中钾元素的质量分数为 。
16.氢能是很有发展前途的新能源。
(1)用可再生能源电解水制氢气,该反应的基本反应类型是 。
(2)我国科学家实现了天然气制氢气的突破,其反应原理为,X的化学式为 。
(3)用液氨()储存氢气是一种新型的储氢技术,中氮元素的化合价为 。
(4)氢能源汽车通过恒温高压途径将氢气储存在储氢罐中,从微观角度解释,该过程是 发生了变化。
17.科技腾飞,化学助力。
(1)“嫦娥五号”带回的月壤中含有丰富的氦-3,氦-3原子的质子数为2,中子数为1,则该原子核外电子数为 。取回的月壤需要在高纯氮气中保存,这说明氮气的化学性质 。
(2)“天舟号”货运飞船换装了以LiFePO4作正极材料的新型锂电池。已知LiFePO4中Li为+1价,P为+5价,则其中Fe的化合价为 价。给电池充电时,是将电能转化为 能。
18.下图为X、Y两种物质的溶解度曲线。请完成下列填空。
(1)20℃时,物质X、Y的溶解度均为 g;
(2)30℃时,X、Y两种物质溶解度中,溶解度较大的是 ;
(3)30℃时,将40gX溶解到50g水中,可得到该温度下X溶液的质量为 。
19.如图表示的是常见物质A—G相互间的反应及转化关系。B为炉具清洁剂主要成分,粉末状固体F呈黑色,D、E常温下为气体且组成元素相同。
(1)C的化学式为 。
(2)A转化为B的化学方程式为 。
(3)E生成G时,固体的现象是 。
(4)图中一定未涉及的基本反应类型是 。
三、实验题(16分)
20.(10分)空气是一种宝贵的资源。
【自然界中的碳氧循环】
(1)绿色植物通过 吸收二氧化碳,释放出氧气。
【气体的实验室制取】
(2)A中仪器①的名称为 。用B装置制取氧气发生反应的化学方程式为 。
(3)实验室制取二氧化碳时,选择的发生和收集装置是 。
(4)用纯氮气及实验室制取的氧气混制一定体积的“富氧空气”,其氧气的体积分数为40%,可使用下图装置,先在装置中装满250mL的水,再从导管 通入氮气,排出 mL的水后,再通入氧气排出80mL的水。
【气体的性质及用途】
(5)空气中的各种成分均可作为原料广泛用于各个领域,下列气体的用途既利用其物理性质又利用其化学性质的是_______。
A.食品包装中充入氮气 B.用于环境监测的飞艇填充氦气
C.氧气用于医疗急救 D.稀有气体通电能发出不同颜色的光
(6)利用空气等原料可以合成尿素。
①空气经液化后,分子间隔 ,利用氧气和氮气的 不同,先分离出氮气,再利用氮气和氢气反应合成氨气。
②补全氨气和二氧化碳反应合成尿素的化学反应方程式: 。
21.(6分)下图为实验室常用仪器和装置的示意图。
(1)写出标号①的仪器名称: 。
(2)实验室制取时,可用D装置收集,说明具有的物理性质是 ;若要测量产生 的体积,应将E装置的 端与量筒连接。
(3)实验室制取的化学方程式为 。选择的发生装置B,其优点是 ,若要获得干燥的,可将发生装置与C装置连接,C中应盛放的试剂是 。
四、计算题(共6分)
22.(6分)实验室用5g石灰石和10g稀盐酸制取二氧化碳,当不再产生气泡时、石灰有剩余,实验结束后容器中物质的总质量为14.12g。计算:
(1)(2分)实验中制得二氧化碳的质量;
(2)(4分)所用稀盐酸中溶质质量分数。(精确至0.1%)
答案
1-5 AACBB 6-10 CDDAD
11.氮气 78% 混合物 12.黑色固体变为红色 还原
13. 氧气和水 铝与氧气反应生成一层致密的氧化膜,阻止铝与氧气继续反应
14. 氧 CH4 15.+4价 62.4% 16.(1)分解反应 (2)CO2 (3)-3 (4)分子之间的间隔
17.(1) 2 不活泼 (2)+2 化学 18.(1)40 (2)X (3)80g
19.(1)HCl/H2SO4 (2) (3)由黑色变成红色 (4)分解反应
20.(1)光合作用 (2)试管 (3)B、C
(4)a 120 (5)B (6)变小 沸点
21.(1)锥形瓶 (2)密度比空气大 a
(3) 可以控制反应发生和停止 浓硫酸
22.(1)0.88g;
(2)设稀盐酸中溶质质量为x,则
x=1.46g
答:稀盐酸中溶质质量分数为14.6%。
化学
可能用到的相对原子质量:H-1;C-12;O-16;Cl-35.5
一、选择题(共20分,每小题2分)
1.下列传统工艺涉及化学变化的是( )
A.粮食酿酒 B.玉器打磨 C.雕梁画栋 D.手工剪纸
2.空气中含量最多的气体是( )
A.氮气 B.氧气 C.二氧化碳 D.水蒸气
3.镓被誉为“电子工业脊梁”。镓元素在元素周期表中的信息如图所示,下列说法错误的是( )
A.镓的原子序数为31 B.镓的元素符号为
C.镓原子的中子数为31 D.镓元素的相对原子质量为69.72
4.下列符号能表示两个氮分子的是( )
A.2N B.2N2 C.2N2O D.N2
5.下列叙述正确的是( )
A.在化合物中,非金属元素只能显负价
B.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳
C.在反应2A+B=2C中,24gA完全反应生成40gC,C的相对分子质量为40,则B的相对分子质量为16
D.SO2、CO2、H2O2中氧元素的化合价相同
6.下列用途中,属于干冰的用途是( )
A.供给呼吸 B.作燃料 C.人工降雨 D.冶炼金属
7.如图,把同样大小的滤纸碎片和乒乓球碎片分开放在一块薄铜片的两侧,加热铜片的中部。下列说法不正确的是( )
A.乒乓球碎片是可燃物,能燃烧
B.实验中使用铜片,是利用了铜的导热性
C.铜片受热的一面变黑,是因为产生了
D.实验说明燃烧的条件之一是可燃物要与氧气接触
8.下列有关溶液的说法正确的是( )
A.碘酒溶液中,酒精为溶质 B.搅拌可增大物质的溶解度
C.均一、稳定的液体是溶液 D.溶液不一定是无色的
9.下列物质混合后产生白色沉淀的是( )
A.Na2CO3溶液和Ca(OH)2溶液 B.H2O2溶液和MnO2
C.KOH溶液和稀硫酸 D.NaHCO3溶液和稀盐酸
10.下列说法正确的是( )
A.有机物是含碳元素的化合物,所以含碳元素的化合物一定是有机物
B.多食用含钙丰富的牛奶、虾皮等食物可预防贫血
C.通过关闭燃气阀门来熄灭燃气灶的火焰,利用了隔绝氧气灭火的原理
D.碱性溶液能使酚酞溶液变红,所以能使酚酞溶液变红的溶液一定是碱性溶液
二、填空题(共28分,每空1分)
11.空气是一种非常宝贵的资源,空气可以用来生产氮肥是因为空气中含有 ,它在空气中的体积含量为 左右。空气是由多种成分组成的,属于 。
12.如图是木炭还原氧化铜的实验装置图。加热一段时间后,试管①中观察到的现象是 ,发生反应的化学方程式为 ;该实验证明了木炭具有 性。
13.金属在生产生活中使用广泛。目前世界上年产量最高的金属制品易腐蚀的原因是其与空气中的 同时接触:铝制品耐腐蚀的原因是 ;用盐酸除铁锈的化学方程式为 。
14.地壳中含量最多的元素是 ;天然气主要成分的化学式是 。
15.某固体混合物由硫化钾和亚硫酸钾两种物质组成,亚硫酸钾中硫元素的化合价为 ;已知该固体混合物中氧元素的质量分数为12%,则该固体混合物中钾元素的质量分数为 。
16.氢能是很有发展前途的新能源。
(1)用可再生能源电解水制氢气,该反应的基本反应类型是 。
(2)我国科学家实现了天然气制氢气的突破,其反应原理为,X的化学式为 。
(3)用液氨()储存氢气是一种新型的储氢技术,中氮元素的化合价为 。
(4)氢能源汽车通过恒温高压途径将氢气储存在储氢罐中,从微观角度解释,该过程是 发生了变化。
17.科技腾飞,化学助力。
(1)“嫦娥五号”带回的月壤中含有丰富的氦-3,氦-3原子的质子数为2,中子数为1,则该原子核外电子数为 。取回的月壤需要在高纯氮气中保存,这说明氮气的化学性质 。
(2)“天舟号”货运飞船换装了以LiFePO4作正极材料的新型锂电池。已知LiFePO4中Li为+1价,P为+5价,则其中Fe的化合价为 价。给电池充电时,是将电能转化为 能。
18.下图为X、Y两种物质的溶解度曲线。请完成下列填空。
(1)20℃时,物质X、Y的溶解度均为 g;
(2)30℃时,X、Y两种物质溶解度中,溶解度较大的是 ;
(3)30℃时,将40gX溶解到50g水中,可得到该温度下X溶液的质量为 。
19.如图表示的是常见物质A—G相互间的反应及转化关系。B为炉具清洁剂主要成分,粉末状固体F呈黑色,D、E常温下为气体且组成元素相同。
(1)C的化学式为 。
(2)A转化为B的化学方程式为 。
(3)E生成G时,固体的现象是 。
(4)图中一定未涉及的基本反应类型是 。
三、实验题(16分)
20.(10分)空气是一种宝贵的资源。
【自然界中的碳氧循环】
(1)绿色植物通过 吸收二氧化碳,释放出氧气。
【气体的实验室制取】
(2)A中仪器①的名称为 。用B装置制取氧气发生反应的化学方程式为 。
(3)实验室制取二氧化碳时,选择的发生和收集装置是 。
(4)用纯氮气及实验室制取的氧气混制一定体积的“富氧空气”,其氧气的体积分数为40%,可使用下图装置,先在装置中装满250mL的水,再从导管 通入氮气,排出 mL的水后,再通入氧气排出80mL的水。
【气体的性质及用途】
(5)空气中的各种成分均可作为原料广泛用于各个领域,下列气体的用途既利用其物理性质又利用其化学性质的是_______。
A.食品包装中充入氮气 B.用于环境监测的飞艇填充氦气
C.氧气用于医疗急救 D.稀有气体通电能发出不同颜色的光
(6)利用空气等原料可以合成尿素。
①空气经液化后,分子间隔 ,利用氧气和氮气的 不同,先分离出氮气,再利用氮气和氢气反应合成氨气。
②补全氨气和二氧化碳反应合成尿素的化学反应方程式: 。
21.(6分)下图为实验室常用仪器和装置的示意图。
(1)写出标号①的仪器名称: 。
(2)实验室制取时,可用D装置收集,说明具有的物理性质是 ;若要测量产生 的体积,应将E装置的 端与量筒连接。
(3)实验室制取的化学方程式为 。选择的发生装置B,其优点是 ,若要获得干燥的,可将发生装置与C装置连接,C中应盛放的试剂是 。
四、计算题(共6分)
22.(6分)实验室用5g石灰石和10g稀盐酸制取二氧化碳,当不再产生气泡时、石灰有剩余,实验结束后容器中物质的总质量为14.12g。计算:
(1)(2分)实验中制得二氧化碳的质量;
(2)(4分)所用稀盐酸中溶质质量分数。(精确至0.1%)
答案
1-5 AACBB 6-10 CDDAD
11.氮气 78% 混合物 12.黑色固体变为红色 还原
13. 氧气和水 铝与氧气反应生成一层致密的氧化膜,阻止铝与氧气继续反应
14. 氧 CH4 15.+4价 62.4% 16.(1)分解反应 (2)CO2 (3)-3 (4)分子之间的间隔
17.(1) 2 不活泼 (2)+2 化学 18.(1)40 (2)X (3)80g
19.(1)HCl/H2SO4 (2) (3)由黑色变成红色 (4)分解反应
20.(1)光合作用 (2)试管 (3)B、C
(4)a 120 (5)B (6)变小 沸点
21.(1)锥形瓶 (2)密度比空气大 a
(3) 可以控制反应发生和停止 浓硫酸
22.(1)0.88g;
(2)设稀盐酸中溶质质量为x,则
x=1.46g
答:稀盐酸中溶质质量分数为14.6%。
同课章节目录
