第二单元 认识物质的构成 单元复习课 课件(共31张PPT)
文档属性
| 名称 | 第二单元 认识物质的构成 单元复习课 课件(共31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 18.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-14 22:44:10 | ||
图片预览









文档简介
(共31张PPT)
感受化学魅力
探寻化学之美
认识物质的构成
第二单元
单元知识复习
目
录
CONTENTS
1
知道原子的结构、性质及相对原子质量,认识核外电子在化学反应中的作用
2
熟记常见的元素符号,理解元素的概念及意义,进一步理解物质的分类
3
掌握化学式及意义,熟记元素的化合价能利用相对原子质量进行有关简单计算
感受化学魅力
探寻化学之美
重点:元素、化学式与化合价、相对原子质量的计算
难点:宏观与微观的思维方式、相对原子质量的计算
知识网络
认识物质的构成
原子
元素
物质组成的表示
原子的结构
计量原子的质量 相对原子质量=质子数+中子数
元素与元素符号
元素周期表简介 族、周期、原子序数、门捷列夫
化合价
物质组成的定量表示
化学式及其意义(宏观、微观)
原子核
核外电子
质子
中子
原子与离子、分子 分子 原子 离子
分裂
结合
得失电子
得失电子
单质(一种元素)
化合物(多种元素)
纯净物
元素及原子团的化合价
根据化合价写化学式
物质中各元素的质量比
物质中某元素的质量分数
1.原子的结构:
原子
01
知识清单
质子:1个质子带1个单位正电荷
原子核
原子 中子:不带电
核外电子:1个电子带1个单位负电荷
(带正电)
不显电性
(2)在原子里,核电荷数=质子数=电子数=原子序数;
注意: (1)原子的质量主要集中在原子核上;
(3)不是所有的原子都有中子(氢原子没有中子)。
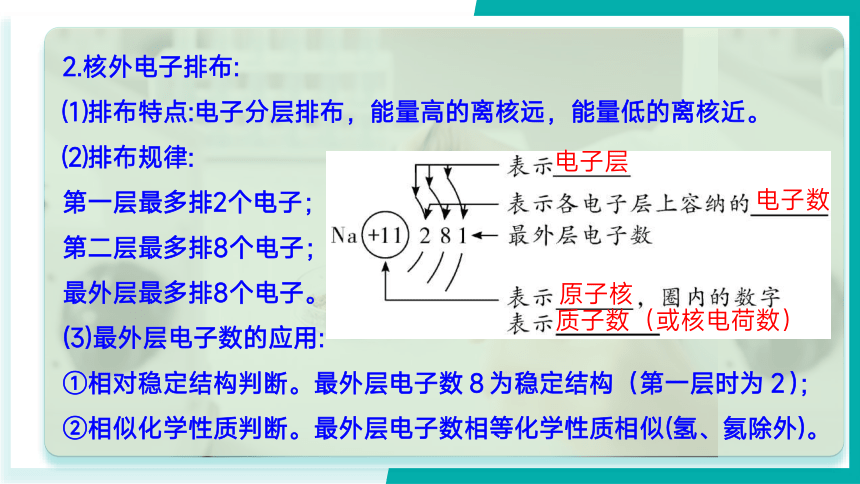
2.核外电子排布:
⑴排布特点:电子分层排布,能量高的离核远,能量低的离核近。
⑵排布规律:
第一层最多排2个电子;
第二层最多排8个电子;
最外层最多排8个电子。
(3)最外层电子数的应用:
①相对稳定结构判断。最外层电子数8为稳定结构(第一层时为2);
②相似化学性质判断。最外层电子数相等化学性质相似(氢、氦除外)。
电子层
电子数
原子核
质子数(或核电荷数)
3.分子、原子、离子的区别与联系:
分子 原子 离子
区别 化学变化中 可以再分 不能再分
原子团在有些化学变化中可以
电性 不显电性 不显电性 原子失去电子,形成阳离子带 电
原子得到电子,形成阴离子带 电
相同点 (1)都是构成物质的 ; (2)质量和体积都 ; (3)粒子之间都有一定的 ; (4)都在不停地 ; 联系 分子 成为原子,原子 成为分子;原子 成为离子,离子 成为原子。 正
负
得失电子
结合
分裂
运动
间隔
很小
基本粒子
得失电子
4.计量原子的质量
某原子的相对原子质量=
原子的实际质量
碳-12原子实际质量的1/12
(1)在上式中分子分母同为质量,单位同为g,相除后单位为1,一般省略不写;
(2)相关数量关系:
原子的质量主要集中在原子核上。近似计算公式:相对原子质量≈质子数+中子数。
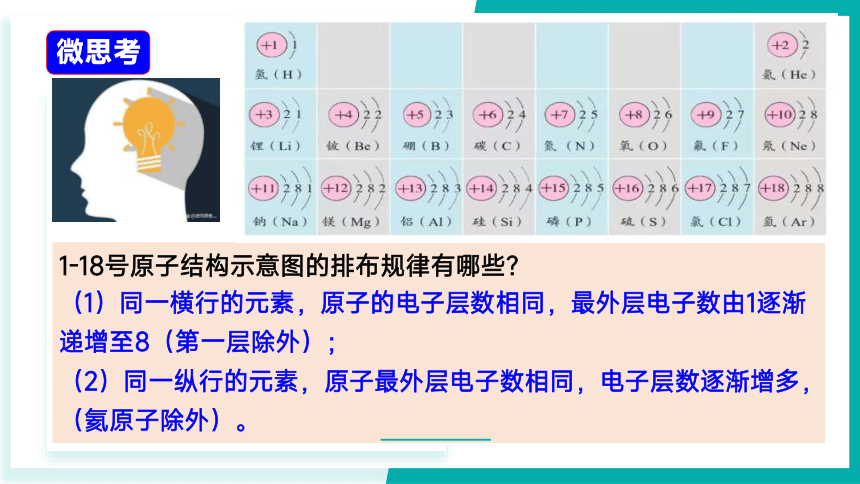
1-18号原子结构示意图的排布规律有哪些?
微思考
(1)同一横行的元素,原子的电子层数相同,最外层电子数由1逐渐递增至8(第一层除外);
(2)同一纵行的元素,原子最外层电子数相同,电子层数逐渐增多,
(氦原子除外)。
元素
02
知识清单
1.元素
(1)概念:元素是_________(即______)相同的一类原子的总称。
理解元素时应注意的问题:
①元素是以质子数(即核电荷数)为标准对原子的分类。它属于宏观概念,只讲种类,不讲个数。
②同种元素的原子,核电荷数一定相同,而核电荷数相同的粒子不一定属于同种元素,如Na+和NH4+。
核电荷数
质子数
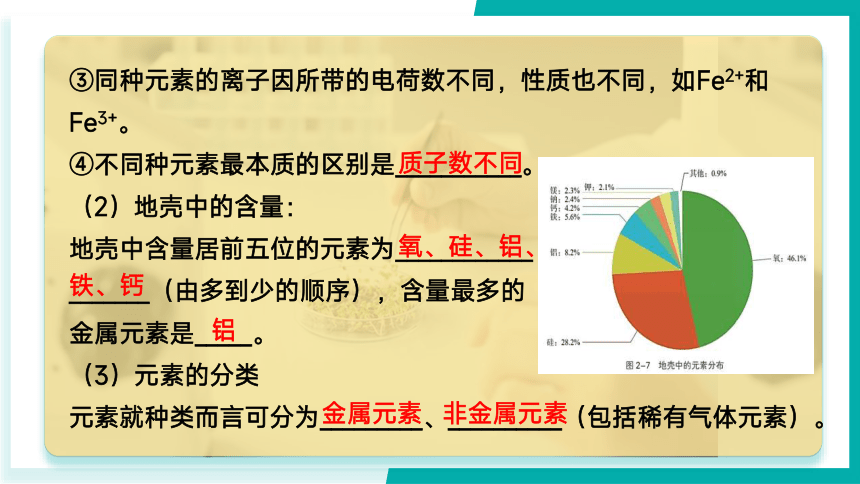
③同种元素的离子因所带的电荷数不同,性质也不同,如Fe2+和Fe3+。
④不同种元素最本质的区别是___________。
(2)地壳中的含量:
地壳中含量居前五位的元素为____________
_______(由多到少的顺序),含量最多的
金属元素是_____。
(3)元素的分类
元素就种类而言可分为_________、__________(包括稀有气体元素)。
质子数不同
氧、硅、铝、
铁、钙
铝
金属元素
非金属元素
2.元素符号
(1)书写规则:国际上统一采用元素拉丁文名称的第一个字母(大写)来表示元素,如氢元素的符号为H;如果几种元素拉丁文名称的第一个字母相同,就附加一个小写字母来区别,如Cu表示铜元素,Ca表示钙元素;
(2)意义:
①宏观意义:a.表示一种_____,如Fe表示_______;b.表示由_____构成的一种物质,如Fe表示____________。
②微观意义:a.表示一种______;b.表示一个______,如果在元素符号前加数字,表示几个该原子,此时该符号只表示微观意义。
元素
铁元素
原子
铁这种物质
原子
原子
3.元素周期表
元素周期表共有7个横行,18个纵行。每一个横行叫做一个______,每一个纵行叫做一个____(8、9、10三个纵行共同组成一个族)。
由元素周期表的一格获取的信息:
①元素名称、原子序数、元素符号、
相对原子质量的判断;
②金属元素和非金属元素的判断
a.“钅”字旁的都是金属元素(汞除外),如图A;
b.“气”、“石”、“氵”字旁的是非金属元素,如图B。
原子
序数
相同原
子质量
周期
族
混合物 纯净物
宏观
微观
性质
例如
不同种物质组成
一种物质组成
不同种分子构成
同种分子构成
没有固定的组成,各组分保持各自的化学性质。没有固定的熔点和沸点。
具有固定的组成,具有固定的熔点、沸点;具有固定的化学性质。
空气是混合物,由氧气、二氧化碳、氮气等组成,含有N2、O2、CO2、等不同种分子。
水是纯净物,由水(H2O)分子构成;氧气是纯净物,由氧(O2)分子构成。
4.混合物与纯净物的比较
物质组成的表示
03
知识清单
1.化合价及其表示方法
(1)概念:元素之间相互化合时,各元素的原子的 总是一定的,各种原子的个数用 来表示;
(2)化合价的表示方法:在元素符号(或原子团)正上方用带“+”与“-”的数字表示;
(3)常见元素的化合价:钾、钠、银、氢+1价;氟、氯、溴、碘-1价;钙、镁、锌、钡+2价;通常氧显-2价;铜1、2,铁2、3;铝3硅4磷+5;碳、氮、磷、硫、氯、锰可变价。
个数比
化合价
(4)化合价的一般规律:
①常见的化合物中,氢元素总是显 价、氧元素总是显 价;
②金属元素在化合物中常显 价;
③非金属元素与氧元素化合时常显 价,与氢元素及金属元素化合时常显 价;
④单质中元素的化合价为 价;
⑤在化合物里,元素正负化合价的代数和为 ;
⑥有些元素在不同的化合物里常显不同的化合价,如NH4NO3中的氮元素的化合价依次为 和 。
+1
-2
正
正
零
零
-3
+5
负
2. 化学式
(1)单质:金属单质、稀有气体单质、常温下为固态的非金属单质三类由原子构成的物质—用元素符号表示(如Fe、He、C);由双原子或多原子分子构成—在元素符号右下角标出原子个数(如O2、H2、O3);
(2)化合物:按左 价元素,右 价元素,写出物质的元素符号(特例:NH3氨气、CH4甲烷);根据化合物中正负化合价代数和为 的原则,确定各元素的原子个数或原子个数比(特例:H2O2);在各元素符号
标出各原子数(1省略不写);检查化学式(必须符合实际)。当原子团不是一个时需要加括号,并把个数写在括号的右下角(1省略不写)。
正
负
零
右下角
(3)化学式的含义
①表示某种物质;(宏观)
②表示某种物质的元素组成;(宏观)
③表示某种物质的一个分子或一个原子或离子构成情况;(微观)
④表示某种物质的一个分子的构成。(微观)
特别提醒:
(1)物质的化学式是经过实验确定的,一种物质只有一个化学式;
(2)若在化学式前加系数,失去宏观意义,只能表示微观意义,
如“2H2O”表示2个水分子。
3.物质组成的定量表示
以化学式AxBy为例总结定量表示的有关计算公式(a为A元素的相对原子质量,b为B元素的相对原子质量)
AxBy的相对分子质量=ax+by
AxBy中A、B元素的质量比=ax:by
AxBy中A元素的质量分数
mgAxBy中A元素的质量
ax
ax+by
= ×100%
ax
ax+by
=mg× ×100%
1.某些花岗岩石材中含有放射性元素——氡,已知一种氡原子的相对原子质量为222,其原子核内含有86个质子,则这种氡原子核内含有 ( )个中子,核外含有( )个电子。
A.86 B.136 C.222 D.308
B
课堂达标
A
2.微粒是构成化学物质的基础,下列对微粒的描述正确的是( )
A. 仅由碳原子构成的物质属于纯净物
B. 原子中一定含有质子、中子、电子
C. NaCl是由离子构成的,所以HCl也是由离子构成的
D. Cl的离子结构示意图为
D
课堂达标
3.实验测定某物质只含有一种元素,则关于该物质的说法中,正确的是( )
A.可能是单质或化合物
B.可能是纯净物或混合物
C.一定是纯净物
D.一定是一种单质
B
课堂达标
4.已知锌的化合价为+2价,硫的化合价有-2、+4和+6价。根据此处提供的化合价,某同学认为锌与硫形成的化合物的化学式有:①Zn2S;②ZnS;③ZnS2;④ZnS3。其中正确的是( )
A.①和② B.仅是② C.②③④ D.全是
B
课堂达标
5.民间常用川乌、草乌泡制药酒。川乌、草乌含有少量有毒物质乌头碱(化学式为C34H47NO11),药酒使用不当会造成中毒。下列关于乌头碱的说法不正确的是( )
A.乌头碱由四种元素组成
B.乌头碱分子中C、H原子个数比为34∶47
C.乌头碱在空气中充分燃烧后的生成物只有CO2和H2O
D.每个乌头碱分子由93个原子构成
C
课堂达标
6.下列粒子中属于原子的是 ;
属于离子的是 。
课堂达标
A
C
D
F
B
E
G
H
课堂达标
7.下图所示原子的核电荷数为 ,核外有 个电子层,第一层有 个电子,次外层上有 个电子,最外层有 个电子,属于 类原子,在化学反应中容
易 电子,形成 。
12
3
8
2
金属
失去
阳离子
2
课堂达标
8.根据右图回答问题:
⑴该元素的原子序数=_____;
质子数=______;电子数为=_____;
相对原子质量为 。
⑵该元素名称为 ,元素符号
为 , 属于 类
元素。在化学反应中容易 电子,形成 。
16
16
16
32.06
硫
S
非金属
得到
阴离子
9.如图是部分微粒的结构
示意图,请按要求用数字序号填空:
(1)属于原子的是______。
(2)属于同种元素的是______。
(3)易得电子的是____。
(4)具有相对稳定结构的是______。
课堂达标
①②
①③
②
③④
10.已知碘元素(元素符号为Ⅰ)原子结构示意图为 ,请回答下列问题:
(1)x的值为_____。
(2)一般情况下,原子的最外层电子数相同,元素具有相似的化学性质。上图四种元素的化学性质与碘元素的化学性质最相似的是_____。
课堂达标
53
C
11.下图是表示气体微粒的示意图,图中的“○”和“●”分别表示两种不同元素的原子,那么其中表示混合物的是 ,表示单质的是 ,表示化合物的是 。
课堂达标
①③
④
②
12.一种新型环保材料被塑胶跑道工程广泛应用,合成这种新材料的原料是二甲苯烷二异氰酸酯(其分子式为C15H10N2O2)。请回答下列有关问题:
(1)二甲苯烷二异氰酸酯(C15H10N2O2)中氢、氧元素的质量比为 (填最简整数比);
(2)二甲苯烷二异氰酸酯(C15H10N2O2)的相对分子质量为 ;
(3)500g二甲苯烷二异氰酸酯中含氮元素的质量为 g。
5:16
课堂达标
250
56
谢谢您的观看
THANKS
感受化学魅力
探寻化学之美
感受化学魅力
探寻化学之美
认识物质的构成
第二单元
单元知识复习
目
录
CONTENTS
1
知道原子的结构、性质及相对原子质量,认识核外电子在化学反应中的作用
2
熟记常见的元素符号,理解元素的概念及意义,进一步理解物质的分类
3
掌握化学式及意义,熟记元素的化合价能利用相对原子质量进行有关简单计算
感受化学魅力
探寻化学之美
重点:元素、化学式与化合价、相对原子质量的计算
难点:宏观与微观的思维方式、相对原子质量的计算
知识网络
认识物质的构成
原子
元素
物质组成的表示
原子的结构
计量原子的质量 相对原子质量=质子数+中子数
元素与元素符号
元素周期表简介 族、周期、原子序数、门捷列夫
化合价
物质组成的定量表示
化学式及其意义(宏观、微观)
原子核
核外电子
质子
中子
原子与离子、分子 分子 原子 离子
分裂
结合
得失电子
得失电子
单质(一种元素)
化合物(多种元素)
纯净物
元素及原子团的化合价
根据化合价写化学式
物质中各元素的质量比
物质中某元素的质量分数
1.原子的结构:
原子
01
知识清单
质子:1个质子带1个单位正电荷
原子核
原子 中子:不带电
核外电子:1个电子带1个单位负电荷
(带正电)
不显电性
(2)在原子里,核电荷数=质子数=电子数=原子序数;
注意: (1)原子的质量主要集中在原子核上;
(3)不是所有的原子都有中子(氢原子没有中子)。
2.核外电子排布:
⑴排布特点:电子分层排布,能量高的离核远,能量低的离核近。
⑵排布规律:
第一层最多排2个电子;
第二层最多排8个电子;
最外层最多排8个电子。
(3)最外层电子数的应用:
①相对稳定结构判断。最外层电子数8为稳定结构(第一层时为2);
②相似化学性质判断。最外层电子数相等化学性质相似(氢、氦除外)。
电子层
电子数
原子核
质子数(或核电荷数)
3.分子、原子、离子的区别与联系:
分子 原子 离子
区别 化学变化中 可以再分 不能再分
原子团在有些化学变化中可以
电性 不显电性 不显电性 原子失去电子,形成阳离子带 电
原子得到电子,形成阴离子带 电
相同点 (1)都是构成物质的 ; (2)质量和体积都 ; (3)粒子之间都有一定的 ; (4)都在不停地 ; 联系 分子 成为原子,原子 成为分子;原子 成为离子,离子 成为原子。 正
负
得失电子
结合
分裂
运动
间隔
很小
基本粒子
得失电子
4.计量原子的质量
某原子的相对原子质量=
原子的实际质量
碳-12原子实际质量的1/12
(1)在上式中分子分母同为质量,单位同为g,相除后单位为1,一般省略不写;
(2)相关数量关系:
原子的质量主要集中在原子核上。近似计算公式:相对原子质量≈质子数+中子数。
1-18号原子结构示意图的排布规律有哪些?
微思考
(1)同一横行的元素,原子的电子层数相同,最外层电子数由1逐渐递增至8(第一层除外);
(2)同一纵行的元素,原子最外层电子数相同,电子层数逐渐增多,
(氦原子除外)。
元素
02
知识清单
1.元素
(1)概念:元素是_________(即______)相同的一类原子的总称。
理解元素时应注意的问题:
①元素是以质子数(即核电荷数)为标准对原子的分类。它属于宏观概念,只讲种类,不讲个数。
②同种元素的原子,核电荷数一定相同,而核电荷数相同的粒子不一定属于同种元素,如Na+和NH4+。
核电荷数
质子数
③同种元素的离子因所带的电荷数不同,性质也不同,如Fe2+和Fe3+。
④不同种元素最本质的区别是___________。
(2)地壳中的含量:
地壳中含量居前五位的元素为____________
_______(由多到少的顺序),含量最多的
金属元素是_____。
(3)元素的分类
元素就种类而言可分为_________、__________(包括稀有气体元素)。
质子数不同
氧、硅、铝、
铁、钙
铝
金属元素
非金属元素
2.元素符号
(1)书写规则:国际上统一采用元素拉丁文名称的第一个字母(大写)来表示元素,如氢元素的符号为H;如果几种元素拉丁文名称的第一个字母相同,就附加一个小写字母来区别,如Cu表示铜元素,Ca表示钙元素;
(2)意义:
①宏观意义:a.表示一种_____,如Fe表示_______;b.表示由_____构成的一种物质,如Fe表示____________。
②微观意义:a.表示一种______;b.表示一个______,如果在元素符号前加数字,表示几个该原子,此时该符号只表示微观意义。
元素
铁元素
原子
铁这种物质
原子
原子
3.元素周期表
元素周期表共有7个横行,18个纵行。每一个横行叫做一个______,每一个纵行叫做一个____(8、9、10三个纵行共同组成一个族)。
由元素周期表的一格获取的信息:
①元素名称、原子序数、元素符号、
相对原子质量的判断;
②金属元素和非金属元素的判断
a.“钅”字旁的都是金属元素(汞除外),如图A;
b.“气”、“石”、“氵”字旁的是非金属元素,如图B。
原子
序数
相同原
子质量
周期
族
混合物 纯净物
宏观
微观
性质
例如
不同种物质组成
一种物质组成
不同种分子构成
同种分子构成
没有固定的组成,各组分保持各自的化学性质。没有固定的熔点和沸点。
具有固定的组成,具有固定的熔点、沸点;具有固定的化学性质。
空气是混合物,由氧气、二氧化碳、氮气等组成,含有N2、O2、CO2、等不同种分子。
水是纯净物,由水(H2O)分子构成;氧气是纯净物,由氧(O2)分子构成。
4.混合物与纯净物的比较
物质组成的表示
03
知识清单
1.化合价及其表示方法
(1)概念:元素之间相互化合时,各元素的原子的 总是一定的,各种原子的个数用 来表示;
(2)化合价的表示方法:在元素符号(或原子团)正上方用带“+”与“-”的数字表示;
(3)常见元素的化合价:钾、钠、银、氢+1价;氟、氯、溴、碘-1价;钙、镁、锌、钡+2价;通常氧显-2价;铜1、2,铁2、3;铝3硅4磷+5;碳、氮、磷、硫、氯、锰可变价。
个数比
化合价
(4)化合价的一般规律:
①常见的化合物中,氢元素总是显 价、氧元素总是显 价;
②金属元素在化合物中常显 价;
③非金属元素与氧元素化合时常显 价,与氢元素及金属元素化合时常显 价;
④单质中元素的化合价为 价;
⑤在化合物里,元素正负化合价的代数和为 ;
⑥有些元素在不同的化合物里常显不同的化合价,如NH4NO3中的氮元素的化合价依次为 和 。
+1
-2
正
正
零
零
-3
+5
负
2. 化学式
(1)单质:金属单质、稀有气体单质、常温下为固态的非金属单质三类由原子构成的物质—用元素符号表示(如Fe、He、C);由双原子或多原子分子构成—在元素符号右下角标出原子个数(如O2、H2、O3);
(2)化合物:按左 价元素,右 价元素,写出物质的元素符号(特例:NH3氨气、CH4甲烷);根据化合物中正负化合价代数和为 的原则,确定各元素的原子个数或原子个数比(特例:H2O2);在各元素符号
标出各原子数(1省略不写);检查化学式(必须符合实际)。当原子团不是一个时需要加括号,并把个数写在括号的右下角(1省略不写)。
正
负
零
右下角
(3)化学式的含义
①表示某种物质;(宏观)
②表示某种物质的元素组成;(宏观)
③表示某种物质的一个分子或一个原子或离子构成情况;(微观)
④表示某种物质的一个分子的构成。(微观)
特别提醒:
(1)物质的化学式是经过实验确定的,一种物质只有一个化学式;
(2)若在化学式前加系数,失去宏观意义,只能表示微观意义,
如“2H2O”表示2个水分子。
3.物质组成的定量表示
以化学式AxBy为例总结定量表示的有关计算公式(a为A元素的相对原子质量,b为B元素的相对原子质量)
AxBy的相对分子质量=ax+by
AxBy中A、B元素的质量比=ax:by
AxBy中A元素的质量分数
mgAxBy中A元素的质量
ax
ax+by
= ×100%
ax
ax+by
=mg× ×100%
1.某些花岗岩石材中含有放射性元素——氡,已知一种氡原子的相对原子质量为222,其原子核内含有86个质子,则这种氡原子核内含有 ( )个中子,核外含有( )个电子。
A.86 B.136 C.222 D.308
B
课堂达标
A
2.微粒是构成化学物质的基础,下列对微粒的描述正确的是( )
A. 仅由碳原子构成的物质属于纯净物
B. 原子中一定含有质子、中子、电子
C. NaCl是由离子构成的,所以HCl也是由离子构成的
D. Cl的离子结构示意图为
D
课堂达标
3.实验测定某物质只含有一种元素,则关于该物质的说法中,正确的是( )
A.可能是单质或化合物
B.可能是纯净物或混合物
C.一定是纯净物
D.一定是一种单质
B
课堂达标
4.已知锌的化合价为+2价,硫的化合价有-2、+4和+6价。根据此处提供的化合价,某同学认为锌与硫形成的化合物的化学式有:①Zn2S;②ZnS;③ZnS2;④ZnS3。其中正确的是( )
A.①和② B.仅是② C.②③④ D.全是
B
课堂达标
5.民间常用川乌、草乌泡制药酒。川乌、草乌含有少量有毒物质乌头碱(化学式为C34H47NO11),药酒使用不当会造成中毒。下列关于乌头碱的说法不正确的是( )
A.乌头碱由四种元素组成
B.乌头碱分子中C、H原子个数比为34∶47
C.乌头碱在空气中充分燃烧后的生成物只有CO2和H2O
D.每个乌头碱分子由93个原子构成
C
课堂达标
6.下列粒子中属于原子的是 ;
属于离子的是 。
课堂达标
A
C
D
F
B
E
G
H
课堂达标
7.下图所示原子的核电荷数为 ,核外有 个电子层,第一层有 个电子,次外层上有 个电子,最外层有 个电子,属于 类原子,在化学反应中容
易 电子,形成 。
12
3
8
2
金属
失去
阳离子
2
课堂达标
8.根据右图回答问题:
⑴该元素的原子序数=_____;
质子数=______;电子数为=_____;
相对原子质量为 。
⑵该元素名称为 ,元素符号
为 , 属于 类
元素。在化学反应中容易 电子,形成 。
16
16
16
32.06
硫
S
非金属
得到
阴离子
9.如图是部分微粒的结构
示意图,请按要求用数字序号填空:
(1)属于原子的是______。
(2)属于同种元素的是______。
(3)易得电子的是____。
(4)具有相对稳定结构的是______。
课堂达标
①②
①③
②
③④
10.已知碘元素(元素符号为Ⅰ)原子结构示意图为 ,请回答下列问题:
(1)x的值为_____。
(2)一般情况下,原子的最外层电子数相同,元素具有相似的化学性质。上图四种元素的化学性质与碘元素的化学性质最相似的是_____。
课堂达标
53
C
11.下图是表示气体微粒的示意图,图中的“○”和“●”分别表示两种不同元素的原子,那么其中表示混合物的是 ,表示单质的是 ,表示化合物的是 。
课堂达标
①③
④
②
12.一种新型环保材料被塑胶跑道工程广泛应用,合成这种新材料的原料是二甲苯烷二异氰酸酯(其分子式为C15H10N2O2)。请回答下列有关问题:
(1)二甲苯烷二异氰酸酯(C15H10N2O2)中氢、氧元素的质量比为 (填最简整数比);
(2)二甲苯烷二异氰酸酯(C15H10N2O2)的相对分子质量为 ;
(3)500g二甲苯烷二异氰酸酯中含氮元素的质量为 g。
5:16
课堂达标
250
56
谢谢您的观看
THANKS
感受化学魅力
探寻化学之美
同课章节目录
