2.3 物质组成的表示(二)课件(共32张PPT)
文档属性
| 名称 | 2.3 物质组成的表示(二)课件(共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 19.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-14 22:47:38 | ||
图片预览











文档简介
(共32张PPT)
感受化学魅力
探寻化学之美
认识物质的构成
第二单元
第三节
物质组成的表示(二)
目
录
CONTENTS
1
掌握化合价的一般规律,会根据化合价写化学式及用化学式求化合价
2
了解相对分子质量的含义,能利用相对原子质量进行有关简单计算
3
进一步建立宏观、微观和符号三重表征的思维方式
感受化学魅力
探寻化学之美
重点:根据化合价写化学式,利用相对分子质量的有关计算计算
难点:建立宏观、微观和符号三重表征的思维方式
上节课学了常见元素和原子团的化合价,谁能熟练背诵?
物质的组成是通过实验测得的,化学式的书写必须依据客观事实。只有确切知道某种化合物的存在,才可能根据元素化合价写出它的化学式,而不能随意写出实际上不存在的物质的化学式。
课堂导入
化学式与化合价
一、
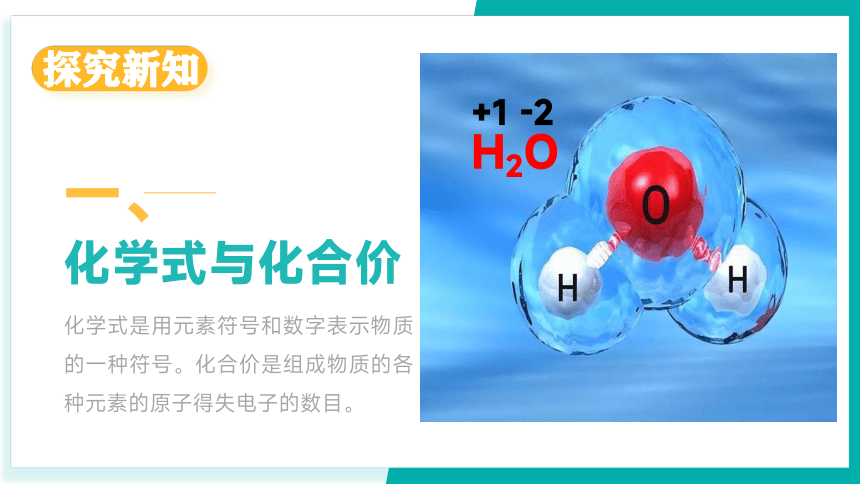
化学式是用元素符号和数字表示物质的一种符号。化合价是组成物质的各种元素的原子得失电子的数目。
探究新知
H2O
+1 -2
常见元素和原子团的化合价
名称 符号 化合价 名称 符号 化合价
钠 Na +1 碳 C +2 +4
钙 Ca +2 氯 Cl -1
钾 K +1 硫 S -2 +4 +6
镁 Mg +2 氮 N -3 +2 +4 +5
铝 Al +3 氢氧根 OH -1
锌 Zn +2 碳酸根 CO3 -2
铁 Fe +2 +3 硝酸根 NO3 -1
铜 Cu +2 硫酸根 SO4 -2
氢 H +1 铵 根 NH4 +1
氧 O -2
①从左表中可以看出金属元素和非金属元素的化合价各有什么特点?
②根据元素的化合价,计算MgO、MgCl2、H2O中各元素的正负化合价之和。
交流共享
探究新知
化合价的一般规律
②化合物中各种元素化合价的代数和为零;
⑤单质中元素的化合价为零。
①通常,金属元素显正价,非金属元素显负价;
④一些元素在不同物质中可显不同的化合价,
③一些元素在同一物质中可显不同的化合价,
例:FeO Fe2O3
+2
+3
例: NH4NO3
(硝酸铵)
-3
+5
(氧化亚铁)
(氧化铁、三氧化二铁)
活动探究2-2
化合价的应用
写出组成该物质的元素符号,正价在前、负价在后。 Al O
标上元素的化合价 Al O
计算元素化合价绝对值的最小公倍数 2×3=6
求出原子的个数 6÷3=2,6÷2=3
将原子个数分别写在元素符号的右下方 Al2O3
检验 (+3)×2 +(-2)×3=0
(1)已知化合价求化学式 例1:写出氧化铝的化学式
+3
-2
交叉法
Al2 O3
+3
-2
活动探究2-2
化合价的应用
设铁元素的化合价为X
明确氧元素的化合价为-2
计算(化合物中各元素的代数和为零)
X×2 +(-2)×3=0
X=+3
将化合价写在化学式中铁元素的上方Fe2O3
(2)已知化学式求化合价 例2:求Fe2O3中铁元素的化合价
化合价
化学式
二、
组成物质的各元素之间存在着固定的质量关系,而化学式就反映了物质中的这种质量关系。
物质组成的定量表示
化学式量:化学式中各原子的相对原子质量的总和。
对于由分子构成的物质,其化学式量也叫相对分子质量。
化学式量(相对分子质量)
例1:求H2、H2O的相对分子质量。
H2的相对分子质量为1×2=2
H2O的相对分子质量为1×2+16×1=18
以化学式AxBy为例总结相对分子质量的计算公式
(a为A元素的相对原子质量,b为B元素的相对原子质量)
AxBy的相对分子质量=ax+by
Cl2的相对分子质量为35.5×2=71
CO2的相对分子质量为12×1+16×2=44
练习1:求Cl2、CO2、Ca(OH)2的相对分子质量。
(H 1 C 12 O 16 Cl 35.5 Ca 40)
Ca(OH)2的相对分子质量为40×1+(16+1)×2=74
例2:计算水中氢元素与氧元素的质量比。
计算组成物质的各种元素的质量比
由上图可知,水中氢元素与氧元素的质量比
=(氢元素的相对原子质量×水分子中氢原子个数):(氢元素的相对原子质量×水分子中氢原子个数)
=(1×2):(16×1)=1:8
AxBy中A、B元素的质量比
水中氢元素与氧元素的质量比
所有水分子中氢原子
与氧原子的质量比
1个水分子中氢原子
与氧原子的质量比
=
=
=ax:by
练习2:计算硝酸铵( NH4NO3 )中各元素的质量比。
N∶H∶O
=(14×2)∶(1×4)∶(16×3)
= 7 ∶ 1 ∶ 12
注意某些物质的化学式中,同种元素并不是写在一起的,这时要注意原子个数。
例3:计算水中氢元素的质量分数。
计算物质中某元素的质量分数
AxBy中A元素的质量分数
水中氢元素的质量分数
= ×100%
= ×100%
≈11.1%
氢元素的相对原子质量×1个水分子中氢原子的个数
水的相对分子质量
1×2
1×2+16×1
ax
ax+by
= ×100%
练习3:计算NH4NO3中氮元素的质量分数。
—————————
14×2
14×2+1×4+16×3
×100%
=
28
80
×100%
=
35%
—————
注意某些物质的化学式中,同种元素并不是写在一起的,这时要注意原子个数。
例4:求60g NH4NO3中含有氮的质量 。
计算一定质量的物质中某元素的质量
mgAxBy中A元素的质量
= 60g × 35%
= 21g
ax
ax+by
=mg× ×100%
60g×—————————
14×2
14×2+1×4+16×3
×100%
练习4:求多少克二氧化碳中含有12g碳元素。
x = 44g
答:44g二氧化碳中含
有12g碳元素。
x×——————
12×1
12×1+16×2
×100%=12g
方法1:
解:设二氧化碳的质量为x。
方法2:
——————
12×1
12×1+16×2
×100%
——————————
12g
x = 44g
答:44g二氧化碳中含有12g碳元素。
1.神舟号载人飞船太空舱里常用NiFe2O4作催化剂将航天员呼出的二氧化碳转化为氧气。已知NiFe2O4中Fe为+3价,则Ni的化合价为( )
A.+1 B.+2 C.+3 D.+4
B
课堂达标
2.有NH3、N2、NO、X、HNO3五种物质,均含氮元素,且氮元素的化合价按一定的顺序排列,则物质X是 ( )
A.NO2 B.N2O
C.N2O5 D.NaNO3
A
课堂达标
课堂达标
3.免洗手消毒凝胶,其中含有正丙醇(C3H8O)。下列有关正丙醇的说法正确的是( )
A.正丙醇相对分子质量为60g
B.碳元素的质量分数是60%
C.碳、氢元素的质量比为3:8
D.正丙醇是混合物
B
4. “清明插柳,端午插艾。”艾草含有黄酮素(C15H10O2),它具有较高的药用价值。下列有关黄酮素的叙述正确的是( )
A.该分子中含有O2
B.黄酮素完全燃烧生成CO2和H2O
C.黄酮素由3个元素组成
D.黄酮素中碳、氢、氧元素质量比为15:10:2
B
课堂达标
课堂达标
5.未成年人正处于生长发育阶段,需要摄入比成年人更多的钙元素。如图为某钙片的商品标签,若某同学每天服用1片这种钙片,他每天至少可以摄入钙元素的质量为( )
A.0.8g B.1.2g
C.1.8g D.2g
A
6.我国化学家团队公布了最新研究成果:通过电催化结合生物合成的方式,将二氧化碳高效还原合成高浓度乙酸,进一步利用微生物可以合成葡萄糖(C6H12O6)和脂肪酸。这项突破为人工和半人工合成“粮食”提供了新技术。葡萄糖中碳、氢、氧的元素质量比为( )
A.1:1:1 B.1:2:1
C.6:1:6 D.6:1:8
D
课堂达标
7.含有杂质的NH4NO3化肥样品,经测定其含氮量为38%,则其中含有的杂质可能为( )
A.NH4HCO3 B.(NH4)2SO4
C.NH4Cl D.CO(NH2)2
D
课堂达标
8. “芯片”是电子产品的核心部件,氮化镓是制造芯片的材料之一,如图是镓元素(Ga)的原子结构示意图及元素周期表的一部分。下列说法不正确的是( )
A.镓属于金属元素,m=3
B.氯化镓的化学式为GaCl2
C.镓元素的位置应该在Z处
D.镓的最外层电子数与A1相同
B
课堂达标
9.有些年轻人喜欢染发,染发时一般要用到一种着色剂﹣对苯二胺,它是一种有毒的化学药品,有致癌性,会对染发者的身体带来伤害,其分子结构如图所示。下列有关对苯二胺的说法不正确的是( )
A.对苯二胺的化学式为C6H8N2
B.对苯二胺的相对分子质量为108g
C.对苯二胺中碳、氢、氮元素的质量比为18:2:7
D.对苯二胺对人体有害
B
课堂达标
课堂达标
10.碘元素是人体必需的微量元素之,碘缺乏会引起甲状腺肿大,幼儿缺碘会影响生长发育,造成思维迟钝,过量也会引起甲状腺肿大。请根据图示回答下列问题。
(1)碘元素的相对原子质量为 _____。
(2)氯元素和碘元素的化学性质相似,原因是 _____。
(3)碘元素与镁元素形成的化合物的化学式为 _____。
(4)我国采用在食盐中添加碘酸钾(KIO3)的方法来防止人体缺碘,碘酸钾中碘元素的化合价 _____价。
126.9
最外层电子数相同
MgI2
+5
课堂达标
11. 免洗手消毒凝胶,其中含有正丙醇(化学式为C3H8O)。请回答下列问题:
(1)正丙醇的相对分子质量为 。
(2)正丙醇中碳元素和氢元素的质量比为 (写出最简整数比)。
(3)6g正丙醇中氧元素的质量为 g。
60
9:2
1.6
课堂达标
12.在江南,有句俗语叫做“清明螺赛肥鹅”,螺蛳之所以鲜美是因为螺肉内含有谷氨酸等多种增鲜物质,已知谷氨酸的化学式为C5H9NO4,回答以下问题:
(1)该物质是由 ___种元素组成。
(2)该物质中碳、氧元素的质量比是 ___。
(3)14.7g谷氨酸中氧元素的质量与多少g
Ca(OH)2中氧元素的质量相等?(要求写出计算过程)
课堂达标
解:(1)有化学式可知,含有碳、氢、氮、氧4种元素;
(2)该物质中碳、氧元素的质量比是(12×5):(16×4)=15:16;
(3)设氢氧化钙的质量为x
14.7g× =x×
x=14.8g
答:14.7g谷氨酸中氧元素质量与14.8gCa(OH)2中氧元素质量相等。
——————————
16×4
12×5+1×9+14+16×4
×100%
———————
16×2
40+(16+1)×2
×100%
知识总结
不良反应
1.化合价的规律:
(1)通常,金属元素显正价,非金属元素显负价;(2)一些元素在不同物质中可显不同的化合价;
(3)一些元素在同一物质中可显不同的化合价;(4)化合物中各种元素化合价的代数和为零;
(5)单质中元素的化合价为零。
2.化合价与化学式
(1)用化合价写化学式—最小公倍数法、交叉法 (2)用化学式求化合价
3.物质组成的定量表示
(1)相对分子质量 (2)计算组成物质的各元素的质量比
(3)计算物质中某元素的质量分数 (4)计算物质中某元素的质量
谢谢您的观看
THANKS
感受化学魅力
探寻化学之美
感受化学魅力
探寻化学之美
认识物质的构成
第二单元
第三节
物质组成的表示(二)
目
录
CONTENTS
1
掌握化合价的一般规律,会根据化合价写化学式及用化学式求化合价
2
了解相对分子质量的含义,能利用相对原子质量进行有关简单计算
3
进一步建立宏观、微观和符号三重表征的思维方式
感受化学魅力
探寻化学之美
重点:根据化合价写化学式,利用相对分子质量的有关计算计算
难点:建立宏观、微观和符号三重表征的思维方式
上节课学了常见元素和原子团的化合价,谁能熟练背诵?
物质的组成是通过实验测得的,化学式的书写必须依据客观事实。只有确切知道某种化合物的存在,才可能根据元素化合价写出它的化学式,而不能随意写出实际上不存在的物质的化学式。
课堂导入
化学式与化合价
一、
化学式是用元素符号和数字表示物质的一种符号。化合价是组成物质的各种元素的原子得失电子的数目。
探究新知
H2O
+1 -2
常见元素和原子团的化合价
名称 符号 化合价 名称 符号 化合价
钠 Na +1 碳 C +2 +4
钙 Ca +2 氯 Cl -1
钾 K +1 硫 S -2 +4 +6
镁 Mg +2 氮 N -3 +2 +4 +5
铝 Al +3 氢氧根 OH -1
锌 Zn +2 碳酸根 CO3 -2
铁 Fe +2 +3 硝酸根 NO3 -1
铜 Cu +2 硫酸根 SO4 -2
氢 H +1 铵 根 NH4 +1
氧 O -2
①从左表中可以看出金属元素和非金属元素的化合价各有什么特点?
②根据元素的化合价,计算MgO、MgCl2、H2O中各元素的正负化合价之和。
交流共享
探究新知
化合价的一般规律
②化合物中各种元素化合价的代数和为零;
⑤单质中元素的化合价为零。
①通常,金属元素显正价,非金属元素显负价;
④一些元素在不同物质中可显不同的化合价,
③一些元素在同一物质中可显不同的化合价,
例:FeO Fe2O3
+2
+3
例: NH4NO3
(硝酸铵)
-3
+5
(氧化亚铁)
(氧化铁、三氧化二铁)
活动探究2-2
化合价的应用
写出组成该物质的元素符号,正价在前、负价在后。 Al O
标上元素的化合价 Al O
计算元素化合价绝对值的最小公倍数 2×3=6
求出原子的个数 6÷3=2,6÷2=3
将原子个数分别写在元素符号的右下方 Al2O3
检验 (+3)×2 +(-2)×3=0
(1)已知化合价求化学式 例1:写出氧化铝的化学式
+3
-2
交叉法
Al2 O3
+3
-2
活动探究2-2
化合价的应用
设铁元素的化合价为X
明确氧元素的化合价为-2
计算(化合物中各元素的代数和为零)
X×2 +(-2)×3=0
X=+3
将化合价写在化学式中铁元素的上方Fe2O3
(2)已知化学式求化合价 例2:求Fe2O3中铁元素的化合价
化合价
化学式
二、
组成物质的各元素之间存在着固定的质量关系,而化学式就反映了物质中的这种质量关系。
物质组成的定量表示
化学式量:化学式中各原子的相对原子质量的总和。
对于由分子构成的物质,其化学式量也叫相对分子质量。
化学式量(相对分子质量)
例1:求H2、H2O的相对分子质量。
H2的相对分子质量为1×2=2
H2O的相对分子质量为1×2+16×1=18
以化学式AxBy为例总结相对分子质量的计算公式
(a为A元素的相对原子质量,b为B元素的相对原子质量)
AxBy的相对分子质量=ax+by
Cl2的相对分子质量为35.5×2=71
CO2的相对分子质量为12×1+16×2=44
练习1:求Cl2、CO2、Ca(OH)2的相对分子质量。
(H 1 C 12 O 16 Cl 35.5 Ca 40)
Ca(OH)2的相对分子质量为40×1+(16+1)×2=74
例2:计算水中氢元素与氧元素的质量比。
计算组成物质的各种元素的质量比
由上图可知,水中氢元素与氧元素的质量比
=(氢元素的相对原子质量×水分子中氢原子个数):(氢元素的相对原子质量×水分子中氢原子个数)
=(1×2):(16×1)=1:8
AxBy中A、B元素的质量比
水中氢元素与氧元素的质量比
所有水分子中氢原子
与氧原子的质量比
1个水分子中氢原子
与氧原子的质量比
=
=
=ax:by
练习2:计算硝酸铵( NH4NO3 )中各元素的质量比。
N∶H∶O
=(14×2)∶(1×4)∶(16×3)
= 7 ∶ 1 ∶ 12
注意某些物质的化学式中,同种元素并不是写在一起的,这时要注意原子个数。
例3:计算水中氢元素的质量分数。
计算物质中某元素的质量分数
AxBy中A元素的质量分数
水中氢元素的质量分数
= ×100%
= ×100%
≈11.1%
氢元素的相对原子质量×1个水分子中氢原子的个数
水的相对分子质量
1×2
1×2+16×1
ax
ax+by
= ×100%
练习3:计算NH4NO3中氮元素的质量分数。
—————————
14×2
14×2+1×4+16×3
×100%
=
28
80
×100%
=
35%
—————
注意某些物质的化学式中,同种元素并不是写在一起的,这时要注意原子个数。
例4:求60g NH4NO3中含有氮的质量 。
计算一定质量的物质中某元素的质量
mgAxBy中A元素的质量
= 60g × 35%
= 21g
ax
ax+by
=mg× ×100%
60g×—————————
14×2
14×2+1×4+16×3
×100%
练习4:求多少克二氧化碳中含有12g碳元素。
x = 44g
答:44g二氧化碳中含
有12g碳元素。
x×——————
12×1
12×1+16×2
×100%=12g
方法1:
解:设二氧化碳的质量为x。
方法2:
——————
12×1
12×1+16×2
×100%
——————————
12g
x = 44g
答:44g二氧化碳中含有12g碳元素。
1.神舟号载人飞船太空舱里常用NiFe2O4作催化剂将航天员呼出的二氧化碳转化为氧气。已知NiFe2O4中Fe为+3价,则Ni的化合价为( )
A.+1 B.+2 C.+3 D.+4
B
课堂达标
2.有NH3、N2、NO、X、HNO3五种物质,均含氮元素,且氮元素的化合价按一定的顺序排列,则物质X是 ( )
A.NO2 B.N2O
C.N2O5 D.NaNO3
A
课堂达标
课堂达标
3.免洗手消毒凝胶,其中含有正丙醇(C3H8O)。下列有关正丙醇的说法正确的是( )
A.正丙醇相对分子质量为60g
B.碳元素的质量分数是60%
C.碳、氢元素的质量比为3:8
D.正丙醇是混合物
B
4. “清明插柳,端午插艾。”艾草含有黄酮素(C15H10O2),它具有较高的药用价值。下列有关黄酮素的叙述正确的是( )
A.该分子中含有O2
B.黄酮素完全燃烧生成CO2和H2O
C.黄酮素由3个元素组成
D.黄酮素中碳、氢、氧元素质量比为15:10:2
B
课堂达标
课堂达标
5.未成年人正处于生长发育阶段,需要摄入比成年人更多的钙元素。如图为某钙片的商品标签,若某同学每天服用1片这种钙片,他每天至少可以摄入钙元素的质量为( )
A.0.8g B.1.2g
C.1.8g D.2g
A
6.我国化学家团队公布了最新研究成果:通过电催化结合生物合成的方式,将二氧化碳高效还原合成高浓度乙酸,进一步利用微生物可以合成葡萄糖(C6H12O6)和脂肪酸。这项突破为人工和半人工合成“粮食”提供了新技术。葡萄糖中碳、氢、氧的元素质量比为( )
A.1:1:1 B.1:2:1
C.6:1:6 D.6:1:8
D
课堂达标
7.含有杂质的NH4NO3化肥样品,经测定其含氮量为38%,则其中含有的杂质可能为( )
A.NH4HCO3 B.(NH4)2SO4
C.NH4Cl D.CO(NH2)2
D
课堂达标
8. “芯片”是电子产品的核心部件,氮化镓是制造芯片的材料之一,如图是镓元素(Ga)的原子结构示意图及元素周期表的一部分。下列说法不正确的是( )
A.镓属于金属元素,m=3
B.氯化镓的化学式为GaCl2
C.镓元素的位置应该在Z处
D.镓的最外层电子数与A1相同
B
课堂达标
9.有些年轻人喜欢染发,染发时一般要用到一种着色剂﹣对苯二胺,它是一种有毒的化学药品,有致癌性,会对染发者的身体带来伤害,其分子结构如图所示。下列有关对苯二胺的说法不正确的是( )
A.对苯二胺的化学式为C6H8N2
B.对苯二胺的相对分子质量为108g
C.对苯二胺中碳、氢、氮元素的质量比为18:2:7
D.对苯二胺对人体有害
B
课堂达标
课堂达标
10.碘元素是人体必需的微量元素之,碘缺乏会引起甲状腺肿大,幼儿缺碘会影响生长发育,造成思维迟钝,过量也会引起甲状腺肿大。请根据图示回答下列问题。
(1)碘元素的相对原子质量为 _____。
(2)氯元素和碘元素的化学性质相似,原因是 _____。
(3)碘元素与镁元素形成的化合物的化学式为 _____。
(4)我国采用在食盐中添加碘酸钾(KIO3)的方法来防止人体缺碘,碘酸钾中碘元素的化合价 _____价。
126.9
最外层电子数相同
MgI2
+5
课堂达标
11. 免洗手消毒凝胶,其中含有正丙醇(化学式为C3H8O)。请回答下列问题:
(1)正丙醇的相对分子质量为 。
(2)正丙醇中碳元素和氢元素的质量比为 (写出最简整数比)。
(3)6g正丙醇中氧元素的质量为 g。
60
9:2
1.6
课堂达标
12.在江南,有句俗语叫做“清明螺赛肥鹅”,螺蛳之所以鲜美是因为螺肉内含有谷氨酸等多种增鲜物质,已知谷氨酸的化学式为C5H9NO4,回答以下问题:
(1)该物质是由 ___种元素组成。
(2)该物质中碳、氧元素的质量比是 ___。
(3)14.7g谷氨酸中氧元素的质量与多少g
Ca(OH)2中氧元素的质量相等?(要求写出计算过程)
课堂达标
解:(1)有化学式可知,含有碳、氢、氮、氧4种元素;
(2)该物质中碳、氧元素的质量比是(12×5):(16×4)=15:16;
(3)设氢氧化钙的质量为x
14.7g× =x×
x=14.8g
答:14.7g谷氨酸中氧元素质量与14.8gCa(OH)2中氧元素质量相等。
——————————
16×4
12×5+1×9+14+16×4
×100%
———————
16×2
40+(16+1)×2
×100%
知识总结
不良反应
1.化合价的规律:
(1)通常,金属元素显正价,非金属元素显负价;(2)一些元素在不同物质中可显不同的化合价;
(3)一些元素在同一物质中可显不同的化合价;(4)化合物中各种元素化合价的代数和为零;
(5)单质中元素的化合价为零。
2.化合价与化学式
(1)用化合价写化学式—最小公倍数法、交叉法 (2)用化学式求化合价
3.物质组成的定量表示
(1)相对分子质量 (2)计算组成物质的各元素的质量比
(3)计算物质中某元素的质量分数 (4)计算物质中某元素的质量
谢谢您的观看
THANKS
感受化学魅力
探寻化学之美
同课章节目录
