九年级化学实验探究专题复习染织 工业中的化学 教学课件
文档属性
| 名称 | 九年级化学实验探究专题复习染织 工业中的化学 教学课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 115.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-15 00:00:00 | ||
图片预览






文档简介
(共21张PPT)
是中国民间传统而独特的手工染色工艺,织物在染色时部分结扎起来使之不能着色的染色方法,中国传统的手工染色技术之一。云南大理的白族扎染技艺、四川的自贡扎染技艺曾先后被文化部列入国家级非物质文化遗产。
扎 染
——初中化学实验探究
碱煮
酸
洗
漂
白
染
色
444
“贝壳(CaCO3)灼烧得到贝壳灰(CaO),加水混合制成石灰乳(Ca(OH)2),再与草木灰水(K2CO3)混合,过滤即得氢氧化钾溶液。”
、 、 。
CaCO3= CaO+CO2↑
Ca(OH)2+K2CO3=2KOH+CaCO3↓
CaO+H2O=Ca(OH)2
高温
碱 煮
(1)某兴趣小组对“混合加水所得溶液”的成分进行了探究。
【提出问题】将烧杯丙中混合物过滤后得到澄清溶液,所得溶液中溶质的成分是什么?
【猜想】
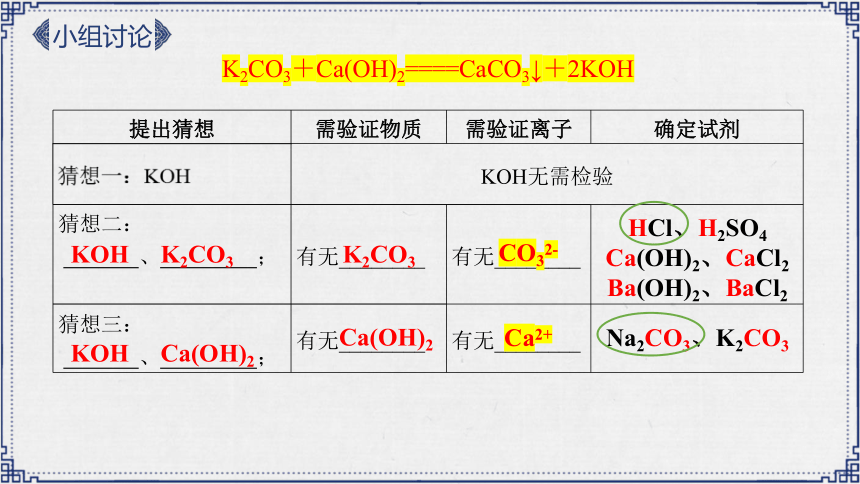
K2CO3+Ca(OH)2====CaCO3↓+2KOH
任务一:反应后物质成分的探究
提出猜想 需验证物质 需验证离子 确定试剂
KOH无需检验 猜想二: 、 ; 有无________ 有无________
猜想三: 、 ; 有无________ 有无________
Ca(OH)2
K2CO3
Ca2+
CO32-
HCl、H2SO4
Ca(OH)2、CaCl2
Ba(OH)2、BaCl2
Na2CO3、K2CO3
KOH K2CO3
KOH Ca(OH)2
K2CO3+Ca(OH)2====CaCO3↓+2KOH
小组讨论
实验探究
【反思评价】在分析化学反应后所得
物质的成分时,除考虑生成物外还需
考虑 。
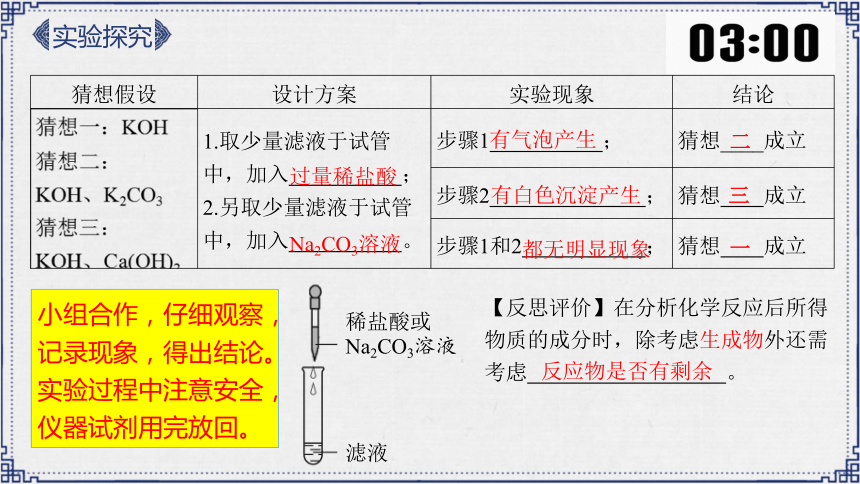
猜想假设 设计方案 实验现象 结论
1.取少量滤液于试管中,加入 ; 2.另取少量滤液于试管中,加入 。 步骤1 ; 猜想____成立
步骤2 ; 猜想 成立
步骤1和2 ; 猜想 成立
滤液
稀盐酸或
Na2CO3溶液
反应物是否有剩余
过量稀盐酸
二
Na2CO3溶液
三
一
小组合作,仔细观察,记录现象,得出结论。
实验过程中注意安全,
仪器试剂用完放回。
有气泡产生
有白色沉淀产生
都无明显现象
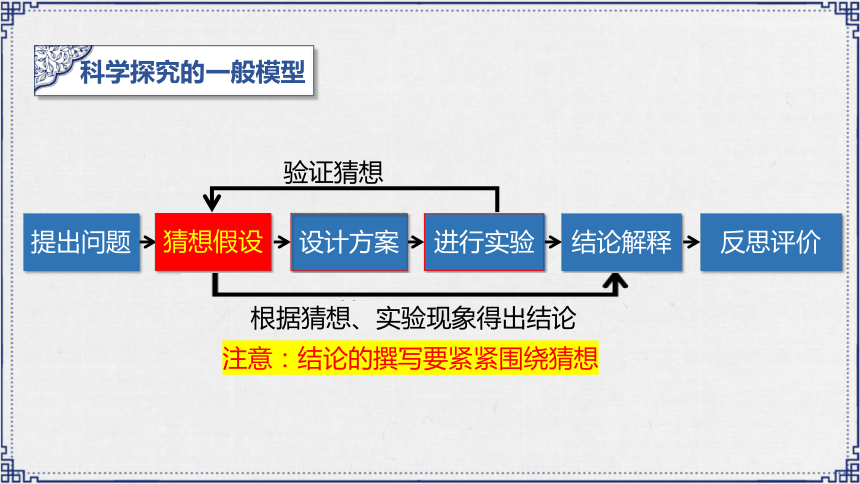
提出问题
猜想假设
进行实验
结论解释
反思评价
验证猜想
根据猜想、实验现象得出结论
注意:结论的撰写要紧紧围绕猜想
设计方案
猜想假设
444
科学探究的一般模型
为进一步探究稀盐酸和澄清石灰水反应后所得溶液中溶质的成分,兴趣小组的同学们进行如下探究活动。
【猜想假设】该组同学的猜想如下:
猜想一:只有 猜想二:有CaCl2和HCl
猜想三:有CaCl2和Ca(OH)2 猜想四:有CaCl2、HCl和Ca(OH)2
其他各兴趣小组的同学对以上猜想提出质疑,认为猜想四不合理,
理由是 。
CaCl2
HCl和Ca(OH)2能发生反应,不能共存
针 对 练 习
猜想假设 实验步骤 实验现象 实验结论
猜想一: 只有CaCl2 取少量反应后的溶液于试管中,加入硝酸银溶液,观察现象 有白色沉淀
生成 猜想一
成立
猜想二:有CaCl2和HCl 用镊子将锌粒放入试管中,向其中滴加反应后的溶液,观察现象 有 产生 猜想二
成立
猜想三:有CaCl2和Ca(OH)2 取少量反应后的溶液于试管中,加入CuCl2溶液,观察现象 无明显现象 猜想
不成立
三
气泡
【交流评价】老师对同学们能用多种方法进行探究,并且能够得出
结论给予表扬,同时指出上述实验探究中有明显的错误。同学们经过反
思后发现了错误,错误的原因是
。
CaCl2和HCl均能与硝酸银反应生成
AgCl白色沉淀,不能证明溶液中只含有CaCl2,故不能证明猜想一成立。
2.为保持碱煮较好的洗涤效果,制得的氢氧化钾溶液必须密封保存。
①小明猜想氢氧化钾与氢氧化钠性质相似,也能与二氧化碳反应,他的依据是二者都含有_______(用符号表示)。
②为验证猜想,进行实验探究(如图):向A、
B两个相同规格且充满CO2的瓶中分别注入等
体积的氢氧化钾溶液和蒸馏水,充分反应后
放在水平桌面上(U形管内为红墨水),观察到
___________________________的现象,则
猜想正确。
OH-
U形管中的液面左高右低
CO2
任务二:物质变质后成分的探究
3.现代“碱煮”使用的物质是烧碱。工业上利用电解饱和食盐水的方法获得烧碱。实验室有一瓶开封且久置的氢氧化钠溶液,某化学小组设计如下方案对其变质情况进行探究。
模 拟 命 题
我是小小命题人,根据下面的题头和科学探究的模型,仿照“任务一”和“针对练习”自主设计问题,完成“任务二物质变质后成分的探究”。
你可以这样回答:
我给他/她打 分,理由是
(他/她的错误是 应该
我的方案是 )
评 价 细 目 表 评价项目 具体内容 得分 总分
科学性 (5分) 设计合理、无知识性错误、有梯度
完整性 (5分) 考点全面、与生产生活相结合 创新性 (5分) 试题结构、设问新颖 语言表达 (5分) 声音洪亮、表述清晰 实验探究
【反思评价】CaCl2溶液必须过量的
原因是 ,
。
猜想假设 设计方案 实验现象 结论
猜想一: ; 猜想二: ; 1.取少量溶液于试管中,加入 ; 2.向1充分反应后溶液中,继续加入 。 1有 产生 2 。 猜想____成立
1有 产生 2 。 猜想____成立
待测液
过量的CaCl2溶液
酚酞溶液
过量CaCl2溶液
酚酞溶液
Na2CO3
白色沉淀
除尽溶液中的Na2CO3,
防止对NaOH的检验造成干扰
模 拟 命 题
小组合作,仔细观察,记录现象,得出结论。
实验过程中注意安全,
仪器试剂用完放回。
Na2CO3、NaOH
溶液变红
二
一
白色沉淀
无明显现象
【提出问题】该氢氧化钠溶液中溶质的成分是什么?
酸 洗
碱煮之后的布料表面残留的碱液(K2CO3和Ca(OH)2反应后的溶液)和铁锈斑会影响布料的手感和后续工艺,需要进行“酸洗”。
(1)写出稀硫酸除去铁锈的化学方程式:
;
(2)用过量的稀硫酸“酸洗”后,溶液中
一定有的阳离子是 ,
可能有的阳离子是 。
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Ca2+
Fe3+
K+
H+
小 结
提出问题
猜想假设
进行实验
结论解释
反思评价
验证猜想
根据猜想、实验现象得出结论
设计方案
猜想假设
444
科学探究的一般模型
能 力 提 升
1.学习复分解反应后,某化学兴趣小组的同学对初中化学常见的四种物质:
稀盐酸、CaCO3粉末、Na2SO4溶液、BaCl2溶液之间的反应进行如图所示的实验探究。
(1)大家一致认为试管①中不发生复分解反应,理由是_______________________
_。
(2)试管②中观察到的现象是__________________________。
试管③中发生反应的化学方程式为 。
(3)将试管③反应后的物质过滤,对滤液中溶质的成分探究:
【提出问题】滤液中溶质的成分是什么?
【猜想假设】
猜想一:NaCl;
猜想二:NaCl、Na2SO4;
猜想三:____________。
稀盐酸与硫酸钠溶液中解离出的离子不能相互结合生成气体、沉淀或水
白色粉末溶解,有气泡冒出
BaCl2+Na2SO4=BaSO4↓+2NaCl
NaCl、BaCl2
实验操作 实验现象 结论
步骤一:取少量滤液于试管中,加入适量BaCl2溶液 无明显现象 猜想____不成立
步骤二:取少量滤液于试管中,加入适量稀硫酸 有白色沉淀生成 猜想三成立
能 力 提 升
【设计实验】
【反思拓展】
Ⅰ.探究反应后溶液中溶质的成分,既要考虑生成物,又要考虑 是否有剩余。
Ⅱ.依据复分解反应发生的条件,步骤二中除可用稀硫酸外,选用 (填字母)也能达到同样的实验目的。
A.稀盐酸 B.氢氧化钠溶液 C.碳酸钠溶液
二
反应物
C
作 业
1.学习非遗染色技艺草木染,利用天然
植物汁液给漂白后布料染色。
2.完成学案上的课后拓展。
染 色
青出于蓝
而胜于蓝
是中国民间传统而独特的手工染色工艺,织物在染色时部分结扎起来使之不能着色的染色方法,中国传统的手工染色技术之一。云南大理的白族扎染技艺、四川的自贡扎染技艺曾先后被文化部列入国家级非物质文化遗产。
扎 染
——初中化学实验探究
碱煮
酸
洗
漂
白
染
色
444
“贝壳(CaCO3)灼烧得到贝壳灰(CaO),加水混合制成石灰乳(Ca(OH)2),再与草木灰水(K2CO3)混合,过滤即得氢氧化钾溶液。”
、 、 。
CaCO3= CaO+CO2↑
Ca(OH)2+K2CO3=2KOH+CaCO3↓
CaO+H2O=Ca(OH)2
高温
碱 煮
(1)某兴趣小组对“混合加水所得溶液”的成分进行了探究。
【提出问题】将烧杯丙中混合物过滤后得到澄清溶液,所得溶液中溶质的成分是什么?
【猜想】
K2CO3+Ca(OH)2====CaCO3↓+2KOH
任务一:反应后物质成分的探究
提出猜想 需验证物质 需验证离子 确定试剂
KOH无需检验 猜想二: 、 ; 有无________ 有无________
猜想三: 、 ; 有无________ 有无________
Ca(OH)2
K2CO3
Ca2+
CO32-
HCl、H2SO4
Ca(OH)2、CaCl2
Ba(OH)2、BaCl2
Na2CO3、K2CO3
KOH K2CO3
KOH Ca(OH)2
K2CO3+Ca(OH)2====CaCO3↓+2KOH
小组讨论
实验探究
【反思评价】在分析化学反应后所得
物质的成分时,除考虑生成物外还需
考虑 。
猜想假设 设计方案 实验现象 结论
1.取少量滤液于试管中,加入 ; 2.另取少量滤液于试管中,加入 。 步骤1 ; 猜想____成立
步骤2 ; 猜想 成立
步骤1和2 ; 猜想 成立
滤液
稀盐酸或
Na2CO3溶液
反应物是否有剩余
过量稀盐酸
二
Na2CO3溶液
三
一
小组合作,仔细观察,记录现象,得出结论。
实验过程中注意安全,
仪器试剂用完放回。
有气泡产生
有白色沉淀产生
都无明显现象
提出问题
猜想假设
进行实验
结论解释
反思评价
验证猜想
根据猜想、实验现象得出结论
注意:结论的撰写要紧紧围绕猜想
设计方案
猜想假设
444
科学探究的一般模型
为进一步探究稀盐酸和澄清石灰水反应后所得溶液中溶质的成分,兴趣小组的同学们进行如下探究活动。
【猜想假设】该组同学的猜想如下:
猜想一:只有 猜想二:有CaCl2和HCl
猜想三:有CaCl2和Ca(OH)2 猜想四:有CaCl2、HCl和Ca(OH)2
其他各兴趣小组的同学对以上猜想提出质疑,认为猜想四不合理,
理由是 。
CaCl2
HCl和Ca(OH)2能发生反应,不能共存
针 对 练 习
猜想假设 实验步骤 实验现象 实验结论
猜想一: 只有CaCl2 取少量反应后的溶液于试管中,加入硝酸银溶液,观察现象 有白色沉淀
生成 猜想一
成立
猜想二:有CaCl2和HCl 用镊子将锌粒放入试管中,向其中滴加反应后的溶液,观察现象 有 产生 猜想二
成立
猜想三:有CaCl2和Ca(OH)2 取少量反应后的溶液于试管中,加入CuCl2溶液,观察现象 无明显现象 猜想
不成立
三
气泡
【交流评价】老师对同学们能用多种方法进行探究,并且能够得出
结论给予表扬,同时指出上述实验探究中有明显的错误。同学们经过反
思后发现了错误,错误的原因是
。
CaCl2和HCl均能与硝酸银反应生成
AgCl白色沉淀,不能证明溶液中只含有CaCl2,故不能证明猜想一成立。
2.为保持碱煮较好的洗涤效果,制得的氢氧化钾溶液必须密封保存。
①小明猜想氢氧化钾与氢氧化钠性质相似,也能与二氧化碳反应,他的依据是二者都含有_______(用符号表示)。
②为验证猜想,进行实验探究(如图):向A、
B两个相同规格且充满CO2的瓶中分别注入等
体积的氢氧化钾溶液和蒸馏水,充分反应后
放在水平桌面上(U形管内为红墨水),观察到
___________________________的现象,则
猜想正确。
OH-
U形管中的液面左高右低
CO2
任务二:物质变质后成分的探究
3.现代“碱煮”使用的物质是烧碱。工业上利用电解饱和食盐水的方法获得烧碱。实验室有一瓶开封且久置的氢氧化钠溶液,某化学小组设计如下方案对其变质情况进行探究。
模 拟 命 题
我是小小命题人,根据下面的题头和科学探究的模型,仿照“任务一”和“针对练习”自主设计问题,完成“任务二物质变质后成分的探究”。
你可以这样回答:
我给他/她打 分,理由是
(他/她的错误是 应该
我的方案是 )
评 价 细 目 表 评价项目 具体内容 得分 总分
科学性 (5分) 设计合理、无知识性错误、有梯度
完整性 (5分) 考点全面、与生产生活相结合 创新性 (5分) 试题结构、设问新颖 语言表达 (5分) 声音洪亮、表述清晰 实验探究
【反思评价】CaCl2溶液必须过量的
原因是 ,
。
猜想假设 设计方案 实验现象 结论
猜想一: ; 猜想二: ; 1.取少量溶液于试管中,加入 ; 2.向1充分反应后溶液中,继续加入 。 1有 产生 2 。 猜想____成立
1有 产生 2 。 猜想____成立
待测液
过量的CaCl2溶液
酚酞溶液
过量CaCl2溶液
酚酞溶液
Na2CO3
白色沉淀
除尽溶液中的Na2CO3,
防止对NaOH的检验造成干扰
模 拟 命 题
小组合作,仔细观察,记录现象,得出结论。
实验过程中注意安全,
仪器试剂用完放回。
Na2CO3、NaOH
溶液变红
二
一
白色沉淀
无明显现象
【提出问题】该氢氧化钠溶液中溶质的成分是什么?
酸 洗
碱煮之后的布料表面残留的碱液(K2CO3和Ca(OH)2反应后的溶液)和铁锈斑会影响布料的手感和后续工艺,需要进行“酸洗”。
(1)写出稀硫酸除去铁锈的化学方程式:
;
(2)用过量的稀硫酸“酸洗”后,溶液中
一定有的阳离子是 ,
可能有的阳离子是 。
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Ca2+
Fe3+
K+
H+
小 结
提出问题
猜想假设
进行实验
结论解释
反思评价
验证猜想
根据猜想、实验现象得出结论
设计方案
猜想假设
444
科学探究的一般模型
能 力 提 升
1.学习复分解反应后,某化学兴趣小组的同学对初中化学常见的四种物质:
稀盐酸、CaCO3粉末、Na2SO4溶液、BaCl2溶液之间的反应进行如图所示的实验探究。
(1)大家一致认为试管①中不发生复分解反应,理由是_______________________
_。
(2)试管②中观察到的现象是__________________________。
试管③中发生反应的化学方程式为 。
(3)将试管③反应后的物质过滤,对滤液中溶质的成分探究:
【提出问题】滤液中溶质的成分是什么?
【猜想假设】
猜想一:NaCl;
猜想二:NaCl、Na2SO4;
猜想三:____________。
稀盐酸与硫酸钠溶液中解离出的离子不能相互结合生成气体、沉淀或水
白色粉末溶解,有气泡冒出
BaCl2+Na2SO4=BaSO4↓+2NaCl
NaCl、BaCl2
实验操作 实验现象 结论
步骤一:取少量滤液于试管中,加入适量BaCl2溶液 无明显现象 猜想____不成立
步骤二:取少量滤液于试管中,加入适量稀硫酸 有白色沉淀生成 猜想三成立
能 力 提 升
【设计实验】
【反思拓展】
Ⅰ.探究反应后溶液中溶质的成分,既要考虑生成物,又要考虑 是否有剩余。
Ⅱ.依据复分解反应发生的条件,步骤二中除可用稀硫酸外,选用 (填字母)也能达到同样的实验目的。
A.稀盐酸 B.氢氧化钠溶液 C.碳酸钠溶液
二
反应物
C
作 业
1.学习非遗染色技艺草木染,利用天然
植物汁液给漂白后布料染色。
2.完成学案上的课后拓展。
染 色
青出于蓝
而胜于蓝
同课章节目录
