用反应势能图理解多重平衡体系 课件(35张PPT)
文档属性
| 名称 | 用反应势能图理解多重平衡体系 课件(35张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-15 00:00:00 | ||
图片预览







文档简介
(共35张PPT)
29题(反应原理)难点专题突破
用反应势能图理解多重平衡体系
多重平衡体系相互关联的多个可逆反应29(2020.7浙江选考)研究CO2氧化C2H6制C2H4对资源综合利用有重要意义。相关的主要化学反应有:Ⅰ C2H6(g) C2H4(g)+H2(g) ΔH1=136 kJ·mol 1Ⅱ C2H6(g)+CO2(g) C2H4(g)+H2O(g)+CO(g) ΔH2=177 kJ·mol 1Ⅲ C2H6(g)+2CO2(g) 4CO(g)+3H2(g) ΔH3Ⅳ CO2(g)+H2(g) CO(g)+H2O(g) ΔH4=41 kJ·mol 1二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g) CH3OH(g) +H2O(g)ΔH=- 49.4 kJ·mol-1该反应一般认为通过如下步骤来实现:反应I:CO2(g)+ H2(g) CO(g) +H2O(g)ΔH1=+41.1 kJ·mol-1反应Ⅱ:CO(g) +2H2(g) CH3OH(g)ΔH2过渡态理论
过渡态理论认为由反应物分子变成生成物分子,中间一定要
经过一个能量较高的过渡态,形成这个过渡态必须吸收一定的能
量,这个过渡态也称为活化络合物(用M 表示),所以又称为
活化络合物理论。
一、过渡态理论与反应势能图
反应原理p38
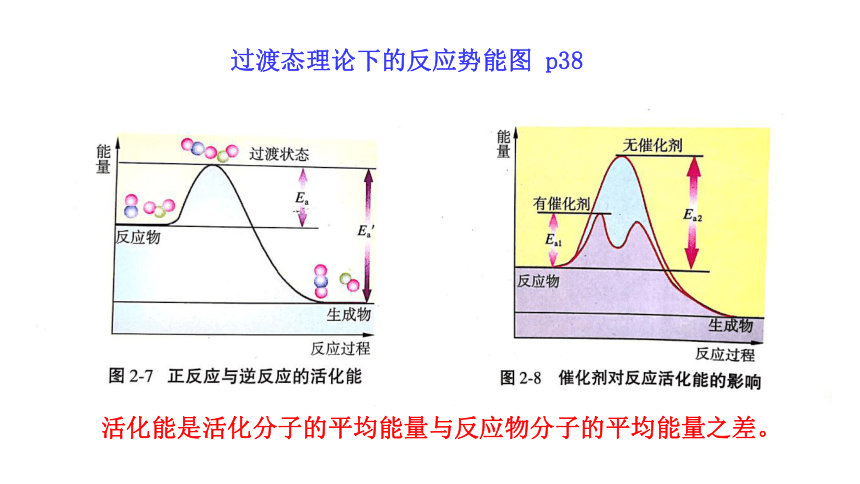
活化能是活化分子的平均能量与反应物分子的平均能量之差。
过渡态理论下的反应势能图 p38
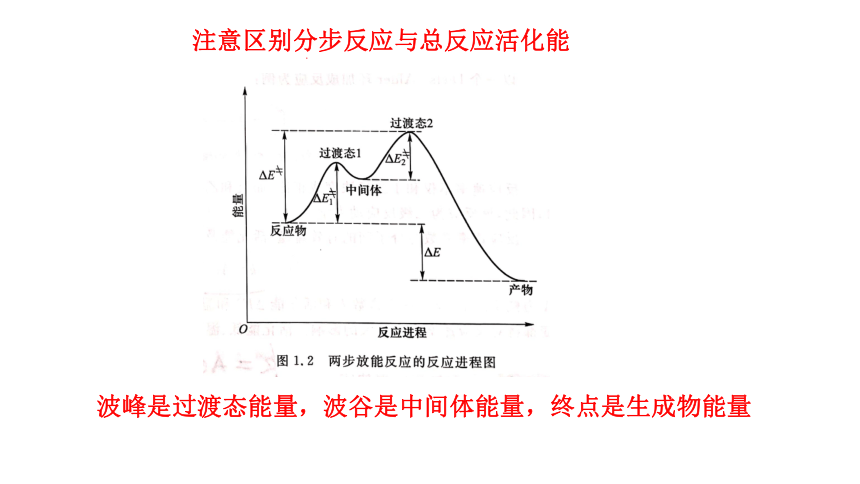
注意区别分步反应与总反应活化能
波峰是过渡态能量,波谷是中间体能量,终点是生成物能量
活化能低相对活化能高的反应有什么优势?
依据反应自发性,ΔH小(放热多)相对ΔH大(放热少)的反应
有什么优势?
结论1:
结论2:
活化能越低反应速率越快
在两个反应的熵变接近的前提下,ΔH越小平衡常数越大
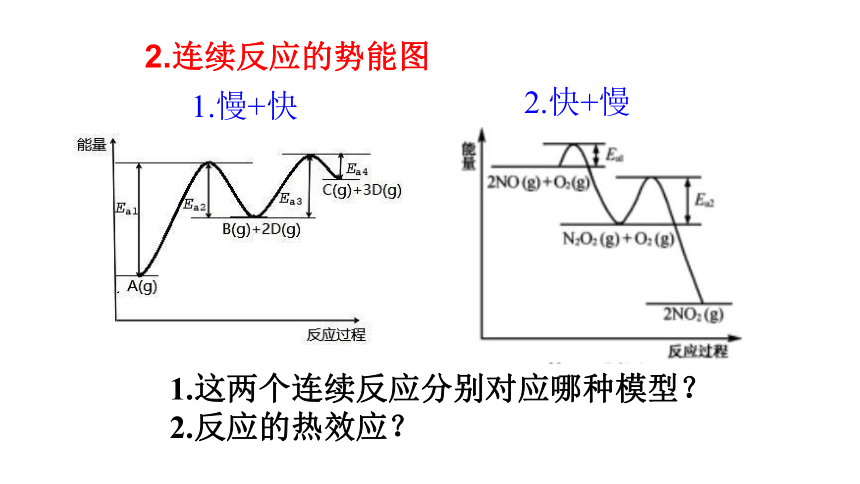
连续反应模型
二、连续反应与势能图
A+B C D
1
2
NO氧化反应:
2NO(g)+O2(g) 2NO2(g)分两步进行,
Ⅰ 2NO(g) +O2(g) N2O4(g ) △H1
Ⅱ N2O4(g) 2NO2(g) △H2
慢
快
慢
快
1.两种经典连续反应模型
A+B C D
A+B C D
2.快+慢
1.慢+快
1.这两个连续反应分别对应哪种模型?
2.反应的热效应?
2.连续反应的势能图
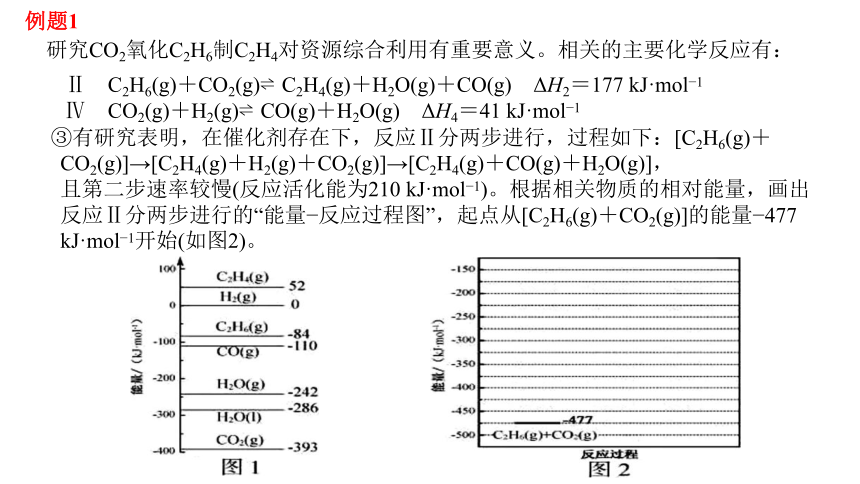
研究CO2氧化C2H6制C2H4对资源综合利用有重要意义。相关的主要化学反应有:
Ⅱ C2H6(g)+CO2(g) C2H4(g)+H2O(g)+CO(g) ΔH2=177 kJ·mol 1
Ⅳ CO2(g)+H2(g) CO(g)+H2O(g) ΔH4=41 kJ·mol 1
③有研究表明,在催化剂存在下,反应Ⅱ分两步进行,过程如下:[C2H6(g)+CO2(g)]→[C2H4(g)+H2(g)+CO2(g)]→[C2H4(g)+CO(g)+H2O(g)],
且第二步速率较慢(反应活化能为210 kJ·mol 1)。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量 反应过程图”,起点从[C2H6(g)+CO2(g)]的能量 477 kJ·mol 1开始(如图2)。
例题1
画反应势能图步骤(要点)
1.标明反应物、中间体、生成物的能量高低
3.考虑过渡态峰的相对高低
4.连线
2.标明反应物中间体生成物状态及量
2.快+慢
1.慢+快
请画出中间产物浓度随时间变化图
3.连续反应中间体浓度随时间变化
1.快+慢2.慢+快结论3:快+慢 中间产物浓度先快升后慢降,
慢+快 中间产物浓度一直维持低水平
3.连续反应中间体浓度随时间变化
十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:
C10H18(l) C10H12(l)+3H2(g) △H1 C10H12(l) C10H8(l)+2H2(g) △H2 △H1>△H2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,请回答:
(3)温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00 mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间变化关系如图1所示。
x1显著低于x2的原因是________________________________________。
例题2
催化剂显著降低了C10H12到C10H8的活化能,反应生成C10H12迅速转变为C10H8,使C10H12不能积累。
慢
快
慢
快
A+B C D
A+B C D
模型中,反应1正向移动对反应2施加何种影响?
4.两个分步反应的相互影响
吸热
放热
升温平衡1如何移动?
A+B C D
1
2
4.两个分步反应的相互影响
(2) NO氧化反应:2NO(g)+O2(g)=2NO2(g)分两步进行,反应过程能量变化示意图如图。
Ⅰ 2NO(g) N2O2(g) ΔH1 Ⅱ N2O2(g)+O2(g) 2NO2(g) ΔH2
①决定NO氧化反应速率的步骤是________(填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因____。
例题3
Ⅱ
T4
ΔH1<0,温度升高,反应Ⅰ平衡逆移,c(N2O2)减小;
浓度降低的影响大于温度对反应Ⅱ速率的影响。
1.并行反应模型
三、并行反应与势能图
A+B
C
D
用CO2直接加氢合成二甲醚包括以下二个相互关联的反应:
1.2CO2(g) + 6H2 (g) CH3OCH3 (g) + 3H2O (g) ΔH1= -73.3kJ/mol
2.CO2 (g) + H2 (g) CO (g) + H2O (g) ΔH2 =20.6 kJ/mol
2.并行反应势能图
1.哪个反应速率快?
2.哪个反应平衡常数大?
各有优势,D动力学优势产物,C热力学优势产物
反应进程
能量
一种经典并行反应势能图
萘与浓硫酸发生取代反应可以生成2种取代产物,反应进程中能量变化如图所示。其中相同投料,经历相同时间,不同反应温度时产物的比例不同,在40 °C和160°C时,得到1-取代产物与2-取代产物的比例分别为96:4和15:85,下列说法正确的是 A.1-取代产物比2-取代产物更稳定B.与40 °C相比,160°C时萘的平衡转化率更大C.选择合适的催化剂同样可以提高2-取代产物比率D.延长反应时间,最终以1-取代产物为主C例题4B
2.并行反应势能图
例题4
加压平衡1如何移动?
多重平衡体系中的平衡移动是相互影响的!
多重平衡体系中的平衡是同时平衡
A(g)+B (g)
2C (g)
3D (g)
1
2
3.并行反应的相互影响
例题5 用CO2直接加氢合成二甲醚包括以下二个相互关联的反应:
1.2CO2(g) + 6H2 (g) CH3OCH3 (g) + 3H2O (g) ΔH1= -73.3kJ/mol
2.CO2 (g) + H2 (g) CO (g) + H2O (g) ΔH2 =20.6 kJ/mol
温度、压强对反应CO2中平衡转化率和二甲醚的选择性的影响如图1、图2:
图1 CO2转化率随温度升高先降后升?
3.并行反应的相互影响
3.并行反应的产物选择性
如何控制(压强)条件提高D的选择性?
如何控制(温度)条件提高D的选择性?
吸热
放热
A(g)+B (g)
2C (g)
3D (g)
1
2
反应进程
能量
A+B
2C
3D
3.并行反应的产物选择性
(2)在一定反应时间内(未达平衡),升高温度对C的选择性有何影响?
结论4:一般情况下反应时间短(未达平衡)动力学产物有利,
反应时间长(平衡)热力学产物有利
(1)如何控制时间提高D的选择性?
v逆
t1 t2
t
v
v正
A+B 2C
放热
结论:升高温度活化能大的反应速率增加的多
结论5:一定反应时间内反应未达平衡前提下,高温对活化能高的热力产物更有利
反应速率时间图:升高温度
图2 二甲醚的选择性随压强升高而升高?
4.并行反应的产物选择性
例题5 用CO2直接加氢合成二甲醚包括以下二个相互关联的反应:
1.2CO2(g) + 6H2 (g) CH3OCH3 (g) + 3H2O (g) ΔH1= -73.3kJ/mol
2.CO2 (g) + H2 (g) CO (g) + H2O (g) ΔH2 =20.6 kJ/mol
温度、压强对反应CO2中平衡转化率和二甲醚的选择性的影响如图1、图2:
在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,
分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。
反应物起始浓度均为0.5 mol·L-1,反应30 min测得氯苯15%转化为
邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高
产物中邻二氯苯的比例,可采用的措施是______。
A.适当提高反应温度 B.改变催化剂
C.适当降低反应温度 D.改变反应物浓度
4.并行反应的产物选择性
速率之比决定浓度之比
生成邻二氯苯的反应活化能高
升高温度两个反应速率都升高,哪个速率增加的多?
结论:升高温度活化能大的反应速率增加的多
AB
观点1:活化能越低反应速率越快
观点2:在两个反应的熵变接近的前提下, ΔH越小平衡常数越大
观点3:快+慢 中间产物浓度先快升后慢降,
慢+快 中间产物浓度一直维持低水平
观点4:一般情况下反应时间短(未达平衡)动力学产物有利,
反应时间长(平衡)热力学产物有利
观点5:一定反应时间内反应未达平衡前提下,
高温对活化能大的热力产物更有利
几个重要观点
小结:
升高温度活化能大的反应速率增加的多
小结:
一、过渡态理论与反应势能图
二、连续反应与势能图
1.两种经典连续反应模型
2.连续反应的势能图
3.连续反应中间体浓度随时间变化
4.两个分步反应的相互影响
三、并行反应与势能图
1.并行反应模型
2.并行反应势能图
3.并行反应的相互影响
4.并行反应的产物选择性
29题(反应原理)难点专题突破
用反应势能图理解多重平衡体系
多重平衡体系相互关联的多个可逆反应29(2020.7浙江选考)研究CO2氧化C2H6制C2H4对资源综合利用有重要意义。相关的主要化学反应有:Ⅰ C2H6(g) C2H4(g)+H2(g) ΔH1=136 kJ·mol 1Ⅱ C2H6(g)+CO2(g) C2H4(g)+H2O(g)+CO(g) ΔH2=177 kJ·mol 1Ⅲ C2H6(g)+2CO2(g) 4CO(g)+3H2(g) ΔH3Ⅳ CO2(g)+H2(g) CO(g)+H2O(g) ΔH4=41 kJ·mol 1二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g) CH3OH(g) +H2O(g)ΔH=- 49.4 kJ·mol-1该反应一般认为通过如下步骤来实现:反应I:CO2(g)+ H2(g) CO(g) +H2O(g)ΔH1=+41.1 kJ·mol-1反应Ⅱ:CO(g) +2H2(g) CH3OH(g)ΔH2过渡态理论
过渡态理论认为由反应物分子变成生成物分子,中间一定要
经过一个能量较高的过渡态,形成这个过渡态必须吸收一定的能
量,这个过渡态也称为活化络合物(用M 表示),所以又称为
活化络合物理论。
一、过渡态理论与反应势能图
反应原理p38
活化能是活化分子的平均能量与反应物分子的平均能量之差。
过渡态理论下的反应势能图 p38
注意区别分步反应与总反应活化能
波峰是过渡态能量,波谷是中间体能量,终点是生成物能量
活化能低相对活化能高的反应有什么优势?
依据反应自发性,ΔH小(放热多)相对ΔH大(放热少)的反应
有什么优势?
结论1:
结论2:
活化能越低反应速率越快
在两个反应的熵变接近的前提下,ΔH越小平衡常数越大
连续反应模型
二、连续反应与势能图
A+B C D
1
2
NO氧化反应:
2NO(g)+O2(g) 2NO2(g)分两步进行,
Ⅰ 2NO(g) +O2(g) N2O4(g ) △H1
Ⅱ N2O4(g) 2NO2(g) △H2
慢
快
慢
快
1.两种经典连续反应模型
A+B C D
A+B C D
2.快+慢
1.慢+快
1.这两个连续反应分别对应哪种模型?
2.反应的热效应?
2.连续反应的势能图
研究CO2氧化C2H6制C2H4对资源综合利用有重要意义。相关的主要化学反应有:
Ⅱ C2H6(g)+CO2(g) C2H4(g)+H2O(g)+CO(g) ΔH2=177 kJ·mol 1
Ⅳ CO2(g)+H2(g) CO(g)+H2O(g) ΔH4=41 kJ·mol 1
③有研究表明,在催化剂存在下,反应Ⅱ分两步进行,过程如下:[C2H6(g)+CO2(g)]→[C2H4(g)+H2(g)+CO2(g)]→[C2H4(g)+CO(g)+H2O(g)],
且第二步速率较慢(反应活化能为210 kJ·mol 1)。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量 反应过程图”,起点从[C2H6(g)+CO2(g)]的能量 477 kJ·mol 1开始(如图2)。
例题1
画反应势能图步骤(要点)
1.标明反应物、中间体、生成物的能量高低
3.考虑过渡态峰的相对高低
4.连线
2.标明反应物中间体生成物状态及量
2.快+慢
1.慢+快
请画出中间产物浓度随时间变化图
3.连续反应中间体浓度随时间变化
1.快+慢2.慢+快结论3:快+慢 中间产物浓度先快升后慢降,
慢+快 中间产物浓度一直维持低水平
3.连续反应中间体浓度随时间变化
十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:
C10H18(l) C10H12(l)+3H2(g) △H1 C10H12(l) C10H8(l)+2H2(g) △H2 △H1>△H2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,请回答:
(3)温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00 mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间变化关系如图1所示。
x1显著低于x2的原因是________________________________________。
例题2
催化剂显著降低了C10H12到C10H8的活化能,反应生成C10H12迅速转变为C10H8,使C10H12不能积累。
慢
快
慢
快
A+B C D
A+B C D
模型中,反应1正向移动对反应2施加何种影响?
4.两个分步反应的相互影响
吸热
放热
升温平衡1如何移动?
A+B C D
1
2
4.两个分步反应的相互影响
(2) NO氧化反应:2NO(g)+O2(g)=2NO2(g)分两步进行,反应过程能量变化示意图如图。
Ⅰ 2NO(g) N2O2(g) ΔH1 Ⅱ N2O2(g)+O2(g) 2NO2(g) ΔH2
①决定NO氧化反应速率的步骤是________(填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因____。
例题3
Ⅱ
T4
ΔH1<0,温度升高,反应Ⅰ平衡逆移,c(N2O2)减小;
浓度降低的影响大于温度对反应Ⅱ速率的影响。
1.并行反应模型
三、并行反应与势能图
A+B
C
D
用CO2直接加氢合成二甲醚包括以下二个相互关联的反应:
1.2CO2(g) + 6H2 (g) CH3OCH3 (g) + 3H2O (g) ΔH1= -73.3kJ/mol
2.CO2 (g) + H2 (g) CO (g) + H2O (g) ΔH2 =20.6 kJ/mol
2.并行反应势能图
1.哪个反应速率快?
2.哪个反应平衡常数大?
各有优势,D动力学优势产物,C热力学优势产物
反应进程
能量
一种经典并行反应势能图
萘与浓硫酸发生取代反应可以生成2种取代产物,反应进程中能量变化如图所示。其中相同投料,经历相同时间,不同反应温度时产物的比例不同,在40 °C和160°C时,得到1-取代产物与2-取代产物的比例分别为96:4和15:85,下列说法正确的是 A.1-取代产物比2-取代产物更稳定B.与40 °C相比,160°C时萘的平衡转化率更大C.选择合适的催化剂同样可以提高2-取代产物比率D.延长反应时间,最终以1-取代产物为主C例题4B
2.并行反应势能图
例题4
加压平衡1如何移动?
多重平衡体系中的平衡移动是相互影响的!
多重平衡体系中的平衡是同时平衡
A(g)+B (g)
2C (g)
3D (g)
1
2
3.并行反应的相互影响
例题5 用CO2直接加氢合成二甲醚包括以下二个相互关联的反应:
1.2CO2(g) + 6H2 (g) CH3OCH3 (g) + 3H2O (g) ΔH1= -73.3kJ/mol
2.CO2 (g) + H2 (g) CO (g) + H2O (g) ΔH2 =20.6 kJ/mol
温度、压强对反应CO2中平衡转化率和二甲醚的选择性的影响如图1、图2:
图1 CO2转化率随温度升高先降后升?
3.并行反应的相互影响
3.并行反应的产物选择性
如何控制(压强)条件提高D的选择性?
如何控制(温度)条件提高D的选择性?
吸热
放热
A(g)+B (g)
2C (g)
3D (g)
1
2
反应进程
能量
A+B
2C
3D
3.并行反应的产物选择性
(2)在一定反应时间内(未达平衡),升高温度对C的选择性有何影响?
结论4:一般情况下反应时间短(未达平衡)动力学产物有利,
反应时间长(平衡)热力学产物有利
(1)如何控制时间提高D的选择性?
v逆
t1 t2
t
v
v正
A+B 2C
放热
结论:升高温度活化能大的反应速率增加的多
结论5:一定反应时间内反应未达平衡前提下,高温对活化能高的热力产物更有利
反应速率时间图:升高温度
图2 二甲醚的选择性随压强升高而升高?
4.并行反应的产物选择性
例题5 用CO2直接加氢合成二甲醚包括以下二个相互关联的反应:
1.2CO2(g) + 6H2 (g) CH3OCH3 (g) + 3H2O (g) ΔH1= -73.3kJ/mol
2.CO2 (g) + H2 (g) CO (g) + H2O (g) ΔH2 =20.6 kJ/mol
温度、压强对反应CO2中平衡转化率和二甲醚的选择性的影响如图1、图2:
在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,
分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。
反应物起始浓度均为0.5 mol·L-1,反应30 min测得氯苯15%转化为
邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高
产物中邻二氯苯的比例,可采用的措施是______。
A.适当提高反应温度 B.改变催化剂
C.适当降低反应温度 D.改变反应物浓度
4.并行反应的产物选择性
速率之比决定浓度之比
生成邻二氯苯的反应活化能高
升高温度两个反应速率都升高,哪个速率增加的多?
结论:升高温度活化能大的反应速率增加的多
AB
观点1:活化能越低反应速率越快
观点2:在两个反应的熵变接近的前提下, ΔH越小平衡常数越大
观点3:快+慢 中间产物浓度先快升后慢降,
慢+快 中间产物浓度一直维持低水平
观点4:一般情况下反应时间短(未达平衡)动力学产物有利,
反应时间长(平衡)热力学产物有利
观点5:一定反应时间内反应未达平衡前提下,
高温对活化能大的热力产物更有利
几个重要观点
小结:
升高温度活化能大的反应速率增加的多
小结:
一、过渡态理论与反应势能图
二、连续反应与势能图
1.两种经典连续反应模型
2.连续反应的势能图
3.连续反应中间体浓度随时间变化
4.两个分步反应的相互影响
三、并行反应与势能图
1.并行反应模型
2.并行反应势能图
3.并行反应的相互影响
4.并行反应的产物选择性
同课章节目录
