7.2 物质溶解的量 课时练习 (含答案) 科粤版(2024) 九年级下册
文档属性
| 名称 | 7.2 物质溶解的量 课时练习 (含答案) 科粤版(2024) 九年级下册 |
|
|
| 格式 | docx | ||
| 文件大小 | 693.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-16 21:59:25 | ||
图片预览




文档简介
粤人版化学九下7.2 物质溶解的量
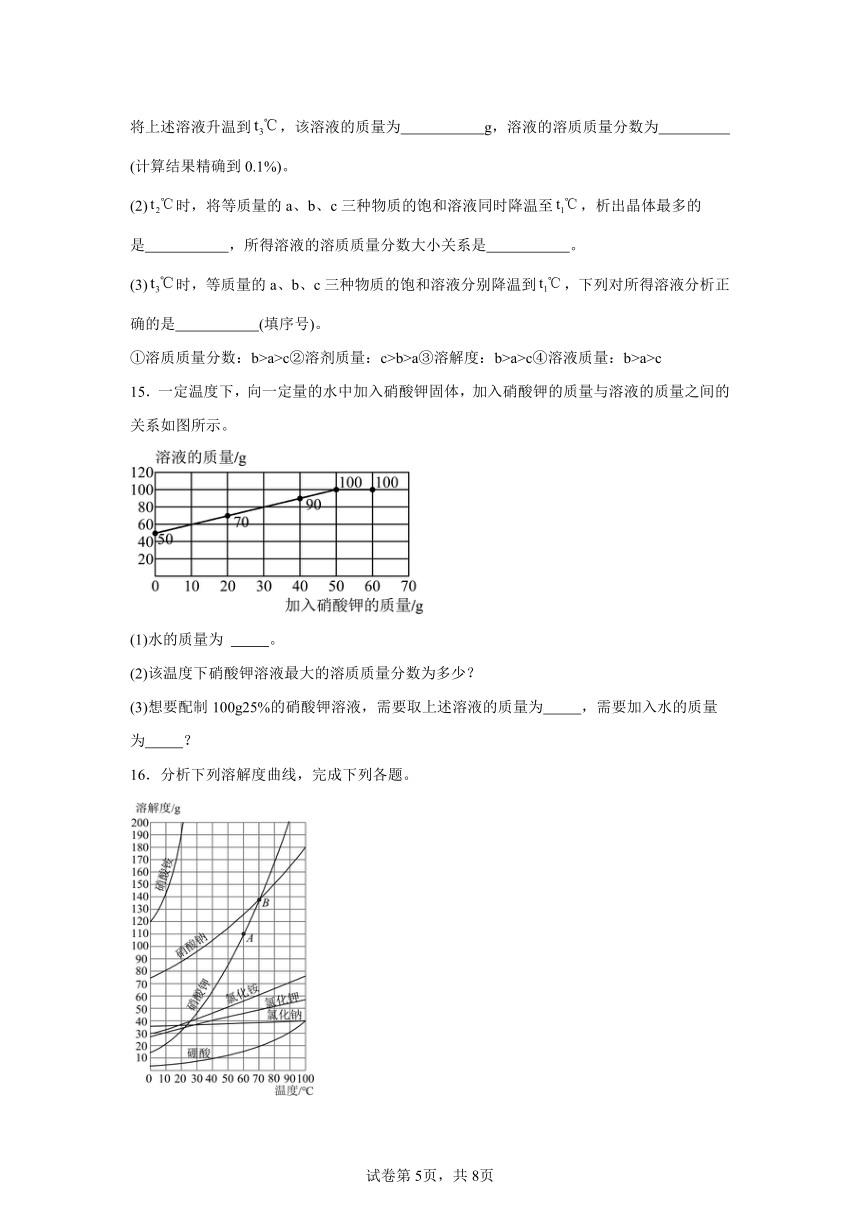
一、选择题
1.生活中的下列现象不能说明气体溶解度随温度升高而减小的是
A.烧开水时,沸腾前有气泡逸出 B.喝下汽水感到有气体冲出鼻腔
C.揭开啤酒瓶盖,有大量的泡沫溢出 D.夏季黄昏,池塘里的鱼常浮出水面
2.海洋中蕴含着丰富的资源,海洋资源的合理开发和综合利用对人类具有重要意义。
从海洋中获得淡水,是解决淡水危机的重要途径。海水淡化的方法很多,蒸馏法是其中的一种。小明同学取少量海水,用下图所示装置进行了蒸馏法淡化海水的模拟探究实验。下列有关说法中,不正确的是
A.蒸馏过程中a试管里溶液的溶质质量分数变大
B.增加导管的长度可以使水蒸气的冷凝效果更好
C.加热过程中水分子的体积和能量都变大
D.蒸馏主要是利用物质的沸点不同将混合物进行分离
3.硼酸在生产生活中有广泛应用。20℃时,进行如下实验。完成下面小题。
资料:20℃时,硼酸的溶解度为5.0g;40℃时,硼酸的溶解度为8.7g。
下列关于①~④的说法不正确的是
A.①所得溶液为不饱和溶液 B.若②升温至40℃,溶质质量变大
C.若向③中加水,溶液质量变大 D.若④升温至40℃,得到不饱和溶液
4.关于粗盐提纯的实验,说法正确的是
A.粗盐不可以放在烧杯里称量
B.涉及的分离操作有溶解、过滤和蒸发
C.蒸发皿不可以直接加热
D.蒸发时发现有固体开始析出,立即停止加热
5.常温下,在两只各盛有100mL水的烧杯中,分别加入相同质量的甲、乙两种物质使其充分溶解,结果如图所示。下列说法正确的是
A.甲溶液是不饱和溶液
B.乙溶液是不饱和溶液
C.升高温度,剩余的甲固体一定能继续溶解
D.乙溶液可能达到饱和,也可能未达饱和
6.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是
A.℃时,三种固体物质的溶解度关系为甲>乙>丙
B.℃ 100g甲物质饱和溶液中含有60g甲
C.将丙物质饱和溶液变为不饱和溶液,可采用升温的方法
D.℃时,分别用100g水配制甲、乙的饱和溶液,再降温到℃,析出无水晶体的质量:甲>乙
7.下列说法正确的是
A.任何物质的饱和溶液都比它的不饱和溶液浓
B.某温度下,在硝酸钾饱和溶液中加入食盐,若温度不变,食盐不溶解
C.浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液
D.在同一温度下,氯化钠的饱和溶液比它的不饱和溶液浓
8.小红同学为证明某硝酸钾溶液是否达到饱和状态,设计了以下方案。一定能达到目的是
A.温度不变,向溶液中加入饱和硝酸钾溶液 B.温度不变,向溶液中加入少量硝酸钾
C.给溶液加热,直至有硝酸钾晶体析出 D.给溶液降温,直至有硝酸钾晶体析出
9.在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解。下列说法正确的是
A.20℃时,氯化钠的溶解度为36g B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140g D.将该溶液倒出一半,则溶液的溶解度增大
10.通过如图所示的实验(不考虑水分蒸发),得到相应的五种溶液。下列叙述不正确的是
A.t1℃时,溶液①是不饱和溶液 B.t2℃时,溶液④是饱和溶液
C.t1℃时,溶液⑤是饱和溶液 D.t2℃时,溶液③是不饱和溶液
二、判断题
11.判断下列说法的正误。
A.甲物质的溶解度为
B.三种物质的溶解度大小关系为甲>乙>丙
C.时,甲、乙、丙三种物质溶解度的大小关系为丙>乙>甲
三、填空与简答
12.如图为硝酸钾和氯化钠的溶解度曲线示意图。
(1)t1℃时,硝酸钾的溶解度是 g。
(2)t3℃时,硝酸钾的溶解度 氯化钠的溶解度(填“大于”、“等于“或“小于”)。
(3)生活在盐湖附近的人们习惯“夏天晒盐”。请你结合溶解度曲线解释原因 。
13.海洋蕴含着丰富的资源,综合开发利用海洋资源已成为世界各国研究的热点。海水晒盐是综合利用海洋资源的一条有效途径。
(1)如图是海水晒盐的流程:图中①是 池(填“蒸发”或“冷却”)。
(2)根据海水晒盐的原理,下列说法中正确的是______。
A.海水进入贮水池,海水的成分基本不变
B.在①中,海水中氯化钠的质量逐渐增加
C.在①中,海水中水的质量逐渐减少
D.析出晶体后的母液是氯化钠的不饱和溶液
14.如图是a、b、c三种物质的溶解度曲线,据图回答下列问题:
(1)时,把20g物质a加入到50g水中充分搅拌、静置,形成的溶液其质量是 g;将上述溶液升温到,该溶液的质量为 g,溶液的溶质质量分数为 (计算结果精确到0.1%)。
(2)时,将等质量的a、b、c三种物质的饱和溶液同时降温至,析出晶体最多的是 ,所得溶液的溶质质量分数大小关系是 。
(3)时,等质量的a、b、c三种物质的饱和溶液分别降温到,下列对所得溶液分析正确的是 (填序号)。
①溶质质量分数:b>a>c②溶剂质量:c>b>a③溶解度:b>a>c④溶液质量:b>a>c
15.一定温度下,向一定量的水中加入硝酸钾固体,加入硝酸钾的质量与溶液的质量之间的关系如图所示。
(1)水的质量为 。
(2)该温度下硝酸钾溶液最大的溶质质量分数为多少?
(3)想要配制100g25%的硝酸钾溶液,需要取上述溶液的质量为 ,需要加入水的质量为 ?
16.分析下列溶解度曲线,完成下列各题。
(1)溶解度曲线中A点的含义: 。
(2)溶解度曲线中B点的含义: 。
(3)判断正误:
①硝酸钾的溶解度比氯化钠的溶解度大。( )
②50℃时,硝酸钠的溶解度小于硝酸钾的溶解度。( )
四、实验题
17.某实验小组利用图1所示仪器进行“配制质量分数一定的氢氧化钠溶液”的实验:
(1)按实验要求,图1中还缺少的玻璃仪器是 (填名称)。
(2)小婧按图2的操作称取氢氧化钠,小民发现小婧的操作有错误。你认为小婧操作中的错误是 ;若按正确方法操作,在称量的过程中发现托盘天平的指针偏向右侧,此时应该 。
A、减少砝码 B、调节平衡螺母 C、减少氢氧化钠 D、增加氢氧化钠
(3)小民所取蒸馏水的体积如图3所示,则该实验小组原计划配制的氢氧化钠溶液中溶质质量分数为 。
(4)配制好的溶液装瓶存放,在细口瓶上写上标签内容,从微观角度看,该溶液中存在的微粒是 (用微粒符号表示)。
(5)若正确称量氢氧化钠,配制该溶液过程中,会导致氢氧化钠质量分数偏小的是______(填序号)。
A.将配制好的溶液装入试剂瓶时有少量溅出
B.量水的体积时,俯视读数
C.砝码缺角
D.量水的体积时,仰视读数
五、科学探究题
18.浩海中学化学综合实践小组的同学在老师的带领下,围绕生活污水危害、净化、成分及污水处理厂的选址等展开了项目式学习之旅。
任务一:调查污水危害及处理
【调查咨询】
(1)i.污水中含有的大量有害元素和氮、磷、钾等营养元素,会严重损害人体健康,影响工农业生产,造成水体 ;
ii.污水处理厂的常见净水方法有曝气、沉淀、过滤、吸附、消毒等。曝气即在阳光下暴晒,使水中溶解的气体逸出,曝气的原理是 。
任务二:设计与制作简易净水器
【设计目的】除去生活污水中的泥沙、茶叶、食物残渣、色素等杂质。
【材料准备】i.一瓶生活污水的水样;ii.大号饮料瓶、纱布、粗砂、细沙、活性炭等。
【设计制作】自制净水器及测试结果如下:
组别 测试结果
洁净程度 收回水的量(%) 净水速度(mL/min)
一组 好 >95 约为250
二组 中 >90 约为90
三组 差 >90 约为15
【交流讨论】
(2)第一组和第二组对比,得出的结论为 。
(3)第三组将活性炭放在最上层,影响活性炭吸附效果的原因是 。
六、计算题
19.计算:欲配制100g溶质质量分数为19.6%的稀硫酸,需98%的浓硫酸多少克?需加水多少克?
试卷第8页,共8页
试卷第7页,共8页
参考答案
1.C
2.C
3.B
4.B
5.D
6.D
7.D
8.B
9.A
10.B
11. × × √
12.(1)20
(2)大于
(3)氯化钠的溶解度受温度影响不大,夏天温度高水分蒸发快,氯化钠易结晶析出
13.(1)蒸发
(2)AC
14.(1) 60 70 28.6%
(2) a b>a>c
(3)①②
15.(1)50g
(2)50%
(3) 50g 50g
16.(1)60℃时,硝酸钾的溶解度为110g
(2)70℃时,硝酸钾和硝酸钠的溶解度相同,为128g
(3) 错误 错误
17.(1)玻璃棒
(2) 药品与砝码位置放反 D
(3)18%
(4)Na+、OH-、H2O
(5)CD
18.(1) 富营养化 气体溶解度随温度升高而减小
(2)细沙与粗砂的填充顺序影响净水效果或污水先通过粗砂净水效果好
(3)水中泥沙堵塞了活性炭上的小孔或泥沙破坏了活性炭疏松多孔结构
19.解:设需要这种浓硫酸的质量是x,根据稀释前后,溶质的质量不变,可得:
,解得
需要水的质量为:100g-20g=80g
答:欲配制100g溶质质量分数为19.6%的稀硫酸,需98%的浓硫酸20克,需加水80克。
答案第2页,共2页
答案第1页,共2页
一、选择题
1.生活中的下列现象不能说明气体溶解度随温度升高而减小的是
A.烧开水时,沸腾前有气泡逸出 B.喝下汽水感到有气体冲出鼻腔
C.揭开啤酒瓶盖,有大量的泡沫溢出 D.夏季黄昏,池塘里的鱼常浮出水面
2.海洋中蕴含着丰富的资源,海洋资源的合理开发和综合利用对人类具有重要意义。
从海洋中获得淡水,是解决淡水危机的重要途径。海水淡化的方法很多,蒸馏法是其中的一种。小明同学取少量海水,用下图所示装置进行了蒸馏法淡化海水的模拟探究实验。下列有关说法中,不正确的是
A.蒸馏过程中a试管里溶液的溶质质量分数变大
B.增加导管的长度可以使水蒸气的冷凝效果更好
C.加热过程中水分子的体积和能量都变大
D.蒸馏主要是利用物质的沸点不同将混合物进行分离
3.硼酸在生产生活中有广泛应用。20℃时,进行如下实验。完成下面小题。
资料:20℃时,硼酸的溶解度为5.0g;40℃时,硼酸的溶解度为8.7g。
下列关于①~④的说法不正确的是
A.①所得溶液为不饱和溶液 B.若②升温至40℃,溶质质量变大
C.若向③中加水,溶液质量变大 D.若④升温至40℃,得到不饱和溶液
4.关于粗盐提纯的实验,说法正确的是
A.粗盐不可以放在烧杯里称量
B.涉及的分离操作有溶解、过滤和蒸发
C.蒸发皿不可以直接加热
D.蒸发时发现有固体开始析出,立即停止加热
5.常温下,在两只各盛有100mL水的烧杯中,分别加入相同质量的甲、乙两种物质使其充分溶解,结果如图所示。下列说法正确的是
A.甲溶液是不饱和溶液
B.乙溶液是不饱和溶液
C.升高温度,剩余的甲固体一定能继续溶解
D.乙溶液可能达到饱和,也可能未达饱和
6.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是
A.℃时,三种固体物质的溶解度关系为甲>乙>丙
B.℃ 100g甲物质饱和溶液中含有60g甲
C.将丙物质饱和溶液变为不饱和溶液,可采用升温的方法
D.℃时,分别用100g水配制甲、乙的饱和溶液,再降温到℃,析出无水晶体的质量:甲>乙
7.下列说法正确的是
A.任何物质的饱和溶液都比它的不饱和溶液浓
B.某温度下,在硝酸钾饱和溶液中加入食盐,若温度不变,食盐不溶解
C.浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液
D.在同一温度下,氯化钠的饱和溶液比它的不饱和溶液浓
8.小红同学为证明某硝酸钾溶液是否达到饱和状态,设计了以下方案。一定能达到目的是
A.温度不变,向溶液中加入饱和硝酸钾溶液 B.温度不变,向溶液中加入少量硝酸钾
C.给溶液加热,直至有硝酸钾晶体析出 D.给溶液降温,直至有硝酸钾晶体析出
9.在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解。下列说法正确的是
A.20℃时,氯化钠的溶解度为36g B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140g D.将该溶液倒出一半,则溶液的溶解度增大
10.通过如图所示的实验(不考虑水分蒸发),得到相应的五种溶液。下列叙述不正确的是
A.t1℃时,溶液①是不饱和溶液 B.t2℃时,溶液④是饱和溶液
C.t1℃时,溶液⑤是饱和溶液 D.t2℃时,溶液③是不饱和溶液
二、判断题
11.判断下列说法的正误。
A.甲物质的溶解度为
B.三种物质的溶解度大小关系为甲>乙>丙
C.时,甲、乙、丙三种物质溶解度的大小关系为丙>乙>甲
三、填空与简答
12.如图为硝酸钾和氯化钠的溶解度曲线示意图。
(1)t1℃时,硝酸钾的溶解度是 g。
(2)t3℃时,硝酸钾的溶解度 氯化钠的溶解度(填“大于”、“等于“或“小于”)。
(3)生活在盐湖附近的人们习惯“夏天晒盐”。请你结合溶解度曲线解释原因 。
13.海洋蕴含着丰富的资源,综合开发利用海洋资源已成为世界各国研究的热点。海水晒盐是综合利用海洋资源的一条有效途径。
(1)如图是海水晒盐的流程:图中①是 池(填“蒸发”或“冷却”)。
(2)根据海水晒盐的原理,下列说法中正确的是______。
A.海水进入贮水池,海水的成分基本不变
B.在①中,海水中氯化钠的质量逐渐增加
C.在①中,海水中水的质量逐渐减少
D.析出晶体后的母液是氯化钠的不饱和溶液
14.如图是a、b、c三种物质的溶解度曲线,据图回答下列问题:
(1)时,把20g物质a加入到50g水中充分搅拌、静置,形成的溶液其质量是 g;将上述溶液升温到,该溶液的质量为 g,溶液的溶质质量分数为 (计算结果精确到0.1%)。
(2)时,将等质量的a、b、c三种物质的饱和溶液同时降温至,析出晶体最多的是 ,所得溶液的溶质质量分数大小关系是 。
(3)时,等质量的a、b、c三种物质的饱和溶液分别降温到,下列对所得溶液分析正确的是 (填序号)。
①溶质质量分数:b>a>c②溶剂质量:c>b>a③溶解度:b>a>c④溶液质量:b>a>c
15.一定温度下,向一定量的水中加入硝酸钾固体,加入硝酸钾的质量与溶液的质量之间的关系如图所示。
(1)水的质量为 。
(2)该温度下硝酸钾溶液最大的溶质质量分数为多少?
(3)想要配制100g25%的硝酸钾溶液,需要取上述溶液的质量为 ,需要加入水的质量为 ?
16.分析下列溶解度曲线,完成下列各题。
(1)溶解度曲线中A点的含义: 。
(2)溶解度曲线中B点的含义: 。
(3)判断正误:
①硝酸钾的溶解度比氯化钠的溶解度大。( )
②50℃时,硝酸钠的溶解度小于硝酸钾的溶解度。( )
四、实验题
17.某实验小组利用图1所示仪器进行“配制质量分数一定的氢氧化钠溶液”的实验:
(1)按实验要求,图1中还缺少的玻璃仪器是 (填名称)。
(2)小婧按图2的操作称取氢氧化钠,小民发现小婧的操作有错误。你认为小婧操作中的错误是 ;若按正确方法操作,在称量的过程中发现托盘天平的指针偏向右侧,此时应该 。
A、减少砝码 B、调节平衡螺母 C、减少氢氧化钠 D、增加氢氧化钠
(3)小民所取蒸馏水的体积如图3所示,则该实验小组原计划配制的氢氧化钠溶液中溶质质量分数为 。
(4)配制好的溶液装瓶存放,在细口瓶上写上标签内容,从微观角度看,该溶液中存在的微粒是 (用微粒符号表示)。
(5)若正确称量氢氧化钠,配制该溶液过程中,会导致氢氧化钠质量分数偏小的是______(填序号)。
A.将配制好的溶液装入试剂瓶时有少量溅出
B.量水的体积时,俯视读数
C.砝码缺角
D.量水的体积时,仰视读数
五、科学探究题
18.浩海中学化学综合实践小组的同学在老师的带领下,围绕生活污水危害、净化、成分及污水处理厂的选址等展开了项目式学习之旅。
任务一:调查污水危害及处理
【调查咨询】
(1)i.污水中含有的大量有害元素和氮、磷、钾等营养元素,会严重损害人体健康,影响工农业生产,造成水体 ;
ii.污水处理厂的常见净水方法有曝气、沉淀、过滤、吸附、消毒等。曝气即在阳光下暴晒,使水中溶解的气体逸出,曝气的原理是 。
任务二:设计与制作简易净水器
【设计目的】除去生活污水中的泥沙、茶叶、食物残渣、色素等杂质。
【材料准备】i.一瓶生活污水的水样;ii.大号饮料瓶、纱布、粗砂、细沙、活性炭等。
【设计制作】自制净水器及测试结果如下:
组别 测试结果
洁净程度 收回水的量(%) 净水速度(mL/min)
一组 好 >95 约为250
二组 中 >90 约为90
三组 差 >90 约为15
【交流讨论】
(2)第一组和第二组对比,得出的结论为 。
(3)第三组将活性炭放在最上层,影响活性炭吸附效果的原因是 。
六、计算题
19.计算:欲配制100g溶质质量分数为19.6%的稀硫酸,需98%的浓硫酸多少克?需加水多少克?
试卷第8页,共8页
试卷第7页,共8页
参考答案
1.C
2.C
3.B
4.B
5.D
6.D
7.D
8.B
9.A
10.B
11. × × √
12.(1)20
(2)大于
(3)氯化钠的溶解度受温度影响不大,夏天温度高水分蒸发快,氯化钠易结晶析出
13.(1)蒸发
(2)AC
14.(1) 60 70 28.6%
(2) a b>a>c
(3)①②
15.(1)50g
(2)50%
(3) 50g 50g
16.(1)60℃时,硝酸钾的溶解度为110g
(2)70℃时,硝酸钾和硝酸钠的溶解度相同,为128g
(3) 错误 错误
17.(1)玻璃棒
(2) 药品与砝码位置放反 D
(3)18%
(4)Na+、OH-、H2O
(5)CD
18.(1) 富营养化 气体溶解度随温度升高而减小
(2)细沙与粗砂的填充顺序影响净水效果或污水先通过粗砂净水效果好
(3)水中泥沙堵塞了活性炭上的小孔或泥沙破坏了活性炭疏松多孔结构
19.解:设需要这种浓硫酸的质量是x,根据稀释前后,溶质的质量不变,可得:
,解得
需要水的质量为:100g-20g=80g
答:欲配制100g溶质质量分数为19.6%的稀硫酸,需98%的浓硫酸20克,需加水80克。
答案第2页,共2页
答案第1页,共2页
