人教版高一化学必修一 4.4氨、硝酸、硫酸 课件 (共68张PPT)
文档属性
| 名称 | 人教版高一化学必修一 4.4氨、硝酸、硫酸 课件 (共68张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-08 00:00:00 | ||
图片预览










文档简介
课件68张PPT。第四节
氨 硝酸 硫酸 1、氮的固定:
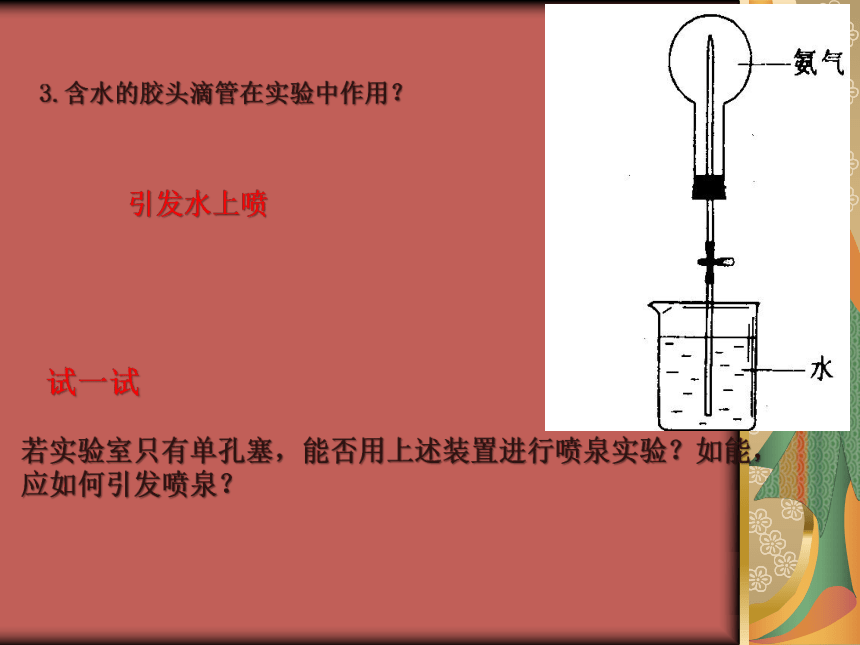
将游离态的氮转变为氮的化合物的方法。自然固氮:豆科植物固氮 人工固氮:工业合成氨雷雨天产生一氧化氮气体 一、氨2、氨的物理性质 无色、有剌激性气味的气体 比空气轻 极易溶于水(1:700) ----常作致冷剂 氨易液化(沸点-33. 35 ℃) 还有氯气(沸点-34. 6 ℃) 二氧化硫(沸点-10 ℃)还有哪些物质也可作致冷剂?实验现象:a.烧杯内的水由玻璃管进入烧瓶内形成喷泉;
形成喷泉的原因:当滴管中的水挤入到烧瓶中时,烧瓶内的氨溶解,使瓶内压强迅速降低,瓶外的空气将烧杯内的溶液很快压入到烧瓶,形成喷泉。a.氨极易溶于水。b.氨水显碱性。实验结论:b.烧瓶内溶液呈红色。:1、形成喷泉的原理?2、喷泉实验成功的关键?3.含水的胶头滴管在实验中作用?4.从上述实验来看,溶液都不能完全充满烧瓶,为什么?5.滴有酚酞的溶液变为红色说明什么?5.引发喷泉的操作是什么?1、形成喷泉的原理?2、喷泉实验成功的关键?烧瓶内外形成压强差思 考a.装置的气密性好;b.气体的纯度高;
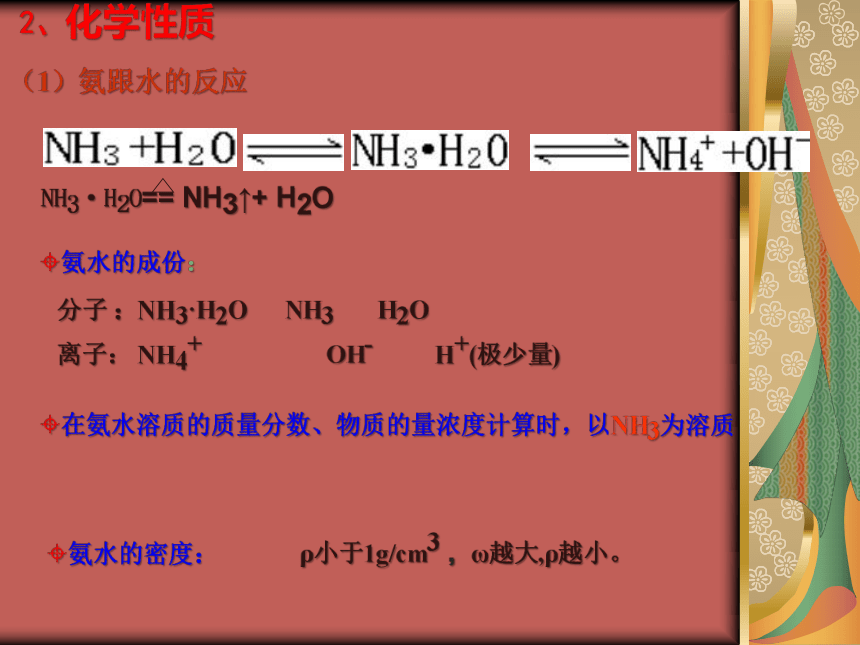
c.烧瓶必须干燥。3.含水的胶头滴管在实验中作用?引发水上喷若实验室只有单孔塞,能否用上述装置进行喷泉实验?如能,应如何引发喷泉?试一试4、从上述实验来看,溶液都不能完全充满烧瓶,为什么?收集到的氨气中混有空气思 考5.滴有酚酞的溶液变为红色说明什么?氨气溶于水,溶液显碱性。2、化学性质(1)氨跟水的反应 分子 :NH3·H2O NH3 H2O
离子: NH4+ OH- H+(极少量)?氨水的成份:?氨水的密度:ρ小于1g/cm3 ,ω越大,ρ越小。?在氨水溶质的质量分数、物质的量浓度计算时,以NH3为溶质?氨水与液氨名 称氨 水液 氨形 成物质分类微粒种类思考氨能否与酸反应? (2)氨跟酸的反应NH3+HCl = NH4Cl (现象:白烟)2NH3+H2SO4 = (NH4)2SO4(3)与某些盐溶液反应:Al3 + +3NH3+3H2O = Al(OH)3↓+3NH4+NH3+HNO3 = NH4NO3
(现象:白烟)NH3+H+=NH4+(与酸反应的本质)NH3三、氨的用途?在遇到氨气泄漏时,应该马上疏散到室外,最好到开阔地带,并站在上风头。
?在撤离时,最好准备一块湿毛巾捂住嘴巴。
?如果是在距离水面比较近的地方,就尽量跑到水边,因为氨气溶于水。 动脑:通过今天的学习,若当你遇到氨气泄漏事故,你将如何应对? 如图所示,在一盛有蒸馏水的烧杯中有一悬浮的小球(小球不会被酸碱腐蚀),当向烧杯中不断通入氨后,会出现什么现象?思考:3、氨的化学性质 氨水中含少量氢氧根离子,呈弱碱性,故能使酚
酞试液变红。(1)氨与水反应NH3+H2O NH3.H2O氨水显碱性的原理氨水很不稳定纯净物混合物NH3 氨水和液氨的区别离子:NH4+、OH-、
微量H+分子:`NH3、 H2O 、 NH3·H2O(主要) 在氨的喷泉实验中,烧瓶内溶液的物质的量浓度是多少?(假设实验是在标准状况下进行) 氨气体积设为VL 注意:氨水中溶质是NH3,不是NH3·H2O 氨气物质的量为(V/22.4)mol 氨水溶液体积也是VL 氨水溶液物质的量浓度为
(V/22.4)/V= 0.045 mol/L(2) 氨与酸反应 书p98页 (图4-28) 步骤: 使两根分别蘸有浓氨水和浓盐酸的
玻璃棒接近。 (不要接触)两根玻璃棒靠近时产生大量白烟。 NH3+HCl==NH4Cl现象: 结论: 氨水挥发的NH3与盐酸挥发的HCl化
合生成固体小颗粒NH4Cl的缘故。——此反应可检验NH3或HCl
挥发性酸(HCl、HNO3等)遇氨气均有白烟生成;难挥发性酸H2SO4、H3PO4无此现象。NH3+ HNO3=NH4NO32NH3+ H2SO4=(NH4)2SO4 NH3+HCl==NH4Cl白烟NH3 不能用浓硫酸干燥. (3)氨的催化氧化N2NH3O2NOO2NO2H2OHNO3思考与交流:氨经一系列反应可以得到硝酸,
如下图所示
1、试写出以下每一步转化的反应方程式。
2、分析上述每一步反应中氮元素化合价的变 化,指出氮元素发生的是氧化反应还是还原反应。①铵盐不稳定,受热易分解 (2)化学性质:4、铵盐(1)物理性质:铵盐均溶于水,为白色固体——由铵根离子(NH4+)和酸根离
子构成的化合物②铵盐与碱反应应用:
a.实验室用来制NH3
b.用于NH4+的检验:加热时,能与碱液反应产生使湿润的红色石蕊试纸
变蓝的气体的物质一定是铵盐5、氨的用途①工业制化肥
②有机合成的重要化工原料
③作制冷剂6、氨的制备(一)氨的工业制备(3)装置:固+固加热型(4)收集:向下排空气法(5)验满:(与氧气的制取装置相同)(1)药品:氯化铵晶体、消石灰固体(2)原理:2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑(二).氨的实验室制法 将湿润的红色石蕊试纸放在试管口,如果试纸变蓝,说明氨气已集满。(6)尾气吸收:浓硫酸吸收多余的氨气.——装置:倒扣漏斗⑺干燥装置CaO、碱石灰等碱性干燥剂
注意:
无水CaCl2不能干燥
NH3(形成CaCl2· 8NH3)
2.棉花的作用:防止空气对流,提高集气的速度和纯度。3.实验室中还可以用哪些方法快速制氨气:
①加热浓氨水法②浓氨水加生石灰法(生石灰吸水、溶解时放热)思考:1.用氢氧化钠代替氢氧化钙好吗? 氢氧化钠易吸水,易结块,不易产生NH3;热的氢氧化钠对玻璃有腐蚀作用。第四节 氨 硝酸 硫酸(二) 硫酸 一、硫酸1.使指示剂变色:2.与活泼金属反应放出氢气 (硝酸除外)3.与碱发生中和反应:4.与碱性氧化物反应:5.与某些盐反应:使紫色石蕊试液变红H++ OH -= H2O2H++ CuO = Cu2++ H2O2H++ CO32- = H2O + CO2↑(一)稀硫酸具有酸的通性
H2SO4=2H++SO42-(二)浓硫酸浓H2SO4的物理性质
A.色态:无色、粘稠的油状液体
B.沸点:约338℃——难挥发酸(高沸点酸)
C.密度:1.84g/cm3——高密度酸
D.溶解性:跟水任意比互溶,溶解放出大量热。[思考] 浓硫酸应如何稀释? 用于制易挥发
酸,如盐酸。⑴ 吸水性用途:可以作干燥剂 浓硫酸吸收物质本来就有的水,
直接与水分子结合; 2. 浓硫酸不能干燥碱性气体:NH3还原性气体:H2S HBr、HI2. 浓硫酸
(2) 脱水性脱水性是指浓硫酸能把有机物中的氢氧原子按2:1(H2O)的个数比脱去。 【实验】取10g蔗糖放入小烧杯中,加入几滴水,用玻璃棒搅拌均匀,再加入10mL浓硫酸,并用玻璃棒迅速搅拌。观察物质的颜色、体积变化并闻味。现象:蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的炭,并有刺激性气味的气体产生。2H2SO4 (浓) + C== CO2 + 2H2O + 2SO2脱水性氧化性△ 浓硫酸的吸水性和脱水性有什么区别?吸水性是指浓硫酸直接与水分子结合。 脱水性是指浓硫酸将许多有机物中的
氢、氧元素按水的比例脱去。吸收现成的水反应生成水问题?现象: 加热能反应,产生的气
体能使品红褪色,使石蕊溶液变红;溶液稀释后呈蓝色。 (3) 浓硫酸氧化性
①与金属反应 浸有碱液的棉团的作用:吸收多余的SO2,防止大气污染结论:浓硫酸既有氧化性又有酸性 Cu + 2H2SO4(浓) = CuSO4 + SO2 + 2H2O△0+6+6+4+2还原剂氧化剂 ①与金属反应2e-若铜过量,硫酸能否完全反应?为什么?② 与某些非金属反应
设计一实验,证明浓硫酸与碳反应的生成物含有
水、二氧化硫和二氧化碳 。思考题无水硫酸铜品红
溶液品红
溶液酸性高锰酸钾溶液澄清石灰水证明含SO2除去SO2证明无SO2证明含CO2证明含水变蓝色褪色褪色不褪色变浑浊(三)硫酸的用途: 硫酸是世界上用量最大、用途最广的化工基本原料之一,故素有“化学工业之母”之称。 硫酸硫酸的消费量被视为一个国家工业发水平的标志浓H2SO4蓄电池化学纤维【问题探究】:稀硫酸是否具有氧化性?浓、稀硫酸的氧化性有什么不同?稀硫酸也有氧化性。稀硫酸的氧化性是由于它电离出的H+;浓硫酸的氧化性是由于分子里的+6价硫引起的;H+的氧化性比+6价硫的弱。 酸类物质均有氧化性,其中氧化性由成酸元素引起的酸,叫氧化性酸(浓硫酸、硝酸)。第四节 氨 硝酸 硫酸(三) 硝酸 ⑴纯硝酸是无色、易挥发、有刺激性气味的液体。三、硝酸 ⑵能以任意比溶于水;
⑶密度比水大;
⑷沸点低:83℃;
⑸常用浓硝酸的浓度为69%,
98%的浓硝酸叫作“发烟硝酸”。(一)硝酸的物理性质:(二)硝酸的化学性质 HNO3=H++NO3- 1、具有酸的通性 2、不稳定性 硝酸分解产生NO2,NO2溶于硝酸而使硝酸呈现黄色。保存:密封于棕色瓶中,并放在阴暗处!久置浓硝酸为什么呈黄色?3Cu+8HNO3(稀) =3Cu(NO3)2+2NO +4H2O结论:硝酸具有强的氧化性。Cu+4HNO3(浓) = Cu(NO3)2+2NO2 +2H2O3.与金属反应 硝酸具有强的氧化性,也能跟许多非金属(如碳)反应4HNO3 (浓)+ C = CO2 + 4NO2 + 2H2O 4.与非金属反应 硝酸浓度越大,氧化性越强。 氧化性:浓HNO3 > 稀HNO3 ⑴大量实验证明:不论浓、稀硝酸都有很强的氧化性,几乎能与所有金属(除Pt、Au等少数金属外)反应,如:Mg、Al、Zn、Fe、Cu等。但Al、Fe在冷、浓硝酸中要发生钝化。(2)Pt、Au不与硝酸反应,但能与王水反应。王水是由浓硝酸和浓盐酸以体积比1:3组成的混合物,具有极强的氧化性,能氧化Pt、Au等极不活泼金属。 记忆方法 :
王水:“三言(盐)一笑(硝)” 可以用铁、铝制的容器盛装浓硫酸或浓硝酸(三)硝酸的用途 p102硝酸是一种重要的化工原料,可用于制造炸药、燃料、塑料、硝酸盐等,在实验室里它是一种化学试剂。氧化性酸小结: 硝酸(浓或稀)、硫酸(浓)、次氯酸、王水(硝酸和盐酸)等,都是具有强氧化性的酸。易钝化物质小结: Mg、Al在空气中其表面形成致密的氧化物薄膜而钝化。
Al、Fe在冷的浓硫酸、浓硝酸中其表面形成致密的氧化物薄膜而钝化。
浓硝酸、浓硫酸、浓盐酸性质对比有有有有有有无有有稳定 稳定不稳定易挥发难挥发易挥发无有无无有无1.分别将盛有浓盐酸、浓硫酸、浓硝酸的烧杯露置于空气中,放置一段时间后,质量增大的是 ,原因是 ,质量减少的是 ,原因是 。浓H2SO4 浓H2SO4吸收空气中的水蒸气 浓盐酸、浓硝酸 浓盐酸、浓硝酸均具有挥发性. 练习2.下列试剂不需要保存在棕色试剂瓶内的是 ( ) A、浓HNO3 B、NaCl溶液
C、新制氯水 D、AgNO3 溶液
见光或受热而易变质的物质需用棕色试剂瓶且密封保存,如:AgNO3、浓HNO3、AgCl、H2O2、溴水、氯水等B3.一定量的浓硝酸里加入过量铜会发生哪些变化? 反应停止后,如果在溶液中再加入足量稀盐酸会出现什么情况?溶液中存在NO3-,它遇到H+后,会继续氧化
铜,当然此时NO3-/H+的溶度较稀.4.下列反应中HNO既表现氧化性又表现酸性的是(??) (A)C+浓HNO3?(B)FeO+HNO3???
(C)Fe2O3+HNO3???? (D) Cu+浓HNO3? BD?5.利用下反应制相同质量的硝酸铜时,从理论上看,消耗硝酸质量最多的是
(A)Cu+浓HNO3? (B)Cu+稀HNO3???? ???
(C)CuO+HNO3????? ?? (D) Cu(OH)2+HNO3A6.在稀硫酸中插入一块铜片,加入下列物质后,可使铜片迅速溶解的是( )
A 稀盐酸 B 芒硝晶体
C KNO3 D FeCl2溶液C将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时,收集到气体为1.12L(标准状况)则所消耗的硝酸的物质的量是( )
A 0.12mol B 0.11mol
C 0.10mol D 0.08molCu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)== 3Cu(NO3)2+2NO↑+4H2O B 3Cu+8HNO3(稀)= 3Cu(NO3)2+2NO↑+4H2O Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O X4X2XY3/8Y 2/3Yn(HNO3)=4×0.0225 +3/8×0.0075=0.11mol 1.92g铜粉 n(Cu)=0.03mol,
气体为1.12L n(气体)=0.05mol方法一 元素守恒法:
n(HNO3)=0.05+0.06=0.11mol1.92g铜粉,气体为1.12LCu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)== 3Cu(NO3)2+2NO↑+4H2O n (HNO3)== n(氧化性) + n(酸性)n(氧化性)= 1.12/22.4 =0.05mol n(酸性) = 2×1.92/64 =0.06mol方法二
将游离态的氮转变为氮的化合物的方法。自然固氮:豆科植物固氮 人工固氮:工业合成氨雷雨天产生一氧化氮气体 一、氨2、氨的物理性质 无色、有剌激性气味的气体 比空气轻 极易溶于水(1:700) ----常作致冷剂 氨易液化(沸点-33. 35 ℃) 还有氯气(沸点-34. 6 ℃) 二氧化硫(沸点-10 ℃)还有哪些物质也可作致冷剂?实验现象:a.烧杯内的水由玻璃管进入烧瓶内形成喷泉;
形成喷泉的原因:当滴管中的水挤入到烧瓶中时,烧瓶内的氨溶解,使瓶内压强迅速降低,瓶外的空气将烧杯内的溶液很快压入到烧瓶,形成喷泉。a.氨极易溶于水。b.氨水显碱性。实验结论:b.烧瓶内溶液呈红色。:1、形成喷泉的原理?2、喷泉实验成功的关键?3.含水的胶头滴管在实验中作用?4.从上述实验来看,溶液都不能完全充满烧瓶,为什么?5.滴有酚酞的溶液变为红色说明什么?5.引发喷泉的操作是什么?1、形成喷泉的原理?2、喷泉实验成功的关键?烧瓶内外形成压强差思 考a.装置的气密性好;b.气体的纯度高;
c.烧瓶必须干燥。3.含水的胶头滴管在实验中作用?引发水上喷若实验室只有单孔塞,能否用上述装置进行喷泉实验?如能,应如何引发喷泉?试一试4、从上述实验来看,溶液都不能完全充满烧瓶,为什么?收集到的氨气中混有空气思 考5.滴有酚酞的溶液变为红色说明什么?氨气溶于水,溶液显碱性。2、化学性质(1)氨跟水的反应 分子 :NH3·H2O NH3 H2O
离子: NH4+ OH- H+(极少量)?氨水的成份:?氨水的密度:ρ小于1g/cm3 ,ω越大,ρ越小。?在氨水溶质的质量分数、物质的量浓度计算时,以NH3为溶质?氨水与液氨名 称氨 水液 氨形 成物质分类微粒种类思考氨能否与酸反应? (2)氨跟酸的反应NH3+HCl = NH4Cl (现象:白烟)2NH3+H2SO4 = (NH4)2SO4(3)与某些盐溶液反应:Al3 + +3NH3+3H2O = Al(OH)3↓+3NH4+NH3+HNO3 = NH4NO3
(现象:白烟)NH3+H+=NH4+(与酸反应的本质)NH3三、氨的用途?在遇到氨气泄漏时,应该马上疏散到室外,最好到开阔地带,并站在上风头。
?在撤离时,最好准备一块湿毛巾捂住嘴巴。
?如果是在距离水面比较近的地方,就尽量跑到水边,因为氨气溶于水。 动脑:通过今天的学习,若当你遇到氨气泄漏事故,你将如何应对? 如图所示,在一盛有蒸馏水的烧杯中有一悬浮的小球(小球不会被酸碱腐蚀),当向烧杯中不断通入氨后,会出现什么现象?思考:3、氨的化学性质 氨水中含少量氢氧根离子,呈弱碱性,故能使酚
酞试液变红。(1)氨与水反应NH3+H2O NH3.H2O氨水显碱性的原理氨水很不稳定纯净物混合物NH3 氨水和液氨的区别离子:NH4+、OH-、
微量H+分子:`NH3、 H2O 、 NH3·H2O(主要) 在氨的喷泉实验中,烧瓶内溶液的物质的量浓度是多少?(假设实验是在标准状况下进行) 氨气体积设为VL 注意:氨水中溶质是NH3,不是NH3·H2O 氨气物质的量为(V/22.4)mol 氨水溶液体积也是VL 氨水溶液物质的量浓度为
(V/22.4)/V= 0.045 mol/L(2) 氨与酸反应 书p98页 (图4-28) 步骤: 使两根分别蘸有浓氨水和浓盐酸的
玻璃棒接近。 (不要接触)两根玻璃棒靠近时产生大量白烟。 NH3+HCl==NH4Cl现象: 结论: 氨水挥发的NH3与盐酸挥发的HCl化
合生成固体小颗粒NH4Cl的缘故。——此反应可检验NH3或HCl
挥发性酸(HCl、HNO3等)遇氨气均有白烟生成;难挥发性酸H2SO4、H3PO4无此现象。NH3+ HNO3=NH4NO32NH3+ H2SO4=(NH4)2SO4 NH3+HCl==NH4Cl白烟NH3 不能用浓硫酸干燥. (3)氨的催化氧化N2NH3O2NOO2NO2H2OHNO3思考与交流:氨经一系列反应可以得到硝酸,
如下图所示
1、试写出以下每一步转化的反应方程式。
2、分析上述每一步反应中氮元素化合价的变 化,指出氮元素发生的是氧化反应还是还原反应。①铵盐不稳定,受热易分解 (2)化学性质:4、铵盐(1)物理性质:铵盐均溶于水,为白色固体——由铵根离子(NH4+)和酸根离
子构成的化合物②铵盐与碱反应应用:
a.实验室用来制NH3
b.用于NH4+的检验:加热时,能与碱液反应产生使湿润的红色石蕊试纸
变蓝的气体的物质一定是铵盐5、氨的用途①工业制化肥
②有机合成的重要化工原料
③作制冷剂6、氨的制备(一)氨的工业制备(3)装置:固+固加热型(4)收集:向下排空气法(5)验满:(与氧气的制取装置相同)(1)药品:氯化铵晶体、消石灰固体(2)原理:2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑(二).氨的实验室制法 将湿润的红色石蕊试纸放在试管口,如果试纸变蓝,说明氨气已集满。(6)尾气吸收:浓硫酸吸收多余的氨气.——装置:倒扣漏斗⑺干燥装置CaO、碱石灰等碱性干燥剂
注意:
无水CaCl2不能干燥
NH3(形成CaCl2· 8NH3)
2.棉花的作用:防止空气对流,提高集气的速度和纯度。3.实验室中还可以用哪些方法快速制氨气:
①加热浓氨水法②浓氨水加生石灰法(生石灰吸水、溶解时放热)思考:1.用氢氧化钠代替氢氧化钙好吗? 氢氧化钠易吸水,易结块,不易产生NH3;热的氢氧化钠对玻璃有腐蚀作用。第四节 氨 硝酸 硫酸(二) 硫酸 一、硫酸1.使指示剂变色:2.与活泼金属反应放出氢气 (硝酸除外)3.与碱发生中和反应:4.与碱性氧化物反应:5.与某些盐反应:使紫色石蕊试液变红H++ OH -= H2O2H++ CuO = Cu2++ H2O2H++ CO32- = H2O + CO2↑(一)稀硫酸具有酸的通性
H2SO4=2H++SO42-(二)浓硫酸浓H2SO4的物理性质
A.色态:无色、粘稠的油状液体
B.沸点:约338℃——难挥发酸(高沸点酸)
C.密度:1.84g/cm3——高密度酸
D.溶解性:跟水任意比互溶,溶解放出大量热。[思考] 浓硫酸应如何稀释? 用于制易挥发
酸,如盐酸。⑴ 吸水性用途:可以作干燥剂 浓硫酸吸收物质本来就有的水,
直接与水分子结合; 2. 浓硫酸不能干燥碱性气体:NH3还原性气体:H2S HBr、HI2. 浓硫酸
(2) 脱水性脱水性是指浓硫酸能把有机物中的氢氧原子按2:1(H2O)的个数比脱去。 【实验】取10g蔗糖放入小烧杯中,加入几滴水,用玻璃棒搅拌均匀,再加入10mL浓硫酸,并用玻璃棒迅速搅拌。观察物质的颜色、体积变化并闻味。现象:蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的炭,并有刺激性气味的气体产生。2H2SO4 (浓) + C== CO2 + 2H2O + 2SO2脱水性氧化性△ 浓硫酸的吸水性和脱水性有什么区别?吸水性是指浓硫酸直接与水分子结合。 脱水性是指浓硫酸将许多有机物中的
氢、氧元素按水的比例脱去。吸收现成的水反应生成水问题?现象: 加热能反应,产生的气
体能使品红褪色,使石蕊溶液变红;溶液稀释后呈蓝色。 (3) 浓硫酸氧化性
①与金属反应 浸有碱液的棉团的作用:吸收多余的SO2,防止大气污染结论:浓硫酸既有氧化性又有酸性 Cu + 2H2SO4(浓) = CuSO4 + SO2 + 2H2O△0+6+6+4+2还原剂氧化剂 ①与金属反应2e-若铜过量,硫酸能否完全反应?为什么?② 与某些非金属反应
设计一实验,证明浓硫酸与碳反应的生成物含有
水、二氧化硫和二氧化碳 。思考题无水硫酸铜品红
溶液品红
溶液酸性高锰酸钾溶液澄清石灰水证明含SO2除去SO2证明无SO2证明含CO2证明含水变蓝色褪色褪色不褪色变浑浊(三)硫酸的用途: 硫酸是世界上用量最大、用途最广的化工基本原料之一,故素有“化学工业之母”之称。 硫酸硫酸的消费量被视为一个国家工业发水平的标志浓H2SO4蓄电池化学纤维【问题探究】:稀硫酸是否具有氧化性?浓、稀硫酸的氧化性有什么不同?稀硫酸也有氧化性。稀硫酸的氧化性是由于它电离出的H+;浓硫酸的氧化性是由于分子里的+6价硫引起的;H+的氧化性比+6价硫的弱。 酸类物质均有氧化性,其中氧化性由成酸元素引起的酸,叫氧化性酸(浓硫酸、硝酸)。第四节 氨 硝酸 硫酸(三) 硝酸 ⑴纯硝酸是无色、易挥发、有刺激性气味的液体。三、硝酸 ⑵能以任意比溶于水;
⑶密度比水大;
⑷沸点低:83℃;
⑸常用浓硝酸的浓度为69%,
98%的浓硝酸叫作“发烟硝酸”。(一)硝酸的物理性质:(二)硝酸的化学性质 HNO3=H++NO3- 1、具有酸的通性 2、不稳定性 硝酸分解产生NO2,NO2溶于硝酸而使硝酸呈现黄色。保存:密封于棕色瓶中,并放在阴暗处!久置浓硝酸为什么呈黄色?3Cu+8HNO3(稀) =3Cu(NO3)2+2NO +4H2O结论:硝酸具有强的氧化性。Cu+4HNO3(浓) = Cu(NO3)2+2NO2 +2H2O3.与金属反应 硝酸具有强的氧化性,也能跟许多非金属(如碳)反应4HNO3 (浓)+ C = CO2 + 4NO2 + 2H2O 4.与非金属反应 硝酸浓度越大,氧化性越强。 氧化性:浓HNO3 > 稀HNO3 ⑴大量实验证明:不论浓、稀硝酸都有很强的氧化性,几乎能与所有金属(除Pt、Au等少数金属外)反应,如:Mg、Al、Zn、Fe、Cu等。但Al、Fe在冷、浓硝酸中要发生钝化。(2)Pt、Au不与硝酸反应,但能与王水反应。王水是由浓硝酸和浓盐酸以体积比1:3组成的混合物,具有极强的氧化性,能氧化Pt、Au等极不活泼金属。 记忆方法 :
王水:“三言(盐)一笑(硝)” 可以用铁、铝制的容器盛装浓硫酸或浓硝酸(三)硝酸的用途 p102硝酸是一种重要的化工原料,可用于制造炸药、燃料、塑料、硝酸盐等,在实验室里它是一种化学试剂。氧化性酸小结: 硝酸(浓或稀)、硫酸(浓)、次氯酸、王水(硝酸和盐酸)等,都是具有强氧化性的酸。易钝化物质小结: Mg、Al在空气中其表面形成致密的氧化物薄膜而钝化。
Al、Fe在冷的浓硫酸、浓硝酸中其表面形成致密的氧化物薄膜而钝化。
浓硝酸、浓硫酸、浓盐酸性质对比有有有有有有无有有稳定 稳定不稳定易挥发难挥发易挥发无有无无有无1.分别将盛有浓盐酸、浓硫酸、浓硝酸的烧杯露置于空气中,放置一段时间后,质量增大的是 ,原因是 ,质量减少的是 ,原因是 。浓H2SO4 浓H2SO4吸收空气中的水蒸气 浓盐酸、浓硝酸 浓盐酸、浓硝酸均具有挥发性. 练习2.下列试剂不需要保存在棕色试剂瓶内的是 ( ) A、浓HNO3 B、NaCl溶液
C、新制氯水 D、AgNO3 溶液
见光或受热而易变质的物质需用棕色试剂瓶且密封保存,如:AgNO3、浓HNO3、AgCl、H2O2、溴水、氯水等B3.一定量的浓硝酸里加入过量铜会发生哪些变化? 反应停止后,如果在溶液中再加入足量稀盐酸会出现什么情况?溶液中存在NO3-,它遇到H+后,会继续氧化
铜,当然此时NO3-/H+的溶度较稀.4.下列反应中HNO既表现氧化性又表现酸性的是(??) (A)C+浓HNO3?(B)FeO+HNO3???
(C)Fe2O3+HNO3???? (D) Cu+浓HNO3? BD?5.利用下反应制相同质量的硝酸铜时,从理论上看,消耗硝酸质量最多的是
(A)Cu+浓HNO3? (B)Cu+稀HNO3???? ???
(C)CuO+HNO3????? ?? (D) Cu(OH)2+HNO3A6.在稀硫酸中插入一块铜片,加入下列物质后,可使铜片迅速溶解的是( )
A 稀盐酸 B 芒硝晶体
C KNO3 D FeCl2溶液C将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时,收集到气体为1.12L(标准状况)则所消耗的硝酸的物质的量是( )
A 0.12mol B 0.11mol
C 0.10mol D 0.08molCu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)== 3Cu(NO3)2+2NO↑+4H2O B 3Cu+8HNO3(稀)= 3Cu(NO3)2+2NO↑+4H2O Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O X4X2XY3/8Y 2/3Yn(HNO3)=4×0.0225 +3/8×0.0075=0.11mol 1.92g铜粉 n(Cu)=0.03mol,
气体为1.12L n(气体)=0.05mol方法一 元素守恒法:
n(HNO3)=0.05+0.06=0.11mol1.92g铜粉,气体为1.12LCu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)== 3Cu(NO3)2+2NO↑+4H2O n (HNO3)== n(氧化性) + n(酸性)n(氧化性)= 1.12/22.4 =0.05mol n(酸性) = 2×1.92/64 =0.06mol方法二
