人教版高一化学必修一 第二章第2节:离子方程式 课件 (共32张PPT)
文档属性
| 名称 | 人教版高一化学必修一 第二章第2节:离子方程式 课件 (共32张PPT) | 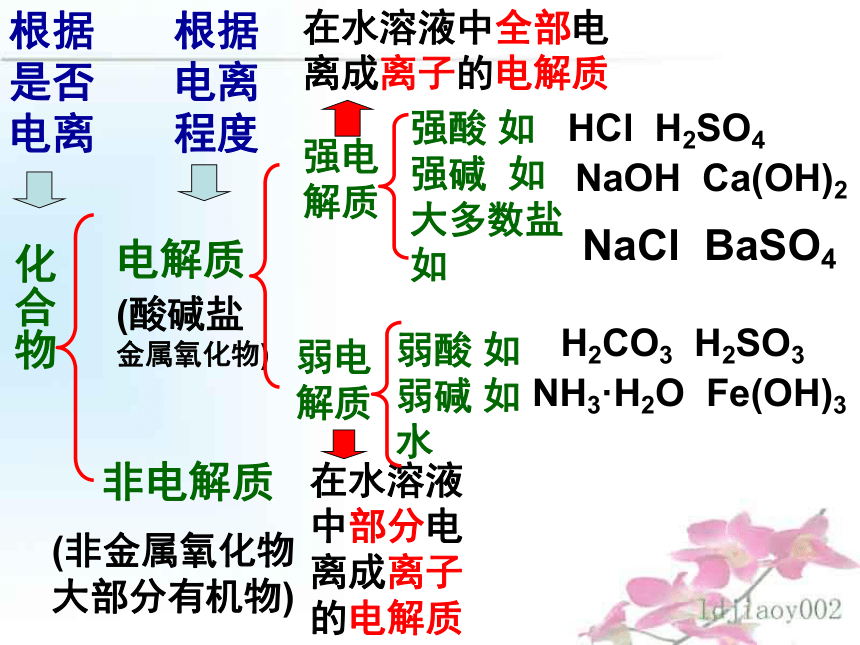 | |
| 格式 | zip | ||
| 文件大小 | 113.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-08 22:13:23 | ||
图片预览










文档简介
课件32张PPT。化合物电解质非电解质(酸碱盐金属氧化物)(非金属氧化物大部分有机物)强电解质弱电解质根据是否电离根据电离程度在水溶液中全部电离成离子的电解质在水溶液中部分电离成离子的电解质强酸 如
强碱 如
大多数盐 如弱酸 如
弱碱 如
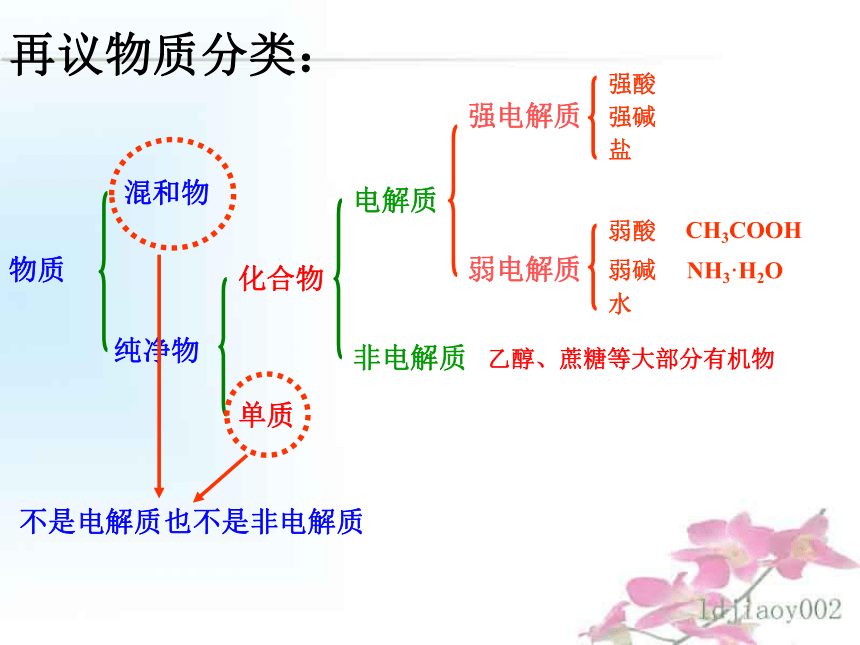
水HCl H2SO4NaOH Ca(OH)2NaCl BaSO4H2CO3 H2SO3NH3·H2O Fe(OH)3物质混和物纯净物化合物单质电解质非电解质强电解质弱电解质强酸强碱盐弱酸弱碱水CH3COOHNH3·H2O再议物质分类:乙醇、蔗糖等大部分有机物不是电解质也不是非电解质小结2:能够导电的物质:1、金属
2、电解质(酸、碱、盐)的溶液
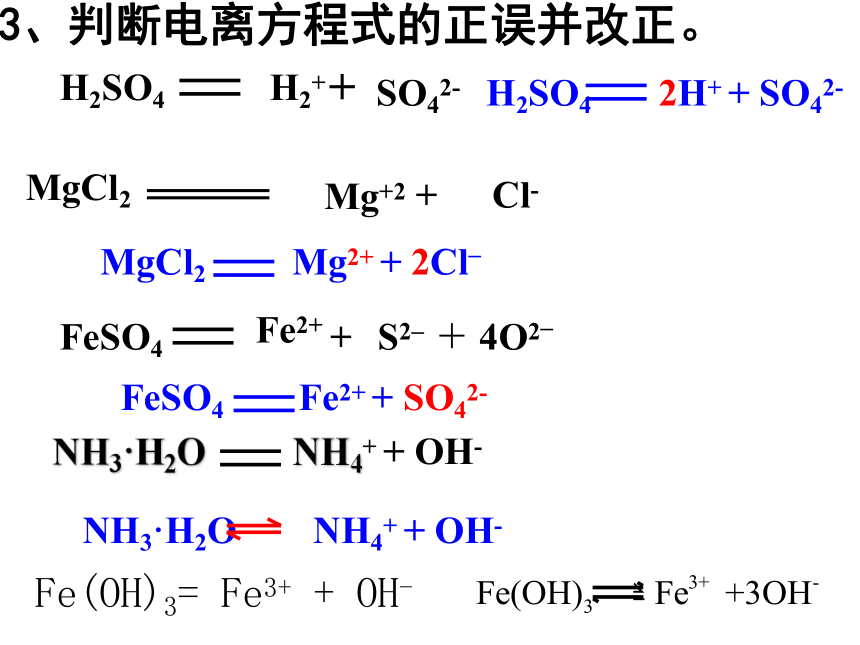
3、熔化的碱、盐(是化合物所以也是电解质)强电解质用“ ”,弱电解质用“ ”三、电离及电离方程式的书写1、电离:在溶液中或在熔融状态下产生了自由移动的离子的过程。2、电离方程式:用化学式和离子符号表示电解质
电离的式子。NaCl Na+ + Cl-遵守质量守恒和电荷守恒 原子团不能拆开左边:化学式 右边:离子符号离子所带电荷数=它在化合物中显示的价态3、判断电离方程式的正误并改正。H2+H2SO4 SO42-+FeSO4Fe2++S2_H2SO4 2H+ + SO42-MgCl2 Mg2+ + 2Cl_4O2_+FeSO4 Fe2+ + SO42-NH3·H2O NH4+ + OH-Fe(OH)3= Fe3+ + OH- 水溶液中酸式盐的电离弱酸的酸式盐强酸的酸式盐二、离子反应及其表示方法无现象白色沉淀Na2SO4+BaCl2==2NaCl+BaSO4↓2Na++SO42-+Ba2++2Cl-= 2Na++2Cl-+BaSO4 ↓SO42-+Ba2+== BaSO4 ↓一、离子反应:Na2SO4溶液与BaCl2溶液反应的实质是:SO42- + Ba2+ BaSO4↓用实际参加反应的离子符号来表示反应的式子叫离子方程式。电解质溶液的反应实质上就是电离出的某些离子之间的反应。
有离子参加或生成的反应称为离子反应。二、离子方程式:1、“写”--写出化学方程式:2AgNO3 + CuCl2 == 2AgCl↓+ Cu(NO3)22、“拆”--把易溶于水、易电离的物质写成离子形式,
难溶或难电离的物质以及气体等仍用化学式表示。2Ag++2NO3-+Cu2++2Cl-==2AgCl↓+Cu2++2NO3-3、“删”--(等量)删去方程式两边不参加反应的离子符号2Ag++2NO3-+Cu2++2Cl- == 2AgCl↓+Cu2++2NO3-4、“查”--整理方程式并检查两边各元素的原子个数和电荷总数是否相等2Ag++2Cl-==2AgCl↓Ag++Cl-==AgCl↓3。离子方程式书写方法应该改写成离子形式的物质:易溶于水、易电离的物质
a、强酸:HCl、H2SO4、HNO3等;
b、强碱:KOH、NaOH、Ba(OH)2、 Ca(OH)2
Ca(OH)2微溶 - 澄清石灰水拆、石灰乳不拆
c、可溶性盐:见下一页。
仍用化学式表示的物质:
a、难溶的物质:
b、难电离的物质(弱电解质):弱酸、弱碱、水
c、气体:H2S、CO2、SO2等
d、单质:H2、Na、I2等
e、氧化物:Na2O、Fe2O3、 CO等易电离物质
(强电解质)常见的盐溶解性表
NH4+、K+、Na+、NO3ˉ、HCO3-(全部溶于水)- 这些盐全拆
SO42-(不溶钡银铅钙)- BaSO4、 CaSO4、 Ag2SO4 PbSO4不拆,其他硫酸盐拆
Clˉ (不溶银和亚汞)- AgCl、 Hg2Cl2不拆,其他氯化物拆
CO32-、(溶水只有钾、钠、铵)- 如K2CO3、 Na2CO3、 (NH4)2CO3拆,其他碳酸盐不拆
蓝色字体部分暂时先了解即可溶液中某些离子的数量会减少或种类会改变。从上面的例子可以知道,发生离子反应以后①HCl+NaOH
②H2SO4+KOH
③HNO3+Ba(OH)2 (3)离子方程式的意义: 离子方程式不仅可表示一定物质间的反应,而且可表示所有同一类型的反应。 思考与交流写出下列反应的离子方程式:2、离子方程式H++OH-== H2O完成下列反应的离子方程式:
①Cu(OH)2+HCl
②CH3COOH+KOH
③Ba(OH)2+H2SO4 练 习▲上面几个反应能否都表示成:
H++OH-==H2OT3.离子方程式CO32-+2H+===CO2↑+H2O表示 ( )
A.碳酸盐与盐酸之间的反应 B.一切碳酸盐与一切酸之间的反应
C.可溶性碳酸盐与强酸之间的反应 D.可溶性碳酸盐与一切酸之间的反应T4.下列反应可以用同一离子方程式表示的是 ( )
A.HCl溶液+Na2CO3溶液 HCl溶液+NaHCO3溶液
B.NaOH溶液+HCl溶液 Ba(OH)2溶液+H2SO4溶液
C.BaCl2溶液+H2SO4溶液 Ba(OH)2溶液+Na2SO4溶液
D.CaCO3+HCl溶液 Na2CO3溶液+H2SO4溶液 4、离子方程式的正误判断
(1)看离子反应是否符合客观事实,不可主观臆造产物及反应。
(2)看“=”、“↑”、“↓”等是否正确。
(3)看表示各物质的化学式是否正确。
(4)看是否漏掉离子反应。应用(5)看电荷是否守恒。如FeCl2溶液与Cl2反应,不能写成Fe2++Cl2==Fe3++2Cl-,而应写成2Fe2++Cl2==2Fe3++2Cl-,同时两边各原子数也应相等。
(6)看反应物或产物的配比是否正确。如稀H2SO4与Ba (OH)2溶液反应
不能写成H++OH-+SO42-+Ba2+==BaSO4↓+H2O
应为2H++2OH-+SO42-+Ba2+ ===BaSO4↓+2H2O
当反应物里有微溶物处于悬浊液或固态时,应写成化学式。
例:在石灰乳中加入Na2CO3溶液:
Ca(OH)2 + CO32- = CaCO3↓+ 2OH-(7)关于微溶物:当反应物里有微溶物处于溶液状态(稀溶液),写成离子符号。
例:少量CO2气体通入澄清石灰水中:
CO2 + Ca2+ + 2OH- =CaCO3 ↓+H2O(8) 不是所有反应都能写离子反应方程式。不是在溶液中进行的反应,不能用离子方程式表示。如:NH4Cl固体与Ca(OH)2固体混合加热,只能
写化学方程式。
2NH4Cl(固)+Ca(OH)2(固)=CaCl2+2NH3↑+2H2O△练习.写出能实现下列变化的相应的化学方程式各一 个。
(1) H+ + OH- = H2O ________________、
(2) Cu2+ + 2OH- = Cu(OH)2↓________________
(3) Fe + 2H+ = Fe2+ +H2↑___________________
(4) CO2 + 2OH- = CO32- + H2O ________________、
(5) H+ + HCO3- = H2O+CO2↑________________、
(6) OH- + HCO3- = H2O+CO32- ________________CO2 + 2NaOH = Na2CO3 + H2O HCl + NaHCO3 = H2O+CO2↑+ NaClNaOH + NaHCO3 = H2O + Na2CO3T5、下列离子方程式中正确的是( )
A、澄清石灰水与稀盐酸反应
Ca(OH)2+2H+===Ca2++2H2O
B、氢氧化钡与硫酸反应
OH- + H+=H2O
C、铜片插入硝酸银溶液中
Cu + Ag+=Cu2++Ag
D、 氯化镁溶液与氢氧化钠溶液反应
Mg2++2OH-===Mg(OH)2↓DT9、下列离子方程式中,正确的是( )
A、氢氧化钡溶液和稀硫酸反应
Ba2++OH-+ H++SO42-=BaSO4↓+H2O
B、大理石和硝酸反应 CO32- +2H+ =H2O + CO2↑
C、铁与稀盐酸反应 2Fe +6H+ =2Fe3+ + 3H2 ↑
D、醋酸溶液与氨水反应
CH3COOH + NH3·H2O = NH4+ + CH3COO- + H2O
E、 氢氧化钡溶液和硫酸铜溶液反应
Ba2++SO42-=BaSO4↓
F、氯化铵晶体和石灰粉共热产生氨气:
NH4+ +OH-=NH3 ↑+H2O
D 3、复分解型离子反应发生的条件条件之一:有沉淀生成条件之二:有挥发性物质生成(放出气体)条件之三:有难电离物质生成(弱酸、弱碱、H2O) Cu2++2OH— == Cu(OH)2↓ CO32-+2H+ == H2O + CO2↑ H++OH-== H2OCH3COO— + H+== CH3COOH ▲离子反应的实质就是通过反应使溶液中某些离子的浓度明显减小的过程。2、离子反应发生的条件
(由复分解反应条件——“生成难溶物、弱电解质(如
水)、气体”来思考)
溶液中某些自由离子数量减少或种类改变。
小结:
1、离子反应
有离子参加或生成的反应。
如:酸、碱、盐在水溶液中的反应。五、离子反应的应用判断离子能否大量共存 这是离子能否反应的问题,掌握酸、碱、盐之间的反应能否发生:凡是会相互反应从而生成难溶物质、挥发性物质或难电离的物质的离子均不能大量共存。 例:下列各组离子能在溶液中大量共存的是 ( )
A.Na+、Mg2+、Cl-、OH- B.H+、Ca2+、CO32-、NO3-
C.Cu2+、K+、SO42-、NO3-
D.Na+、 HCO32- 、OH-、Ca2+
附加隐含条件的应用规律:⑴ 溶液无色透明时,则溶液中一定没有色离子。 常见的有色离子:Cu2+、Fe3+、Fe2+、MnO4-等⑵ 强碱性溶液中肯定不存在与OH-反应的离子。⑶强酸性溶液中肯定不存在与H+反应的离子。1、下列离子在水溶液中,能大量共存的是
A、Na+ 、 K+ 、 CO32-、H+
B、Fe3+、K+ 、 Cl-、 OH-
C、K+ 、NH4+ 、 H+ 、SO42-
D、 Ba2+、Cu2+ 、NO3- 、SO42-
2、下列离子在水溶液中,无色且能大量共存的是
A. Fe3+ 、K+ 、NO3- 、Cl-
B. Ba2+ 、K+ 、Cl- 、OH-
C. H+ 、Mg2+ 、HCO3- 、SO42-
D. Na+ 、K+ 、MnO4- 、NO3- CBT7.下列各组离子一定能大量共存的是 ( )
A.含有大量Ba2+的溶液中:Cl-、K+、SO42-、CO32-
B.含有大量H+的溶液中:Mg2+、Na+、HCO32-、SO42-
C.含有大量OH-的溶液中:Mg2+、NO3-、SO42-、CO32-D.含有大量Na+的溶液中:H+、K+、SO42-、NO3-
T8.在水溶液中能大量共存,且加入过量稀硫酸时,有气体生成的是
A.Na+、Ag+、CO32-、SO42-
B.K+、Ba2+、SO42-、Cl-
C.Na+、K+、CO32-、Cl-
D.Na+、K+、Cl-、SO42- DCT10.下列离子在能使石蕊试液变红色的溶液中能大量共存的是
A、Mg2+ K+ CO32- SO42-
B、Zn2+ Na+ OH- Cl-
C、K+ Ca2+ Cl- SO42-
D、Na+ Al 3+ NO3- Cl-
T11、下列离子在能使酚酞变红色的溶液中能大量共存的是
A、Ag2+、 Na+ 、SO42-、Cl-
B、Na+、Ba2+、 CO32- 、NO3-
C、Cu2+、K+、 Cl- 、SO42-
D、K+、Na+、Cl-、 CO32- DDH+OH-T12
现有H+、OH-、Cl-、CO32-、SO42-、Cu2+、Ag+、Mg2+
1)当溶液中含Ba2+时,不可能同时存在的
是 离子
2)当溶液中含H+ 时,不可能同时存在的
是 离子
3)当溶液中含OH-时,不可能同时存在的
是 离子
4)当溶液中含Cu2+时,不可能同时存在的
是 离子
5)当溶液中含Ag+时,不可能同时存在的
是 离子CO32-、SO42-CO32-、 OH-H+、Cu2+、Mg2+、Ag+CO32-、 OH-CO32-、OH-、 SO42- 、 Cl-3-1、CuO + HCl
3-2、CO2(少量)+ NaOH
CO2(足量或过量)+ NaOH
4-1、Fe + HCl
Zn + CuSO4练习:有甲、乙两相邻的工厂,排放的污水经初步处理后只溶有: Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、NO3-、OH-中的各不相同的4种离子,若单独排入会造成环境污染。如将两厂的污水按适当比例混合,沉淀后,污水转变成无色澄清的硝酸钠溶液排出,则污染程度大为降低,现又测得甲厂的污水PH>7,试推断:
(1)甲厂污水中含有的4种离子是 ;
(2)乙厂污水中含有的4种离子是 。 Na+、Cl-、SO42-、OH-Ag+、Ba2+、Fe3+、NO3-
强碱 如
大多数盐 如弱酸 如
弱碱 如
水HCl H2SO4NaOH Ca(OH)2NaCl BaSO4H2CO3 H2SO3NH3·H2O Fe(OH)3物质混和物纯净物化合物单质电解质非电解质强电解质弱电解质强酸强碱盐弱酸弱碱水CH3COOHNH3·H2O再议物质分类:乙醇、蔗糖等大部分有机物不是电解质也不是非电解质小结2:能够导电的物质:1、金属
2、电解质(酸、碱、盐)的溶液
3、熔化的碱、盐(是化合物所以也是电解质)强电解质用“ ”,弱电解质用“ ”三、电离及电离方程式的书写1、电离:在溶液中或在熔融状态下产生了自由移动的离子的过程。2、电离方程式:用化学式和离子符号表示电解质
电离的式子。NaCl Na+ + Cl-遵守质量守恒和电荷守恒 原子团不能拆开左边:化学式 右边:离子符号离子所带电荷数=它在化合物中显示的价态3、判断电离方程式的正误并改正。H2+H2SO4 SO42-+FeSO4Fe2++S2_H2SO4 2H+ + SO42-MgCl2 Mg2+ + 2Cl_4O2_+FeSO4 Fe2+ + SO42-NH3·H2O NH4+ + OH-Fe(OH)3= Fe3+ + OH- 水溶液中酸式盐的电离弱酸的酸式盐强酸的酸式盐二、离子反应及其表示方法无现象白色沉淀Na2SO4+BaCl2==2NaCl+BaSO4↓2Na++SO42-+Ba2++2Cl-= 2Na++2Cl-+BaSO4 ↓SO42-+Ba2+== BaSO4 ↓一、离子反应:Na2SO4溶液与BaCl2溶液反应的实质是:SO42- + Ba2+ BaSO4↓用实际参加反应的离子符号来表示反应的式子叫离子方程式。电解质溶液的反应实质上就是电离出的某些离子之间的反应。
有离子参加或生成的反应称为离子反应。二、离子方程式:1、“写”--写出化学方程式:2AgNO3 + CuCl2 == 2AgCl↓+ Cu(NO3)22、“拆”--把易溶于水、易电离的物质写成离子形式,
难溶或难电离的物质以及气体等仍用化学式表示。2Ag++2NO3-+Cu2++2Cl-==2AgCl↓+Cu2++2NO3-3、“删”--(等量)删去方程式两边不参加反应的离子符号2Ag++2NO3-+Cu2++2Cl- == 2AgCl↓+Cu2++2NO3-4、“查”--整理方程式并检查两边各元素的原子个数和电荷总数是否相等2Ag++2Cl-==2AgCl↓Ag++Cl-==AgCl↓3。离子方程式书写方法应该改写成离子形式的物质:易溶于水、易电离的物质
a、强酸:HCl、H2SO4、HNO3等;
b、强碱:KOH、NaOH、Ba(OH)2、 Ca(OH)2
Ca(OH)2微溶 - 澄清石灰水拆、石灰乳不拆
c、可溶性盐:见下一页。
仍用化学式表示的物质:
a、难溶的物质:
b、难电离的物质(弱电解质):弱酸、弱碱、水
c、气体:H2S、CO2、SO2等
d、单质:H2、Na、I2等
e、氧化物:Na2O、Fe2O3、 CO等易电离物质
(强电解质)常见的盐溶解性表
NH4+、K+、Na+、NO3ˉ、HCO3-(全部溶于水)- 这些盐全拆
SO42-(不溶钡银铅钙)- BaSO4、 CaSO4、 Ag2SO4 PbSO4不拆,其他硫酸盐拆
Clˉ (不溶银和亚汞)- AgCl、 Hg2Cl2不拆,其他氯化物拆
CO32-、(溶水只有钾、钠、铵)- 如K2CO3、 Na2CO3、 (NH4)2CO3拆,其他碳酸盐不拆
蓝色字体部分暂时先了解即可溶液中某些离子的数量会减少或种类会改变。从上面的例子可以知道,发生离子反应以后①HCl+NaOH
②H2SO4+KOH
③HNO3+Ba(OH)2 (3)离子方程式的意义: 离子方程式不仅可表示一定物质间的反应,而且可表示所有同一类型的反应。 思考与交流写出下列反应的离子方程式:2、离子方程式H++OH-== H2O完成下列反应的离子方程式:
①Cu(OH)2+HCl
②CH3COOH+KOH
③Ba(OH)2+H2SO4 练 习▲上面几个反应能否都表示成:
H++OH-==H2OT3.离子方程式CO32-+2H+===CO2↑+H2O表示 ( )
A.碳酸盐与盐酸之间的反应 B.一切碳酸盐与一切酸之间的反应
C.可溶性碳酸盐与强酸之间的反应 D.可溶性碳酸盐与一切酸之间的反应T4.下列反应可以用同一离子方程式表示的是 ( )
A.HCl溶液+Na2CO3溶液 HCl溶液+NaHCO3溶液
B.NaOH溶液+HCl溶液 Ba(OH)2溶液+H2SO4溶液
C.BaCl2溶液+H2SO4溶液 Ba(OH)2溶液+Na2SO4溶液
D.CaCO3+HCl溶液 Na2CO3溶液+H2SO4溶液 4、离子方程式的正误判断
(1)看离子反应是否符合客观事实,不可主观臆造产物及反应。
(2)看“=”、“↑”、“↓”等是否正确。
(3)看表示各物质的化学式是否正确。
(4)看是否漏掉离子反应。应用(5)看电荷是否守恒。如FeCl2溶液与Cl2反应,不能写成Fe2++Cl2==Fe3++2Cl-,而应写成2Fe2++Cl2==2Fe3++2Cl-,同时两边各原子数也应相等。
(6)看反应物或产物的配比是否正确。如稀H2SO4与Ba (OH)2溶液反应
不能写成H++OH-+SO42-+Ba2+==BaSO4↓+H2O
应为2H++2OH-+SO42-+Ba2+ ===BaSO4↓+2H2O
当反应物里有微溶物处于悬浊液或固态时,应写成化学式。
例:在石灰乳中加入Na2CO3溶液:
Ca(OH)2 + CO32- = CaCO3↓+ 2OH-(7)关于微溶物:当反应物里有微溶物处于溶液状态(稀溶液),写成离子符号。
例:少量CO2气体通入澄清石灰水中:
CO2 + Ca2+ + 2OH- =CaCO3 ↓+H2O(8) 不是所有反应都能写离子反应方程式。不是在溶液中进行的反应,不能用离子方程式表示。如:NH4Cl固体与Ca(OH)2固体混合加热,只能
写化学方程式。
2NH4Cl(固)+Ca(OH)2(固)=CaCl2+2NH3↑+2H2O△练习.写出能实现下列变化的相应的化学方程式各一 个。
(1) H+ + OH- = H2O ________________、
(2) Cu2+ + 2OH- = Cu(OH)2↓________________
(3) Fe + 2H+ = Fe2+ +H2↑___________________
(4) CO2 + 2OH- = CO32- + H2O ________________、
(5) H+ + HCO3- = H2O+CO2↑________________、
(6) OH- + HCO3- = H2O+CO32- ________________CO2 + 2NaOH = Na2CO3 + H2O HCl + NaHCO3 = H2O+CO2↑+ NaClNaOH + NaHCO3 = H2O + Na2CO3T5、下列离子方程式中正确的是( )
A、澄清石灰水与稀盐酸反应
Ca(OH)2+2H+===Ca2++2H2O
B、氢氧化钡与硫酸反应
OH- + H+=H2O
C、铜片插入硝酸银溶液中
Cu + Ag+=Cu2++Ag
D、 氯化镁溶液与氢氧化钠溶液反应
Mg2++2OH-===Mg(OH)2↓DT9、下列离子方程式中,正确的是( )
A、氢氧化钡溶液和稀硫酸反应
Ba2++OH-+ H++SO42-=BaSO4↓+H2O
B、大理石和硝酸反应 CO32- +2H+ =H2O + CO2↑
C、铁与稀盐酸反应 2Fe +6H+ =2Fe3+ + 3H2 ↑
D、醋酸溶液与氨水反应
CH3COOH + NH3·H2O = NH4+ + CH3COO- + H2O
E、 氢氧化钡溶液和硫酸铜溶液反应
Ba2++SO42-=BaSO4↓
F、氯化铵晶体和石灰粉共热产生氨气:
NH4+ +OH-=NH3 ↑+H2O
D 3、复分解型离子反应发生的条件条件之一:有沉淀生成条件之二:有挥发性物质生成(放出气体)条件之三:有难电离物质生成(弱酸、弱碱、H2O) Cu2++2OH— == Cu(OH)2↓ CO32-+2H+ == H2O + CO2↑ H++OH-== H2OCH3COO— + H+== CH3COOH ▲离子反应的实质就是通过反应使溶液中某些离子的浓度明显减小的过程。2、离子反应发生的条件
(由复分解反应条件——“生成难溶物、弱电解质(如
水)、气体”来思考)
溶液中某些自由离子数量减少或种类改变。
小结:
1、离子反应
有离子参加或生成的反应。
如:酸、碱、盐在水溶液中的反应。五、离子反应的应用判断离子能否大量共存 这是离子能否反应的问题,掌握酸、碱、盐之间的反应能否发生:凡是会相互反应从而生成难溶物质、挥发性物质或难电离的物质的离子均不能大量共存。 例:下列各组离子能在溶液中大量共存的是 ( )
A.Na+、Mg2+、Cl-、OH- B.H+、Ca2+、CO32-、NO3-
C.Cu2+、K+、SO42-、NO3-
D.Na+、 HCO32- 、OH-、Ca2+
附加隐含条件的应用规律:⑴ 溶液无色透明时,则溶液中一定没有色离子。 常见的有色离子:Cu2+、Fe3+、Fe2+、MnO4-等⑵ 强碱性溶液中肯定不存在与OH-反应的离子。⑶强酸性溶液中肯定不存在与H+反应的离子。1、下列离子在水溶液中,能大量共存的是
A、Na+ 、 K+ 、 CO32-、H+
B、Fe3+、K+ 、 Cl-、 OH-
C、K+ 、NH4+ 、 H+ 、SO42-
D、 Ba2+、Cu2+ 、NO3- 、SO42-
2、下列离子在水溶液中,无色且能大量共存的是
A. Fe3+ 、K+ 、NO3- 、Cl-
B. Ba2+ 、K+ 、Cl- 、OH-
C. H+ 、Mg2+ 、HCO3- 、SO42-
D. Na+ 、K+ 、MnO4- 、NO3- CBT7.下列各组离子一定能大量共存的是 ( )
A.含有大量Ba2+的溶液中:Cl-、K+、SO42-、CO32-
B.含有大量H+的溶液中:Mg2+、Na+、HCO32-、SO42-
C.含有大量OH-的溶液中:Mg2+、NO3-、SO42-、CO32-D.含有大量Na+的溶液中:H+、K+、SO42-、NO3-
T8.在水溶液中能大量共存,且加入过量稀硫酸时,有气体生成的是
A.Na+、Ag+、CO32-、SO42-
B.K+、Ba2+、SO42-、Cl-
C.Na+、K+、CO32-、Cl-
D.Na+、K+、Cl-、SO42- DCT10.下列离子在能使石蕊试液变红色的溶液中能大量共存的是
A、Mg2+ K+ CO32- SO42-
B、Zn2+ Na+ OH- Cl-
C、K+ Ca2+ Cl- SO42-
D、Na+ Al 3+ NO3- Cl-
T11、下列离子在能使酚酞变红色的溶液中能大量共存的是
A、Ag2+、 Na+ 、SO42-、Cl-
B、Na+、Ba2+、 CO32- 、NO3-
C、Cu2+、K+、 Cl- 、SO42-
D、K+、Na+、Cl-、 CO32- DDH+OH-T12
现有H+、OH-、Cl-、CO32-、SO42-、Cu2+、Ag+、Mg2+
1)当溶液中含Ba2+时,不可能同时存在的
是 离子
2)当溶液中含H+ 时,不可能同时存在的
是 离子
3)当溶液中含OH-时,不可能同时存在的
是 离子
4)当溶液中含Cu2+时,不可能同时存在的
是 离子
5)当溶液中含Ag+时,不可能同时存在的
是 离子CO32-、SO42-CO32-、 OH-H+、Cu2+、Mg2+、Ag+CO32-、 OH-CO32-、OH-、 SO42- 、 Cl-3-1、CuO + HCl
3-2、CO2(少量)+ NaOH
CO2(足量或过量)+ NaOH
4-1、Fe + HCl
Zn + CuSO4练习:有甲、乙两相邻的工厂,排放的污水经初步处理后只溶有: Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、NO3-、OH-中的各不相同的4种离子,若单独排入会造成环境污染。如将两厂的污水按适当比例混合,沉淀后,污水转变成无色澄清的硝酸钠溶液排出,则污染程度大为降低,现又测得甲厂的污水PH>7,试推断:
(1)甲厂污水中含有的4种离子是 ;
(2)乙厂污水中含有的4种离子是 。 Na+、Cl-、SO42-、OH-Ag+、Ba2+、Fe3+、NO3-
