人教版高一化学必修一 第三章第一节:金属的化学性质 课件 (共27张PPT)
文档属性
| 名称 | 人教版高一化学必修一 第三章第一节:金属的化学性质 课件 (共27张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 457.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-08 22:14:36 | ||
图片预览


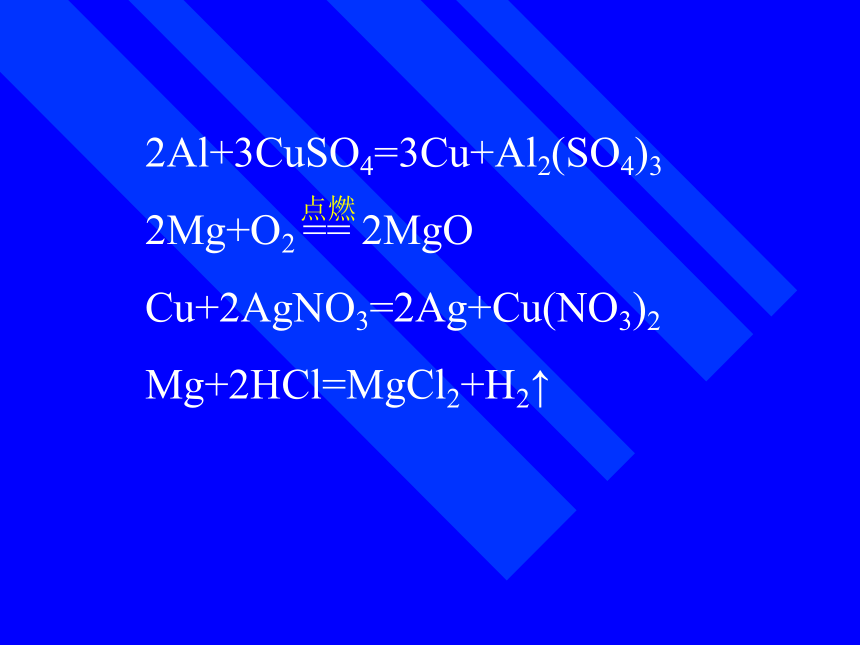





文档简介
课件27张PPT。第一节
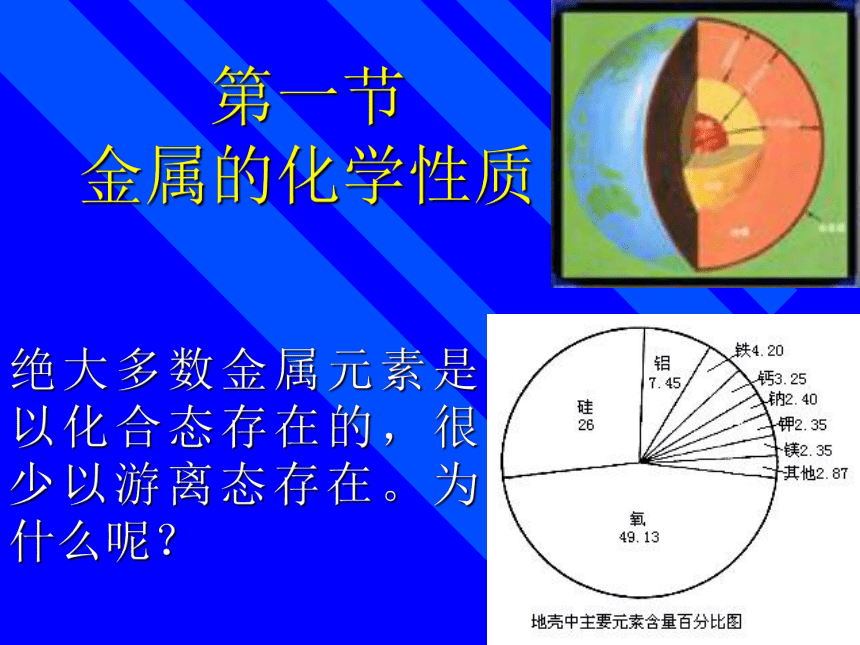
金属的化学性质绝大多数金属元素是以化合态存在的,很少以游离态存在。为什么呢? 铝与硫酸铜溶液 镁条燃烧 铜丝与硝酸 镁条与稀盐酸
反应 银溶液反应 反应下图是一些化学反应的照片,请分析这些反应,并写出化学方程式。 2Al+3CuSO4=3Cu+Al2(SO4)3
2Mg+O2 == 2MgO
Cu+2AgNO3=2Ag+Cu(NO3)2
Mg+2HCl=MgCl2+H2↑点燃金属所具有的共同的化学性质1、金属与非金属的反应
2、金属与酸的反应
3、金属与盐溶液的反应实验3-1 :取一小块金属钠,用滤纸擦干表面的煤油后,用刀切去一端的外皮.观察钠的表面光泽和颜色。注意:新切开的钠的表面在空气中是否会发生变化?一.金属与非金属的反应注意:取用一小块钠后剩余的钠必须放回原瓶!!!物理性质:取出的金属表面有一灰黄色层,钠具有银白色金属光泽,质软。
实验现象:切开后的切口处露出银白色金属光泽。切口在空气中露置一会儿,会逐渐变暗。(久置后表面还会形成溶液,最后变成白色粉末。为什么?)
结论:钠的氧化速度远比镁铝要快,金属性要强。4Na+O2=2Na2O钠的物理性质 银白色、有金属光泽的固体,热、电的良导体,质软,密度小,熔点低。思考: 刚才切开钠时看到银白色,但很快就失去光泽,为什么?在空气中:4Na + O2 = 2Na2O
实验要求:仔细操作、注意安全、认真观察、
小组讨论、主动发言。实验3-2:把一小块金属钠放在石棉网上,加热,有什么现象?实验3-2 现象:钠先熔化后燃烧,燃烧时火焰呈黄色,最后留下的固体呈淡黄色。
结论:钠的熔点较低,钠与O2反应,条件不同,现象不同,产物不同。
2Na+O2===Na2O2 △:P44科学探究1 加热铝箔现象:铝箔熔化并失去光泽,熔化的铝并不滴落,好像有一层膜兜着。
原因:Al2O3的熔点(2050℃)远高于铝的熔点,包在铝的外面,所以熔化的液态铝不会低落。演示实验2:P44 科学探究2 先用砂纸打磨铝箔后加热现象:熔化的铝仍不滴落。
原因:铝很活泼,在空气中很快又生成一层新的氧化膜。绝大多数金属都能与氧气反应,越活泼的金属与氧气反应就越容易小结活泼性很弱的金属(如铂、金)不能被氧气氧化(真金不怕火炼)金属跟氧气反应时生成的氧化物一般为普通氧化物如MgO、Al2O3,但钠在氧气中燃烧生成Na2O2,铁在氧气中燃烧生成Fe3O4 金属元素的最外层电子数较少,容易失去,单质往往表现出还原性,当遇到氧化剂时,就会发生氧化还原反应。因此 ,除了能被氧气氧化外,还能被氯气、硫等具有氧化性的物质氧化,生成相应的氯化物或硫化物。2001年7月8日广州日报新闻:
珠江水面惊现神秘“水雷”
2001年7月6日、7日、8日接连三天,广州市珠江河段上惊现神秘“水雷”,先后有8个铁皮桶漂浮在水面上,其中5个发生剧烈爆炸,另外3个被有关部门成功打捞,在整个过程中,幸无人员伤亡,经广州市化工集团的化学品专家们初步认定,铁桶内装的是金属钠。
看完以上新闻,你会提出什么问题?二、金属与酸和水的反应)
a.将钠投入水中,钠浮在水上面还是沉没水下?可得出什么结论?
b.钠是否熔成一个小球?还有什么现象发生?
c.反应时溶液颜色有什么变化?生成的是什么物质? 实验现象:
a.钠浮在水面上(浮)——钠密度比水小
b.立刻熔成一个闪亮的小球,有水雾,有时有火花或伴有爆鸣声 (熔)——钠熔点较低,钠与水反应放热
c.在水面上四处游动,发出嘶嘶声,最后完全消失(游,响)——钠与水剧烈反应生成气体。
d.反应后溶液由无色变成红色(红)——钠与水反应生成碱性物质(NaOH)
e.钠球逐渐变小,最后完全消失
结论:2Na+2H2O=2NaOH+H2↑ 钠与冷水剧烈反应生成了NaOH和H22Na+2H2O=NaOH+H2↑氧化剂是H2O,还原剂是Na。 钠为什么要保存在煤油中?思考与交流:1、钠保存在哪里?能否用汽油或酒精?应该满足什么条件才能保存钠?为什么?
2、金属钠着火能否用水灭火,为什么呢?保存在煤油里和石蜡油中,目的是防止钠被氧化成Na2O;同时防止钠与空气中的水蒸气反应。不能。因为钠与水反应生成可燃性气体H2 ,导致火势更大。练习:把一小块金属钠投入盛有煤油和水的烧杯中,可以观察到
A、钠浮在烧杯中的液面上。
B、钠沉在烧杯的底部。
C、煤油会燃烧起来,产生很浓的黑烟。
D、钠会在水和煤油的交界面上下浮动,直到反应结束。
D那铁呢?能否跟冷水反应?热水?通过预习你已经知道铁与水蒸气可以反应,试将此与 钠和水的反应比较,有何不同?为什么?思考与交流:
钠能与水发生非常剧烈的反应,那么其它的金属又能不能与水反应呢?你是如何推断的?请大家思考、交流。 1.水蒸气的发生装置2.水蒸气与铁粉反应装置3.产物的检验(收集)装置现象:加热时铁粉红热,烧瓶内产生水蒸气,点燃肥皂泡可听到爆鸣声。 3Fe+4H2O(g)===Fe3O4+4H2↑△实验操作时,要注意哪些问题?组装仪器时要由下到上,由左到右;先检查装置的气密性,再加试剂;实验结束后,要先把导管从水槽中撤出,再熄灭酒精灯。实验开始时,要先点燃制取水蒸气的烧瓶处的酒精灯,再点燃铁粉处的酒精灯。思考和交流:钠与水、铁与水的反应情况进行归纳:不同的金属与水反应的剧烈程度以及产物的不同,与哪些因素有关? 实验3-4(P47)①开始现象不明显。
②后来有少量气泡产生,气泡逐渐增多。
③试管很热。
④将点燃的木条放在试管口时,都有爆鸣声。 ①氧化膜与酸、碱发生反应。
②铝与酸、碱反应产生气体。
③反应放热。
④生成氢气。
反应 银溶液反应 反应下图是一些化学反应的照片,请分析这些反应,并写出化学方程式。 2Al+3CuSO4=3Cu+Al2(SO4)3
2Mg+O2 == 2MgO
Cu+2AgNO3=2Ag+Cu(NO3)2
Mg+2HCl=MgCl2+H2↑点燃金属所具有的共同的化学性质1、金属与非金属的反应
2、金属与酸的反应
3、金属与盐溶液的反应实验3-1 :取一小块金属钠,用滤纸擦干表面的煤油后,用刀切去一端的外皮.观察钠的表面光泽和颜色。注意:新切开的钠的表面在空气中是否会发生变化?一.金属与非金属的反应注意:取用一小块钠后剩余的钠必须放回原瓶!!!物理性质:取出的金属表面有一灰黄色层,钠具有银白色金属光泽,质软。
实验现象:切开后的切口处露出银白色金属光泽。切口在空气中露置一会儿,会逐渐变暗。(久置后表面还会形成溶液,最后变成白色粉末。为什么?)
结论:钠的氧化速度远比镁铝要快,金属性要强。4Na+O2=2Na2O钠的物理性质 银白色、有金属光泽的固体,热、电的良导体,质软,密度小,熔点低。思考: 刚才切开钠时看到银白色,但很快就失去光泽,为什么?在空气中:4Na + O2 = 2Na2O
实验要求:仔细操作、注意安全、认真观察、
小组讨论、主动发言。实验3-2:把一小块金属钠放在石棉网上,加热,有什么现象?实验3-2 现象:钠先熔化后燃烧,燃烧时火焰呈黄色,最后留下的固体呈淡黄色。
结论:钠的熔点较低,钠与O2反应,条件不同,现象不同,产物不同。
2Na+O2===Na2O2 △:P44科学探究1 加热铝箔现象:铝箔熔化并失去光泽,熔化的铝并不滴落,好像有一层膜兜着。
原因:Al2O3的熔点(2050℃)远高于铝的熔点,包在铝的外面,所以熔化的液态铝不会低落。演示实验2:P44 科学探究2 先用砂纸打磨铝箔后加热现象:熔化的铝仍不滴落。
原因:铝很活泼,在空气中很快又生成一层新的氧化膜。绝大多数金属都能与氧气反应,越活泼的金属与氧气反应就越容易小结活泼性很弱的金属(如铂、金)不能被氧气氧化(真金不怕火炼)金属跟氧气反应时生成的氧化物一般为普通氧化物如MgO、Al2O3,但钠在氧气中燃烧生成Na2O2,铁在氧气中燃烧生成Fe3O4 金属元素的最外层电子数较少,容易失去,单质往往表现出还原性,当遇到氧化剂时,就会发生氧化还原反应。因此 ,除了能被氧气氧化外,还能被氯气、硫等具有氧化性的物质氧化,生成相应的氯化物或硫化物。2001年7月8日广州日报新闻:
珠江水面惊现神秘“水雷”
2001年7月6日、7日、8日接连三天,广州市珠江河段上惊现神秘“水雷”,先后有8个铁皮桶漂浮在水面上,其中5个发生剧烈爆炸,另外3个被有关部门成功打捞,在整个过程中,幸无人员伤亡,经广州市化工集团的化学品专家们初步认定,铁桶内装的是金属钠。
看完以上新闻,你会提出什么问题?二、金属与酸和水的反应)
a.将钠投入水中,钠浮在水上面还是沉没水下?可得出什么结论?
b.钠是否熔成一个小球?还有什么现象发生?
c.反应时溶液颜色有什么变化?生成的是什么物质? 实验现象:
a.钠浮在水面上(浮)——钠密度比水小
b.立刻熔成一个闪亮的小球,有水雾,有时有火花或伴有爆鸣声 (熔)——钠熔点较低,钠与水反应放热
c.在水面上四处游动,发出嘶嘶声,最后完全消失(游,响)——钠与水剧烈反应生成气体。
d.反应后溶液由无色变成红色(红)——钠与水反应生成碱性物质(NaOH)
e.钠球逐渐变小,最后完全消失
结论:2Na+2H2O=2NaOH+H2↑ 钠与冷水剧烈反应生成了NaOH和H22Na+2H2O=NaOH+H2↑氧化剂是H2O,还原剂是Na。 钠为什么要保存在煤油中?思考与交流:1、钠保存在哪里?能否用汽油或酒精?应该满足什么条件才能保存钠?为什么?
2、金属钠着火能否用水灭火,为什么呢?保存在煤油里和石蜡油中,目的是防止钠被氧化成Na2O;同时防止钠与空气中的水蒸气反应。不能。因为钠与水反应生成可燃性气体H2 ,导致火势更大。练习:把一小块金属钠投入盛有煤油和水的烧杯中,可以观察到
A、钠浮在烧杯中的液面上。
B、钠沉在烧杯的底部。
C、煤油会燃烧起来,产生很浓的黑烟。
D、钠会在水和煤油的交界面上下浮动,直到反应结束。
D那铁呢?能否跟冷水反应?热水?通过预习你已经知道铁与水蒸气可以反应,试将此与 钠和水的反应比较,有何不同?为什么?思考与交流:
钠能与水发生非常剧烈的反应,那么其它的金属又能不能与水反应呢?你是如何推断的?请大家思考、交流。 1.水蒸气的发生装置2.水蒸气与铁粉反应装置3.产物的检验(收集)装置现象:加热时铁粉红热,烧瓶内产生水蒸气,点燃肥皂泡可听到爆鸣声。 3Fe+4H2O(g)===Fe3O4+4H2↑△实验操作时,要注意哪些问题?组装仪器时要由下到上,由左到右;先检查装置的气密性,再加试剂;实验结束后,要先把导管从水槽中撤出,再熄灭酒精灯。实验开始时,要先点燃制取水蒸气的烧瓶处的酒精灯,再点燃铁粉处的酒精灯。思考和交流:钠与水、铁与水的反应情况进行归纳:不同的金属与水反应的剧烈程度以及产物的不同,与哪些因素有关? 实验3-4(P47)①开始现象不明显。
②后来有少量气泡产生,气泡逐渐增多。
③试管很热。
④将点燃的木条放在试管口时,都有爆鸣声。 ①氧化膜与酸、碱发生反应。
②铝与酸、碱反应产生气体。
③反应放热。
④生成氢气。
