人教版高一化学必修一 4.2富集在海水中的元素——氯(导学案,答案不全)
文档属性
| 名称 | 人教版高一化学必修一 4.2富集在海水中的元素——氯(导学案,答案不全) |
|
|
| 格式 | zip | ||
| 文件大小 | 283.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-08 00:00:00 | ||
图片预览


文档简介
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
编写人:钟燕 审核人:林彩霞 领导签字:
【学习目标】:1,掌握氯气的物理性质和化学性质,会写氯气与金属、非金属反应的化学方程式。
2,了解氯气的实验室制法(包括试剂、反应原理、反应装置、收集方法)。
【学习重、难点】:氯气的化学性质。
【学习要求】:上课前请完成“一、预习自学”。
一、【预习自学】
(一)、Cl2的物理性质:请阅读课本P82“科学史话”,完成填空。
1、颜色:________色、刺激性气味、有毒的气体。(正确闻Cl2的方法:________________)
2、密度:比空气________ (ρ1/ρ2=M1/M2)
3、溶解度:________________。(课本P84第3行)
4、氯气熔点-1010°C,沸点-34.6°C,所以氯气是易液化的气体。
思考:氯水与液氯是同一种物质吗?
(二)、Cl2的实验室制法:
1、反应原理: MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
2、请指出上述反应的氧化剂、还原剂、氧化产物、还原产物,并用双线桥标出电子转移的情况和数目。
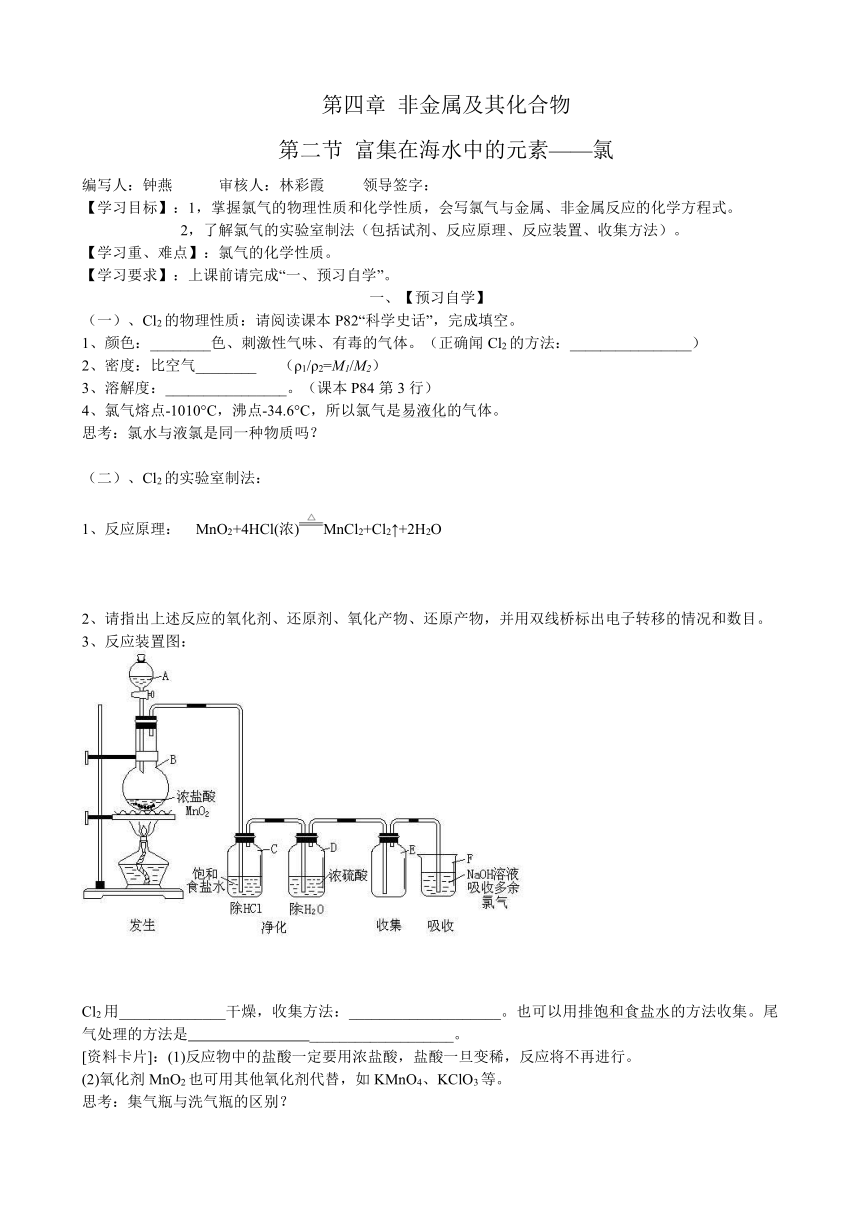
3、反应装置图:
( http: / / www.21cnjy.com )
Cl2用______________干燥 ( http: / / www.21cnjy.com ),收集方法:____________________。也可以用排饱和食盐水的方法收集。尾气处理的方法是 ___________________。
[资料卡片]:(1)反应物中的盐酸一定要用浓盐酸,盐酸一旦变稀,反应将不再进行。
(2)氧化剂MnO2也可用其他氧化剂代替,如KMnO4、KClO3等。
思考:集气瓶与洗气瓶的区别?
(三)、Cl2的化学性质:
1、请阅读课本P82完成:氯的原子结构示意 ( http: / / www.21cnjy.com )图为________________,易________电子,达到8个电子的稳定结构。故氯元素的非金属性很强,在化学反应中表现出很强的氧化性。氯在自然界中以________态存在,主要以________的形式存在于____________________中。
2、Cl2与金属的反应:(课前请先完成方程式,反应现象待课上解决,下同)
与Na反应方程式:_________________________________________;(注意注明反应条件)
现象:___________ _______________________
与Fe反应方程式:_________________________________________;(注意注明反应条件)
现象:___________ _______________________
与Cu反应方程式:_________________________________________;(注意注明反应条件)
现象:___________ _______________________
思考:为什么液氯可以保存在钢瓶中?
【小结】氯气的化学性质非常_______,具有很强的_________性,在一定的条件下几乎与所有的金属反应,且与Cu、Fe等变价金属反应时,均生成_______价金属氯化物。
3、Cl2与非金属的反应:
[实验4-3]:
操作 现象 化学方程式
在空气中点燃H2,然后把导管缓缓伸入盛满Cl2的集气瓶中。 (对比:H2在空气中燃烧的现象: )
H2、Cl2混合后光照。
小组讨论完成:(1)为什么H2在Cl2中能安静燃烧,而在混合后光照会爆炸?工业上生产盐酸又应该采取哪种反应条件呢?
(2)通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?是否所有燃烧都要有氧气参加?
(3)“点燃”和“燃烧”有何区别?
4、Cl2与还原性盐类的反应:
(1)Cl2、Br2、I2 ( http: / / www.21cnjy.com )都具有氧化性,其氧化性Cl2>Br2>I2,Cl2能把Br2从溴化物中置换出来,其余依次类推。请据此写出下列置换反应的化学方程式。
将Cl2分别通入KBr溶液和KI溶液中:
_____________________________________,_____________________________________
将溴水滴入KI溶液中:__________________________________
思考:为什么可以用湿润的淀粉KI试纸检验Cl2?
(2)将Cl2通入FeCl2溶液中:
方程式:_____________________________,现象:____________________________
(3)Cl2与Na2SO3溶液的反应:
请完成方程式(未配平):__Cl2+__Na2SO3+______=__Na2SO4+__HCl (除去废水中的氯)
(四)、氯离子(Cl-)的检验:
[实验4-6] 在下列溶液中各滴入几滴AgNO3溶液,观察现象。然后再分别加入少量稀HNO3,观察现象。
思考:检验Cl-时,为什么滴加AgNO3溶液后还要再加稀硝酸呢?
【资料卡片】:请阅读课本P86[科学视野]——成盐元素(卤素)
1、卤素:F、Cl、Br、I、At。最处电子层都是7个电子。是典型的非金属元素,具有氧化性。
2、单质的氧化性强弱:F2>Cl2>Br2>I2
3、应用:AgI——人工降雨,AgBr——感光材料, KIO3——加碘盐。
二、【课堂检测】
1、2005年3月19日,京泸高速 ( http: / / www.21cnjy.com )公路淮安段。一辆载有35吨的槽罐车与一辆货车相撞,发生液氯泄露事故,事故发生后采取的措施不正确的是:( )
A.群众向高处转移 B.用沾NaOH溶液的湿毛巾捂住口鼻
C.向液氯中喷洒NaOH溶液 D.用沾Na2CO3溶液的湿毛巾捂住口鼻
2、下列物质属于纯净物的是( )
A. 氯水 B. 盐酸 C. 液氯 D. 漂白粉
3、下列说法正确的是: ( )
A. 氯气以液态形式存在时可称作氯水或液氯
B. Cl2有毒,Cl-也有毒,Cl、Cl2和Cl-都是黄绿色
C. 0.1mol Fe与Cl2充分反应后,生成物的质量比Fe的质量增加了7.1g
D. 红热的铜丝在氯气中燃烧,生成棕黄色的固体CuCl2
4、下列氯化物中,不能用金属和氯气直接反应制得的是( )
A.CuCl2 B.FeCl2 C.MgCl2 D.KCl
5、检验氯化氢气体中是否混有Cl2 ( http: / / www.21cnjy.com ),可采用的方法是( )
A.用干燥的蓝色石蕊试纸 B.用干燥的有色布条
C.将气体通入硝酸银溶液. D.用湿润的淀粉碘化钾试纸
6、使体积相同的NaCl、MgCl2、AlC ( http: / / www.21cnjy.com )l3溶液中的Cl-完全转变为AgCl,若消耗AgNO3体积相同,则NaCl、MgCl2、AlCl3三种溶液物质的量浓度之比 ( )
A.6:3:2 B.3:2:1 C.1:2:3 D.1:1:1
7、向FeCl2溶液中滴入氯水的离子方程式____________________________________
8、请你验证某固体试剂是NaCl和Na2SO4的混合物。
限选实验试剂:稀H2SO4 ( http: / / www.21cnjy.com )、稀HNO3、稀HCl、Ba(NO3)2溶液、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、NaOH溶液。
实验仪器:中学化学实验室中常用的仪器
实验步骤 预期现象和结论
步骤1: 现象:结论:证明有Na+
步骤2:取少量固体于大试管中,加适量的蒸馏水完全溶解, 现象:证明:有SO42-
步骤3: 现象:结论:
答案:1、B 2、C 3、D 4、B 5、D 6、A
8、答案:
7、已知常温下氯酸钾与浓 ( http: / / www.21cnjy.com )盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是 ( )A
① ② ③ ④
A 黄绿色 橙色 蓝色 白色
B 无色 橙色 紫色 白色
C 黄绿色 橙色 蓝色 无色
D 黄绿色 无色 紫色 白色
9、若含4mol HCl的浓盐酸与足量 ( http: / / www.21cnjy.com )的MnO2混合加热,充分反应后生成氯气在标况下_____ (填“大于”、“等于”或“小于”)22.4L,其主要原因有①_____________________________________________________________________②_____________________________________________________________________
答案:MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑小于 ①反应中HCl消耗同时生成水,浓盐酸逐渐变为稀盐酸,稀盐酸不能与MnO2反应生成Cl2 ②加热中有部分HCl挥发而损失
10、实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华。下图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答: ( http: / / www.21cnjy.com )
(1)B中反应的离子方程式为
(2)D中的反应开始前,需排除装置中的 ( http: / / www.21cnjy.com )空气,应采取的方法是 __________________________________________________________________
(3)D中反应化学方程式为
(4)装置(Ⅰ)的主要缺点是 ( http: / / www.21cnjy.com )
(5)装置(Ⅱ)的主要缺点是
如果选用此装置来完成实验,则必须采取的改进措施是
答案:(1)MnO2+4H++2Cl- Mn2++ Cl 2↑+2H2O
(2)B中的反应进行一段时间后,看到黄绿色气体充满装置,再开始加热D
(3)3Cl2 +2Fe2FeCl3
(4)导管易被产品堵塞;尾气排入空气,易造成环境污染
(5)产品易潮解 在瓶E和F之间连接装有干燥剂的装置 (或在瓶E和F之间连接装有浓硫酸的洗气瓶)
第二节 富集在海水中的元素——氯
编写人:钟燕 审核人:林彩霞 领导签字:
【学习目标】:1,掌握氯气的物理性质和化学性质,会写氯气与金属、非金属反应的化学方程式。
2,了解氯气的实验室制法(包括试剂、反应原理、反应装置、收集方法)。
【学习重、难点】:氯气的化学性质。
【学习要求】:上课前请完成“一、预习自学”。
一、【预习自学】
(一)、Cl2的物理性质:请阅读课本P82“科学史话”,完成填空。
1、颜色:________色、刺激性气味、有毒的气体。(正确闻Cl2的方法:________________)
2、密度:比空气________ (ρ1/ρ2=M1/M2)
3、溶解度:________________。(课本P84第3行)
4、氯气熔点-1010°C,沸点-34.6°C,所以氯气是易液化的气体。
思考:氯水与液氯是同一种物质吗?
(二)、Cl2的实验室制法:
1、反应原理: MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
2、请指出上述反应的氧化剂、还原剂、氧化产物、还原产物,并用双线桥标出电子转移的情况和数目。
3、反应装置图:
( http: / / www.21cnjy.com )
Cl2用______________干燥 ( http: / / www.21cnjy.com ),收集方法:____________________。也可以用排饱和食盐水的方法收集。尾气处理的方法是 ___________________。
[资料卡片]:(1)反应物中的盐酸一定要用浓盐酸,盐酸一旦变稀,反应将不再进行。
(2)氧化剂MnO2也可用其他氧化剂代替,如KMnO4、KClO3等。
思考:集气瓶与洗气瓶的区别?
(三)、Cl2的化学性质:
1、请阅读课本P82完成:氯的原子结构示意 ( http: / / www.21cnjy.com )图为________________,易________电子,达到8个电子的稳定结构。故氯元素的非金属性很强,在化学反应中表现出很强的氧化性。氯在自然界中以________态存在,主要以________的形式存在于____________________中。
2、Cl2与金属的反应:(课前请先完成方程式,反应现象待课上解决,下同)
与Na反应方程式:_________________________________________;(注意注明反应条件)
现象:___________ _______________________
与Fe反应方程式:_________________________________________;(注意注明反应条件)
现象:___________ _______________________
与Cu反应方程式:_________________________________________;(注意注明反应条件)
现象:___________ _______________________
思考:为什么液氯可以保存在钢瓶中?
【小结】氯气的化学性质非常_______,具有很强的_________性,在一定的条件下几乎与所有的金属反应,且与Cu、Fe等变价金属反应时,均生成_______价金属氯化物。
3、Cl2与非金属的反应:
[实验4-3]:
操作 现象 化学方程式
在空气中点燃H2,然后把导管缓缓伸入盛满Cl2的集气瓶中。 (对比:H2在空气中燃烧的现象: )
H2、Cl2混合后光照。
小组讨论完成:(1)为什么H2在Cl2中能安静燃烧,而在混合后光照会爆炸?工业上生产盐酸又应该采取哪种反应条件呢?
(2)通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?是否所有燃烧都要有氧气参加?
(3)“点燃”和“燃烧”有何区别?
4、Cl2与还原性盐类的反应:
(1)Cl2、Br2、I2 ( http: / / www.21cnjy.com )都具有氧化性,其氧化性Cl2>Br2>I2,Cl2能把Br2从溴化物中置换出来,其余依次类推。请据此写出下列置换反应的化学方程式。
将Cl2分别通入KBr溶液和KI溶液中:
_____________________________________,_____________________________________
将溴水滴入KI溶液中:__________________________________
思考:为什么可以用湿润的淀粉KI试纸检验Cl2?
(2)将Cl2通入FeCl2溶液中:
方程式:_____________________________,现象:____________________________
(3)Cl2与Na2SO3溶液的反应:
请完成方程式(未配平):__Cl2+__Na2SO3+______=__Na2SO4+__HCl (除去废水中的氯)
(四)、氯离子(Cl-)的检验:
[实验4-6] 在下列溶液中各滴入几滴AgNO3溶液,观察现象。然后再分别加入少量稀HNO3,观察现象。
思考:检验Cl-时,为什么滴加AgNO3溶液后还要再加稀硝酸呢?
【资料卡片】:请阅读课本P86[科学视野]——成盐元素(卤素)
1、卤素:F、Cl、Br、I、At。最处电子层都是7个电子。是典型的非金属元素,具有氧化性。
2、单质的氧化性强弱:F2>Cl2>Br2>I2
3、应用:AgI——人工降雨,AgBr——感光材料, KIO3——加碘盐。
二、【课堂检测】
1、2005年3月19日,京泸高速 ( http: / / www.21cnjy.com )公路淮安段。一辆载有35吨的槽罐车与一辆货车相撞,发生液氯泄露事故,事故发生后采取的措施不正确的是:( )
A.群众向高处转移 B.用沾NaOH溶液的湿毛巾捂住口鼻
C.向液氯中喷洒NaOH溶液 D.用沾Na2CO3溶液的湿毛巾捂住口鼻
2、下列物质属于纯净物的是( )
A. 氯水 B. 盐酸 C. 液氯 D. 漂白粉
3、下列说法正确的是: ( )
A. 氯气以液态形式存在时可称作氯水或液氯
B. Cl2有毒,Cl-也有毒,Cl、Cl2和Cl-都是黄绿色
C. 0.1mol Fe与Cl2充分反应后,生成物的质量比Fe的质量增加了7.1g
D. 红热的铜丝在氯气中燃烧,生成棕黄色的固体CuCl2
4、下列氯化物中,不能用金属和氯气直接反应制得的是( )
A.CuCl2 B.FeCl2 C.MgCl2 D.KCl
5、检验氯化氢气体中是否混有Cl2 ( http: / / www.21cnjy.com ),可采用的方法是( )
A.用干燥的蓝色石蕊试纸 B.用干燥的有色布条
C.将气体通入硝酸银溶液. D.用湿润的淀粉碘化钾试纸
6、使体积相同的NaCl、MgCl2、AlC ( http: / / www.21cnjy.com )l3溶液中的Cl-完全转变为AgCl,若消耗AgNO3体积相同,则NaCl、MgCl2、AlCl3三种溶液物质的量浓度之比 ( )
A.6:3:2 B.3:2:1 C.1:2:3 D.1:1:1
7、向FeCl2溶液中滴入氯水的离子方程式____________________________________
8、请你验证某固体试剂是NaCl和Na2SO4的混合物。
限选实验试剂:稀H2SO4 ( http: / / www.21cnjy.com )、稀HNO3、稀HCl、Ba(NO3)2溶液、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、NaOH溶液。
实验仪器:中学化学实验室中常用的仪器
实验步骤 预期现象和结论
步骤1: 现象:结论:证明有Na+
步骤2:取少量固体于大试管中,加适量的蒸馏水完全溶解, 现象:证明:有SO42-
步骤3: 现象:结论:
答案:1、B 2、C 3、D 4、B 5、D 6、A
8、答案:
7、已知常温下氯酸钾与浓 ( http: / / www.21cnjy.com )盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是 ( )A
① ② ③ ④
A 黄绿色 橙色 蓝色 白色
B 无色 橙色 紫色 白色
C 黄绿色 橙色 蓝色 无色
D 黄绿色 无色 紫色 白色
9、若含4mol HCl的浓盐酸与足量 ( http: / / www.21cnjy.com )的MnO2混合加热,充分反应后生成氯气在标况下_____ (填“大于”、“等于”或“小于”)22.4L,其主要原因有①_____________________________________________________________________②_____________________________________________________________________
答案:MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑小于 ①反应中HCl消耗同时生成水,浓盐酸逐渐变为稀盐酸,稀盐酸不能与MnO2反应生成Cl2 ②加热中有部分HCl挥发而损失
10、实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华。下图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答: ( http: / / www.21cnjy.com )
(1)B中反应的离子方程式为
(2)D中的反应开始前,需排除装置中的 ( http: / / www.21cnjy.com )空气,应采取的方法是 __________________________________________________________________
(3)D中反应化学方程式为
(4)装置(Ⅰ)的主要缺点是 ( http: / / www.21cnjy.com )
(5)装置(Ⅱ)的主要缺点是
如果选用此装置来完成实验,则必须采取的改进措施是
答案:(1)MnO2+4H++2Cl- Mn2++ Cl 2↑+2H2O
(2)B中的反应进行一段时间后,看到黄绿色气体充满装置,再开始加热D
(3)3Cl2 +2Fe2FeCl3
(4)导管易被产品堵塞;尾气排入空气,易造成环境污染
(5)产品易潮解 在瓶E和F之间连接装有干燥剂的装置 (或在瓶E和F之间连接装有浓硫酸的洗气瓶)
