人教版高中化学必修二 1.2 元素周期律 课件 (共15张PPT)
文档属性
| 名称 | 人教版高中化学必修二 1.2 元素周期律 课件 (共15张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 715.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-08 22:33:37 | ||
图片预览



文档简介
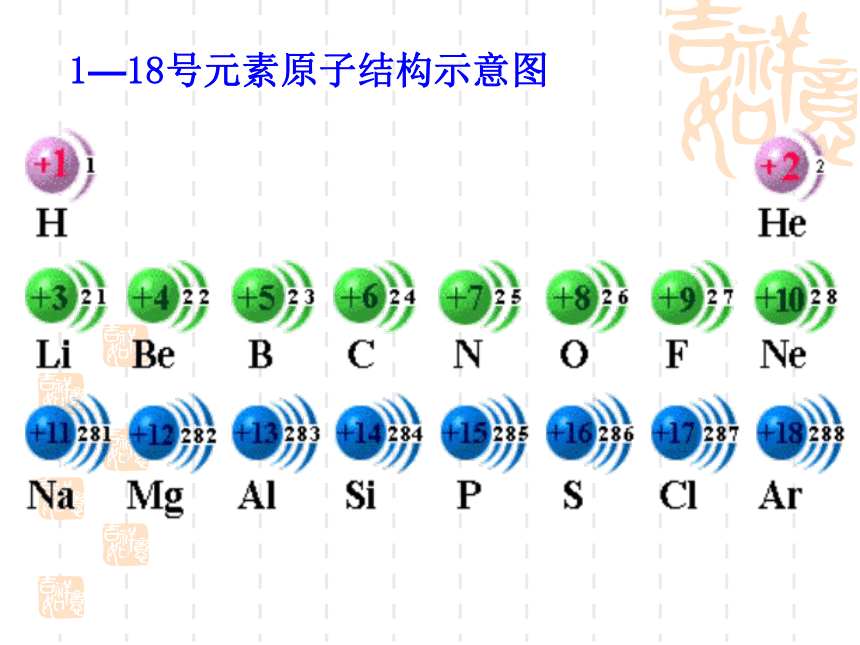
课件15张PPT。第二节 元素周期律第一课时 原子核外电子排布2018年11月19日星期一复习:1.元素周期表的结构3.请画出1—18号元素原子结构示意图
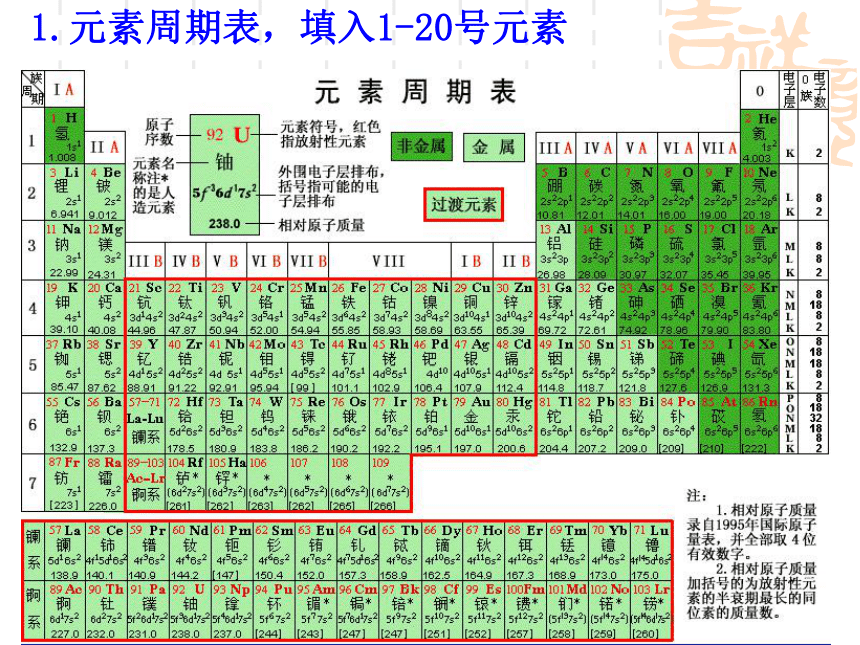
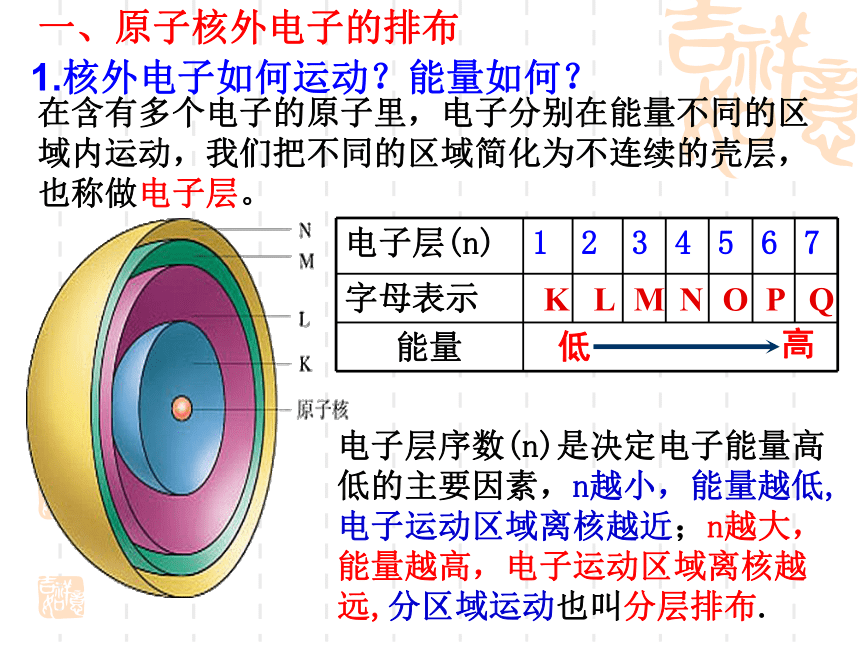
2.请画出元素周期表,只填入1-20号元素的原子序数及元素符号1.元素周期表,填入1-20号元素 1—18号元素原子结构示意图在含有多个电子的原子里,电子分别在能量不同的区域内运动,我们把不同的区域简化为不连续的壳层,也称做电子层。KL
MNOPQ电子层序数(n)是决定电子能量高低的主要因素,n越小,能量越低,电子运动区域离核越近;n越大,能量越高,电子运动区域离核越远,分区域运动也叫分层排布.一、原子核外电子的排布1.核外电子如何运动?能量如何?倒数第三层电子不能超过 个。次外层电子不能超过 个,3.最外层电子不能超过 个
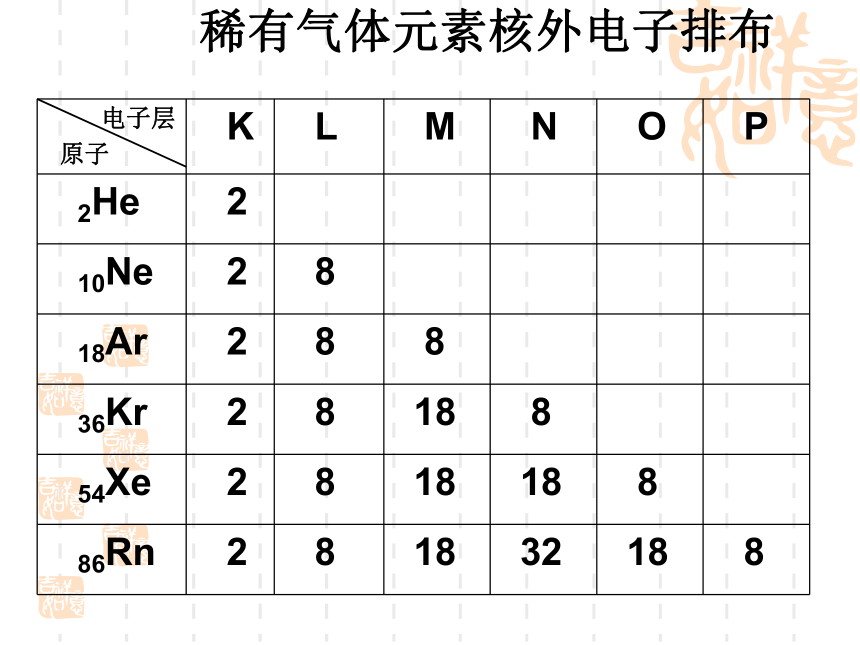
(K层是最外层时不超过 个), 2.每层电子最多不能超过 个;1.核外电子总是尽先排布在 的电子层里,排满一层后再排下一层;(能量最低原理)能量最低2n2818322 以上各项是相互联系的,不能孤立地理解。2. 核外电子排布规律:稀有气体元素核外电子排布
3、原子结构与元素性质的关系 (1)我们把最外层8个电子(只有K层时为2个电子)的结构,称为稳定结构。一般不与其他物质发学生化学反应。当元素原子的最外层电子数小于8(K层小于2)时,是不稳定结构。
(2)金属性与非金属性(一般规律):深度探究:1. 113号元素原子核外有几个电子层?最外层电子数?此元素在周期表中何位置?属于金属元素还是非金属元素?(2 8 18 32 32 18 3)2 8 18 32 50 32 18 8(50种)(7、3;第七周期,第ⅢA族;金属)2. 如果将来填满第八周期,此周期将有多少种元素?3. 若aAn+与bB2-两种离子的核外电子层结构相同,则a的数值为( )?
A、b+n+2 B、b+n-2
C、b-n-2 D、b-n+2 巩固练习: 1.判断下列示意图是否正确?为什么?2.画出下列微粒的结构示意图。
19K 35Br 53I Mg2+ Ca2+A4.元素推断: 1-18号元素中:(1)最外层电子数是电子层数2倍的元素是:
(2)内层电子数是最外层电子数2倍的元素是:
(3)某元素的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图为:He、C、SLi、P今有 结构示意图,试指出x的可能数值及相应微粒符号,并画出该微粒的结构示意图。思考与交流:还有哪些微粒有10电子?710111213F-NeNa+Mg2+Al3+二核: HF、OH-
三核: H2O
四核: NH3、H3O+
五核: CH4、NH4+ 89O2-N3-5.10电子和18电子微粒(1)10电子微粒(2)18电子微粒思考与交流:还有哪些微粒有18个电子?单核:P3-、S2-、Cl-、Ar、K+、Ca2+等
二核: HCl、F2、HS-
三核: H2S
多核: PH3、H2O2、SiH4、CH3F、CH3OH、N2H4、CH3NH2、C2H6等 6.今有甲、乙、丙、丁四种元素。已知:甲元素是自然界中含量最多的元素;乙元素为金属元素,它的原子核外K层、L层电子数之和等于M、N层电子数之和;丙元素的单质及其化合物的焰色反应都显黄色;氢气在丁元素单质中燃烧火焰呈苍白色。
(1)试推断并写出甲、乙、丙、丁四种元素的名
称和符号;
(2)写出上述元素两两化合成的化合物的化学式。氧O 钙Ca 钠Na 氯ClCaO 、Na2O 、Na2O2 、ClO2 、CaCl2 、NaCl 本节课我们重点学习了:
1.原子核外电子的排布规律,
2.画原子离子结构示意图,
3.据核外电子排布规律进行元素推断。回顾反思: 本节课你学会了什么?
2.请画出元素周期表,只填入1-20号元素的原子序数及元素符号1.元素周期表,填入1-20号元素 1—18号元素原子结构示意图在含有多个电子的原子里,电子分别在能量不同的区域内运动,我们把不同的区域简化为不连续的壳层,也称做电子层。KL
MNOPQ电子层序数(n)是决定电子能量高低的主要因素,n越小,能量越低,电子运动区域离核越近;n越大,能量越高,电子运动区域离核越远,分区域运动也叫分层排布.一、原子核外电子的排布1.核外电子如何运动?能量如何?倒数第三层电子不能超过 个。次外层电子不能超过 个,3.最外层电子不能超过 个
(K层是最外层时不超过 个), 2.每层电子最多不能超过 个;1.核外电子总是尽先排布在 的电子层里,排满一层后再排下一层;(能量最低原理)能量最低2n2818322 以上各项是相互联系的,不能孤立地理解。2. 核外电子排布规律:稀有气体元素核外电子排布
3、原子结构与元素性质的关系 (1)我们把最外层8个电子(只有K层时为2个电子)的结构,称为稳定结构。一般不与其他物质发学生化学反应。当元素原子的最外层电子数小于8(K层小于2)时,是不稳定结构。
(2)金属性与非金属性(一般规律):深度探究:1. 113号元素原子核外有几个电子层?最外层电子数?此元素在周期表中何位置?属于金属元素还是非金属元素?(2 8 18 32 32 18 3)2 8 18 32 50 32 18 8(50种)(7、3;第七周期,第ⅢA族;金属)2. 如果将来填满第八周期,此周期将有多少种元素?3. 若aAn+与bB2-两种离子的核外电子层结构相同,则a的数值为( )?
A、b+n+2 B、b+n-2
C、b-n-2 D、b-n+2 巩固练习: 1.判断下列示意图是否正确?为什么?2.画出下列微粒的结构示意图。
19K 35Br 53I Mg2+ Ca2+A4.元素推断: 1-18号元素中:(1)最外层电子数是电子层数2倍的元素是:
(2)内层电子数是最外层电子数2倍的元素是:
(3)某元素的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图为:He、C、SLi、P今有 结构示意图,试指出x的可能数值及相应微粒符号,并画出该微粒的结构示意图。思考与交流:还有哪些微粒有10电子?710111213F-NeNa+Mg2+Al3+二核: HF、OH-
三核: H2O
四核: NH3、H3O+
五核: CH4、NH4+ 89O2-N3-5.10电子和18电子微粒(1)10电子微粒(2)18电子微粒思考与交流:还有哪些微粒有18个电子?单核:P3-、S2-、Cl-、Ar、K+、Ca2+等
二核: HCl、F2、HS-
三核: H2S
多核: PH3、H2O2、SiH4、CH3F、CH3OH、N2H4、CH3NH2、C2H6等 6.今有甲、乙、丙、丁四种元素。已知:甲元素是自然界中含量最多的元素;乙元素为金属元素,它的原子核外K层、L层电子数之和等于M、N层电子数之和;丙元素的单质及其化合物的焰色反应都显黄色;氢气在丁元素单质中燃烧火焰呈苍白色。
(1)试推断并写出甲、乙、丙、丁四种元素的名
称和符号;
(2)写出上述元素两两化合成的化合物的化学式。氧O 钙Ca 钠Na 氯ClCaO 、Na2O 、Na2O2 、ClO2 、CaCl2 、NaCl 本节课我们重点学习了:
1.原子核外电子的排布规律,
2.画原子离子结构示意图,
3.据核外电子排布规律进行元素推断。回顾反思: 本节课你学会了什么?
