人教版高中化学必修二 2.1化学能与热能(导学案,含答案)
文档属性
| 名称 | 人教版高中化学必修二 2.1化学能与热能(导学案,含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 64.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-08 22:38:24 | ||
图片预览

文档简介
第一节 化学能与热能
【学习目标】:1、了解化学能与热能的相互转化,掌握吸热反应和放热反应的概念。
2、通过实验学会定性和定量地探究化学反应中热量变化的科学方法。
【学习重、难点】:通过实验,掌握吸热反应和放热反应的概念。
【预习自学】
一、化学键与化学反应中能量变化的关系
1.化学反应的实质
化学反应的实质是原子(或原子团)的重新组合,,即反应物中旧化学键的 断裂 和生成物中新化学键的 生成 。
2.化学反应中能量变化的原因(微观角度)
(1)断开反应物中的化学键要 吸收 能量,形成生成物中的新化学键要 放出 能量。
(2)物质在化学反应中发生能量变化的主要原因是 。
3.化学反应中能量变化的决定因素
(1)化学反应中能量变化的决定因素(用E表示物质能量)
E(反应物)>E(生成物) _____放出__能量
E(反应物)<E(生成物) ______吸收__能量
【练一练1】 下列变化过程中,需吸收能量的是( B )
A.O+OO2 B.H2H+H C.H+ClHCl D.C+O2CO2
二、化学能与热能的相互转化
1.两条基本的自然定律(两个守恒):
(1)质量定律:自然界的物质可以发生转化,但是 总质量 保持不变。
(2)能量定律:一种形式的能量可以转化为另一种形式的能量,转化的途径和能量的形式可以不同,但是 总能量是不变。
2.吸热反应和放热反应
(1)定义:吸热反应: E(反应物)<E(生成物) 的化学反应;放热反应: E(反应物)>E(生成物) 的化学反应。
三、人类利用能源的三个阶段
1.柴草时期:该时期从火的发现至18世纪产业革命,以树枝杂草为主要能源。
2.化石能源时期:从18世纪中期到现代,以煤、 、天然气为主要能源。
3.多能源结构时期:以可再生能源和清洁能源(绿色能源)为主要能源,主要包括 、 、 、生物质地壳地表能等。
【练一练2】 下列燃料中不属于化石燃料的是( D )
A.煤 B.石油 C.天然气 D.水煤气
【课堂探究】
探究点一:化学键与化学反应中能量变化的关系
【讨论交流1】化学反应中为什么会有能量变化?从化学键角度分析化学反应的本质是什么?
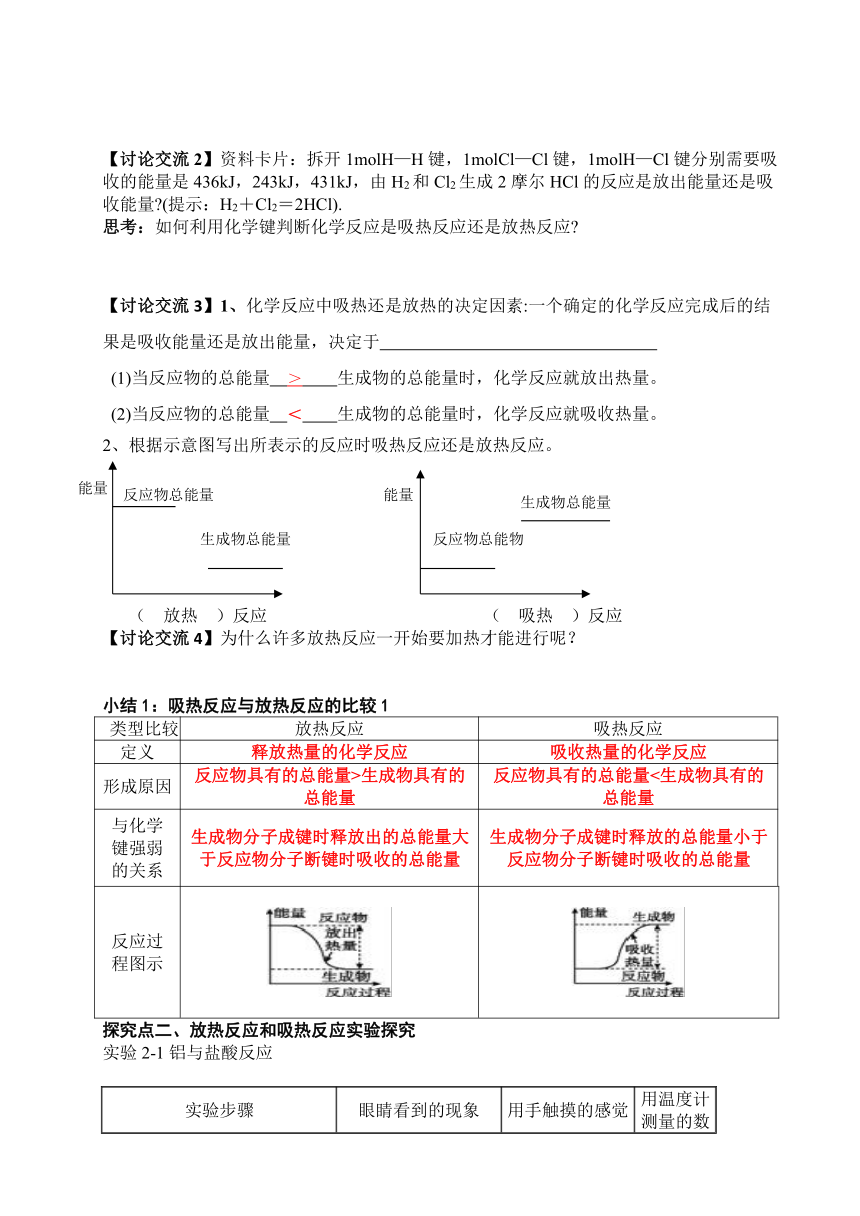
【讨论交流2】资料卡片:拆开1molH—H键,1molCl—Cl键,1molH—Cl键分别需要吸收的能量是436kJ,243kJ,431kJ,由H2和Cl2生成2摩尔HCl的反应是放出能量还是吸收能量?(提示:H2+Cl2=2HCl).
思考:如何利用化学键判断化学反应是吸热反应还是放热反应?
【讨论交流3】1、化学反应中吸热还是放热的决定因素:一个确定的化学反应完成后的结果是吸收能量还是放出能量,决定于
(1)当反应物的总能量 > 生成物的总能量时,化学反应就放出热量。
(2)当反应物的总能量 < 生成物的总能量时,化学反应就吸收热量。
2、根据示意图写出所表示的反应时吸热反应还是放热反应。
( 放热 )反应 ( 吸热 )反应
【讨论交流4】为什么许多放热反应一开始要加热才能进行呢?
小结1:吸热反应与放热反应的比较1
类型比较
放热反应
吸热反应
定义
释放热量的化学反应
吸收热量的化学反应
形成原因
反应物具有的总能量>生成物具有的总能量
反应物具有的总能量<生成物具有的总能量
与化学
键强弱
的关系
生成物分子成键时释放出的总能量大于反应物分子断键时吸收的总能量
生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量
反应过
程图示
探究点二、放热反应和吸热反应实验探究
实验2-1铝与盐酸反应
实验步骤
眼睛看到的现象
用手触摸的感觉
用温度计测量的数据变化
在一支试管中加入2~3mL 2mol/L的盐酸溶液
有大量的无色气泡放出
冷
示数上升
向含有盐酸溶液的试管中插入铝条
发热
结 论
Al与盐酸的反应在生成新物质的同时还有热量放出
结论:1.大多数置换反应是 ???反应;2.?? ? 能转化为? ? 释放出来。
实验2-2 氢氧化钡晶体与氯化铵晶体的反应
实验步骤
实验现象
得出结论
在烧杯将晶体混合后立即用玻璃棒快速搅拌混合物
有刺激性气味的气体产生;混合物成糊状
有NH3和水
生成 ;
反应吸热 。
用手触摸烧杯下部
烧杯变凉
用手拿起烧杯
玻璃片粘到了烧杯底部
实验2-3酸碱中和反应
实验步骤
数据
结论
反应离子方程式
20ml 2mol/L 盐酸的温度
盐酸与氢氧化钠的反应要放出热量
H+ + OH- = H2O
20ml 2mol/L NaOH溶液的温度
混合后温度
小结2:吸热反应与放热反应的比较2
类型比较
放热反应
吸热反应
常见反应
(1)大多数化合反应;
(2)所有的燃烧反应;
(3)酸碱中和反应
(4)金属与水、酸反应;
(1)大多数分解反应;
(2)Ba(OH)2·8H2O与NH4Cl反应;
(3)C和CO2、C和H2O(g)反应
【课堂检测】
1、一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( B )
A.浓硫酸与水 B.生石灰与水 C.熟石灰与水 D.氯化钠与水
2、下列反应既属于氧化还原反应,又属于吸热反应的是( C )
A.铝片与稀盐酸的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与CO2的反应 D.甲烷在氧气中的燃烧
3、如图表示吸热反应的图像是( C )
4、下列说法中正确的是( C )
A.需要加热方能发生的反应一定是吸热反应 B.放热的反应在常温下一定很容易发生
C.是放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定
D.吸热反应发生过程中要不断从外界获得能量,放热反应自始至终不需要外界能量
5、如图所示,把试管小心地放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入适量的镁片,再用滴管滴加适量6.0mol/L稀盐酸于试管中,试回答下列问题:
(1)实验中观察到的现象是试管中镁片和稀盐酸剧烈反应,产生大量的气体;烧杯中有固体析出
(2)产生上述现象的原因是镁属于活泼的金属易与盐酸反应产生氢气,镁与盐酸反应属于放热反应,而氢氧化钙的溶解度随温度的升高而降低,所以有固体析出
(3)试管中发生反应的化学方程式为: Mg+2HCl=MgCl2+H2↑(由实验推知,氯化镁溶液和氢气的总能量 小于 (填“大于”、“小于”或“等于”)稀盐酸和镁片的总能量,所以该反应是 放热 反应(填“放热”或“吸热”).
【课后反思与评价】
【学习目标】:1、了解化学能与热能的相互转化,掌握吸热反应和放热反应的概念。
2、通过实验学会定性和定量地探究化学反应中热量变化的科学方法。
【学习重、难点】:通过实验,掌握吸热反应和放热反应的概念。
【预习自学】
一、化学键与化学反应中能量变化的关系
1.化学反应的实质
化学反应的实质是原子(或原子团)的重新组合,,即反应物中旧化学键的 断裂 和生成物中新化学键的 生成 。
2.化学反应中能量变化的原因(微观角度)
(1)断开反应物中的化学键要 吸收 能量,形成生成物中的新化学键要 放出 能量。
(2)物质在化学反应中发生能量变化的主要原因是 。
3.化学反应中能量变化的决定因素
(1)化学反应中能量变化的决定因素(用E表示物质能量)
E(反应物)>E(生成物) _____放出__能量
E(反应物)<E(生成物) ______吸收__能量
【练一练1】 下列变化过程中,需吸收能量的是( B )
A.O+OO2 B.H2H+H C.H+ClHCl D.C+O2CO2
二、化学能与热能的相互转化
1.两条基本的自然定律(两个守恒):
(1)质量定律:自然界的物质可以发生转化,但是 总质量 保持不变。
(2)能量定律:一种形式的能量可以转化为另一种形式的能量,转化的途径和能量的形式可以不同,但是 总能量是不变。
2.吸热反应和放热反应
(1)定义:吸热反应: E(反应物)<E(生成物) 的化学反应;放热反应: E(反应物)>E(生成物) 的化学反应。
三、人类利用能源的三个阶段
1.柴草时期:该时期从火的发现至18世纪产业革命,以树枝杂草为主要能源。
2.化石能源时期:从18世纪中期到现代,以煤、 、天然气为主要能源。
3.多能源结构时期:以可再生能源和清洁能源(绿色能源)为主要能源,主要包括 、 、 、生物质地壳地表能等。
【练一练2】 下列燃料中不属于化石燃料的是( D )
A.煤 B.石油 C.天然气 D.水煤气
【课堂探究】
探究点一:化学键与化学反应中能量变化的关系
【讨论交流1】化学反应中为什么会有能量变化?从化学键角度分析化学反应的本质是什么?
【讨论交流2】资料卡片:拆开1molH—H键,1molCl—Cl键,1molH—Cl键分别需要吸收的能量是436kJ,243kJ,431kJ,由H2和Cl2生成2摩尔HCl的反应是放出能量还是吸收能量?(提示:H2+Cl2=2HCl).
思考:如何利用化学键判断化学反应是吸热反应还是放热反应?
【讨论交流3】1、化学反应中吸热还是放热的决定因素:一个确定的化学反应完成后的结果是吸收能量还是放出能量,决定于
(1)当反应物的总能量 > 生成物的总能量时,化学反应就放出热量。
(2)当反应物的总能量 < 生成物的总能量时,化学反应就吸收热量。
2、根据示意图写出所表示的反应时吸热反应还是放热反应。
( 放热 )反应 ( 吸热 )反应
【讨论交流4】为什么许多放热反应一开始要加热才能进行呢?
小结1:吸热反应与放热反应的比较1
类型比较
放热反应
吸热反应
定义
释放热量的化学反应
吸收热量的化学反应
形成原因
反应物具有的总能量>生成物具有的总能量
反应物具有的总能量<生成物具有的总能量
与化学
键强弱
的关系
生成物分子成键时释放出的总能量大于反应物分子断键时吸收的总能量
生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量
反应过
程图示
探究点二、放热反应和吸热反应实验探究
实验2-1铝与盐酸反应
实验步骤
眼睛看到的现象
用手触摸的感觉
用温度计测量的数据变化
在一支试管中加入2~3mL 2mol/L的盐酸溶液
有大量的无色气泡放出
冷
示数上升
向含有盐酸溶液的试管中插入铝条
发热
结 论
Al与盐酸的反应在生成新物质的同时还有热量放出
结论:1.大多数置换反应是 ???反应;2.?? ? 能转化为? ? 释放出来。
实验2-2 氢氧化钡晶体与氯化铵晶体的反应
实验步骤
实验现象
得出结论
在烧杯将晶体混合后立即用玻璃棒快速搅拌混合物
有刺激性气味的气体产生;混合物成糊状
有NH3和水
生成 ;
反应吸热 。
用手触摸烧杯下部
烧杯变凉
用手拿起烧杯
玻璃片粘到了烧杯底部
实验2-3酸碱中和反应
实验步骤
数据
结论
反应离子方程式
20ml 2mol/L 盐酸的温度
盐酸与氢氧化钠的反应要放出热量
H+ + OH- = H2O
20ml 2mol/L NaOH溶液的温度
混合后温度
小结2:吸热反应与放热反应的比较2
类型比较
放热反应
吸热反应
常见反应
(1)大多数化合反应;
(2)所有的燃烧反应;
(3)酸碱中和反应
(4)金属与水、酸反应;
(1)大多数分解反应;
(2)Ba(OH)2·8H2O与NH4Cl反应;
(3)C和CO2、C和H2O(g)反应
【课堂检测】
1、一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( B )
A.浓硫酸与水 B.生石灰与水 C.熟石灰与水 D.氯化钠与水
2、下列反应既属于氧化还原反应,又属于吸热反应的是( C )
A.铝片与稀盐酸的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与CO2的反应 D.甲烷在氧气中的燃烧
3、如图表示吸热反应的图像是( C )
4、下列说法中正确的是( C )
A.需要加热方能发生的反应一定是吸热反应 B.放热的反应在常温下一定很容易发生
C.是放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定
D.吸热反应发生过程中要不断从外界获得能量,放热反应自始至终不需要外界能量
5、如图所示,把试管小心地放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入适量的镁片,再用滴管滴加适量6.0mol/L稀盐酸于试管中,试回答下列问题:
(1)实验中观察到的现象是试管中镁片和稀盐酸剧烈反应,产生大量的气体;烧杯中有固体析出
(2)产生上述现象的原因是镁属于活泼的金属易与盐酸反应产生氢气,镁与盐酸反应属于放热反应,而氢氧化钙的溶解度随温度的升高而降低,所以有固体析出
(3)试管中发生反应的化学方程式为: Mg+2HCl=MgCl2+H2↑(由实验推知,氯化镁溶液和氢气的总能量 小于 (填“大于”、“小于”或“等于”)稀盐酸和镁片的总能量,所以该反应是 放热 反应(填“放热”或“吸热”).
【课后反思与评价】
