2025年湖南省郴州市中考二模化学试题(含答案)
文档属性
| 名称 | 2025年湖南省郴州市中考二模化学试题(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 609.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-16 00:00:00 | ||
图片预览



文档简介
2025年湖南省郴州市中考二模化学试题
学校:___________姓名:___________班级:___________考号:___________
一、选择题
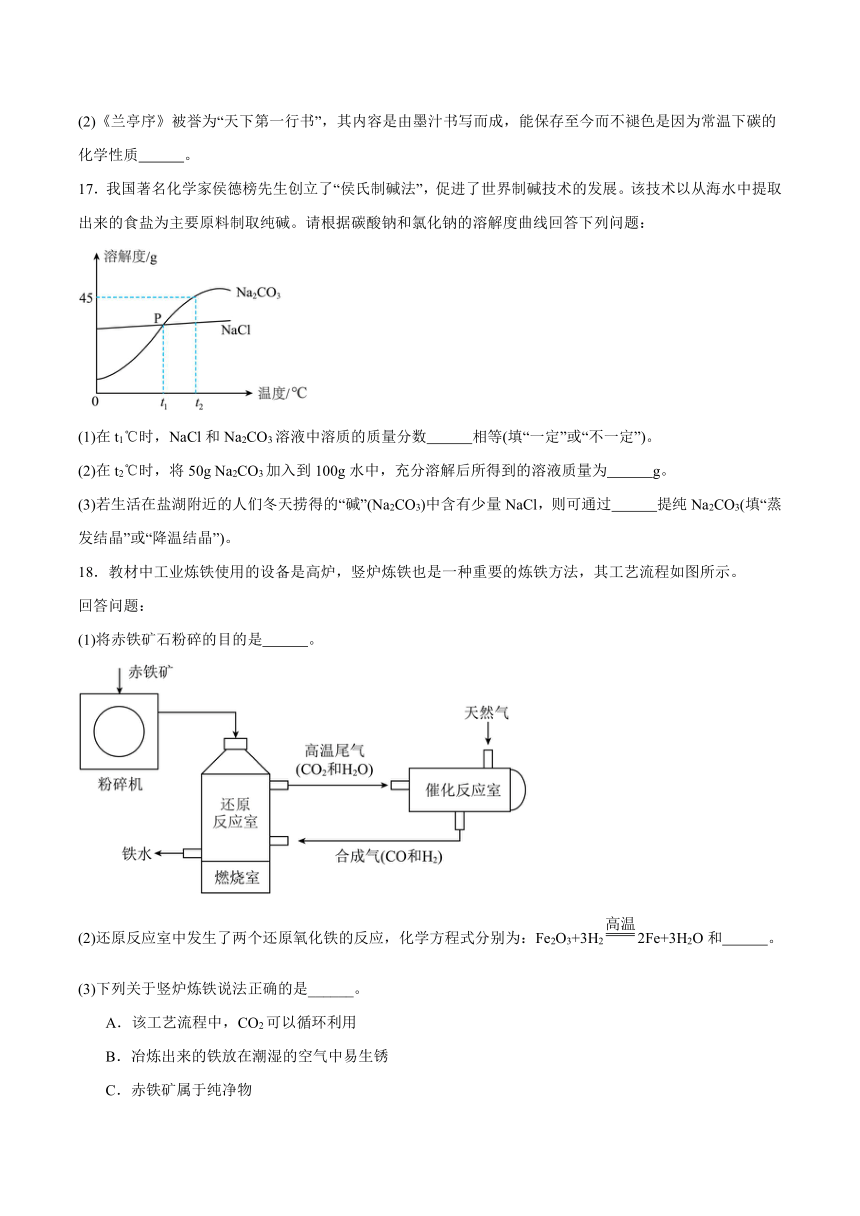
1.“五育并举,劳育先行”。下列劳动项目中涉及化学变化的是
A.打扫房间 B.整理书桌 C.生火做饭 D.晾晒衣物
2.体育是五育的基础,同学们在运动后喝的矿泉水可为其身体补充“钠”、“镁”等,矿泉水中的“钠”、“镁”指的是
A.元素 B.原子 C.单质 D.分子
3.五彩斑斓的颜色变化体现了化学实验之美,以下描述正确的是
A.溶液颜色:FeCl2溶液——黄色
B.沉淀颜色:氢氧化铜——蓝色
C.火焰颜色:硫在氧气中燃烧——淡蓝色
D.固体颜色:四氧化三铁——红色
4.具备规范的实验技能是进行科学探究的基础。下列实验操作正确的是
A.稀释浓硫酸 B.过滤
C.验满氧气 D.测定pH
5.2025年“中国水周”活动的主题为“推动水利高质量发展,保障我国水安全”。下列不利于环境保护的是
A.使用绿色公共交通出行 B.合理使用农药和化肥
C.工业废水直接浇灌农田 D.不使用含磷洗衣粉
6.根据国际权威机构的最新认证,我国企业自主研发的晶硅-钙钛矿叠层电池效率达到33.9%,成为目前全球叠层太阳能电池效率的最高纪录。硅在元素周期表中的信息如图所示,下列说法错误的是
A.硅原子的核内质子数为14 B.X可表示为Si
C.硅属于非金属元素 D.硅的相对原子质量是28.08g
7.新能源汽车机身不仅外表流畅美观,本身安全性能也强,彰显中国制造的魅力。下列生产原料中不属于金属材料的是
A.高强度钢 B.铝合金 C.塑料 D.铜导线
8.与新能源汽车相比,传统油车需要安装“三元催化器”来处理汽车尾气,其中某个反应的微观示意图如图所示。下列说法错误的是
A.该图能反映反应前后原子的种类不变
B.催化剂在反应前后,质量和化学性质都不变
C.该反应有利于保护环境
D.该反应属于置换反应
9.晋代葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银”,丹砂指的是HgS。其中汞元素的化合价为+2价,则硫元素的化合价为
A.-2 B.+2 C.+4 D.+6
10.姜黄为药食两用材料,有着极高的药用价值,从姜黄中提取的姜黄素(化学式为C21H20O6)具有抗炎、抗氧化等作用。下列关于姜黄素的说法正确的是
A.姜黄素属于氧化物
B.姜黄素中氧元素的质量分数最小
C.姜黄素由47个原子构成
D.姜黄素由碳、氢、氧三种元素组成
11.化学让我们的生活更加美好。请你从化学的视角判断,下列说法正确的是
A.发霉的大米洗干净再食用
B.利用氩氦刀可低温冷冻微创治疗肿瘤
C.为防止甲状腺肿大,食用大量的含碘食物
D.将塑料垃圾就地焚烧
12.化学学科核心素养展现了化学课程对学生发展的重要价值。下列说法正确的是
A.科学态度与责任:将生活垃圾分类投放,可实现资源的回收再利用
B.科学思维:活泼金属能与稀盐酸反应产生气泡,所以与稀盐酸反应产生气泡的物质一定是活泼金属
C.科学探究与实践:将一根洁净的金属丝浸入硫酸铝溶液中,无明显现象,则说明该金属的活动性比铝强
D.化学观念:生成盐和水的反应叫做中和反应
13.食醋中含有醋酸,食醋除作调味剂外,生活中还有些妙用,下列使用食醋肯定不能达到目的的是( )
A.除去菜刀上的铁锈 B.除去水壶壁上的水垢
C.清洗溅到皮肤上的碱液 D.鉴别黄金饰品中是否含有铜
14.“物质的性质与应用”是学习义务教育化学课程的主题之一,下列说法正确的是
A.浓盐酸常用作气体干燥剂 B.烧碱可用于治疗胃酸过多
C.活性炭具有吸附性 D.空气中的氮气不能用做保护气
15.诗人陆游的笔记中记载“书灯勿用铜盏,惟瓷盏最省油,蜀中有夹瓷盏……可省油之半”“一端作小窍(孔),注清冷水于其中,每夕一易(更换)之”。夹瓷盏被称为省油灯,其结构如图所示,用棉绳做炷(灯芯),上层盏盛油,下层盏盛水。下列说法中不正确的是
A.剪掉灯芯熄灭油灯,其灭火原理是清除可燃物
B.使用时水会不断减少,是因为水分子受热分解
C.下层水吸热,减少了上层油的蒸发,从而达到省油的目的
D.“书灯勿用铜盏”的原因是铜有良好的导热性,会加速油的蒸发
二、填空与简答
16.品味古籍中的传统文化,厚植爱国主义情怀。
(1)《十五从军征》中的“舂谷持作饭,采葵持作羹”,生动展现了老兵归家后做饭的场景,其中米饭富含六类营养物质中的 。
(2)《兰亭序》被誉为“天下第一行书”,其内容是由墨汁书写而成,能保存至今而不褪色是因为常温下碳的化学性质 。
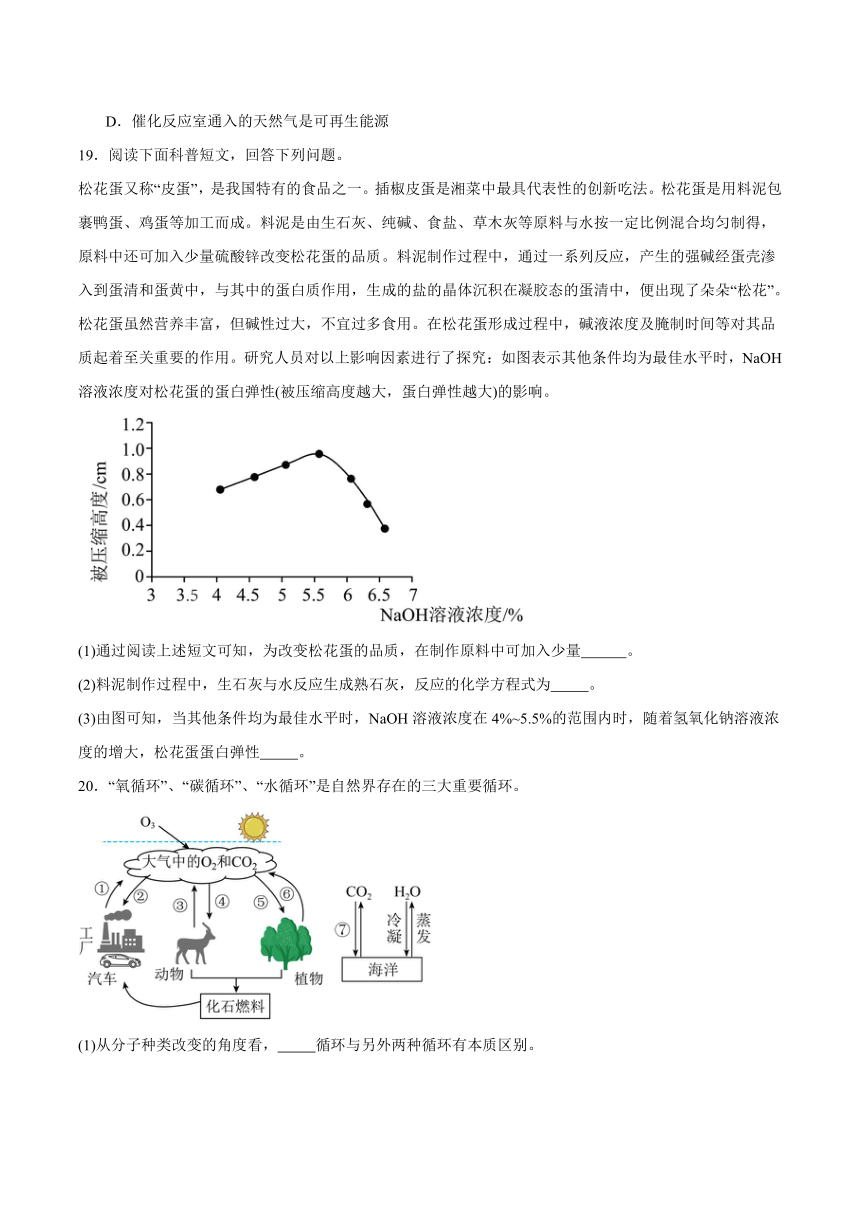
17.我国著名化学家侯德榜先生创立了“侯氏制碱法”,促进了世界制碱技术的发展。该技术以从海水中提取出来的食盐为主要原料制取纯碱。请根据碳酸钠和氯化钠的溶解度曲线回答下列问题:
(1)在t1℃时,NaCl和Na2CO3溶液中溶质的质量分数 相等(填“一定”或“不一定”)。
(2)在t2℃时,将50g Na2CO3加入到100g水中,充分溶解后所得到的溶液质量为 g。
(3)若生活在盐湖附近的人们冬天捞得的“碱”(Na2CO3)中含有少量NaCl,则可通过 提纯Na2CO3(填“蒸发结晶”或“降温结晶”)。
18.教材中工业炼铁使用的设备是高炉,竖炉炼铁也是一种重要的炼铁方法,其工艺流程如图所示。
回答问题:
(1)将赤铁矿石粉碎的目的是 。
(2)还原反应室中发生了两个还原氧化铁的反应,化学方程式分别为:Fe2O3+3H22Fe+3H2O和 。
(3)下列关于竖炉炼铁说法正确的是______。
A.该工艺流程中,CO2可以循环利用
B.冶炼出来的铁放在潮湿的空气中易生锈
C.赤铁矿属于纯净物
D.催化反应室通入的天然气是可再生能源
19.阅读下面科普短文,回答下列问题。
松花蛋又称“皮蛋”,是我国特有的食品之一。插椒皮蛋是湘菜中最具代表性的创新吃法。松花蛋是用料泥包裹鸭蛋、鸡蛋等加工而成。料泥是由生石灰、纯碱、食盐、草木灰等原料与水按一定比例混合均匀制得,原料中还可加入少量硫酸锌改变松花蛋的品质。料泥制作过程中,通过一系列反应,产生的强碱经蛋壳渗入到蛋清和蛋黄中,与其中的蛋白质作用,生成的盐的晶体沉积在凝胶态的蛋清中,便出现了朵朵“松花”。
松花蛋虽然营养丰富,但碱性过大,不宜过多食用。在松花蛋形成过程中,碱液浓度及腌制时间等对其品质起着至关重要的作用。研究人员对以上影响因素进行了探究:如图表示其他条件均为最佳水平时,NaOH溶液浓度对松花蛋的蛋白弹性(被压缩高度越大,蛋白弹性越大)的影响。
(1)通过阅读上述短文可知,为改变松花蛋的品质,在制作原料中可加入少量 。
(2)料泥制作过程中,生石灰与水反应生成熟石灰,反应的化学方程式为 。
(3)由图可知,当其他条件均为最佳水平时,NaOH溶液浓度在4%~5.5%的范围内时,随着氢氧化钠溶液浓度的增大,松花蛋蛋白弹性 。
20.“氧循环”、“碳循环”、“水循环”是自然界存在的三大重要循环。
(1)从分子种类改变的角度看, 循环与另外两种循环有本质区别。
(2)过程⑤为绿色植物的光合作用,其化学方程式为6X+6H2OC6H12O6+6O2,则X的化学式为 。
(3)下列关于碳、氧循环的相关认识,错误的是______(填序号)。
A.空气中二氧化碳含量过多会导致温室效应
B.碳、氧循环过程中各元素守恒,碳、氧元素质量和化合价均不变
C.碳循环是自然界物质和能量循环的重要组成部分
D.将从排放源捕集的二氧化碳注入海底,是一项二氧化碳封存技术
(4)作为一名中学生,请你基于碳中和理念设计一条切实可行的低碳行动方案: 。
三、实验题
21.小张同学在老师的指导下进行了相关实验,如表是部分实验记录,请你完善表格。
实验记录:氧气、二氧化碳的实验室制取与性质验证
【实验目的】 练习实验室制取氧气和二氧化碳并进行相关实验
【实验原理】 制取氧气∶2KMnO4K2MnO4+MnO2+O2↑、 (用化学方程式表示) 制取二氧化碳:CaCO3+2HCl=CaCl2+CO2↑+H2O
【实验装置】
【实验过程】 (1)实验室用高锰酸钾制取并收集较纯净的O2,应选择的装置组合是 (填字母序号);当看到气泡 时才开始收集氧气。 (2)该同学将湿润的紫色石蕊纸花放入收集好的二氧化碳集气瓶中,发现纸花变为 色。
四、科学探究题
22.某校聚焦“确保国家粮食安全,确保不发生规模性返贫”主题,组织学校兴趣小组的同学对“试验田”中农作物优产增收方案开展了如下项目式学习活动,以下是活动中的部分任务。
任务一:选择优质种子
(1)农业上常用16%的氯化钠溶液来选择成熟饱满的种子,现需配制50g16%的氯化钠溶液,需要称量氯化钠的质量为 g。
任务二:选择适宜种植的农作物
【信息检索】如表为该地几种经济作物种植时所需土壤的pH范围。
农作物 茶树 棉花 苹果树 葱 海水稻
pH 4.5-6.0 6.0-7.5 5.5-7.0 6.0-7.5 7.5-9.0
【小组交流】
(2)小组同学配制试验田土壤样品的浸出液,并测得土壤pH约为8,最适宜种植的一种农作物是 。
任务三:寻找改变溶液酸碱性的方法
(3)取一定量的稀盐酸和氢氧化钠溶液进行实验,用传感器实时获得溶液的pH、温度曲线,如图1、图2所示。
①图1中烧杯中的试剂为 (填名称)。
②图2中t2时烧杯中溶液的溶质成分为 (填化学式)。
任务四:探究引起土壤盐碱化的物质
【信息检索】
a.该土壤盐碱化可能由Na2CO3、Na2SO4中的一种或两种引起
b.BaCO3为白色固体,难溶于水;BaSO4为白色固体,难溶于水和盐酸
【作出猜想】
(4)猜想1:Na2CO3猜想2:Na2SO4猜想3: 。
【设计实验】
(5)取少量土壤浸出液于试管中,加入足量的BaCl2溶液, ,则证明猜想3成立。(补充实验步骤及现象)
五、计算题
23.合理使用消毒剂,对于控制传染病的传播、保障人体健康具有重要作用。84消毒液是常用的消毒剂,主要成分次氯酸钠(NaClO),制取的反应原理为Cl2+2NaOH=NaClO+NaCl+H2O。若用100g的NaOH溶液与Cl2恰好完全反应,反应后所得到的溶液质量为107.1g。请回答下列问题:
(1)参加反应的氯气质量为 g。
(2)所用NaOH溶液中溶质的质量分数是多少?
《2025年湖南省郴州市中考二模化学试题》参考答案
1.C
2.A
3.B
4.A
5.C
6.D
7.C
8.D
9.A
10.D
11.B
12.A
13.D
14.C
15.B
16.(1)糖类
(2)不活泼(或稳定)
17.(1)不一定
(2)145
(3)降温结晶
18.(1)增大反应物的接触面积,加快化学反应速率
(2)Fe2O3+3CO2Fe+3CO2
(3)AB
19.(1)硫酸锌(或ZnSO4)
(2)CaO+H2O=Ca(OH)2
(3)增大
20.(1)水
(2)CO2
(3)B
(4)乘坐公共交通工具出行(合理即可)
21. 2H2O22H2O+O2↑() AC 连续均匀冒出 红
22.(1)8
(2)海水稻
(3) 稀盐酸 NaCl、NaOH
(4)Na2CO3和Na2SO4
(5)产生白色沉淀,向沉淀中加入足量稀盐酸,沉淀部分溶解,有气泡产生
23.(1)7.1
(2)设NaOH溶液中的溶质质量为x。
x=8g
所用氢氧化钠溶液中NaOH的质量分数为×100%=8%
答:所用氢氧化钠溶液中NaOH的质量分数为8%。
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.“五育并举,劳育先行”。下列劳动项目中涉及化学变化的是
A.打扫房间 B.整理书桌 C.生火做饭 D.晾晒衣物
2.体育是五育的基础,同学们在运动后喝的矿泉水可为其身体补充“钠”、“镁”等,矿泉水中的“钠”、“镁”指的是
A.元素 B.原子 C.单质 D.分子
3.五彩斑斓的颜色变化体现了化学实验之美,以下描述正确的是
A.溶液颜色:FeCl2溶液——黄色
B.沉淀颜色:氢氧化铜——蓝色
C.火焰颜色:硫在氧气中燃烧——淡蓝色
D.固体颜色:四氧化三铁——红色
4.具备规范的实验技能是进行科学探究的基础。下列实验操作正确的是
A.稀释浓硫酸 B.过滤
C.验满氧气 D.测定pH
5.2025年“中国水周”活动的主题为“推动水利高质量发展,保障我国水安全”。下列不利于环境保护的是
A.使用绿色公共交通出行 B.合理使用农药和化肥
C.工业废水直接浇灌农田 D.不使用含磷洗衣粉
6.根据国际权威机构的最新认证,我国企业自主研发的晶硅-钙钛矿叠层电池效率达到33.9%,成为目前全球叠层太阳能电池效率的最高纪录。硅在元素周期表中的信息如图所示,下列说法错误的是
A.硅原子的核内质子数为14 B.X可表示为Si
C.硅属于非金属元素 D.硅的相对原子质量是28.08g
7.新能源汽车机身不仅外表流畅美观,本身安全性能也强,彰显中国制造的魅力。下列生产原料中不属于金属材料的是
A.高强度钢 B.铝合金 C.塑料 D.铜导线
8.与新能源汽车相比,传统油车需要安装“三元催化器”来处理汽车尾气,其中某个反应的微观示意图如图所示。下列说法错误的是
A.该图能反映反应前后原子的种类不变
B.催化剂在反应前后,质量和化学性质都不变
C.该反应有利于保护环境
D.该反应属于置换反应
9.晋代葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银”,丹砂指的是HgS。其中汞元素的化合价为+2价,则硫元素的化合价为
A.-2 B.+2 C.+4 D.+6
10.姜黄为药食两用材料,有着极高的药用价值,从姜黄中提取的姜黄素(化学式为C21H20O6)具有抗炎、抗氧化等作用。下列关于姜黄素的说法正确的是
A.姜黄素属于氧化物
B.姜黄素中氧元素的质量分数最小
C.姜黄素由47个原子构成
D.姜黄素由碳、氢、氧三种元素组成
11.化学让我们的生活更加美好。请你从化学的视角判断,下列说法正确的是
A.发霉的大米洗干净再食用
B.利用氩氦刀可低温冷冻微创治疗肿瘤
C.为防止甲状腺肿大,食用大量的含碘食物
D.将塑料垃圾就地焚烧
12.化学学科核心素养展现了化学课程对学生发展的重要价值。下列说法正确的是
A.科学态度与责任:将生活垃圾分类投放,可实现资源的回收再利用
B.科学思维:活泼金属能与稀盐酸反应产生气泡,所以与稀盐酸反应产生气泡的物质一定是活泼金属
C.科学探究与实践:将一根洁净的金属丝浸入硫酸铝溶液中,无明显现象,则说明该金属的活动性比铝强
D.化学观念:生成盐和水的反应叫做中和反应
13.食醋中含有醋酸,食醋除作调味剂外,生活中还有些妙用,下列使用食醋肯定不能达到目的的是( )
A.除去菜刀上的铁锈 B.除去水壶壁上的水垢
C.清洗溅到皮肤上的碱液 D.鉴别黄金饰品中是否含有铜
14.“物质的性质与应用”是学习义务教育化学课程的主题之一,下列说法正确的是
A.浓盐酸常用作气体干燥剂 B.烧碱可用于治疗胃酸过多
C.活性炭具有吸附性 D.空气中的氮气不能用做保护气
15.诗人陆游的笔记中记载“书灯勿用铜盏,惟瓷盏最省油,蜀中有夹瓷盏……可省油之半”“一端作小窍(孔),注清冷水于其中,每夕一易(更换)之”。夹瓷盏被称为省油灯,其结构如图所示,用棉绳做炷(灯芯),上层盏盛油,下层盏盛水。下列说法中不正确的是
A.剪掉灯芯熄灭油灯,其灭火原理是清除可燃物
B.使用时水会不断减少,是因为水分子受热分解
C.下层水吸热,减少了上层油的蒸发,从而达到省油的目的
D.“书灯勿用铜盏”的原因是铜有良好的导热性,会加速油的蒸发
二、填空与简答
16.品味古籍中的传统文化,厚植爱国主义情怀。
(1)《十五从军征》中的“舂谷持作饭,采葵持作羹”,生动展现了老兵归家后做饭的场景,其中米饭富含六类营养物质中的 。
(2)《兰亭序》被誉为“天下第一行书”,其内容是由墨汁书写而成,能保存至今而不褪色是因为常温下碳的化学性质 。
17.我国著名化学家侯德榜先生创立了“侯氏制碱法”,促进了世界制碱技术的发展。该技术以从海水中提取出来的食盐为主要原料制取纯碱。请根据碳酸钠和氯化钠的溶解度曲线回答下列问题:
(1)在t1℃时,NaCl和Na2CO3溶液中溶质的质量分数 相等(填“一定”或“不一定”)。
(2)在t2℃时,将50g Na2CO3加入到100g水中,充分溶解后所得到的溶液质量为 g。
(3)若生活在盐湖附近的人们冬天捞得的“碱”(Na2CO3)中含有少量NaCl,则可通过 提纯Na2CO3(填“蒸发结晶”或“降温结晶”)。
18.教材中工业炼铁使用的设备是高炉,竖炉炼铁也是一种重要的炼铁方法,其工艺流程如图所示。
回答问题:
(1)将赤铁矿石粉碎的目的是 。
(2)还原反应室中发生了两个还原氧化铁的反应,化学方程式分别为:Fe2O3+3H22Fe+3H2O和 。
(3)下列关于竖炉炼铁说法正确的是______。
A.该工艺流程中,CO2可以循环利用
B.冶炼出来的铁放在潮湿的空气中易生锈
C.赤铁矿属于纯净物
D.催化反应室通入的天然气是可再生能源
19.阅读下面科普短文,回答下列问题。
松花蛋又称“皮蛋”,是我国特有的食品之一。插椒皮蛋是湘菜中最具代表性的创新吃法。松花蛋是用料泥包裹鸭蛋、鸡蛋等加工而成。料泥是由生石灰、纯碱、食盐、草木灰等原料与水按一定比例混合均匀制得,原料中还可加入少量硫酸锌改变松花蛋的品质。料泥制作过程中,通过一系列反应,产生的强碱经蛋壳渗入到蛋清和蛋黄中,与其中的蛋白质作用,生成的盐的晶体沉积在凝胶态的蛋清中,便出现了朵朵“松花”。
松花蛋虽然营养丰富,但碱性过大,不宜过多食用。在松花蛋形成过程中,碱液浓度及腌制时间等对其品质起着至关重要的作用。研究人员对以上影响因素进行了探究:如图表示其他条件均为最佳水平时,NaOH溶液浓度对松花蛋的蛋白弹性(被压缩高度越大,蛋白弹性越大)的影响。
(1)通过阅读上述短文可知,为改变松花蛋的品质,在制作原料中可加入少量 。
(2)料泥制作过程中,生石灰与水反应生成熟石灰,反应的化学方程式为 。
(3)由图可知,当其他条件均为最佳水平时,NaOH溶液浓度在4%~5.5%的范围内时,随着氢氧化钠溶液浓度的增大,松花蛋蛋白弹性 。
20.“氧循环”、“碳循环”、“水循环”是自然界存在的三大重要循环。
(1)从分子种类改变的角度看, 循环与另外两种循环有本质区别。
(2)过程⑤为绿色植物的光合作用,其化学方程式为6X+6H2OC6H12O6+6O2,则X的化学式为 。
(3)下列关于碳、氧循环的相关认识,错误的是______(填序号)。
A.空气中二氧化碳含量过多会导致温室效应
B.碳、氧循环过程中各元素守恒,碳、氧元素质量和化合价均不变
C.碳循环是自然界物质和能量循环的重要组成部分
D.将从排放源捕集的二氧化碳注入海底,是一项二氧化碳封存技术
(4)作为一名中学生,请你基于碳中和理念设计一条切实可行的低碳行动方案: 。
三、实验题
21.小张同学在老师的指导下进行了相关实验,如表是部分实验记录,请你完善表格。
实验记录:氧气、二氧化碳的实验室制取与性质验证
【实验目的】 练习实验室制取氧气和二氧化碳并进行相关实验
【实验原理】 制取氧气∶2KMnO4K2MnO4+MnO2+O2↑、 (用化学方程式表示) 制取二氧化碳:CaCO3+2HCl=CaCl2+CO2↑+H2O
【实验装置】
【实验过程】 (1)实验室用高锰酸钾制取并收集较纯净的O2,应选择的装置组合是 (填字母序号);当看到气泡 时才开始收集氧气。 (2)该同学将湿润的紫色石蕊纸花放入收集好的二氧化碳集气瓶中,发现纸花变为 色。
四、科学探究题
22.某校聚焦“确保国家粮食安全,确保不发生规模性返贫”主题,组织学校兴趣小组的同学对“试验田”中农作物优产增收方案开展了如下项目式学习活动,以下是活动中的部分任务。
任务一:选择优质种子
(1)农业上常用16%的氯化钠溶液来选择成熟饱满的种子,现需配制50g16%的氯化钠溶液,需要称量氯化钠的质量为 g。
任务二:选择适宜种植的农作物
【信息检索】如表为该地几种经济作物种植时所需土壤的pH范围。
农作物 茶树 棉花 苹果树 葱 海水稻
pH 4.5-6.0 6.0-7.5 5.5-7.0 6.0-7.5 7.5-9.0
【小组交流】
(2)小组同学配制试验田土壤样品的浸出液,并测得土壤pH约为8,最适宜种植的一种农作物是 。
任务三:寻找改变溶液酸碱性的方法
(3)取一定量的稀盐酸和氢氧化钠溶液进行实验,用传感器实时获得溶液的pH、温度曲线,如图1、图2所示。
①图1中烧杯中的试剂为 (填名称)。
②图2中t2时烧杯中溶液的溶质成分为 (填化学式)。
任务四:探究引起土壤盐碱化的物质
【信息检索】
a.该土壤盐碱化可能由Na2CO3、Na2SO4中的一种或两种引起
b.BaCO3为白色固体,难溶于水;BaSO4为白色固体,难溶于水和盐酸
【作出猜想】
(4)猜想1:Na2CO3猜想2:Na2SO4猜想3: 。
【设计实验】
(5)取少量土壤浸出液于试管中,加入足量的BaCl2溶液, ,则证明猜想3成立。(补充实验步骤及现象)
五、计算题
23.合理使用消毒剂,对于控制传染病的传播、保障人体健康具有重要作用。84消毒液是常用的消毒剂,主要成分次氯酸钠(NaClO),制取的反应原理为Cl2+2NaOH=NaClO+NaCl+H2O。若用100g的NaOH溶液与Cl2恰好完全反应,反应后所得到的溶液质量为107.1g。请回答下列问题:
(1)参加反应的氯气质量为 g。
(2)所用NaOH溶液中溶质的质量分数是多少?
《2025年湖南省郴州市中考二模化学试题》参考答案
1.C
2.A
3.B
4.A
5.C
6.D
7.C
8.D
9.A
10.D
11.B
12.A
13.D
14.C
15.B
16.(1)糖类
(2)不活泼(或稳定)
17.(1)不一定
(2)145
(3)降温结晶
18.(1)增大反应物的接触面积,加快化学反应速率
(2)Fe2O3+3CO2Fe+3CO2
(3)AB
19.(1)硫酸锌(或ZnSO4)
(2)CaO+H2O=Ca(OH)2
(3)增大
20.(1)水
(2)CO2
(3)B
(4)乘坐公共交通工具出行(合理即可)
21. 2H2O22H2O+O2↑() AC 连续均匀冒出 红
22.(1)8
(2)海水稻
(3) 稀盐酸 NaCl、NaOH
(4)Na2CO3和Na2SO4
(5)产生白色沉淀,向沉淀中加入足量稀盐酸,沉淀部分溶解,有气泡产生
23.(1)7.1
(2)设NaOH溶液中的溶质质量为x。
x=8g
所用氢氧化钠溶液中NaOH的质量分数为×100%=8%
答:所用氢氧化钠溶液中NaOH的质量分数为8%。
同课章节目录
