2.1 课时2影响化学反应速率的因素(含答案) 2024-2025学年高二化学苏教版(2019)选择性必修第一册
文档属性
| 名称 | 2.1 课时2影响化学反应速率的因素(含答案) 2024-2025学年高二化学苏教版(2019)选择性必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-18 12:46:37 | ||
图片预览




文档简介
课时2 影响化学反应速率的因素
1. 了解温度、浓度、压强和催化剂对化学反应速率的影响,认识其一般规律。
2. 知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响,了解活化分子、活化能的概念。
3. 知道催化剂可以改变反应历程,了解催化剂在生产、生活和科学研究领域中的重大作用。
4. 认识化学反应速率的调控在生活、生产和科学研究领域中的重要作用。
硫代硫酸钠溶液与稀硫酸发生下列反应:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O。向A、B、C三支试管中各加入2 mL 不同浓度的硫代硫酸钠溶液,浓度依次为0.1 mol/L、0.05 mol/L、0.01 mol/L,再同时各加入2 mL 0.2 mol/L稀硫酸,观察并比较试管中出现浑浊现象的快慢。
1. 实验现象:_____________________________________________________。
2. 实验结论:_____________________________________________________
______________________________________________________________________。
1. 阅读教材,了解碰撞理论,下图是两种碰撞,讨论有效碰撞需要什么条件?
无效碰撞 有效碰撞
2. 阅读教材,什么是活化分子?什么是活化能?
3. 为什么增加反应物浓度可以增大反应速率?
4. 阅读教材,什么是基元反应?基元反应有没有中间产物生成?氢气与碘的反应是否是基元反应?
5. 基元反应的活化能大小与反应速率有什么关系?
1. 在一定温度下,一定质量的气体的物质的量浓度与压强有何种关系?
2. 讨论:对于有气体参加的反应,在密闭容器中保持温度不变时,改变压强对反应速率有什么影响?为什么?
3. 压强改变对反应速率的影响可以归结为浓度改变对反应速率的影响。思考:若反应物以液体或固体状态存在,改变反应体系的压强,反应速率是否改变?
4. 在三个密闭容器中分别进行下列反应:
(1) 10 mL 1 mol/L HCl溶液与10 mL 0.1 mol/L NaOH溶液;
(2) CaO固体与SiO2固体在高温下反应生成CaSiO3;
(3) SO2气体与O2气体在一密闭容器内反应生成SO3气体。
给上述三个反应容器加压,反应物的浓度怎样变化?
编号 反应物的状态 反应物是否能被压缩 加压后反应物浓度的变化
(1)
(2)
(3)
1. 阅读教材,完成教材实验,记录实验现象。
实验 冰水 室温中 热水中
褪色的时间
实验结论
2. 根据实验结论,结合你以往化学实验的经验,你能得出温度对化学反应速率影响的一般规律是什么?
3. 科学研究表明,对于许多反应而言,一般温度每升高10 K,其反应速率可增大2~4倍。从活化分子有效碰撞角度解释,随着温度升高反应速率增大的原理。在实验室或工业生产中,温度对反应速率的影响有什么应用?
1. 通过实验探究催化剂对化学反应速率的影响。
向A、B、C 3支试管中分别加入等体积5%的H2O2溶液,再向试管中分别加入2~3滴洗涤剂。向试管A中加入2~3滴FeCl3溶液,向试管B中加入少量MnO2粉末,C试管留作比较。观察、比较 3支试管中发生的实验现象,并试着分析导致实验现象差异的原因。
实验 A B C
实验现象
实验结论
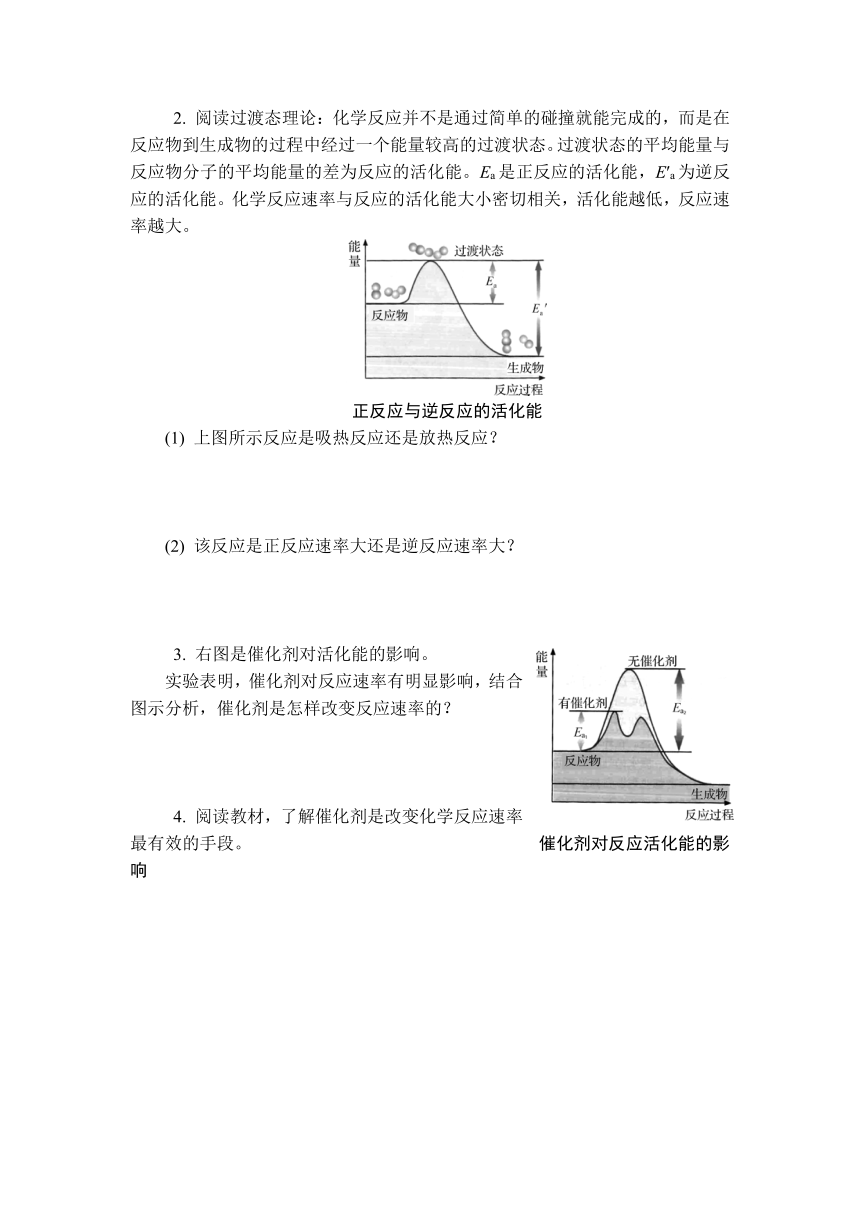
2. 阅读过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个能量较高的过渡状态。过渡状态的平均能量与反应物分子的平均能量的差为反应的活化能。Ea是正反应的活化能,E′a为逆反应的活化能。化学反应速率与反应的活化能大小密切相关,活化能越低,反应速率越大。
正反应与逆反应的活化能
(1) 上图所示反应是吸热反应还是放热反应?
(2) 该反应是正反应速率大还是逆反应速率大?
3. 右图是催化剂对活化能的影响。
实验表明,催化剂对反应速率有明显影响,结合图示分析,催化剂是怎样改变反应速率的?
4. 阅读教材,了解催化剂是改变化学反应速率最有效的手段。 催化剂对反应活化能的影响
通常认为,酶的催化作用是酶与反应物先形成中间化合物,然后中间化合物分解成产物并释放酶。
酶催化原理示意图
阅读教材,讨论酶的催化作用有哪些特点。
1. 阅读课本,影响化学反应速率的因素还有哪些?
2. 结合教材学以致用内容,从内外因两个角度讨论如何调控反应速率。
1. [人教版教材习题]下列对化学反应速率增大原因的分析错误的是( )
A. 对有气体参加的化学反应,增大压强使容器容积减小,单位体积内活化分子数增多
B. 向反应体系中加入相同浓度的反应物,使活化分子百分数增大
C. 升高温度,使反应物分子中活化分子百分数增大
D. 加入适宜的催化剂,使反应物分子中活化分子百分数增大
2. 下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是( )
A. Cu能与浓硝酸反应,不能与浓盐酸反应
B. Cu与浓硝酸反应比与稀硝酸反应快
C. N2与O2在常温、常压下不反应,放电时可反应
D. Cu能与浓硫酸反应,不能与稀硫酸反应
3. 将镁条投入盛有盐酸的敞口容器,产生氢气的速率变化如图。下列影响反应的因素有( )
① 盐酸的浓度 ② 镁条的表面积
③ 溶液的温度 ④ Cl-的浓度
A. ①④ B. ③④ C. ①②③ D. ②③④
4. 反应A+B===C分两步进行:①A+B===X,②X===C。反应过程中的能量变化如图所示。E1表示反应A+B===X的活化能。下列有关叙述正确的是( )
A. E2表示反应X===C的活化能
B. X是反应A+B===C的催化剂
C. 反应A+B===C的ΔH<0
D. 加入催化剂可改变反应A+B===C的焓变
5. 下列措施中,不能增大化学反应速率的是( )
A. Zn与稀硫酸反应制取H2时,加入少量CuSO4溶液
B. Al在O2中燃烧生成Al2O3时,用铝粉替代铝片
C. 用H2O2分解制取O2时,添加少量MnO2
D. CaCO3与稀盐酸反应生成CO2时,将盐酸换成等浓度的硝酸
6. H2O2是重要的消毒剂、氧化剂,研究其分解反应有重要意义。KI能催化H2O2的分解。
①不加KI:2H2O2===2H2O+O2↑
②加入KI:H2O2+I-===H2O+IO-、
H2O2+IO-===H2O+O2↑+I-
H2O2分解反应过程中能量变化如图所示。下列判断不正确的是( )
A. 加入KI后改变了反应的历程
B. 加入KI后改变了反应2H2O2===2H2O+O2的反应热
C. H2O2+I-===H2O+IO-是吸热反应
D. KI降低了该反应的活化能
7. 图中曲线表示一定条件下一定量的锌粒与足量的稀硫酸反应的过程。若使曲线b变为曲线a,可采取的措施是( )
A. 加入硫酸铜固体 B. 加入醋酸钠固体
C. 稀硫酸换成浓硫酸 D. 加热使溶液温度升高
8. 化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项 化学反应 测量依据(单位时间内)
A CO(g)+H2O(g)===CO2(g)+H2(g) 压强变化
B Zn+H2SO4===ZnSO4+H2↑ H2体积
C 2NO2 N2O4 颜色深浅
D Ca(OH)2+Na2CO3===CaCO3↓+2NaOH 沉淀质量
9. 某同学探究外界条件对H2O2分解速率的影响。实验所用试剂:0.4 mol/L H2O2溶液、蒸馏水、MnO2粉末、Fe2O3粉末。
实验序号 H2O2浓度/ (mol/L) V(H2O2溶液) /mL 温度 催化剂 收集112 mL O2所需时间/s
1 0.4 20 室温 无 几乎无气体产生
2 0.4 20 50 ℃水浴 无 296
3 0.4 20 室温 0.5 g a 45
4 0.4 20 室温 0.5 g MnO2粉末 100
5 0.4 b 室温 0.5 g a >45
(1) 实验1、2的目的是其他条件相同时,探究________对H2O2分解速率的影响。
(2) 表中a处所用试剂为____________;对比实验3、4可得出的结论是______
______________________________________________________________________。
(3) 实验3、5是其他条件相同时,探究浓度对该化学反应速率的影响。b处取用10 mL 0.4 mol/L H2O2溶液,还应添加的试剂及用量为________________。
(4) 控制其他条件相同,印刷电路板的金属粉末用0.4 mol/L H2O2溶液和3.0 mol/L H2SO4溶液处理,其化学方程式为Cu+H2O2+2H+===Cu2++2H2O。某同学在不同温度下完成该实验,测得铜的平均溶解速率分别如下表所示。
温度/℃ 20 30 40 50 60 70 80
铜的平均溶解速率/ [×10-3 mol/(L·min)] 7.34 8.01 9.25 7.98 7.24 6.73 5.76
当温度高于40 ℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是________________________________________________________________。
课时2 影响化学反应速率的因素
【活动方案】
活动一:
1. 浓度大的先出现浑浊,浓度小的后出现浑浊
2. 其他条件相同的情况下,反应物浓度越大,反应速率越大,反应物浓度越小,反应速率越小
活动二:
1. 有效碰撞必须满足的条件:分子具有足够高的能量,分子在一定的方向上发生碰撞。
2. 化学反应中能量较高、有可能发生有效碰撞的分子称为活化分子。活化分子的平均能量与所有分子的平均能量之差称为活化能。
3. 增加反应物浓度,单位体积内反应物的活化分子数增多(即活化分子浓度增大),反应物发生有效碰撞的次数增多,反应速率增大。
4. 反应物分子经过一次碰撞就转化为产物分子的反应,称为基元反应,基元反应过程中没有中间产物生成。反应H2+I2===2HI不是基元反应,反应历程含两步基元反应:I2===2I、H2+2I===2HI。
5. 每个基元反应都有对应的活化能,反应的活化能越大,活化分子所占比例越小,有效碰撞的比例也就越小,故化学反应速率越小。
活动三:
1. 如果气体的压强增大,气体的体积减小,单位体积内的气体分子数增多,气体物质的量浓度增大。
2. 对于有气体参加的反应,在密闭容器中保持温度不变时,增大压强,气体体积减小,相当于增大反应物的浓度,反应速率增大;减小压强,气体体积增大,相当于减小反应物的浓度,反应速率减小。
3. 其他条件相同时,若反应物为液态或固态,改变压强对它们体积的影响很小,因此可以忽略压强改变对反应速率的影响。
4. (1) 液态 否 不变 (2) 固态 否 不变 (3) 气态 是 增大
活动四:
1. 略
2. 当其他条件相同时,升高温度,反应速率增大,降低温度,反应速率减小。
3. 随着温度的升高,反应物的活化分子数目增多,分子运动加快,活化分子有效碰撞的次数增多,反应速率增大。实验或生产中常常采用加热的方法,使反应在较高温度下进行,以提高反应速率。
活动五:
1. 迅速产生大量气泡 迅速产生大量气泡 几乎无气泡产生 催化剂可增大反应速率
2. (1) 放热反应。 (2) 正反应的活化能小,反应速率大,逆反应的活化能大,反应速率小。
3. 催化剂是通过降低化学反应所需的活化能来增大反应速率的。根据图示,使用催化剂时活化能降低,能量不足的分子就有可能变成活化分子,从而使有效碰撞的概率提高,反应速率增大。
4. 略
活动六:
高效的催化活性;高度的选择性;特殊的温度效应。
活动七:
1. 影响化学反应速率的因素还有很多,如反应物间的接触面积、光、电磁波、超声波等因素也会对反应速率产生影响。
2. 略
【课堂反馈】
1. B 向反应体系中加入相同浓度的反应物,活化分子数变多,活化分子百分数不变,B错误。
2. A
3. C 随着反应的进行,c(H+)不断减小,反应速率会逐渐减小,说明①盐酸的浓度影响反应;在镁条的表面有一层氧化膜,当将镁条投入盐酸中时,随着氧化膜的不断溶解,镁与盐酸的接触面积不断增大,产生H2的速率会增大,说明②镁条的表面积影响反应;该反应放出热量,使温度升高,反应速率也会增大,说明③溶液的温度影响反应;镁条和盐酸反应产生H2的离子方程式为Mg+2H+===Mg2++H2↑,是镁与H+的置换反应,与Cl-无关,说明④ Cl-的浓度不影响反应,故选C。
4. C 反应X===C的活化能小于E2,A错误;由①②可知,X是反应A+B===C的中间产物,B错误;反应物A和B的总能量大于生成物C的总能量,故反应A+B===C是放热反应,即ΔH<0,C正确;加入正催化剂可以增大反应速率,但反应物和生成物具有的总能量不变,则反应的焓变不改变,D错误。
5. D Zn与稀硫酸反应制取H2时,加入少量CuSO4溶液,会形成原电池,增大化学反应速率,A正确;Al在O2中燃烧生成Al2O3时,用铝粉替代铝片,增大接触面积,增大化学反应速率,B正确;用H2O2分解制取O2时,添加少量MnO2起到了催化剂的作用,增大化学反应速率,C正确;CaCO3与稀盐酸反应生成CO2时,将盐酸换成等浓度的硝酸,并没有改变酸的浓度,不能增大化学反应速率,D错误。
6. B 由反应历程图可知,不加KI时反应一步完成,加入KI后分两步进行,反应历程改变,A正确;KI是该反应的催化剂,不能改变反应的反应热,B错误;由图可知,第一步反应中,H2O2和I-具有的能量小于H2O和IO-具有的能量,是吸热反应,C正确;KI是该反应的催化剂,能降低反应的活化能,D正确。
7. D 由图像可知,曲线b变为曲线a,反应速率增大,生成氢气的物质的量不变。一定量的锌与足量的稀硫酸反应生成氢气,生成的氢气的量取决于锌的量。加入硫酸铜固体,部分锌和硫酸铜反应生成铜,构成铜锌原电池,反应速率增大,但和硫酸反应的锌质量减小,生成氢气的物质的量减小,A错误;加入醋酸钠固体,醋酸钠和硫酸反应生成醋酸和硫酸钠,溶液中氢离子浓度降低,反应速率减小,B错误;浓硫酸和锌反应不能生成氢气,C错误;加热使溶液温度升高,反应速率增大,生成氢气的物质的量不变,D正确。
8. A 该反应是气体体积不变的反应,反应前后压强始终不变,测量依据不可行,A符合题意。
9. (1) 温度 (2) Fe2O3粉末 其他条件相同时,不同催化剂对H2O2分解速率影响不同 (3) 10 mL蒸馏水 (4) 温度高于40 ℃时,有较多H2O2分解,反应物浓度降低,使铜的平均溶解速率降低
1. 了解温度、浓度、压强和催化剂对化学反应速率的影响,认识其一般规律。
2. 知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响,了解活化分子、活化能的概念。
3. 知道催化剂可以改变反应历程,了解催化剂在生产、生活和科学研究领域中的重大作用。
4. 认识化学反应速率的调控在生活、生产和科学研究领域中的重要作用。
硫代硫酸钠溶液与稀硫酸发生下列反应:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O。向A、B、C三支试管中各加入2 mL 不同浓度的硫代硫酸钠溶液,浓度依次为0.1 mol/L、0.05 mol/L、0.01 mol/L,再同时各加入2 mL 0.2 mol/L稀硫酸,观察并比较试管中出现浑浊现象的快慢。
1. 实验现象:_____________________________________________________。
2. 实验结论:_____________________________________________________
______________________________________________________________________。
1. 阅读教材,了解碰撞理论,下图是两种碰撞,讨论有效碰撞需要什么条件?
无效碰撞 有效碰撞
2. 阅读教材,什么是活化分子?什么是活化能?
3. 为什么增加反应物浓度可以增大反应速率?
4. 阅读教材,什么是基元反应?基元反应有没有中间产物生成?氢气与碘的反应是否是基元反应?
5. 基元反应的活化能大小与反应速率有什么关系?
1. 在一定温度下,一定质量的气体的物质的量浓度与压强有何种关系?
2. 讨论:对于有气体参加的反应,在密闭容器中保持温度不变时,改变压强对反应速率有什么影响?为什么?
3. 压强改变对反应速率的影响可以归结为浓度改变对反应速率的影响。思考:若反应物以液体或固体状态存在,改变反应体系的压强,反应速率是否改变?
4. 在三个密闭容器中分别进行下列反应:
(1) 10 mL 1 mol/L HCl溶液与10 mL 0.1 mol/L NaOH溶液;
(2) CaO固体与SiO2固体在高温下反应生成CaSiO3;
(3) SO2气体与O2气体在一密闭容器内反应生成SO3气体。
给上述三个反应容器加压,反应物的浓度怎样变化?
编号 反应物的状态 反应物是否能被压缩 加压后反应物浓度的变化
(1)
(2)
(3)
1. 阅读教材,完成教材实验,记录实验现象。
实验 冰水 室温中 热水中
褪色的时间
实验结论
2. 根据实验结论,结合你以往化学实验的经验,你能得出温度对化学反应速率影响的一般规律是什么?
3. 科学研究表明,对于许多反应而言,一般温度每升高10 K,其反应速率可增大2~4倍。从活化分子有效碰撞角度解释,随着温度升高反应速率增大的原理。在实验室或工业生产中,温度对反应速率的影响有什么应用?
1. 通过实验探究催化剂对化学反应速率的影响。
向A、B、C 3支试管中分别加入等体积5%的H2O2溶液,再向试管中分别加入2~3滴洗涤剂。向试管A中加入2~3滴FeCl3溶液,向试管B中加入少量MnO2粉末,C试管留作比较。观察、比较 3支试管中发生的实验现象,并试着分析导致实验现象差异的原因。
实验 A B C
实验现象
实验结论
2. 阅读过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个能量较高的过渡状态。过渡状态的平均能量与反应物分子的平均能量的差为反应的活化能。Ea是正反应的活化能,E′a为逆反应的活化能。化学反应速率与反应的活化能大小密切相关,活化能越低,反应速率越大。
正反应与逆反应的活化能
(1) 上图所示反应是吸热反应还是放热反应?
(2) 该反应是正反应速率大还是逆反应速率大?
3. 右图是催化剂对活化能的影响。
实验表明,催化剂对反应速率有明显影响,结合图示分析,催化剂是怎样改变反应速率的?
4. 阅读教材,了解催化剂是改变化学反应速率最有效的手段。 催化剂对反应活化能的影响
通常认为,酶的催化作用是酶与反应物先形成中间化合物,然后中间化合物分解成产物并释放酶。
酶催化原理示意图
阅读教材,讨论酶的催化作用有哪些特点。
1. 阅读课本,影响化学反应速率的因素还有哪些?
2. 结合教材学以致用内容,从内外因两个角度讨论如何调控反应速率。
1. [人教版教材习题]下列对化学反应速率增大原因的分析错误的是( )
A. 对有气体参加的化学反应,增大压强使容器容积减小,单位体积内活化分子数增多
B. 向反应体系中加入相同浓度的反应物,使活化分子百分数增大
C. 升高温度,使反应物分子中活化分子百分数增大
D. 加入适宜的催化剂,使反应物分子中活化分子百分数增大
2. 下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是( )
A. Cu能与浓硝酸反应,不能与浓盐酸反应
B. Cu与浓硝酸反应比与稀硝酸反应快
C. N2与O2在常温、常压下不反应,放电时可反应
D. Cu能与浓硫酸反应,不能与稀硫酸反应
3. 将镁条投入盛有盐酸的敞口容器,产生氢气的速率变化如图。下列影响反应的因素有( )
① 盐酸的浓度 ② 镁条的表面积
③ 溶液的温度 ④ Cl-的浓度
A. ①④ B. ③④ C. ①②③ D. ②③④
4. 反应A+B===C分两步进行:①A+B===X,②X===C。反应过程中的能量变化如图所示。E1表示反应A+B===X的活化能。下列有关叙述正确的是( )
A. E2表示反应X===C的活化能
B. X是反应A+B===C的催化剂
C. 反应A+B===C的ΔH<0
D. 加入催化剂可改变反应A+B===C的焓变
5. 下列措施中,不能增大化学反应速率的是( )
A. Zn与稀硫酸反应制取H2时,加入少量CuSO4溶液
B. Al在O2中燃烧生成Al2O3时,用铝粉替代铝片
C. 用H2O2分解制取O2时,添加少量MnO2
D. CaCO3与稀盐酸反应生成CO2时,将盐酸换成等浓度的硝酸
6. H2O2是重要的消毒剂、氧化剂,研究其分解反应有重要意义。KI能催化H2O2的分解。
①不加KI:2H2O2===2H2O+O2↑
②加入KI:H2O2+I-===H2O+IO-、
H2O2+IO-===H2O+O2↑+I-
H2O2分解反应过程中能量变化如图所示。下列判断不正确的是( )
A. 加入KI后改变了反应的历程
B. 加入KI后改变了反应2H2O2===2H2O+O2的反应热
C. H2O2+I-===H2O+IO-是吸热反应
D. KI降低了该反应的活化能
7. 图中曲线表示一定条件下一定量的锌粒与足量的稀硫酸反应的过程。若使曲线b变为曲线a,可采取的措施是( )
A. 加入硫酸铜固体 B. 加入醋酸钠固体
C. 稀硫酸换成浓硫酸 D. 加热使溶液温度升高
8. 化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项 化学反应 测量依据(单位时间内)
A CO(g)+H2O(g)===CO2(g)+H2(g) 压强变化
B Zn+H2SO4===ZnSO4+H2↑ H2体积
C 2NO2 N2O4 颜色深浅
D Ca(OH)2+Na2CO3===CaCO3↓+2NaOH 沉淀质量
9. 某同学探究外界条件对H2O2分解速率的影响。实验所用试剂:0.4 mol/L H2O2溶液、蒸馏水、MnO2粉末、Fe2O3粉末。
实验序号 H2O2浓度/ (mol/L) V(H2O2溶液) /mL 温度 催化剂 收集112 mL O2所需时间/s
1 0.4 20 室温 无 几乎无气体产生
2 0.4 20 50 ℃水浴 无 296
3 0.4 20 室温 0.5 g a 45
4 0.4 20 室温 0.5 g MnO2粉末 100
5 0.4 b 室温 0.5 g a >45
(1) 实验1、2的目的是其他条件相同时,探究________对H2O2分解速率的影响。
(2) 表中a处所用试剂为____________;对比实验3、4可得出的结论是______
______________________________________________________________________。
(3) 实验3、5是其他条件相同时,探究浓度对该化学反应速率的影响。b处取用10 mL 0.4 mol/L H2O2溶液,还应添加的试剂及用量为________________。
(4) 控制其他条件相同,印刷电路板的金属粉末用0.4 mol/L H2O2溶液和3.0 mol/L H2SO4溶液处理,其化学方程式为Cu+H2O2+2H+===Cu2++2H2O。某同学在不同温度下完成该实验,测得铜的平均溶解速率分别如下表所示。
温度/℃ 20 30 40 50 60 70 80
铜的平均溶解速率/ [×10-3 mol/(L·min)] 7.34 8.01 9.25 7.98 7.24 6.73 5.76
当温度高于40 ℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是________________________________________________________________。
课时2 影响化学反应速率的因素
【活动方案】
活动一:
1. 浓度大的先出现浑浊,浓度小的后出现浑浊
2. 其他条件相同的情况下,反应物浓度越大,反应速率越大,反应物浓度越小,反应速率越小
活动二:
1. 有效碰撞必须满足的条件:分子具有足够高的能量,分子在一定的方向上发生碰撞。
2. 化学反应中能量较高、有可能发生有效碰撞的分子称为活化分子。活化分子的平均能量与所有分子的平均能量之差称为活化能。
3. 增加反应物浓度,单位体积内反应物的活化分子数增多(即活化分子浓度增大),反应物发生有效碰撞的次数增多,反应速率增大。
4. 反应物分子经过一次碰撞就转化为产物分子的反应,称为基元反应,基元反应过程中没有中间产物生成。反应H2+I2===2HI不是基元反应,反应历程含两步基元反应:I2===2I、H2+2I===2HI。
5. 每个基元反应都有对应的活化能,反应的活化能越大,活化分子所占比例越小,有效碰撞的比例也就越小,故化学反应速率越小。
活动三:
1. 如果气体的压强增大,气体的体积减小,单位体积内的气体分子数增多,气体物质的量浓度增大。
2. 对于有气体参加的反应,在密闭容器中保持温度不变时,增大压强,气体体积减小,相当于增大反应物的浓度,反应速率增大;减小压强,气体体积增大,相当于减小反应物的浓度,反应速率减小。
3. 其他条件相同时,若反应物为液态或固态,改变压强对它们体积的影响很小,因此可以忽略压强改变对反应速率的影响。
4. (1) 液态 否 不变 (2) 固态 否 不变 (3) 气态 是 增大
活动四:
1. 略
2. 当其他条件相同时,升高温度,反应速率增大,降低温度,反应速率减小。
3. 随着温度的升高,反应物的活化分子数目增多,分子运动加快,活化分子有效碰撞的次数增多,反应速率增大。实验或生产中常常采用加热的方法,使反应在较高温度下进行,以提高反应速率。
活动五:
1. 迅速产生大量气泡 迅速产生大量气泡 几乎无气泡产生 催化剂可增大反应速率
2. (1) 放热反应。 (2) 正反应的活化能小,反应速率大,逆反应的活化能大,反应速率小。
3. 催化剂是通过降低化学反应所需的活化能来增大反应速率的。根据图示,使用催化剂时活化能降低,能量不足的分子就有可能变成活化分子,从而使有效碰撞的概率提高,反应速率增大。
4. 略
活动六:
高效的催化活性;高度的选择性;特殊的温度效应。
活动七:
1. 影响化学反应速率的因素还有很多,如反应物间的接触面积、光、电磁波、超声波等因素也会对反应速率产生影响。
2. 略
【课堂反馈】
1. B 向反应体系中加入相同浓度的反应物,活化分子数变多,活化分子百分数不变,B错误。
2. A
3. C 随着反应的进行,c(H+)不断减小,反应速率会逐渐减小,说明①盐酸的浓度影响反应;在镁条的表面有一层氧化膜,当将镁条投入盐酸中时,随着氧化膜的不断溶解,镁与盐酸的接触面积不断增大,产生H2的速率会增大,说明②镁条的表面积影响反应;该反应放出热量,使温度升高,反应速率也会增大,说明③溶液的温度影响反应;镁条和盐酸反应产生H2的离子方程式为Mg+2H+===Mg2++H2↑,是镁与H+的置换反应,与Cl-无关,说明④ Cl-的浓度不影响反应,故选C。
4. C 反应X===C的活化能小于E2,A错误;由①②可知,X是反应A+B===C的中间产物,B错误;反应物A和B的总能量大于生成物C的总能量,故反应A+B===C是放热反应,即ΔH<0,C正确;加入正催化剂可以增大反应速率,但反应物和生成物具有的总能量不变,则反应的焓变不改变,D错误。
5. D Zn与稀硫酸反应制取H2时,加入少量CuSO4溶液,会形成原电池,增大化学反应速率,A正确;Al在O2中燃烧生成Al2O3时,用铝粉替代铝片,增大接触面积,增大化学反应速率,B正确;用H2O2分解制取O2时,添加少量MnO2起到了催化剂的作用,增大化学反应速率,C正确;CaCO3与稀盐酸反应生成CO2时,将盐酸换成等浓度的硝酸,并没有改变酸的浓度,不能增大化学反应速率,D错误。
6. B 由反应历程图可知,不加KI时反应一步完成,加入KI后分两步进行,反应历程改变,A正确;KI是该反应的催化剂,不能改变反应的反应热,B错误;由图可知,第一步反应中,H2O2和I-具有的能量小于H2O和IO-具有的能量,是吸热反应,C正确;KI是该反应的催化剂,能降低反应的活化能,D正确。
7. D 由图像可知,曲线b变为曲线a,反应速率增大,生成氢气的物质的量不变。一定量的锌与足量的稀硫酸反应生成氢气,生成的氢气的量取决于锌的量。加入硫酸铜固体,部分锌和硫酸铜反应生成铜,构成铜锌原电池,反应速率增大,但和硫酸反应的锌质量减小,生成氢气的物质的量减小,A错误;加入醋酸钠固体,醋酸钠和硫酸反应生成醋酸和硫酸钠,溶液中氢离子浓度降低,反应速率减小,B错误;浓硫酸和锌反应不能生成氢气,C错误;加热使溶液温度升高,反应速率增大,生成氢气的物质的量不变,D正确。
8. A 该反应是气体体积不变的反应,反应前后压强始终不变,测量依据不可行,A符合题意。
9. (1) 温度 (2) Fe2O3粉末 其他条件相同时,不同催化剂对H2O2分解速率影响不同 (3) 10 mL蒸馏水 (4) 温度高于40 ℃时,有较多H2O2分解,反应物浓度降低,使铜的平均溶解速率降低
