3.2 课时2酸碱中和滴定(含答案) 2024-2025学年高二化学苏教版(2019)选择性必修第一册
文档属性
| 名称 | 3.2 课时2酸碱中和滴定(含答案) 2024-2025学年高二化学苏教版(2019)选择性必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 852.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-18 10:20:44 | ||
图片预览

文档简介
课时2 酸碱中和滴定
1. 了解酸碱中和滴定的原理,能利用中和滴定法测定酸或碱的物质的量浓度。
2. 认识滴定管,学会酸碱中和滴定的实验操作。
3. 能进行中和滴定相关的误差分析。
4. 学会滴定原理的迁移应用。
阅读教材,了解酸碱中和反应在工业生产、农业生产、环保领域有哪些应用?
1. 酸碱中和滴定是一种快速、准确的测量未知浓度酸碱溶液浓度的方法。
2. 将已知浓度的酸(或碱)溶液与一定体积、未知浓度的碱(或酸)溶液反应,反应完全时测定消耗的已知浓度酸(或碱)溶液的体积,根据参加反应的酸(或碱)的物质的量对应关系,即可推算出未知浓度的碱(或酸)溶液的浓度。你认为酸碱中和滴定的原理是什么?
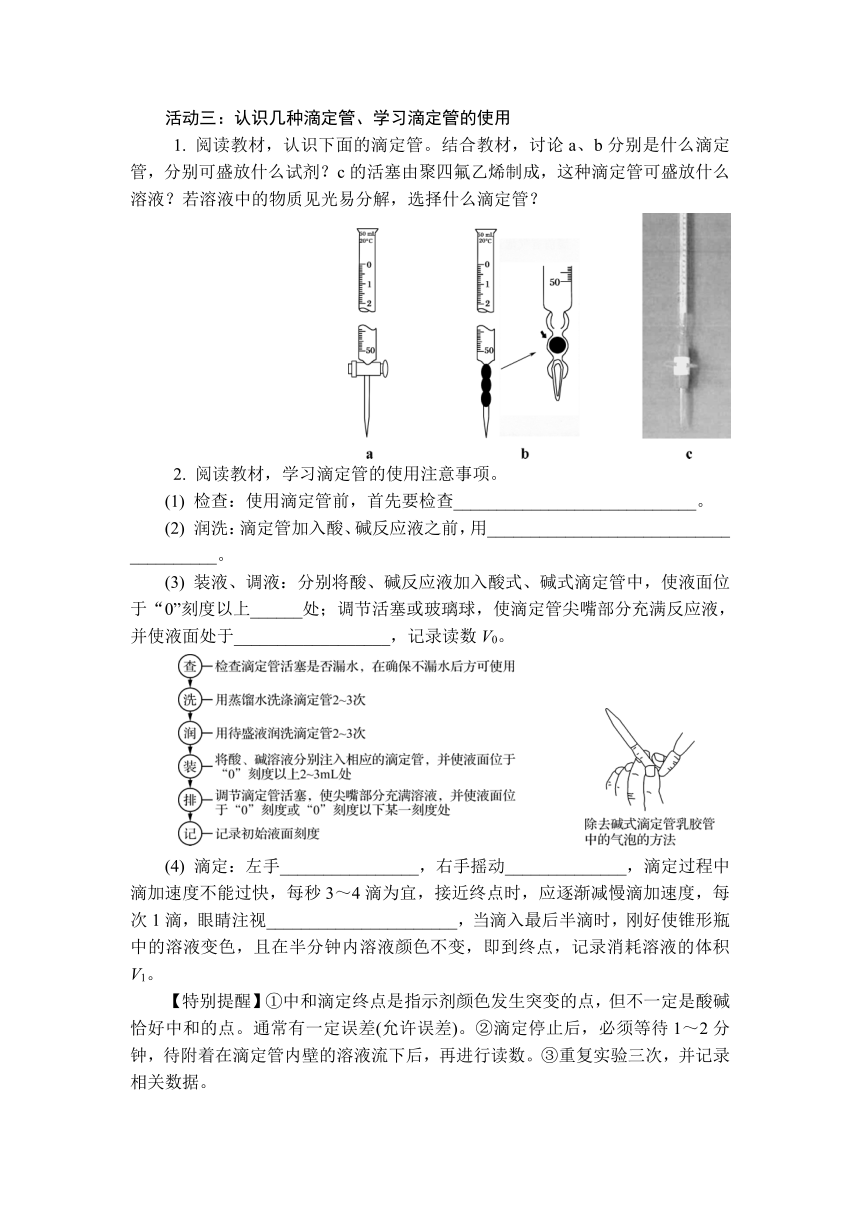
1. 阅读教材,认识下面的滴定管。结合教材,讨论a、b分别是什么滴定管,分别可盛放什么试剂?c的活塞由聚四氟乙烯制成,这种滴定管可盛放什么溶液?若溶液中的物质见光易分解,选择什么滴定管?
2. 阅读教材,学习滴定管的使用注意事项。
(1) 检查:使用滴定管前,首先要检查____________________________。
(2) 润洗:滴定管加入酸、碱反应液之前,用____________________________
__________。
(3) 装液、调液:分别将酸、碱反应液加入酸式、碱式滴定管中,使液面位于“0”刻度以上______处;调节活塞或玻璃球,使滴定管尖嘴部分充满反应液,并使液面处于__________________,记录读数V0。
(4) 滴定:左手________________,右手摇动______________,滴定过程中滴加速度不能过快,每秒3~4滴为宜,接近终点时,应逐渐减慢滴加速度,每次1滴,眼睛注视______________________,当滴入最后半滴时,刚好使锥形瓶中的溶液变色,且在半分钟内溶液颜色不变,即到终点,记录消耗溶液的体积V1。
【特别提醒】①中和滴定终点是指示剂颜色发生突变的点,但不一定是酸碱恰好中和的点。通常有一定误差(允许误差)。②滴定停止后,必须等待1~2分钟,待附着在滴定管内壁的溶液流下后,再进行读数。③重复实验三次,并记录相关数据。
1. 了解常用酸碱指示剂的变色范围。
指示剂 pH变色范围 酸性(溶液颜色) 碱性(溶液颜色)
甲基橙
甲基红
酚酞
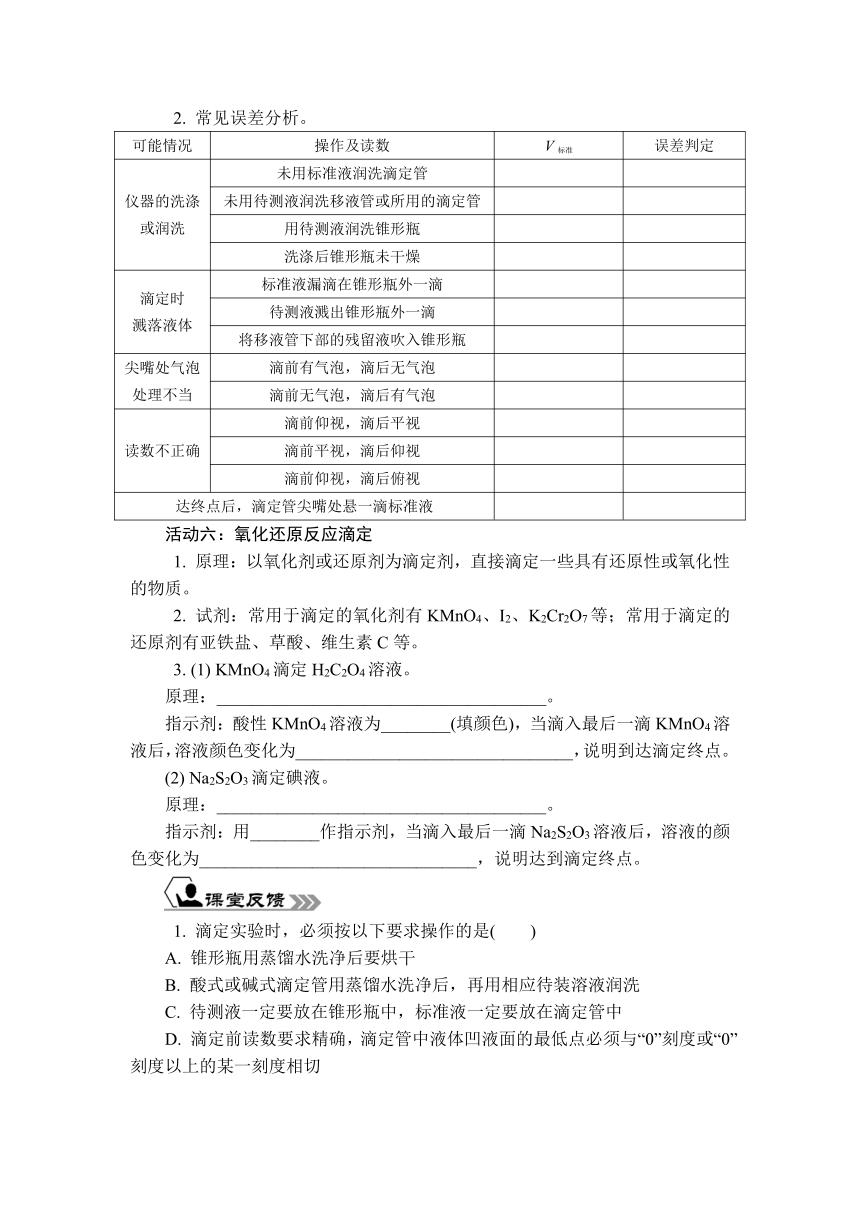
2. 下图是用0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L HCl溶液过程中的pH变化曲线图。
从理论上来说,强酸、强碱完全反应时,溶液的pH应为____,滴定时应选用在pH=____时变色的指示剂。但从图所示的中和滴定曲线上可以看出,当氢氧化钠溶液的体积从 19.98 mL 变为20.02 mL时,溶液的pH从________突跃至________。因此,只要选择________在这一范围内的指示剂就不会造成较大的误差。
3. 酸碱指示剂的选择。
滴定种类 选用的指示剂 达滴定终点时颜色变化 指示剂用量 滴定终点判断标准
强酸滴定强碱 甲基橙 2~3滴 当指示剂刚好变色,并在半分钟内不恢复原来的颜色,即认为已达滴定终点
酚酞
强碱滴定强酸 甲基橙
酚酞
强酸滴定弱碱 甲基橙
强碱滴定弱酸 酚酞
1. 分析误差一般根据c(待测)=进行,若用标准液滴定待测液,c标准、V待测均为定值,c待测的大小由什么决定?
2. 常见误差分析。
可能情况 操作及读数 V标准 误差判定
仪器的洗涤 或润洗 未用标准液润洗滴定管
未用待测液润洗移液管或所用的滴定管
用待测液润洗锥形瓶
洗涤后锥形瓶未干燥
滴定时 溅落液体 标准液漏滴在锥形瓶外一滴
待测液溅出锥形瓶外一滴
将移液管下部的残留液吹入锥形瓶
尖嘴处气泡 处理不当 滴前有气泡,滴后无气泡
滴前无气泡,滴后有气泡
读数不正确 滴前仰视,滴后平视
滴前平视,滴后仰视
滴前仰视,滴后俯视
达终点后,滴定管尖嘴处悬一滴标准液
1. 原理:以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质。
2. 试剂:常用于滴定的氧化剂有KMnO4、I2、K2Cr2O7等;常用于滴定的还原剂有亚铁盐、草酸、维生素C等。
3. (1) KMnO4滴定H2C2O4溶液。
原理:______________________________________。
指示剂:酸性KMnO4溶液为________(填颜色),当滴入最后一滴KMnO4溶液后,溶液颜色变化为________________________________,说明到达滴定终点。
(2) Na2S2O3滴定碘液。
原理:______________________________________。
指示剂:用________作指示剂,当滴入最后一滴Na2S2O3溶液后,溶液的颜色变化为________________________________,说明达到滴定终点。
1. 滴定实验时,必须按以下要求操作的是( )
A. 锥形瓶用蒸馏水洗净后要烘干
B. 酸式或碱式滴定管用蒸馏水洗净后,再用相应待装溶液润洗
C. 待测液一定要放在锥形瓶中,标准液一定要放在滴定管中
D. 滴定前读数要求精确,滴定管中液体凹液面的最低点必须与“0”刻度或“0”刻度以上的某一刻度相切
2. 测定浓硫酸试剂中H2SO4含量的主要操作包括:①量取一定量的浓硫酸,稀释;②转移定容得待测液;③移取20.00 mL待测液,用0.100 0 mol/L NaOH溶液滴定。上述操作中,不需要用到的仪器为( )
A B C D
3. 准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol/L NaOH溶液滴定。下列说法正确的是( )
A. 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B. 随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C. 用酚酞作为指示剂,当锥形瓶中溶液由红色变为无色时停止滴定
D. 达到滴定终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
4. 下列实验操作不会引起误差的是( )
A. 酸碱中和滴定时,用待测液润洗锥形瓶
B. 酸碱中和滴定时,用冲洗干净的滴定管直接盛装标准溶液
C. 用NaOH标准溶液测定未知浓度的盐酸时,实验时不小心多加了几滴酚酞指示剂
D. 用标准盐酸测定未知浓度NaOH溶液,实验结束时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡
5. 用已知浓度的NaOH溶液测定某硫酸的浓度,从下表中选出正确选项( )
序号 锥形瓶中溶液 滴定管中溶液 选用指示剂 选用滴定管
① 碱 酸 石蕊 甲
② 酸 碱 酚酞 甲
③ 碱 酸 甲基橙 甲
④ 酸 碱 酚酞 乙
甲 乙
A. ①② B. ②③ C. ③④ D. ②④
6. 实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作为指示剂,下列操作可能使测定结果偏低的是( )
A. 滴定前平视读数,滴定后仰视读数
B. 滴定结束后,滴定管尖嘴处有一悬挂液滴
C. 取NaOH溶液时先平视读数,后仰视读数
D. 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
7. 实验室用标准KMnO4溶液滴定未知浓度的FeSO4溶液,下列说法或操作正确的是( )
A. 盛FeSO4溶液的锥形瓶滴定前用FeSO4溶液润洗2~3次
B. 选碱式滴定管量取标准KMnO4溶液,并用淀粉 KI溶液作指示剂
C. 滴定前仰视读数,滴定后俯视读数会导致滴定结果偏低
D. 锥形瓶内溶液颜色由浅绿色变为浅紫红色,立即记下滴定管液面所在刻度
8. 用未知浓度的NaOH溶液来滴定10 mL盐酸(标准液)所得的曲线(25 ℃)如图所示。下列说法不正确的是( )
A. 标准液盐酸的浓度为0.1 mol/L
B. NaOH溶液的浓度为0.05 mol/L
C. 滴定终点时,俯视碱式滴定管读数,所测NaOH溶液浓度会偏高
D. 指示剂变色时,说明盐酸与NaOH恰好完全反应
9. 电流滴定法(电压10~100 mV)根据电流情况来判断滴定终点,如图所示,仅I2、I-同时存在时才能产生电流。可用此法来测定Na2S2O3溶液的浓度。已知:2S2O+I2===S4O+2I-。下列说法错误的是(I—127)( )
A. b为滴定终点
B. ab段电流减小是因为离子浓度降低
C. 该反应可不用指示剂,通过电流就可以判断滴定情况
D. 若碘液中含有38.1 g的I2,则硫代硫酸钠溶液的浓度为0.5 mol/L
10. 现使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤
(1) 用________________(填仪器名称,下同)量取10.00 mL 食用白醋,在________中用水稀释后转移到100 mL的________中定容,摇匀即得待测白醋溶液。
(2) 用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3) 读取盛装0.100 0 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
(4) 滴定。当_______________________________________________________
________________时,停止滴定,并记录滴定管中NaOH溶液的最终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数 1 2 3 4
V样品/mL 20.00 20.00 20.00 20.00
V消耗(NaOH)/mL 15.95 15.00 15.05 14.95
Ⅲ.数据处理与讨论
甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V= mL=15.24 mL。
指出他计算的不合理之处:___________________________________________。
按正确数据处理,可得c(市售白醋)=________mol/L。
市售白醋总酸量=________g/100 mL。
课时2 酸碱中和滴定
【活动方案】
活动一:
在工业生产中,溶液的pH常常是影响产品质量和产量的关键因素,人们经常利用酸碱中和反应来调节溶液的pH;在农业生产中,不同农作物对土壤酸碱性的要求不同,有不同的最适宜生长的pH范围,人们也常用酸碱中和反应来改良土壤;在环保领域,酸性废水(或碱性废水)也是通过投入碱性物质(或酸性物质)进行中和的方法进行处理的。
活动二:
2. 酸提供的H+与碱提供的OH-的物质的量相等,即c(H+)·V酸=c(OH-)·V碱(酸为强酸,碱为强碱)。
活动三:
1. a为酸式滴定管,可盛放酸性或中性溶液,不能盛放碱性溶液;b为碱式滴定管,可盛放碱性溶液,不能盛放酸性溶液和强氧化性溶液;c既可盛放酸性溶液,也可盛放碱性溶液;若溶液中的物质见光易分解,可选择棕色的滴定管盛放。
2. (1) 活塞是否漏水
(2) 待装的酸、碱溶液分别润洗对应的酸式、碱式滴定管内壁2~3次
(3) 2~3 mL “0”刻度或“0”刻度以下
(4) 控制滴定管 锥形瓶 锥形瓶内溶液颜色变化
活动四:
1. 3.14.4 红色 黄色
4.46.2 红色 黄色
8.210.0 无色 红色
2. 7 7 4.3 9.7 变色范围
3. 黄色→橙色 红色→无色 红色→橙色
无色→粉红色 黄色→橙色 无色→粉红色
活动五:
1. V(标准)的大小:依据原理c(标准)·V(标准)=c(待测)·V(待测),得c(待测)=,因为c(标准)与V(待测)已确定,所以只要分析出不正确操作引起V(标准)的变化,即分析出结果。
2. 偏大 偏高 偏小 偏低 偏大 偏高 无变化 无影响 偏大 偏高 偏小
偏低 偏大 偏高 偏大 偏高 偏小 偏低 偏小 偏低 偏大 偏高 偏小 偏低 偏大 偏高
活动六:
3. (1) 2MnO+6H++5H2C2O4===10CO2↑+2Mn2++8H2O 紫红色 由无色变为浅红色,且半分钟内不褪色
(2) 2Na2S2O3+I2===Na2S4O6+2NaI 蓝色褪去且半分钟内不恢复原色
【课堂反馈】
1. B
2. B 实验过程中,①量取一定量的浓硫酸并稀释,所需仪器为量筒、烧杯、玻璃棒;②转移定容得待测液,所需仪器为烧杯、玻璃棒、容量瓶、胶头滴管;③移取20.00 mL待测液,用0.100 0 mol/L NaOH溶液滴定,所需仪器为酸式滴定管、碱式滴定管、锥形瓶。选项中A为容量瓶,B为分液漏斗,C为锥形瓶,D为碱式滴定管,上述操作中,不需要用到的仪器为分液漏斗。故选B。
3. B 滴定管用蒸馏水洗涤后,需用待装液润洗才能装入NaOH溶液进行滴定,A错误;随着NaOH溶液的滴入,锥形瓶内溶液中c(H+)越来越小,故pH由小变大,B正确;用酚酞作为指示剂,当锥形瓶内溶液由无色变为浅红色,且半分钟内不褪去,说明达到滴定终点,应停止滴定,C错误;达到滴定终点时,滴定管尖嘴部分有悬滴,测定结果偏大,D错误。
4. C 在滴定过程中,指示剂略多加了几滴,一般不影响实验结果,但加得太多会影响实验结果,因为酸碱指示剂也会与酸或碱反应,C正确。
5. C 酸碱中和滴定中一般不选用石蕊溶液作指示剂,①错误;酸式滴定管不能盛放碱液,②错误。故选C。
6. C 滴定前平视读数,滴定后仰视读数,造成V(标准)偏大,根据c(待测)=,可知c(待测)偏高,A错误;滴定结束后,滴定管尖嘴处有一悬挂液滴,导致消耗的V(标准)偏大,根据c(待测)=,可知c(待测)偏高,B错误;取NaOH溶液时先平视读数,后仰视读数,会使读取的V(待测)偏大,测定结果偏低,C正确;盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次,会使氢氧化钠的物质的量偏高,造成V(标准)偏大,测定结果偏高,D错误。
7. C 滴定操作时锥形瓶只需水洗干净,不能润洗,A错误;标准KMnO4溶液应用酸式滴定管量取,不用添加任何指示剂,B错误;实验时读数前仰后俯,导致读数体积小于实际消耗标准溶液体积,所测溶液浓度偏低,C正确;确定滴定终点时,溶液由浅绿色变为浅紫红色,且30 s内溶液颜色不再发生变化再读数,D错误。
8. D 由图可知,标准盐酸pH=1,说明浓度为0.1 mol/L,A正确;20 mL NaOH溶液与10 mL 0.1 mol/L盐酸恰好中和,所以NaOH溶液的浓度为0.05 mol/L,B正确;滴定终点时,俯视碱式滴定管读数,导致V(待测)偏小,据c(待测)=分析,c(待测)偏大,C正确;盐酸与NaOH溶液恰好完全反应时溶液显中性,不同指示剂变色的pH范围不同,指示剂变色时不一定恰好完全反应,D错误。
9. B 根据信息I2、I-同时存在时才能产生电流,滴定终点时无I2,电流为0,A正确;根据2S2O+I2===S4O+2I-,该反应生成的离子的物质的量增加,电流减小是因为I2浓度减小,B错误;不需要指示剂,通过电流就可以判断滴定情况,C正确;若碘液中含有38.1 g的I2,n(I2)==0.15 mol,n(Na2S2O3)=2n(I2)=0.3 mol,V=600 mL,所以硫代硫酸钠溶液的浓度为0.5 mol/L,D正确。
10. Ⅰ. (1) 酸式滴定管 烧杯 容量瓶 (2) 酚酞 (3) 0.60 (4) 滴入最后半滴NaOH溶液,溶液由无色恰好变为浅红色,并在半分钟内不褪色 Ⅲ. 第1次滴定误差明显较大,属异常值,应舍去 0.750 0 4.5
1. 了解酸碱中和滴定的原理,能利用中和滴定法测定酸或碱的物质的量浓度。
2. 认识滴定管,学会酸碱中和滴定的实验操作。
3. 能进行中和滴定相关的误差分析。
4. 学会滴定原理的迁移应用。
阅读教材,了解酸碱中和反应在工业生产、农业生产、环保领域有哪些应用?
1. 酸碱中和滴定是一种快速、准确的测量未知浓度酸碱溶液浓度的方法。
2. 将已知浓度的酸(或碱)溶液与一定体积、未知浓度的碱(或酸)溶液反应,反应完全时测定消耗的已知浓度酸(或碱)溶液的体积,根据参加反应的酸(或碱)的物质的量对应关系,即可推算出未知浓度的碱(或酸)溶液的浓度。你认为酸碱中和滴定的原理是什么?
1. 阅读教材,认识下面的滴定管。结合教材,讨论a、b分别是什么滴定管,分别可盛放什么试剂?c的活塞由聚四氟乙烯制成,这种滴定管可盛放什么溶液?若溶液中的物质见光易分解,选择什么滴定管?
2. 阅读教材,学习滴定管的使用注意事项。
(1) 检查:使用滴定管前,首先要检查____________________________。
(2) 润洗:滴定管加入酸、碱反应液之前,用____________________________
__________。
(3) 装液、调液:分别将酸、碱反应液加入酸式、碱式滴定管中,使液面位于“0”刻度以上______处;调节活塞或玻璃球,使滴定管尖嘴部分充满反应液,并使液面处于__________________,记录读数V0。
(4) 滴定:左手________________,右手摇动______________,滴定过程中滴加速度不能过快,每秒3~4滴为宜,接近终点时,应逐渐减慢滴加速度,每次1滴,眼睛注视______________________,当滴入最后半滴时,刚好使锥形瓶中的溶液变色,且在半分钟内溶液颜色不变,即到终点,记录消耗溶液的体积V1。
【特别提醒】①中和滴定终点是指示剂颜色发生突变的点,但不一定是酸碱恰好中和的点。通常有一定误差(允许误差)。②滴定停止后,必须等待1~2分钟,待附着在滴定管内壁的溶液流下后,再进行读数。③重复实验三次,并记录相关数据。
1. 了解常用酸碱指示剂的变色范围。
指示剂 pH变色范围 酸性(溶液颜色) 碱性(溶液颜色)
甲基橙
甲基红
酚酞
2. 下图是用0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L HCl溶液过程中的pH变化曲线图。
从理论上来说,强酸、强碱完全反应时,溶液的pH应为____,滴定时应选用在pH=____时变色的指示剂。但从图所示的中和滴定曲线上可以看出,当氢氧化钠溶液的体积从 19.98 mL 变为20.02 mL时,溶液的pH从________突跃至________。因此,只要选择________在这一范围内的指示剂就不会造成较大的误差。
3. 酸碱指示剂的选择。
滴定种类 选用的指示剂 达滴定终点时颜色变化 指示剂用量 滴定终点判断标准
强酸滴定强碱 甲基橙 2~3滴 当指示剂刚好变色,并在半分钟内不恢复原来的颜色,即认为已达滴定终点
酚酞
强碱滴定强酸 甲基橙
酚酞
强酸滴定弱碱 甲基橙
强碱滴定弱酸 酚酞
1. 分析误差一般根据c(待测)=进行,若用标准液滴定待测液,c标准、V待测均为定值,c待测的大小由什么决定?
2. 常见误差分析。
可能情况 操作及读数 V标准 误差判定
仪器的洗涤 或润洗 未用标准液润洗滴定管
未用待测液润洗移液管或所用的滴定管
用待测液润洗锥形瓶
洗涤后锥形瓶未干燥
滴定时 溅落液体 标准液漏滴在锥形瓶外一滴
待测液溅出锥形瓶外一滴
将移液管下部的残留液吹入锥形瓶
尖嘴处气泡 处理不当 滴前有气泡,滴后无气泡
滴前无气泡,滴后有气泡
读数不正确 滴前仰视,滴后平视
滴前平视,滴后仰视
滴前仰视,滴后俯视
达终点后,滴定管尖嘴处悬一滴标准液
1. 原理:以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质。
2. 试剂:常用于滴定的氧化剂有KMnO4、I2、K2Cr2O7等;常用于滴定的还原剂有亚铁盐、草酸、维生素C等。
3. (1) KMnO4滴定H2C2O4溶液。
原理:______________________________________。
指示剂:酸性KMnO4溶液为________(填颜色),当滴入最后一滴KMnO4溶液后,溶液颜色变化为________________________________,说明到达滴定终点。
(2) Na2S2O3滴定碘液。
原理:______________________________________。
指示剂:用________作指示剂,当滴入最后一滴Na2S2O3溶液后,溶液的颜色变化为________________________________,说明达到滴定终点。
1. 滴定实验时,必须按以下要求操作的是( )
A. 锥形瓶用蒸馏水洗净后要烘干
B. 酸式或碱式滴定管用蒸馏水洗净后,再用相应待装溶液润洗
C. 待测液一定要放在锥形瓶中,标准液一定要放在滴定管中
D. 滴定前读数要求精确,滴定管中液体凹液面的最低点必须与“0”刻度或“0”刻度以上的某一刻度相切
2. 测定浓硫酸试剂中H2SO4含量的主要操作包括:①量取一定量的浓硫酸,稀释;②转移定容得待测液;③移取20.00 mL待测液,用0.100 0 mol/L NaOH溶液滴定。上述操作中,不需要用到的仪器为( )
A B C D
3. 准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol/L NaOH溶液滴定。下列说法正确的是( )
A. 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B. 随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C. 用酚酞作为指示剂,当锥形瓶中溶液由红色变为无色时停止滴定
D. 达到滴定终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
4. 下列实验操作不会引起误差的是( )
A. 酸碱中和滴定时,用待测液润洗锥形瓶
B. 酸碱中和滴定时,用冲洗干净的滴定管直接盛装标准溶液
C. 用NaOH标准溶液测定未知浓度的盐酸时,实验时不小心多加了几滴酚酞指示剂
D. 用标准盐酸测定未知浓度NaOH溶液,实验结束时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡
5. 用已知浓度的NaOH溶液测定某硫酸的浓度,从下表中选出正确选项( )
序号 锥形瓶中溶液 滴定管中溶液 选用指示剂 选用滴定管
① 碱 酸 石蕊 甲
② 酸 碱 酚酞 甲
③ 碱 酸 甲基橙 甲
④ 酸 碱 酚酞 乙
甲 乙
A. ①② B. ②③ C. ③④ D. ②④
6. 实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作为指示剂,下列操作可能使测定结果偏低的是( )
A. 滴定前平视读数,滴定后仰视读数
B. 滴定结束后,滴定管尖嘴处有一悬挂液滴
C. 取NaOH溶液时先平视读数,后仰视读数
D. 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
7. 实验室用标准KMnO4溶液滴定未知浓度的FeSO4溶液,下列说法或操作正确的是( )
A. 盛FeSO4溶液的锥形瓶滴定前用FeSO4溶液润洗2~3次
B. 选碱式滴定管量取标准KMnO4溶液,并用淀粉 KI溶液作指示剂
C. 滴定前仰视读数,滴定后俯视读数会导致滴定结果偏低
D. 锥形瓶内溶液颜色由浅绿色变为浅紫红色,立即记下滴定管液面所在刻度
8. 用未知浓度的NaOH溶液来滴定10 mL盐酸(标准液)所得的曲线(25 ℃)如图所示。下列说法不正确的是( )
A. 标准液盐酸的浓度为0.1 mol/L
B. NaOH溶液的浓度为0.05 mol/L
C. 滴定终点时,俯视碱式滴定管读数,所测NaOH溶液浓度会偏高
D. 指示剂变色时,说明盐酸与NaOH恰好完全反应
9. 电流滴定法(电压10~100 mV)根据电流情况来判断滴定终点,如图所示,仅I2、I-同时存在时才能产生电流。可用此法来测定Na2S2O3溶液的浓度。已知:2S2O+I2===S4O+2I-。下列说法错误的是(I—127)( )
A. b为滴定终点
B. ab段电流减小是因为离子浓度降低
C. 该反应可不用指示剂,通过电流就可以判断滴定情况
D. 若碘液中含有38.1 g的I2,则硫代硫酸钠溶液的浓度为0.5 mol/L
10. 现使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤
(1) 用________________(填仪器名称,下同)量取10.00 mL 食用白醋,在________中用水稀释后转移到100 mL的________中定容,摇匀即得待测白醋溶液。
(2) 用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3) 读取盛装0.100 0 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
(4) 滴定。当_______________________________________________________
________________时,停止滴定,并记录滴定管中NaOH溶液的最终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数 1 2 3 4
V样品/mL 20.00 20.00 20.00 20.00
V消耗(NaOH)/mL 15.95 15.00 15.05 14.95
Ⅲ.数据处理与讨论
甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V= mL=15.24 mL。
指出他计算的不合理之处:___________________________________________。
按正确数据处理,可得c(市售白醋)=________mol/L。
市售白醋总酸量=________g/100 mL。
课时2 酸碱中和滴定
【活动方案】
活动一:
在工业生产中,溶液的pH常常是影响产品质量和产量的关键因素,人们经常利用酸碱中和反应来调节溶液的pH;在农业生产中,不同农作物对土壤酸碱性的要求不同,有不同的最适宜生长的pH范围,人们也常用酸碱中和反应来改良土壤;在环保领域,酸性废水(或碱性废水)也是通过投入碱性物质(或酸性物质)进行中和的方法进行处理的。
活动二:
2. 酸提供的H+与碱提供的OH-的物质的量相等,即c(H+)·V酸=c(OH-)·V碱(酸为强酸,碱为强碱)。
活动三:
1. a为酸式滴定管,可盛放酸性或中性溶液,不能盛放碱性溶液;b为碱式滴定管,可盛放碱性溶液,不能盛放酸性溶液和强氧化性溶液;c既可盛放酸性溶液,也可盛放碱性溶液;若溶液中的物质见光易分解,可选择棕色的滴定管盛放。
2. (1) 活塞是否漏水
(2) 待装的酸、碱溶液分别润洗对应的酸式、碱式滴定管内壁2~3次
(3) 2~3 mL “0”刻度或“0”刻度以下
(4) 控制滴定管 锥形瓶 锥形瓶内溶液颜色变化
活动四:
1. 3.14.4 红色 黄色
4.46.2 红色 黄色
8.210.0 无色 红色
2. 7 7 4.3 9.7 变色范围
3. 黄色→橙色 红色→无色 红色→橙色
无色→粉红色 黄色→橙色 无色→粉红色
活动五:
1. V(标准)的大小:依据原理c(标准)·V(标准)=c(待测)·V(待测),得c(待测)=,因为c(标准)与V(待测)已确定,所以只要分析出不正确操作引起V(标准)的变化,即分析出结果。
2. 偏大 偏高 偏小 偏低 偏大 偏高 无变化 无影响 偏大 偏高 偏小
偏低 偏大 偏高 偏大 偏高 偏小 偏低 偏小 偏低 偏大 偏高 偏小 偏低 偏大 偏高
活动六:
3. (1) 2MnO+6H++5H2C2O4===10CO2↑+2Mn2++8H2O 紫红色 由无色变为浅红色,且半分钟内不褪色
(2) 2Na2S2O3+I2===Na2S4O6+2NaI 蓝色褪去且半分钟内不恢复原色
【课堂反馈】
1. B
2. B 实验过程中,①量取一定量的浓硫酸并稀释,所需仪器为量筒、烧杯、玻璃棒;②转移定容得待测液,所需仪器为烧杯、玻璃棒、容量瓶、胶头滴管;③移取20.00 mL待测液,用0.100 0 mol/L NaOH溶液滴定,所需仪器为酸式滴定管、碱式滴定管、锥形瓶。选项中A为容量瓶,B为分液漏斗,C为锥形瓶,D为碱式滴定管,上述操作中,不需要用到的仪器为分液漏斗。故选B。
3. B 滴定管用蒸馏水洗涤后,需用待装液润洗才能装入NaOH溶液进行滴定,A错误;随着NaOH溶液的滴入,锥形瓶内溶液中c(H+)越来越小,故pH由小变大,B正确;用酚酞作为指示剂,当锥形瓶内溶液由无色变为浅红色,且半分钟内不褪去,说明达到滴定终点,应停止滴定,C错误;达到滴定终点时,滴定管尖嘴部分有悬滴,测定结果偏大,D错误。
4. C 在滴定过程中,指示剂略多加了几滴,一般不影响实验结果,但加得太多会影响实验结果,因为酸碱指示剂也会与酸或碱反应,C正确。
5. C 酸碱中和滴定中一般不选用石蕊溶液作指示剂,①错误;酸式滴定管不能盛放碱液,②错误。故选C。
6. C 滴定前平视读数,滴定后仰视读数,造成V(标准)偏大,根据c(待测)=,可知c(待测)偏高,A错误;滴定结束后,滴定管尖嘴处有一悬挂液滴,导致消耗的V(标准)偏大,根据c(待测)=,可知c(待测)偏高,B错误;取NaOH溶液时先平视读数,后仰视读数,会使读取的V(待测)偏大,测定结果偏低,C正确;盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次,会使氢氧化钠的物质的量偏高,造成V(标准)偏大,测定结果偏高,D错误。
7. C 滴定操作时锥形瓶只需水洗干净,不能润洗,A错误;标准KMnO4溶液应用酸式滴定管量取,不用添加任何指示剂,B错误;实验时读数前仰后俯,导致读数体积小于实际消耗标准溶液体积,所测溶液浓度偏低,C正确;确定滴定终点时,溶液由浅绿色变为浅紫红色,且30 s内溶液颜色不再发生变化再读数,D错误。
8. D 由图可知,标准盐酸pH=1,说明浓度为0.1 mol/L,A正确;20 mL NaOH溶液与10 mL 0.1 mol/L盐酸恰好中和,所以NaOH溶液的浓度为0.05 mol/L,B正确;滴定终点时,俯视碱式滴定管读数,导致V(待测)偏小,据c(待测)=分析,c(待测)偏大,C正确;盐酸与NaOH溶液恰好完全反应时溶液显中性,不同指示剂变色的pH范围不同,指示剂变色时不一定恰好完全反应,D错误。
9. B 根据信息I2、I-同时存在时才能产生电流,滴定终点时无I2,电流为0,A正确;根据2S2O+I2===S4O+2I-,该反应生成的离子的物质的量增加,电流减小是因为I2浓度减小,B错误;不需要指示剂,通过电流就可以判断滴定情况,C正确;若碘液中含有38.1 g的I2,n(I2)==0.15 mol,n(Na2S2O3)=2n(I2)=0.3 mol,V=600 mL,所以硫代硫酸钠溶液的浓度为0.5 mol/L,D正确。
10. Ⅰ. (1) 酸式滴定管 烧杯 容量瓶 (2) 酚酞 (3) 0.60 (4) 滴入最后半滴NaOH溶液,溶液由无色恰好变为浅红色,并在半分钟内不褪色 Ⅲ. 第1次滴定误差明显较大,属异常值,应舍去 0.750 0 4.5
