人教版高中化学选择性必修2第二章分子结构与性质第三节第一课时共价键的极性课件(共44张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修2第二章分子结构与性质第三节第一课时共价键的极性课件(共44张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-18 00:00:00 | ||
图片预览











文档简介
(共44张PPT)
第二章 分子结构与性质
第三节 分子结构与物质的性质
第一课时 共价键的极性
学习目标:1.了解共价键的极性。2.了解分子的极性及产生极性的原因。3.根据分子 结构特点和键的极性判断分子极性,并对分子性质及应用作出解释。
第*页
研习任务一 键的极性和分子的极性
教材 认知
1. 键的极性
极性键与非极性键的比较
共价键 极性共价键 非极性共价键
成键原子 元素的原子 元素的原子
电子对 偏移 偏移
成键原子的 电性 一个原子呈正电性(δ+),一个原子呈负 电性(δ-) 电中性
电负性 电负性不同 电负性相同
示例 H2、O2、Cl2
不同种
同种
发生
不发生
2. 分子的极性
非极性分子和极性分子的比较
重合
正电
负电
非极性
极
性
非极性
极性
对称
不对称
3. 键的极性与分子的极性之间的关系
√
探究 活动
[问题探讨]
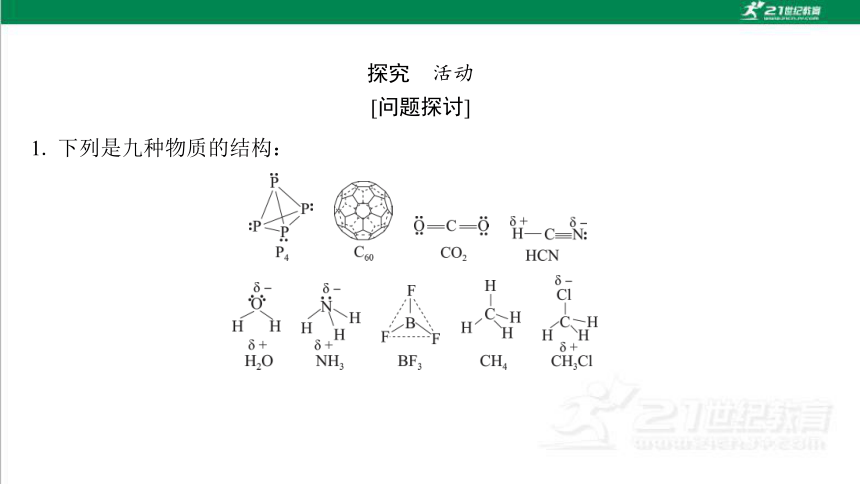
1. 下列是九种物质的结构:
(1)上述九种物质中含非极性共价键的物质有哪些?
(2)上述九种物质中,哪些是非极性分子?哪些是极性分子?
提示:P4、C60、CO2、BF3、CH4为非极性分子,HCN、H2O、NH3、CH3Cl为 极性分子。
提示: P4中的P—P为非极性共价键,C60中的C—C为非极性共价键。
2. 已知H2O2的分子空间结构可在二面角中表示,如图所示:
(1)H2O2分子中共价键的类型有哪些?
提示:H2O2分子中H—O为极性共价键,O—O为非极性共价键。
(2)H2O2分子中正电重心和负电重心是否重合?H2O2属于极性分子还是非极性 分子?
提示:不重合;H2O2属于极性分子。
应用 体验
A. CH4 B. CO2 C. SO3 D. NH3
解析:CH4空间结构为正四面体,结构对称,属于非极性分子,故A错误;CO2空间 结构为直线形,结构对称,属于非极性分子,故B错误;SO3空间结构为平面三角 形,结构对称,属于非极性分子,故C错误;NH3空间结构为三角锥形,结构不对 称,正电重心和负电重心不重合,属于极性分子,故D正确。
D
A. CH4和Br2 B. NH3和H2S
C. BF3和CO2 D. BeCl2和HCl
解析:CH4是由极性键构成的非极性分子,单质溴是由非极性键构成的非极性分子, 故A不符合题意;氨气和硫化氢分子都是由极性键构成的极性分子,故B符合题意; BF3和二氧化碳都是由极性键构成的非极性分子,故C不符合题意;氯化铍是由极性 键构成的非极性分子,HCl是由极性键构成的极性分子,故D不符合题意。
B
3. 在①HF、②H2O、③NH3、④CS2、⑤CH4、⑥N2、⑦BF3分子中:
(1)以非极性键结合的非极性分子是 (填序号,下同)。
解析:(1)以非极性键结合的非极性分子是N2。
(2)以极性键结合的具有直线形结构的非极性分子是 。
解析:(2)以极性键结合的具有直线形结构的非极性分子是CS2。
(3)以极性键结合的具有正四面体形结构的非极性分子是 。
解析:(3)以极性键结合的具有正四面体形结构的非极性分子是CH4。
(4)以极性键结合的具有三角锥形结构的极性分子是 。
解析:(4)以极性键结合的具有三角锥形结构的极性分子是NH3。
(5)以极性键结合的具有sp3杂化轨道和V形结构的分子是 。
解析:(5)以极性键结合的具有sp3杂化轨道和V形结构的分子是H2O。
⑥
④
⑤
③
②
(6)以极性键结合的具有sp2杂化轨道结构的分子是 。
⑦
解析:(6)以极性键结合的具有sp2杂化轨道结构的分子是BF3。
4. (1)判断AB n 型分子的极性。
①完成下表:
直线形
V形
三角锥
形
平面正
三角形
正四面
体形
重合
不重合
不重合
重合
重合
非极性
分子
极性分
子
极性分
子
非极性
分子
非极性
分子
②认真研究①中各分子中心原子的化合价,寻找中心原子的化合价与分子极性 的关系。
。
(2)探究判断下列分子是极性分子还是非极性分子。
极性分子: (填序号,下同);
非极性分子: 。
中心原子A的化合价呈最高价的AB n 型分子为非极性分子,否则为极性分子
④
①②③⑤
分子极性的判断方法
1. 键的极性法
2. 中心原子的化合价法
AB m 型分子中,中心原子的化合价的绝对值等于该元素的价电子数时,该分子为非极 性分子,此时分子的空间结构对称;若中心原子的化合价的绝对值不等于其价电子 数,则分子的空间结构不对称,其分子为极性分子,具体实例如下:
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
中心原子化合价绝对值 3 4 5 6 2 3 4
中心原子价电子数 3 4 5 6 6 5 6
分子极性 非极性 非极性 非极性 非极性 极性 极性 极性
3. AB n 型分子极性的经验规律
若中心原子有孤电子对,则为极性分子;若无孤电子对,则为非极性分子。
如CS2、BF3、SO3、CH4为非极性分子;H2S、SO2、NH3、PCl3为极性分子。
第*页
研习任务二 键的极性对化学性质的影响
教材 认知
键的极性对化学性质的影响
(1)羧酸酸性与p Ka的关系
羧酸的酸性可用p Ka的大小来衡量,p Ka越小,酸性越 。
(2)羧酸的酸性大小与分子组成和结构的关系
①酸性强弱顺序
a.氟乙酸 氯乙酸 溴乙酸 碘乙酸。
b.三氯乙酸 二氯乙酸 氯乙酸。
c.三氟乙酸 三氯乙酸 三溴乙酸 三碘乙酸。
d.甲酸 乙酸 丙酸 丁酸。
强
>
>
>
>
>
>
>
>
>
>
>
②原因解释(以三氟乙酸>三氯乙酸为例)
由于氟的电负性大于氯,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C— 的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出H+,故酸性:三氟 乙酸>三氯乙酸。
③烷基(R—)对羧酸酸性的影响
烷基(R—)是推电子基团,烷基越长推电子效应越大,使羧基中的羟基的极性越 小,羧酸的酸性越弱,故酸性:甲酸>乙酸>丙酸>……
探究 活动
[问题探讨]
1. CH3CH2OH、H2O分别与钠反应,哪个反应更剧烈?解释原因。
提示:水与钠反应更剧烈,烷基是推电子基团,使醇分子中的氢氧键的极性小于水分 子中的氢氧键的极性。
2. 三氟乙酸(CF3COOH)的酸性远强于乙酸(CH3COOH)的原因是什么?
提示:由于F的电负性较大,—CF3是吸电子基团,使羧基中羟基的极性更大,更易电 离出H+。
应用 体验
A. HCOOH B. HOCOOH
C. CH3COOH D. C6H13COOH
解析:推电子效应:—C6H13>—CH3>—H,HOCOOH是碳酸,故酸性最强的是 HCOOH。
A
①乙酸(CH3COOH) ②氯乙酸(CH2ClCOOH)
③三氯乙酸(CCl3COOH) ④三氟乙酸(CF3COOH)
A. ②①④③ B. ①②③④
C. ④③②① D. ③②④①
解析:由于电负性:F>Cl>H,则键的极性:C—F>C—Cl>C—H,故三氟乙酸中 羧基中的羟基的极性最大,最易电离出氢离子,酸性最强;乙酸中羧基中的羟基的极 性最小,酸性最弱。酸性强弱顺序:CF3COOH>CCl3COOH>CH2ClCOOH> CH3COOH,C正确。
C
3. CH3COOH是一种弱酸,而氯乙酸(ClCH2COOH)的酸性强于CH3COOH,这是因 为—Cl是一种强吸电子基团,能使—OH上的H原子具有更大的活泼性;有的基团属于 推电子基团,能减弱—OH上H原子的活泼性;这些作用统称为“诱导效应”。试依 据上述规律填空:
(1)HCOOH显酸性,而H2O显中性,这是由于HCOOH分子中存在 (填 “吸”或“推”)电子基团,这种基团是 。
解析:(1)HCOOH显酸性,H2O显中性,说明HCOOH分子中存在强吸电子基团, 能使—OH上的H原子活泼性增强而使该物质的酸性大于水,HCOOH中含有—CHO, 属于强吸电子基团。
吸
—CHO
(2)CH3COOH的酸性弱于HCOOH,这是由于CH3COOH分子中存在 (填 “吸”或“推”)电子基团,这种基团是 。
解析:(2)CH3COOH的酸性弱于HCOOH,说明CH3COOH分子中存在推电子基 团,能减弱—OH上H原子的活泼性而使该物质的酸性减弱,CH3COOH中含有— CH3,—CH3属于推电子基团。
(3)—C6H5属于吸电子基团,故C6H5COOH的酸性比CH3COOH的酸性 (填 “强”或“弱”)。
解析:(3)—C6H5属于吸电子基团,—CH3属于推电子基团,故C6H5COOH的酸性 比CH3COOH的酸性强。
推
—CH3
强
第*页
课堂强研习 合作学习 精研重难
课时作业
A. 以非极性键结合起来的双原子分子一定是非极性分子
B. BCl3与NCl3均为三角锥形结构,均为极性分子
C. 非极性分子只能是双原子单质分子
D. 非极性分子中一定含有非极性键
解析:以非极性键结合起来的双原子分子一定是非极性分子,A正确;BCl3为平面三 角形结构,为非极性分子,B错误;正电荷重心与负电荷重心重合的分子属于非极性 分子,某些共价化合物,如CH4、C2H4等也是非极性分子,C错误;非极性分子中不 一定含有非极性键,如CH4、CO2等,D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
A. ①②④ B. ②④⑤
C. ③⑤⑥ D. ①②⑤
解析:非极性分子中电荷的空间分布是均匀的,①CO2呈直线形;②CCl4呈正四面体 形;④BH3呈平面三角形,三者属非极性分子,故A正确;③NH3呈三角锥形;⑤H2O 呈V形;⑥HBr是双原子分子,故③⑤⑥为极性分子,B、C、D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 分子中不能含有氢原子
B. 在AB n 分子中A原子没有孤电子对(或A原子最外层电子均已成键)
C. 在AB n 分子中每个共价键的键长和键能都相等
D. 分子中所有原子在同一平面内
解析:由题意可知,甲烷是含有氢原子的非极性分子,故A错误;由题意可知,非极 性分子中中心原子A的最外层电子均已成键,都不含孤电子对,故B正确;氨分子为 极性分子,分子中氮氢键的键长和键能都相等,故C错误;水分子、硫化氢分子和二 氧化硫都是极性分子,分子中所有原子在同一平面内,故D错误。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 分子的正、负电中心不重合
B. H2O2分子内既含极性键又含非极性键
C. H2O2是极性分子
D. H2O2是非极性分子
解析:由题图知,H2O2分子的空间结构是二面角形,正、负电中心不重合,为极性分 子,A、C正确,D错误;H2O2是共价化合物,氢原子与氧原子之间形成极性共价 键,氧原子和氧原子之间形成非极性共价键,B正确。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 卤化氢分子中,卤素的非金属性越强,共价键的极性也越强,稳定性也越强
B. 以极性键结合的分子,不一定是极性分子
C. 判断A2B或AB2型分子是否为极性分子必须知道该分子的空间结构
D. 非极性分子中,各原子间都应以非极性键结合
解析:非金属性越强,对应氢化物越稳定,键的极性越强,则卤化氢分子中,卤素的 非金属性越强,共价键的极性越强,稳定性也越强,故A正确;以极性键结合的分 子,可能结构对称,如甲烷、二氧化碳等均为只含极性键的非极性分子,故B正确; 判断A2B或AB2型分子为极性分子,正、负电荷的中心不重合,结构一定不对称,即 判断分子是否为极性分子必须知道该分子的空间结构,故C正确;非极性分子中,可 能只含极性键,如甲烷,故D错误。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 分子中只有极性键
B. CH4分子中含有极性共价键,是极性分子
C. CO2分子中的化学键为非极性键
D. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
D
1
2
3
4
5
6
7
8
9
10
11
12
13
p Ka 4.88 4.76 3.75 2.86 1.29 0.65 0.23
羧酸 丙酸 乙酸 甲酸 氯乙酸 二氯乙酸 三氯乙酸 三氟乙酸
A. 相对分子质量越大,羧酸的酸性越强
B. 羧酸的酸性大小与分子中氢原子数目有关
C. 连接羧基的烷基越大,羧酸的酸性越强
D. 羧酸的酸性强弱与其分子的组成和结构有关
D
解析:p Ka是表示 Ka的负对数,p Ka越大,酸性越弱。羧酸的酸性强弱与其分子的组 成和结构有关,与相对分子质量和分子中氢原子数目无关,故A、B错误,D正确;羧 基所连基团的极性越强,如—CF3,羧酸的酸性越强,而烷基越大,酸性越弱,故C 错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 乙二酸的酸性强于己二酸
B. 一元酸的酸性:一氯乙酸>二氯乙酸
C. 由酸性ClCH2COOH>CH3COOH,可知酸性FCH2COOH>CH3COOH
D. 氮气稳定性强于白磷(P4)的原因是N≡N的键能大于P—P的键能
B
1
2
3
4
5
6
7
8
9
10
11
12
13
解析:—Cl为吸电子基团,C—Cl个数越多,使得羧基中的羟基极性越大,酸性越 强,一元酸的酸性:一氯乙酸<二氯乙酸,B错误;—F和—Cl均为吸电子基团,甲 基为推电子基团,F—C的极性大于Cl—C的极性,使得FCH2COOH中的羟基的极性> ClCH2COOH中的羟基的极性>CH3COOH中的羟基的极性,从而使得酸性: FCH2COOH>ClCH2COOH>CH3COOH,C正确;氮气中的N≡N键能较大,导致氮气 化学性质稳定,一般不易与其他物质反应,而白磷中的P—P的键能较小,使白磷性质 活泼,易发生自燃等化学变化,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 分子中只含极性键
B. SF6是极性分子
C. S与F之间共用电子对偏向S
D. S原子满足8电子稳定结构
解析:SF6中的键为6个S—F键,为极性键,此分子中只含极性键,故A正确;SF6是 结构对称、正负电荷重心重合的分子,为非极性分子,故B错误;由于F的电负性比S 的大,S与F之间共用电子对偏向F,故C错误;由SF6的结构式可知,化合物中S元素 化合价+价电子数=6+6=12,则S原子不是8电子稳定结构,故D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 假设为平面四边形,则该分子一定为非极性分子
B. 假设为四面体,则该分子一定为非极性分子
C. 假设为平面四边形,则该分子可能为非极性分子
D. 假设为四面体,则该分子可能为非极性分子
C
1
2
3
4
5
6
7
8
9
10
11
12
13
解析:
1
2
3
4
5
6
7
8
9
10
11
12
13
A. H2O2中存在非极性共价键,是非极性分子
B. 反应Ⅰ中涉及极性键的断裂和非极性键的形成
C. H2O分子的VSEPR模型为V形
D. H2O是非极性分子
B
解析:H2O2是极性分子,A错误;反应Ⅰ是H2O生成H2和H2O2,涉及极性键H—O的断 裂和非极性键H—H、O—O的形成,B正确;H2O的中心原子O的价层电子对数为4, VSEPR模型为(正)四面体形,C错误;H2O是极性分子,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 其分子中各原子最外层都达到了8电子稳定结构
B. 其分子中只含极性键
C. 其分子是非极性分子
D. 其与化合物S2N2互为同素异形体
解析:硫原子最外层有6个电子,若形成两个共价单键,则达到8电子稳定结构,氮原 子最外层有5个电子,若形成3个共价单键,则达到8电子稳定结构,据图可知,A项 正确;该物质的分子中既含S—N极性键,也含N—N非极性键,B项错误;该分子 正、负电荷中心不重合,属于极性分子,C项错误;同素异形体描述的对象是单质, 而不是化合物,D项错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
13. 在极性分子中,正电荷重心与负电荷重心间的距离称为偶极长,通常用 d 表示。 极性分子的极性强弱与偶极长和电荷量( q )有关,一般用偶极矩(μ)来衡量。分 子的偶极矩是偶极长和电荷量的乘积,即μ= dq 。在非极性分子中,其正、负电荷重 心重合,故μ为0。试回答下列问题:
(1)HCl、CS2、H2S、SO2四种分子中μ=0的有 。
解析:(1)HCl是由极性键形成的双原子极性分子;根据价电子对互斥理论可知, CS2是直线形分子,正、负电荷重心重合,为非极性分子,其偶极矩为0;H2S、SO2 都是V形结构,是极性分子,其μ>0。
CS2
1
2
3
4
5
6
7
8
9
10
11
12
13
(2)实验测得:μ(PF3)=1.03、μ(BCl3)=0。
①由此可知,PF3分子的空间结构为 。
②BCl3分子的空间结构为 , 中心原子的杂化方式为 。
三角锥形
平面正三角形
sp2杂化
解析:(2)①μ(PF3)=1.03说明PF3是极性分子,则PF3是三角锥形结构。②μ (BCl3)=0,说明BCl3是非极性分子,其正、负电荷重心重合,应该是平面正三角 形结构;中心原子B与3个Cl原子形成3个共价键(没有孤电子对),即B的杂化方式 是sp2杂化。
1
2
3
4
5
6
7
8
9
10
11
12
13
(3)治癌药物Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分 别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的μ>0, 淡黄色化合物的μ=0。试写出两种同分异构体的结构简 式: 、 , 在水中溶解度较大的是 (填结构简 式)。
1
2
3
4
5
6
7
8
9
10
11
12
13
解析:(3)根据题意,Pt(NH3)2Cl2具有平面四边形结构,若μ=0,则为非极性分 子,NH3和Cl分别对称分布在四边形的4个顶点上,即正、负电荷重心重合,故淡黄 色化合物是 ;若μ>0,则为极性分子,NH3和Cl在四边形的4个顶点上的分布 是不对称的,即正、负电荷重心不重合,故棕黄色化合物是 。根据“相似相 溶”规律,水是极性分子,因此属于极性分子的溶质易溶解在水中,即在水中溶解度 较大的是棕黄色化合物,其结构简式为 。
1
2
3
4
5
6
7
8
9
10
11
12
13
第二章 分子结构与性质
第三节 分子结构与物质的性质
第一课时 共价键的极性
学习目标:1.了解共价键的极性。2.了解分子的极性及产生极性的原因。3.根据分子 结构特点和键的极性判断分子极性,并对分子性质及应用作出解释。
第*页
研习任务一 键的极性和分子的极性
教材 认知
1. 键的极性
极性键与非极性键的比较
共价键 极性共价键 非极性共价键
成键原子 元素的原子 元素的原子
电子对 偏移 偏移
成键原子的 电性 一个原子呈正电性(δ+),一个原子呈负 电性(δ-) 电中性
电负性 电负性不同 电负性相同
示例 H2、O2、Cl2
不同种
同种
发生
不发生
2. 分子的极性
非极性分子和极性分子的比较
重合
正电
负电
非极性
极
性
非极性
极性
对称
不对称
3. 键的极性与分子的极性之间的关系
√
探究 活动
[问题探讨]
1. 下列是九种物质的结构:
(1)上述九种物质中含非极性共价键的物质有哪些?
(2)上述九种物质中,哪些是非极性分子?哪些是极性分子?
提示:P4、C60、CO2、BF3、CH4为非极性分子,HCN、H2O、NH3、CH3Cl为 极性分子。
提示: P4中的P—P为非极性共价键,C60中的C—C为非极性共价键。
2. 已知H2O2的分子空间结构可在二面角中表示,如图所示:
(1)H2O2分子中共价键的类型有哪些?
提示:H2O2分子中H—O为极性共价键,O—O为非极性共价键。
(2)H2O2分子中正电重心和负电重心是否重合?H2O2属于极性分子还是非极性 分子?
提示:不重合;H2O2属于极性分子。
应用 体验
A. CH4 B. CO2 C. SO3 D. NH3
解析:CH4空间结构为正四面体,结构对称,属于非极性分子,故A错误;CO2空间 结构为直线形,结构对称,属于非极性分子,故B错误;SO3空间结构为平面三角 形,结构对称,属于非极性分子,故C错误;NH3空间结构为三角锥形,结构不对 称,正电重心和负电重心不重合,属于极性分子,故D正确。
D
A. CH4和Br2 B. NH3和H2S
C. BF3和CO2 D. BeCl2和HCl
解析:CH4是由极性键构成的非极性分子,单质溴是由非极性键构成的非极性分子, 故A不符合题意;氨气和硫化氢分子都是由极性键构成的极性分子,故B符合题意; BF3和二氧化碳都是由极性键构成的非极性分子,故C不符合题意;氯化铍是由极性 键构成的非极性分子,HCl是由极性键构成的极性分子,故D不符合题意。
B
3. 在①HF、②H2O、③NH3、④CS2、⑤CH4、⑥N2、⑦BF3分子中:
(1)以非极性键结合的非极性分子是 (填序号,下同)。
解析:(1)以非极性键结合的非极性分子是N2。
(2)以极性键结合的具有直线形结构的非极性分子是 。
解析:(2)以极性键结合的具有直线形结构的非极性分子是CS2。
(3)以极性键结合的具有正四面体形结构的非极性分子是 。
解析:(3)以极性键结合的具有正四面体形结构的非极性分子是CH4。
(4)以极性键结合的具有三角锥形结构的极性分子是 。
解析:(4)以极性键结合的具有三角锥形结构的极性分子是NH3。
(5)以极性键结合的具有sp3杂化轨道和V形结构的分子是 。
解析:(5)以极性键结合的具有sp3杂化轨道和V形结构的分子是H2O。
⑥
④
⑤
③
②
(6)以极性键结合的具有sp2杂化轨道结构的分子是 。
⑦
解析:(6)以极性键结合的具有sp2杂化轨道结构的分子是BF3。
4. (1)判断AB n 型分子的极性。
①完成下表:
直线形
V形
三角锥
形
平面正
三角形
正四面
体形
重合
不重合
不重合
重合
重合
非极性
分子
极性分
子
极性分
子
非极性
分子
非极性
分子
②认真研究①中各分子中心原子的化合价,寻找中心原子的化合价与分子极性 的关系。
。
(2)探究判断下列分子是极性分子还是非极性分子。
极性分子: (填序号,下同);
非极性分子: 。
中心原子A的化合价呈最高价的AB n 型分子为非极性分子,否则为极性分子
④
①②③⑤
分子极性的判断方法
1. 键的极性法
2. 中心原子的化合价法
AB m 型分子中,中心原子的化合价的绝对值等于该元素的价电子数时,该分子为非极 性分子,此时分子的空间结构对称;若中心原子的化合价的绝对值不等于其价电子 数,则分子的空间结构不对称,其分子为极性分子,具体实例如下:
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
中心原子化合价绝对值 3 4 5 6 2 3 4
中心原子价电子数 3 4 5 6 6 5 6
分子极性 非极性 非极性 非极性 非极性 极性 极性 极性
3. AB n 型分子极性的经验规律
若中心原子有孤电子对,则为极性分子;若无孤电子对,则为非极性分子。
如CS2、BF3、SO3、CH4为非极性分子;H2S、SO2、NH3、PCl3为极性分子。
第*页
研习任务二 键的极性对化学性质的影响
教材 认知
键的极性对化学性质的影响
(1)羧酸酸性与p Ka的关系
羧酸的酸性可用p Ka的大小来衡量,p Ka越小,酸性越 。
(2)羧酸的酸性大小与分子组成和结构的关系
①酸性强弱顺序
a.氟乙酸 氯乙酸 溴乙酸 碘乙酸。
b.三氯乙酸 二氯乙酸 氯乙酸。
c.三氟乙酸 三氯乙酸 三溴乙酸 三碘乙酸。
d.甲酸 乙酸 丙酸 丁酸。
强
>
>
>
>
>
>
>
>
>
>
>
②原因解释(以三氟乙酸>三氯乙酸为例)
由于氟的电负性大于氯,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C— 的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出H+,故酸性:三氟 乙酸>三氯乙酸。
③烷基(R—)对羧酸酸性的影响
烷基(R—)是推电子基团,烷基越长推电子效应越大,使羧基中的羟基的极性越 小,羧酸的酸性越弱,故酸性:甲酸>乙酸>丙酸>……
探究 活动
[问题探讨]
1. CH3CH2OH、H2O分别与钠反应,哪个反应更剧烈?解释原因。
提示:水与钠反应更剧烈,烷基是推电子基团,使醇分子中的氢氧键的极性小于水分 子中的氢氧键的极性。
2. 三氟乙酸(CF3COOH)的酸性远强于乙酸(CH3COOH)的原因是什么?
提示:由于F的电负性较大,—CF3是吸电子基团,使羧基中羟基的极性更大,更易电 离出H+。
应用 体验
A. HCOOH B. HOCOOH
C. CH3COOH D. C6H13COOH
解析:推电子效应:—C6H13>—CH3>—H,HOCOOH是碳酸,故酸性最强的是 HCOOH。
A
①乙酸(CH3COOH) ②氯乙酸(CH2ClCOOH)
③三氯乙酸(CCl3COOH) ④三氟乙酸(CF3COOH)
A. ②①④③ B. ①②③④
C. ④③②① D. ③②④①
解析:由于电负性:F>Cl>H,则键的极性:C—F>C—Cl>C—H,故三氟乙酸中 羧基中的羟基的极性最大,最易电离出氢离子,酸性最强;乙酸中羧基中的羟基的极 性最小,酸性最弱。酸性强弱顺序:CF3COOH>CCl3COOH>CH2ClCOOH> CH3COOH,C正确。
C
3. CH3COOH是一种弱酸,而氯乙酸(ClCH2COOH)的酸性强于CH3COOH,这是因 为—Cl是一种强吸电子基团,能使—OH上的H原子具有更大的活泼性;有的基团属于 推电子基团,能减弱—OH上H原子的活泼性;这些作用统称为“诱导效应”。试依 据上述规律填空:
(1)HCOOH显酸性,而H2O显中性,这是由于HCOOH分子中存在 (填 “吸”或“推”)电子基团,这种基团是 。
解析:(1)HCOOH显酸性,H2O显中性,说明HCOOH分子中存在强吸电子基团, 能使—OH上的H原子活泼性增强而使该物质的酸性大于水,HCOOH中含有—CHO, 属于强吸电子基团。
吸
—CHO
(2)CH3COOH的酸性弱于HCOOH,这是由于CH3COOH分子中存在 (填 “吸”或“推”)电子基团,这种基团是 。
解析:(2)CH3COOH的酸性弱于HCOOH,说明CH3COOH分子中存在推电子基 团,能减弱—OH上H原子的活泼性而使该物质的酸性减弱,CH3COOH中含有— CH3,—CH3属于推电子基团。
(3)—C6H5属于吸电子基团,故C6H5COOH的酸性比CH3COOH的酸性 (填 “强”或“弱”)。
解析:(3)—C6H5属于吸电子基团,—CH3属于推电子基团,故C6H5COOH的酸性 比CH3COOH的酸性强。
推
—CH3
强
第*页
课堂强研习 合作学习 精研重难
课时作业
A. 以非极性键结合起来的双原子分子一定是非极性分子
B. BCl3与NCl3均为三角锥形结构,均为极性分子
C. 非极性分子只能是双原子单质分子
D. 非极性分子中一定含有非极性键
解析:以非极性键结合起来的双原子分子一定是非极性分子,A正确;BCl3为平面三 角形结构,为非极性分子,B错误;正电荷重心与负电荷重心重合的分子属于非极性 分子,某些共价化合物,如CH4、C2H4等也是非极性分子,C错误;非极性分子中不 一定含有非极性键,如CH4、CO2等,D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
A. ①②④ B. ②④⑤
C. ③⑤⑥ D. ①②⑤
解析:非极性分子中电荷的空间分布是均匀的,①CO2呈直线形;②CCl4呈正四面体 形;④BH3呈平面三角形,三者属非极性分子,故A正确;③NH3呈三角锥形;⑤H2O 呈V形;⑥HBr是双原子分子,故③⑤⑥为极性分子,B、C、D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 分子中不能含有氢原子
B. 在AB n 分子中A原子没有孤电子对(或A原子最外层电子均已成键)
C. 在AB n 分子中每个共价键的键长和键能都相等
D. 分子中所有原子在同一平面内
解析:由题意可知,甲烷是含有氢原子的非极性分子,故A错误;由题意可知,非极 性分子中中心原子A的最外层电子均已成键,都不含孤电子对,故B正确;氨分子为 极性分子,分子中氮氢键的键长和键能都相等,故C错误;水分子、硫化氢分子和二 氧化硫都是极性分子,分子中所有原子在同一平面内,故D错误。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 分子的正、负电中心不重合
B. H2O2分子内既含极性键又含非极性键
C. H2O2是极性分子
D. H2O2是非极性分子
解析:由题图知,H2O2分子的空间结构是二面角形,正、负电中心不重合,为极性分 子,A、C正确,D错误;H2O2是共价化合物,氢原子与氧原子之间形成极性共价 键,氧原子和氧原子之间形成非极性共价键,B正确。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 卤化氢分子中,卤素的非金属性越强,共价键的极性也越强,稳定性也越强
B. 以极性键结合的分子,不一定是极性分子
C. 判断A2B或AB2型分子是否为极性分子必须知道该分子的空间结构
D. 非极性分子中,各原子间都应以非极性键结合
解析:非金属性越强,对应氢化物越稳定,键的极性越强,则卤化氢分子中,卤素的 非金属性越强,共价键的极性越强,稳定性也越强,故A正确;以极性键结合的分 子,可能结构对称,如甲烷、二氧化碳等均为只含极性键的非极性分子,故B正确; 判断A2B或AB2型分子为极性分子,正、负电荷的中心不重合,结构一定不对称,即 判断分子是否为极性分子必须知道该分子的空间结构,故C正确;非极性分子中,可 能只含极性键,如甲烷,故D错误。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 分子中只有极性键
B. CH4分子中含有极性共价键,是极性分子
C. CO2分子中的化学键为非极性键
D. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
D
1
2
3
4
5
6
7
8
9
10
11
12
13
p Ka 4.88 4.76 3.75 2.86 1.29 0.65 0.23
羧酸 丙酸 乙酸 甲酸 氯乙酸 二氯乙酸 三氯乙酸 三氟乙酸
A. 相对分子质量越大,羧酸的酸性越强
B. 羧酸的酸性大小与分子中氢原子数目有关
C. 连接羧基的烷基越大,羧酸的酸性越强
D. 羧酸的酸性强弱与其分子的组成和结构有关
D
解析:p Ka是表示 Ka的负对数,p Ka越大,酸性越弱。羧酸的酸性强弱与其分子的组 成和结构有关,与相对分子质量和分子中氢原子数目无关,故A、B错误,D正确;羧 基所连基团的极性越强,如—CF3,羧酸的酸性越强,而烷基越大,酸性越弱,故C 错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 乙二酸的酸性强于己二酸
B. 一元酸的酸性:一氯乙酸>二氯乙酸
C. 由酸性ClCH2COOH>CH3COOH,可知酸性FCH2COOH>CH3COOH
D. 氮气稳定性强于白磷(P4)的原因是N≡N的键能大于P—P的键能
B
1
2
3
4
5
6
7
8
9
10
11
12
13
解析:—Cl为吸电子基团,C—Cl个数越多,使得羧基中的羟基极性越大,酸性越 强,一元酸的酸性:一氯乙酸<二氯乙酸,B错误;—F和—Cl均为吸电子基团,甲 基为推电子基团,F—C的极性大于Cl—C的极性,使得FCH2COOH中的羟基的极性> ClCH2COOH中的羟基的极性>CH3COOH中的羟基的极性,从而使得酸性: FCH2COOH>ClCH2COOH>CH3COOH,C正确;氮气中的N≡N键能较大,导致氮气 化学性质稳定,一般不易与其他物质反应,而白磷中的P—P的键能较小,使白磷性质 活泼,易发生自燃等化学变化,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 分子中只含极性键
B. SF6是极性分子
C. S与F之间共用电子对偏向S
D. S原子满足8电子稳定结构
解析:SF6中的键为6个S—F键,为极性键,此分子中只含极性键,故A正确;SF6是 结构对称、正负电荷重心重合的分子,为非极性分子,故B错误;由于F的电负性比S 的大,S与F之间共用电子对偏向F,故C错误;由SF6的结构式可知,化合物中S元素 化合价+价电子数=6+6=12,则S原子不是8电子稳定结构,故D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 假设为平面四边形,则该分子一定为非极性分子
B. 假设为四面体,则该分子一定为非极性分子
C. 假设为平面四边形,则该分子可能为非极性分子
D. 假设为四面体,则该分子可能为非极性分子
C
1
2
3
4
5
6
7
8
9
10
11
12
13
解析:
1
2
3
4
5
6
7
8
9
10
11
12
13
A. H2O2中存在非极性共价键,是非极性分子
B. 反应Ⅰ中涉及极性键的断裂和非极性键的形成
C. H2O分子的VSEPR模型为V形
D. H2O是非极性分子
B
解析:H2O2是极性分子,A错误;反应Ⅰ是H2O生成H2和H2O2,涉及极性键H—O的断 裂和非极性键H—H、O—O的形成,B正确;H2O的中心原子O的价层电子对数为4, VSEPR模型为(正)四面体形,C错误;H2O是极性分子,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 其分子中各原子最外层都达到了8电子稳定结构
B. 其分子中只含极性键
C. 其分子是非极性分子
D. 其与化合物S2N2互为同素异形体
解析:硫原子最外层有6个电子,若形成两个共价单键,则达到8电子稳定结构,氮原 子最外层有5个电子,若形成3个共价单键,则达到8电子稳定结构,据图可知,A项 正确;该物质的分子中既含S—N极性键,也含N—N非极性键,B项错误;该分子 正、负电荷中心不重合,属于极性分子,C项错误;同素异形体描述的对象是单质, 而不是化合物,D项错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
13. 在极性分子中,正电荷重心与负电荷重心间的距离称为偶极长,通常用 d 表示。 极性分子的极性强弱与偶极长和电荷量( q )有关,一般用偶极矩(μ)来衡量。分 子的偶极矩是偶极长和电荷量的乘积,即μ= dq 。在非极性分子中,其正、负电荷重 心重合,故μ为0。试回答下列问题:
(1)HCl、CS2、H2S、SO2四种分子中μ=0的有 。
解析:(1)HCl是由极性键形成的双原子极性分子;根据价电子对互斥理论可知, CS2是直线形分子,正、负电荷重心重合,为非极性分子,其偶极矩为0;H2S、SO2 都是V形结构,是极性分子,其μ>0。
CS2
1
2
3
4
5
6
7
8
9
10
11
12
13
(2)实验测得:μ(PF3)=1.03、μ(BCl3)=0。
①由此可知,PF3分子的空间结构为 。
②BCl3分子的空间结构为 , 中心原子的杂化方式为 。
三角锥形
平面正三角形
sp2杂化
解析:(2)①μ(PF3)=1.03说明PF3是极性分子,则PF3是三角锥形结构。②μ (BCl3)=0,说明BCl3是非极性分子,其正、负电荷重心重合,应该是平面正三角 形结构;中心原子B与3个Cl原子形成3个共价键(没有孤电子对),即B的杂化方式 是sp2杂化。
1
2
3
4
5
6
7
8
9
10
11
12
13
(3)治癌药物Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分 别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的μ>0, 淡黄色化合物的μ=0。试写出两种同分异构体的结构简 式: 、 , 在水中溶解度较大的是 (填结构简 式)。
1
2
3
4
5
6
7
8
9
10
11
12
13
解析:(3)根据题意,Pt(NH3)2Cl2具有平面四边形结构,若μ=0,则为非极性分 子,NH3和Cl分别对称分布在四边形的4个顶点上,即正、负电荷重心重合,故淡黄 色化合物是 ;若μ>0,则为极性分子,NH3和Cl在四边形的4个顶点上的分布 是不对称的,即正、负电荷重心不重合,故棕黄色化合物是 。根据“相似相 溶”规律,水是极性分子,因此属于极性分子的溶质易溶解在水中,即在水中溶解度 较大的是棕黄色化合物,其结构简式为 。
1
2
3
4
5
6
7
8
9
10
11
12
13
