人教版高中化学选择性必修2第二章分子结构与性质第三节第二课时分子间的作用力分子的手性课件共57张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修2第二章分子结构与性质第三节第二课时分子间的作用力分子的手性课件共57张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-18 00:00:00 | ||
图片预览









文档简介
(共57张PPT)
第二章 分子结构与性质
第三节 分子结构与物质的性质
第二课时 分子间的作用力 分子的手性
学习目标:1.掌握范德华力、氢键的概念。2.掌握分子间作用力对物质性质的影响。 3.理解分子的手性及对物质性质的理解。
第*页
研习任务一 分子间的作用力
教材 认知
1. 范德华力及其对物质性质的影响
(1)概念:范德华力是 之间普遍存在的相互作用力,它使得许多物质能以 一定凝聚态(固态和液态)存在。
(2)特征:很 (比化学键的键能小1~2个数量级),无方向性和饱和性。
(3)影响因素:
①结构和组成相似的物质,相对分子质量越大,范德华力越 ;
②分子的极性越大,范德华力越 。
(4)范德华力的大小影响物质的熔、沸点
范德华力主要影响物质的物理性质,如熔、沸点,范德华力越大,熔沸点越高。
分子
弱
大
大
2. 氢键及其对物质性质的影响
(1)概念:已经与N、F、O等 很大的原子形成共价键的 与另 外的N、F、O等 很大的原子之间的作用力。
(2)氢键的形成条件和表示方法
①形成条件
a.要有与电负性很 的原子A以共价键结合的 原子;
b.要有电负性很 且含有 的原子B;
电负性
氢原子
电负性
大
氢
大
孤电子对
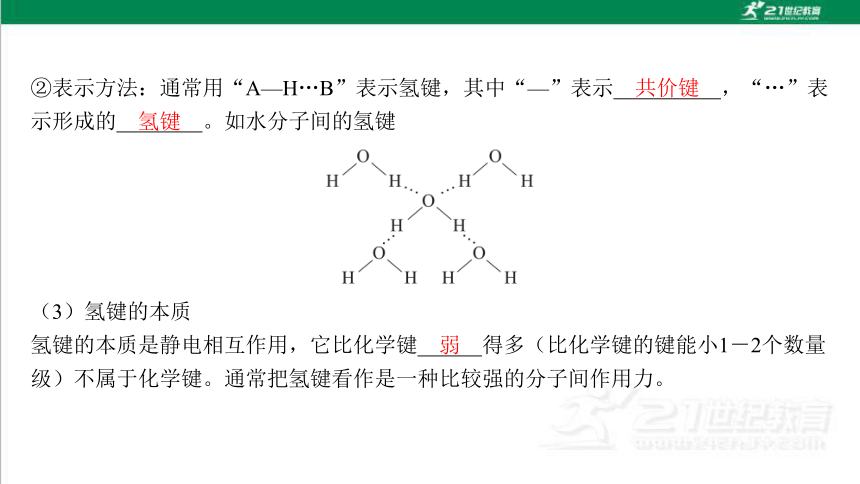
②表示方法:通常用“A—H…B”表示氢键,其中“—”表示 ,“…”表 示形成的 。如水分子间的氢键
(3)氢键的本质
氢键的本质是静电相互作用,它比化学键 得多(比化学键的键能小1-2个数量 级)不属于化学键。通常把氢键看作是一种比较强的分子间作用力。
共价键
氢键
弱
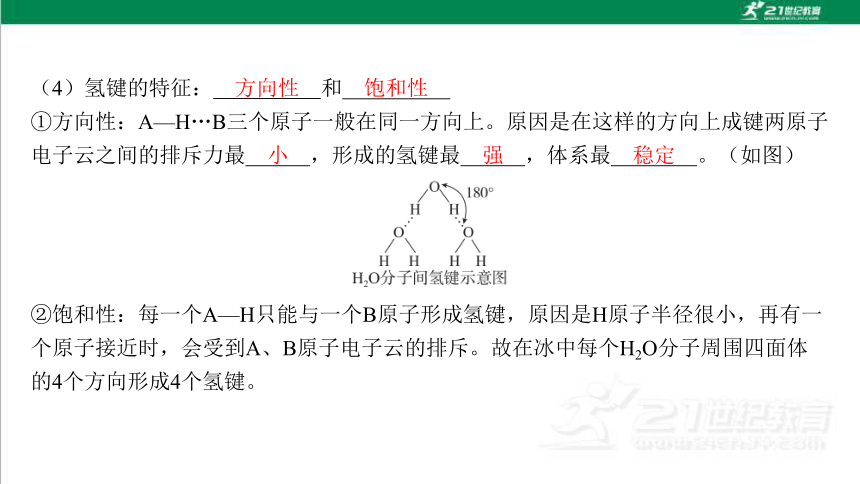
(4)氢键的特征: 和
①方向性:A—H…B三个原子一般在同一方向上。原因是在这样的方向上成键两原子 电子云之间的排斥力最 ,形成的氢键最 ,体系最 。(如图)
②饱和性:每一个A—H只能与一个B原子形成氢键,原因是H原子半径很小,再有一 个原子接近时,会受到A、B原子电子云的排斥。故在冰中每个H2O分子周围四面体 的4个方向形成4个氢键。
方向性
饱和性
小
强
稳定
(5)分类:氢键可分为 氢键和 氢键两类。
只存在 氢键,不存在 氢键; 存 在 氢键,不可能形成分子内氢键。前者的沸点 后者。
(6)氢键对物质性质的影响
①氢键对物质熔、沸点的影响
某些氢化物分子间存在氢键,物质的熔、沸点将 。如H2O、NH3、HF等,与 同族氢化物相比沸点反常,如H2O>H2Te>H2Se>H2S。
②氢键对物质溶解度的影响:溶剂和溶质之间形成氢键使溶质的溶解度 ,如 NH3、甲醇、甲酸等易溶于水。
③水分子间的氢键对水的性质的影响
水结冰时,体积膨胀,密度 。接近沸点时形成“ ”分子水蒸气的相 对分子质量比用化学式H2O计算出来的相对分子质量大。
分子间
分子内
分子内
分子间
分子间
低于
升高
增大
减小
缔合
3. 溶解性
(1)“相似相溶”规律
非极性溶质一般能溶于 溶剂,极性溶质一般能溶于 溶剂。 如蔗糖和氨 溶于水, 溶于四氯化碳。萘和碘 溶于四氯化 碳, 溶于水。
(2)氢键:溶剂和溶质之间的氢键作用力越大,溶解性越 。
(3)分子结构的相似性:溶质和溶剂的分子结构相似程度越大,其溶解性 越 ,如乙醇与水互溶,而戊醇在水中的溶解度明显减小。
(4)反应:溶质与水反应时可增加其溶解度,如SO2与H2O生成H2SO3。
非极性
极性
易
难
易
难
好
大
自我 排查
微判断
√
√
√
探究 活动
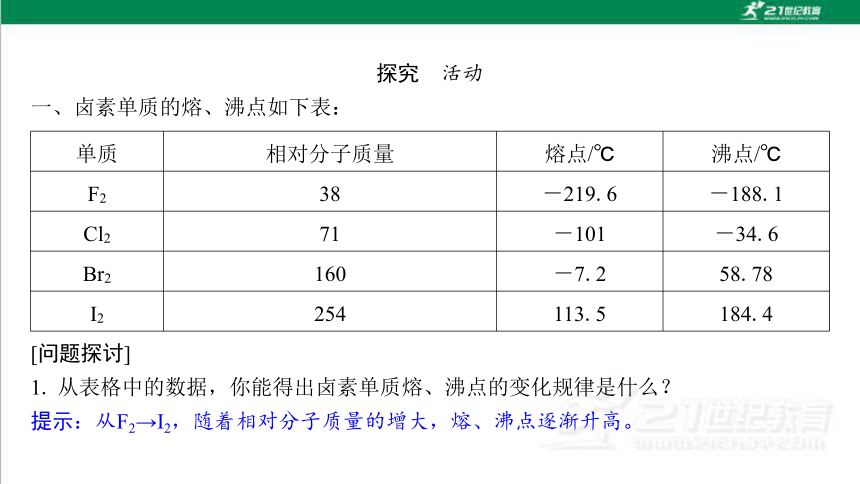
一、卤素单质的熔、沸点如下表:
单质 相对分子质量 熔点/℃ 沸点/℃
F2 38 -219.6 -188.1
Cl2 71 -101 -34.6
Br2 160 -7.2 58.78
I2 254 113.5 184.4
[问题探讨]
1. 从表格中的数据,你能得出卤素单质熔、沸点的变化规律是什么?
提示:从F2→I2,随着相对分子质量的增大,熔、沸点逐渐升高。
2. 怎样解释卤素单质从F2→I2的熔、沸点越来越高?
提示:从F2→I2,相对分子质量逐渐增大,范德华力逐渐增大,故熔、沸点逐渐 升高。
3. 范德华力属于化学键吗?分子中范德华力越大,分子的稳定性越强,这句话 对吗?
提示:范德华力不属于化学键;范德华力主要影响物质的熔、沸点和溶解性等,但不 影响物质的稳定性。
二、有机物A( )的结构可以表示为 (虚线表示氢键),而有机物 B( )只能形成分子间氢键。
[问题探讨]
1. 工业上用水蒸气蒸馏法将A和B进行分离,首先被蒸出的成分是哪一种?为什么?
提示:首先被蒸出的物质为A。因为A易形成分子内氢键,B易形成分子间氢键,所以 B的沸点比A的高。
2. 在第ⅤA、ⅥA、ⅦA族元素的氢化物中,为什么NH3、H2O、HF三者的相对分子 质量分别小于同主族其他元素的氢化物,但熔、沸点却比其他元素的氢化物高?
提示:因为NH3、H2O、HF三者的分子间能形成氢键,同主族其他元素的氢化物不能 形成氢键,所以它们的熔点和沸点高于同主族其他元素的氢化物。
应用 体验
A. 在相同条件下,N2在水中的溶解度小于O2
B. HF、HCl、HBr、HI的热稳定性依次减弱
C. F2、Cl2、Br2、I2的熔、沸点逐渐升高
D. CH3CH3、CH3CH2CH3、(CH3)2CHCH3、CH3CH2CH2CH3的沸点逐渐升高
B
解析:N2和O2都是非极性分子,在水中的溶解度都不大,但在相同条件下,O2分子 与水分子之间的作用力比N2分子与水分子之间的作用力大,故O2在水中的溶解度大于 N2,故不选A;HF、HCl、HBr、HI的热稳定性与其分子中的极性键的强弱有关,而 与分子间作用力无关,故选B;F2、Cl2、Br2、I2的组成和结构相似,分子间作用力随 相对分子质量的增大而增大,故其熔、沸点逐渐升高,故不选C;烷烃分子之间的作 用力随相对分子质量的增大而增大,故乙烷、丙烷、丁烷的沸点逐渐升高,在烷烃的 同分异构体中,支链越多,分子间作用力越小,熔、沸点越低,故异丁烷的沸点低于 正丁烷的沸点,故不选D。
A. 极性溶质一定易溶于极性溶剂,非极性溶质一定易溶于非极性溶剂
B. Br2和H2O均是极性分子,CCl4是非极性分子,所以Br2难溶于H2O而易溶于CCl4
C. CS2和白磷均是非极性分子,H2O是极性分子,所以白磷难溶于H2O而易溶于CS2
D. H2O是极性分子,CO2可溶于H2O,因此CO2是极性分子
解析:“相似相溶”规律是经验规律,存在特殊情况,部分有机物分子是极性分子, 但因为极性很弱,所以大部分难溶于水,故A错误;Br2是非极性分子,H2O是极性分 子,CCl4是非极性分子,根据“相似相溶”,Br2难溶于H2O而易溶于CCl4,故B错 误;CS2和白磷均是非极性分子,H2O是极性分子,所以白磷难溶于H2O而易溶于 CS2,故C正确;CO2是非极性分子,CO2溶于H2O时,部分与H2O反应生成H2CO3,故 D错误。
C
A. 氨气极易溶于水
B. 邻羟基苯甲酸( )的熔点为159 ℃,对羟基苯甲酸 ( )的熔点为213 ℃
C. 乙醚微溶于水,而乙醇可与水以任意比互溶
D. HF分解时吸收的热量比HCl分解时吸收的热量多
D
解析:NH3与H2O分子之间可以形成氢键,增大了NH3在水中的溶解度;邻羟基苯甲 酸形成分子内氢键,而对羟基苯甲酸形成分子间氢键,分子间氢键增大了分子间作用 力,使对羟基苯甲酸的熔、沸点比邻羟基苯甲酸的高;乙醇分子结构中含有羟基,可 以与水分子形成分子间氢键,从而增大了乙醇在水中的溶解度,使其能与水以任意比 互溶,而乙醚分子结构中无羟基,不能与水分子形成氢键,在水中的溶解度比乙醇小 得多;HF分解时吸收的热量比HCl分解时吸收的热量多的原因是H—F的键能比H—Cl 的大,与氢键无关。
A. 纤维素是自然界分布广泛的一种多糖
B. 纤维素难溶于水的主要原因是其链间有多个氢键
C. NaOH提供OH-破坏纤维素链之间的氢键
D. 低温降低了纤维素在NaOH溶液中的溶解性
B
解析:纤维素属于多糖,大量存在于我们吃的蔬菜水果中,在自然界广泛分布,A正 确;纤维素难溶于水,一是因为纤维素不能跟水形成氢键,二是因为碳骨架比较大, B错误;纤维素在低温下可溶于氢氧化钠溶液,是因为碱性体系主要破坏的是纤维素 分子内和分子间的氢键促进其溶解,C正确;温度越低,物质的溶解度越低,所以低 温降低了纤维素在氢氧化钠溶液中的溶解性,D正确。
5. (1)NH3在水中的溶解度是常见气体中最大的。
①下列因素与NH3的水溶性没有关系的是 (填字母,下同)。
a.NH3和H2O都是极性分子
b.NH3在水中易形成氢键
d.NH3是一种易液化的气体
d
②NH3溶于水时,大部分NH3与H2O通过氢键结合形成NH3·H2O。根据氨水的性质推 知NH3·H2O的结构式为 。
a. b.
c. d.
b
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2 是 (填“极性”或“非极性”)分子。
解析:(2)CCl4、CS2是非极性溶剂,根据“相似相溶”原理,CrO2Cl2是非极 性分子。
非极性
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)4,呈正四面体 结构。Ni(CO)4易溶于下列 (填字母)。
a.水 b.CCl4
c .C6H6(苯) d.NiSO4溶液
解析:(3)由常温下Ni(CO)4易挥发,可知Ni(CO)4为共价化合物分子,由于Ni (CO)4为正四面体形,所以Ni(CO)4为非极性分子,根据“相似相溶”规律,非 极性溶质Ni(CO)4易溶于非极性溶剂CCl4和苯。
解析:(4)由有机物与H2O分子间能否形成氢键的角度思考其原因。
bc
甲醛、甲醇和甲酸等碳原子个数较少的醛、醇、
羧酸与H2O分子间都能形成氢键,而CH4、HCOOCH3与H2O分子间难形成氢键
范德华力、氢键、共价键的比较
范德华力 氢键 共价键
概 念 物质分子之间普遍存在的一种作用力 已经与电负性很强的原子形成共 价键的氢原子与另一个电负性很 强的原子之间的静电作用 原子间通过共用电子 对所形成的相互作用
作用
粒子 分子 H与N、O、F 原子
特征 无方向性和饱和性 有方向性和饱和性 有方向性和饱和性
范德华力 氢键 共价键
强度 共价键>氢键>范德华力
影响
强度
的因
素 ①随分子极性的增大而增大
②组成和结构相似的由分子构成 的物质,相对分子质量越大,范 德华力越大 X—H…Y—中X、Y的电负性越大,Y原子的半径越小,作用力越强 成键原子半径和共 用电子对数目。键 长越短,键能越 大,共价键越稳定
对物
质性
质的
影响 ①影响物质的熔点、沸点、溶解 度等物理性质
②组成和结构相似的物质,随相 对分子质量的增大,物质的熔、 沸点升高。如熔、沸点:CF4< CCl4<CBr4 分子间氢键的存 在,使物质的熔、 沸点升高,在水中 的溶解度增大。如 熔、沸点:H2O>H2S 共价键键能越大, 分子稳定性越强
第*页
研习任务二 分子的手性
教材 认知
1. 手性分子:具有完全相同的 和 的一对分子,如同左手与右 手一样互为 ,却在三维空间里不能 ,互称手性异构体(或对映异构 体),具有手性异构体的分子称为手性分子。
2. 手性分子的判断
(1)判断方法:有机物分子中是否存在手性碳原子。
(2)手性碳原子:有机物分子中连有四个各不相同的原子或基团的碳原子。 如 ,R1、R2、R3、R4互不相同,即*C是手性碳原子。
组成
原子排列
镜像
叠合
3. 手性分子的重要用途
(1)手性分子:构成生命体的绝大多数分子为手性分子。两个手性分子的性质不 同,且手性有机物中必含手性碳原子。
(2)手性分子的应用:生产手性药物、生产手性催化剂(手性催化剂只催化或主要 催化一种手性分子的合成)。
探究 活动
“手性”指一个物体不能与其镜像相叠合 。如我们的双手,左手与互成镜像的右手 不叠合。一个手性分子与其镜像不叠合,分子的手性通常由不对称碳引起,即一个碳 上的四个基团互不相同。 通常用RS、DL对其进行识别。例如:
[问题探讨]
1. 互为手性分子的物质是同一种物质吗?
二者具有什么关系?
提示:不是同一种物质,二者互为同分异构体。
2. 互为手性分子的物质化学性质几乎完全相同,分析其原因。
提示:物质结构决定性质。互为手性分子的物质组成、结构几乎完全相同,所以其化 学性质几乎完全相同。
A. 互为手性异构体的分子互为镜像
B. 利用手性催化剂可主要得到一种手性分子
C. 手性异构体分子组成相同
D. 手性异构体性质相同
解析:互为手性异构体的分子互为镜像,故A正确;在手性合成中,与催化剂手性匹 配的分子在反应过程中会与手性催化剂形成一种最稳定的过渡态,从而主要诱导生成 一种手性分子,故B正确;手性异构体分子组成相同,故C正确;手性异构体旋光性 不同,化学性质可能有差异,故D错误。
D
A. B.
C. D.
解析:根据手性碳原子的概念判断,A项中有一个手性碳原子,B项中有两个手性碳 原子,C项中有三个手性碳原子,D项中没有手性碳原子。
B
A. B.
C. D.
D
解析:A项中无手性碳原子,B、C、D中含有的手性碳原子(用*标记)分别为 B: ;C: ; D: ,故选项D正确。
第*页
课堂强研习 合作学习 精研重难
课时作业
A. 分子间作用力是分子间静电作用的总称
B. 分子间氢键的形成除使物质的熔、沸点升高外,对物质的溶解、电离等也都有影 响
C. 只有电负性很强、半径很小的原子(如F、O、N)才能形成氢键
D. 氢键是一种特殊的化学键,它广泛存在于自然界中
解析:分子间作用力是分子间静电作用的总称,包括氢键与范德华力,它的作用弱于 化学键,但不属于化学键,它对物质熔、沸点,物质的溶解和电离等均有影响。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. 乙醇可以和水以任意比互溶
B. 冰的密度比液态水的密度小
C. HF的沸点比HCl的沸点高
D. 水分子在较高温度下也很稳定
解析:因乙醇、水分子之间能形成大量氢键,所以乙醇可以和水以任意比互溶,A项 不符合题意;冰中存在的氢键比液态水中氢键多,使冰呈立体网状结构,冰中产生大 量空隙,使其体积变大,则相同质量时冰的密度比液态水的密度小,B项不符合题 意;HF易形成分子间氢键,而HCl分子间不能形成氢键,HF的沸点比HCl高,C项不 符合题意;水分子稳定性与化学键有关,与氢键无关,D项符合题意;故选D。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. CH4 B. CH3CH2OH
C. D. CH3COOH
解析:连有4个不同原子或基团的碳原子叫手性碳原子,含手性碳原子的分子叫手性 分子,手性分子具有手性异构体,称为对映异构。因此4个选项中只有C项物质存在 手性异构体, 中标有“*”的碳原子是手性碳原子,其余碳原子均不是手 性碳原子。
C
1
2
3
4
5
6
7
8
9
10
11
12
A. 利用手性催化剂合成可只得到一种或主要得到一种手性分子
B. 分子间氢键和分子内氢键都会使沸点升高
C. 互为手性异构体的分子互为镜像,且分子组成相同,性质相似
D. 由酸性FCH2COOH>CH3COOH,可知酸性ClCH2COOH>CH3COOH
解析:利用手性催化剂合成可只得到一种或主要得到一种手性分子,称为手性合成, 故A正确;分子间氢键属于分子间作用力,它可使沸点升高,分子内氢键不属于分子 间作用力,故B错误;互为手性异构体的分子互为镜像,且分子组成和原子排列都完 全相同,性质相似,故C正确;F和Cl都是吸电子基,F或Cl取代了乙酸分子中甲基上 的H,使得FCH2COOH和ClCH2COOH中羧基里的羟基的极性更大,酸性都大于乙 酸,所以酸性FCH2COOH>CH3COOH,ClCH2COOH>CH3COOH,故D正确。
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 丙酸酸性弱于乙酸,是因为丙酸的烃基长,推电子效应大,其羧基中羟基的极性小
B. H2O比H2S沸点高,是因为O—H键能大于S—H键能
C. 乙醇与水任意比互溶,主要是因为乙醇与水易形成分子间氢键
D. 沸点:I2>Cl2,是因为范德华力:I2>Cl2
B
解析:丙酸酸性弱于乙酸,是因为丙酸的烃基长,推电子效应大,使其羧基中羟基的 极性小,羟基的H—O键不容易断裂,因此其酸性比CH3COOH弱,A正确;H2O比H2S 沸点高,是因为H2O分子之间除范德华力,还存在氢键,而H2S分子之间只存在分子 间作用力,而与物质分子内的化学键的键能大小无关,B错误;乙醇与水以任意比互 溶,主要是因为乙醇与水易形成大量分子间氢键,C正确;对于结构相似的物质,分 子的相对分子质量越大,范德华力就越大,物质的熔沸点就越高。I2、Cl2都是由分子 构成,二者结构相似,相对分子质量:I2>Cl2,范德华力:I2>Cl2,所以沸点:I2> Cl2,D正确;故选B。
1
2
3
4
5
6
7
8
9
10
11
12
A. F2、Cl2、Br2、I2熔点随相对分子质量的增大而升高
B. 乳酸( )分子中含有2个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D. 氨气极易溶于水、邻羟基苯甲醛的沸点低于对羟基苯甲醛都能用氢键来解释
B
1
2
3
4
5
6
7
8
9
10
11
12
解析:F2、Cl2、Br2、I2是组成和结构相似的分子,熔点随相对分子质量的增大而升 高,故A正确; 中间碳原子上连有四个不同的基团,是手性碳原子,只 有1个,故B错误;碘、四氯化碳、甲烷都为非极性分子,水为极性分子,分子极性 相似的分子易溶,故C正确;氨气分子和水分子之间能形成氢键,所以氨气极易溶于 水,邻羟基苯甲醛分子内存在氢键,而对羟基苯甲醛分子间存在氢键,所以邻羟基苯 甲醛的沸点低于对羟基苯甲醛,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
①CH3CH2OH的沸点高于CH3OCH3
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑤水分子高温下也很稳定
A. ①②③④⑤ B. ①②③④
C. ①②③ D. ①②
B
1
2
3
4
5
6
7
8
9
10
11
12
解析:乙醇能形成分子间氢键,二甲醚不能形成分子间氢键,则乙醇的分子间作用力 大于二甲醚,沸点高于二甲醚,所以乙醇的沸点高于二甲醚与氢键有关,故①正确; 小分子的醇中含有羟基、羧酸中含有羧基,都能与水分子形成分子间氢键,则小分子 的醇、羧酸可以和水以任意比互溶,所以小分子的醇、羧酸可以和水以任意比互溶与 氢键有关,故②正确;冰中水分子与周围四个水分子以分子间氢键形成四面体结构, 中间有空隙,则冰的密度比液态水的密度小,所以冰的密度比液态水的密度小与氢键 有关,故③正确;邻羟基苯甲酸能形成分子内氢键,对羟基苯甲酸能形成分子间氢 键,则邻羟基苯甲酸的分子间作用力小于对羟基苯甲酸,熔、沸点低于对羟基苯甲 酸,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低与氢键有关,故④正确;水分 子高温下也很稳定与氧元素的非金属性强,氢氧键的键能大有关,与氢键无关,故⑤ 错误。故选B。
1
2
3
4
5
6
7
8
9
10
11
12
A. AB2分子的空间构型为V形
B. A—B键为极性共价键,AB2分子为非极性分子
C. AB2与H2O相比,AB2的熔点、沸点比H2O的低
D. AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
选项 物质的结构或性质 解释
A 键角:CH4>H2O C—H的键长大于O—H的键长
B 用乙酸乙酯而不用水溶解油漆 乙酸乙酯与油漆中的成分极性都较小,利用了相似相 溶原理,而水分子极性较大,对油漆溶解效果不好
C 酸性:CH3COOH> CH3CH2COOH 烃基(R—)越长,推电子效应越小,羧基中羟基的 极性越大,羧酸的酸性越弱
D
的沸点高于
因为 分子间的范德华力大于 分子间的范德华力
B
1
2
3
4
5
6
7
8
9
10
11
12
解析:甲烷为sp3杂化,没有孤电子对,为正四面体结构,键角为109°28',水为sp3杂 化,2对孤电子对,为V形,约为105°,所以键角:CH4>H2O,A错误;乙酸乙酯与 油漆中的成分极性都较小,而水分子极性较大,利用了相似相溶原理,极性溶质易溶 于极性溶剂,非极性溶质易溶于非极性溶剂,B正确;烃基(R—)越长推电子效应 越大,则CH3CH2—的推电子效应比CH3—大,从而使—COOH中—OH的极性减弱, 电离能力减弱,酸性减弱,所以酸性:CH3COOH>CH3CH2COOH,C错误;对羟基 苯甲醛可以形成分子间氢键,邻羟基苯甲醛可以形成分子内氢键,分子间氢键使得熔 沸点升高,所以对羟基苯甲醛熔沸点大于邻羟基苯甲醛,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. 水很稳定(1 000 ℃以上才会部分分解)是因为水中含有大量的氢 键
B. 碘易溶于四氯化碳、甲烷难溶于水都可用“相似相溶”规律解释
C. 过氧化氢是含有极性键和非极性键的极性分子
D. 青蒿素的分子式为C15H22O5,结构如图所示,该分子中包含7个手性 碳原子
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:水很稳定(1 000 ℃以上才会部分分解)是因为水中含有的H—O键非常稳定, 与分子间氢键无关,A错误;碘是非极性分子,易溶于非极性溶剂四氯化碳,甲烷属 于非极性分子,难溶于极性溶剂水,所以都可用“相似相溶”规律解释,B正确;过 氧化氢中含有O—H极性键和O—O非极性键,其正电中心和负电中心不重合,属于极 性分子,C正确;由结构简式可知,青蒿素的分子式为C15H22O5,手性碳原子连接的4 个原子或原子团互不相同,根据青蒿素的结构图,可知该分子中包含7个手性碳原 子,如图: ,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
A
A易形成分子内氢键,B易形成分子间氢键,所以B的
沸点比A的高
1
2
3
4
5
6
7
8
9
10
11
12
(2)苯胺( )与甲苯( )的相对分子质量相近,但苯胺的熔 点(-5.9 ℃)、沸点(184.4 ℃)分别高于甲苯的熔点(-95.0 ℃)、沸点(111 ℃),原因是 。
(3)如图为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因是 。
苯胺分子间存在氢键
S8相对分子质量大,分子间范德华力大
H2O>CH3OH>CO2>H2
H2O与CH3OH均
为极性分子,H2O中氢键比甲醇多;CO2与H2均为非极性分子,CO2相对分子质量较
大,范德华力较大
1
2
3
4
5
6
7
8
9
10
11
12
解析:(1)(SCN)2的结构式为N≡C—S—S—C≡N, 单键为σ键,三键中含有1个σ键、2个π键,故1 mol (SCN)2中含有π键的数目为4 NA;异硫氰酸分子间可形 成氢键,而硫氰酸不能,故异硫氰酸的沸点较高。
4 NA
异硫氰酸分子间可
形成氢键,而硫氰酸不能
1
2
3
4
5
6
7
8
9
10
11
12
解析:(2)H2O2与H2O分子间可以形成氢键,溶解度增 大,导致二者之间互溶。
H2O2
与H2O分子之间可以形成氢键
解析:(3)乙二胺(H2N—CH2—CH2—NH2)中N原子形成3个σ键,含1对孤电子对,价层电子对数为4,采取sp3杂化;乙二胺(H2N—CH2—CH2—NH2)分子之间可 以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高。
sp3
乙二胺分子之间可以形成氢键,三甲胺分子
之间不能形成氢键
1
2
3
4
5
6
7
8
9
10
11
12
(4)氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分 子。根据氨水的性质可推知NH3·H2O的结构式为 。
A. B.
C. D.
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(5)在元素周期表中氟的电负性最大,用氢键表示式写出HF水溶液中存在的所有氢 键: 。
解析:(5)HF在水溶液中形成的氢键可从HF和HF、 H2O和H2O、HF和H2O(HF提供氢)、H2O和HF(H2O 提供氢)四个方面来考虑。由此可以得出HF水溶液中存 在的氢键,有四种:F—H…F、F—H…O、O—H…F、 O—H…O。
F—H…F、F—H…O、O—H…F、O—H…O
1
2
3
4
5
6
7
8
9
10
11
12
第二章 分子结构与性质
第三节 分子结构与物质的性质
第二课时 分子间的作用力 分子的手性
学习目标:1.掌握范德华力、氢键的概念。2.掌握分子间作用力对物质性质的影响。 3.理解分子的手性及对物质性质的理解。
第*页
研习任务一 分子间的作用力
教材 认知
1. 范德华力及其对物质性质的影响
(1)概念:范德华力是 之间普遍存在的相互作用力,它使得许多物质能以 一定凝聚态(固态和液态)存在。
(2)特征:很 (比化学键的键能小1~2个数量级),无方向性和饱和性。
(3)影响因素:
①结构和组成相似的物质,相对分子质量越大,范德华力越 ;
②分子的极性越大,范德华力越 。
(4)范德华力的大小影响物质的熔、沸点
范德华力主要影响物质的物理性质,如熔、沸点,范德华力越大,熔沸点越高。
分子
弱
大
大
2. 氢键及其对物质性质的影响
(1)概念:已经与N、F、O等 很大的原子形成共价键的 与另 外的N、F、O等 很大的原子之间的作用力。
(2)氢键的形成条件和表示方法
①形成条件
a.要有与电负性很 的原子A以共价键结合的 原子;
b.要有电负性很 且含有 的原子B;
电负性
氢原子
电负性
大
氢
大
孤电子对
②表示方法:通常用“A—H…B”表示氢键,其中“—”表示 ,“…”表 示形成的 。如水分子间的氢键
(3)氢键的本质
氢键的本质是静电相互作用,它比化学键 得多(比化学键的键能小1-2个数量 级)不属于化学键。通常把氢键看作是一种比较强的分子间作用力。
共价键
氢键
弱
(4)氢键的特征: 和
①方向性:A—H…B三个原子一般在同一方向上。原因是在这样的方向上成键两原子 电子云之间的排斥力最 ,形成的氢键最 ,体系最 。(如图)
②饱和性:每一个A—H只能与一个B原子形成氢键,原因是H原子半径很小,再有一 个原子接近时,会受到A、B原子电子云的排斥。故在冰中每个H2O分子周围四面体 的4个方向形成4个氢键。
方向性
饱和性
小
强
稳定
(5)分类:氢键可分为 氢键和 氢键两类。
只存在 氢键,不存在 氢键; 存 在 氢键,不可能形成分子内氢键。前者的沸点 后者。
(6)氢键对物质性质的影响
①氢键对物质熔、沸点的影响
某些氢化物分子间存在氢键,物质的熔、沸点将 。如H2O、NH3、HF等,与 同族氢化物相比沸点反常,如H2O>H2Te>H2Se>H2S。
②氢键对物质溶解度的影响:溶剂和溶质之间形成氢键使溶质的溶解度 ,如 NH3、甲醇、甲酸等易溶于水。
③水分子间的氢键对水的性质的影响
水结冰时,体积膨胀,密度 。接近沸点时形成“ ”分子水蒸气的相 对分子质量比用化学式H2O计算出来的相对分子质量大。
分子间
分子内
分子内
分子间
分子间
低于
升高
增大
减小
缔合
3. 溶解性
(1)“相似相溶”规律
非极性溶质一般能溶于 溶剂,极性溶质一般能溶于 溶剂。 如蔗糖和氨 溶于水, 溶于四氯化碳。萘和碘 溶于四氯化 碳, 溶于水。
(2)氢键:溶剂和溶质之间的氢键作用力越大,溶解性越 。
(3)分子结构的相似性:溶质和溶剂的分子结构相似程度越大,其溶解性 越 ,如乙醇与水互溶,而戊醇在水中的溶解度明显减小。
(4)反应:溶质与水反应时可增加其溶解度,如SO2与H2O生成H2SO3。
非极性
极性
易
难
易
难
好
大
自我 排查
微判断
√
√
√
探究 活动
一、卤素单质的熔、沸点如下表:
单质 相对分子质量 熔点/℃ 沸点/℃
F2 38 -219.6 -188.1
Cl2 71 -101 -34.6
Br2 160 -7.2 58.78
I2 254 113.5 184.4
[问题探讨]
1. 从表格中的数据,你能得出卤素单质熔、沸点的变化规律是什么?
提示:从F2→I2,随着相对分子质量的增大,熔、沸点逐渐升高。
2. 怎样解释卤素单质从F2→I2的熔、沸点越来越高?
提示:从F2→I2,相对分子质量逐渐增大,范德华力逐渐增大,故熔、沸点逐渐 升高。
3. 范德华力属于化学键吗?分子中范德华力越大,分子的稳定性越强,这句话 对吗?
提示:范德华力不属于化学键;范德华力主要影响物质的熔、沸点和溶解性等,但不 影响物质的稳定性。
二、有机物A( )的结构可以表示为 (虚线表示氢键),而有机物 B( )只能形成分子间氢键。
[问题探讨]
1. 工业上用水蒸气蒸馏法将A和B进行分离,首先被蒸出的成分是哪一种?为什么?
提示:首先被蒸出的物质为A。因为A易形成分子内氢键,B易形成分子间氢键,所以 B的沸点比A的高。
2. 在第ⅤA、ⅥA、ⅦA族元素的氢化物中,为什么NH3、H2O、HF三者的相对分子 质量分别小于同主族其他元素的氢化物,但熔、沸点却比其他元素的氢化物高?
提示:因为NH3、H2O、HF三者的分子间能形成氢键,同主族其他元素的氢化物不能 形成氢键,所以它们的熔点和沸点高于同主族其他元素的氢化物。
应用 体验
A. 在相同条件下,N2在水中的溶解度小于O2
B. HF、HCl、HBr、HI的热稳定性依次减弱
C. F2、Cl2、Br2、I2的熔、沸点逐渐升高
D. CH3CH3、CH3CH2CH3、(CH3)2CHCH3、CH3CH2CH2CH3的沸点逐渐升高
B
解析:N2和O2都是非极性分子,在水中的溶解度都不大,但在相同条件下,O2分子 与水分子之间的作用力比N2分子与水分子之间的作用力大,故O2在水中的溶解度大于 N2,故不选A;HF、HCl、HBr、HI的热稳定性与其分子中的极性键的强弱有关,而 与分子间作用力无关,故选B;F2、Cl2、Br2、I2的组成和结构相似,分子间作用力随 相对分子质量的增大而增大,故其熔、沸点逐渐升高,故不选C;烷烃分子之间的作 用力随相对分子质量的增大而增大,故乙烷、丙烷、丁烷的沸点逐渐升高,在烷烃的 同分异构体中,支链越多,分子间作用力越小,熔、沸点越低,故异丁烷的沸点低于 正丁烷的沸点,故不选D。
A. 极性溶质一定易溶于极性溶剂,非极性溶质一定易溶于非极性溶剂
B. Br2和H2O均是极性分子,CCl4是非极性分子,所以Br2难溶于H2O而易溶于CCl4
C. CS2和白磷均是非极性分子,H2O是极性分子,所以白磷难溶于H2O而易溶于CS2
D. H2O是极性分子,CO2可溶于H2O,因此CO2是极性分子
解析:“相似相溶”规律是经验规律,存在特殊情况,部分有机物分子是极性分子, 但因为极性很弱,所以大部分难溶于水,故A错误;Br2是非极性分子,H2O是极性分 子,CCl4是非极性分子,根据“相似相溶”,Br2难溶于H2O而易溶于CCl4,故B错 误;CS2和白磷均是非极性分子,H2O是极性分子,所以白磷难溶于H2O而易溶于 CS2,故C正确;CO2是非极性分子,CO2溶于H2O时,部分与H2O反应生成H2CO3,故 D错误。
C
A. 氨气极易溶于水
B. 邻羟基苯甲酸( )的熔点为159 ℃,对羟基苯甲酸 ( )的熔点为213 ℃
C. 乙醚微溶于水,而乙醇可与水以任意比互溶
D. HF分解时吸收的热量比HCl分解时吸收的热量多
D
解析:NH3与H2O分子之间可以形成氢键,增大了NH3在水中的溶解度;邻羟基苯甲 酸形成分子内氢键,而对羟基苯甲酸形成分子间氢键,分子间氢键增大了分子间作用 力,使对羟基苯甲酸的熔、沸点比邻羟基苯甲酸的高;乙醇分子结构中含有羟基,可 以与水分子形成分子间氢键,从而增大了乙醇在水中的溶解度,使其能与水以任意比 互溶,而乙醚分子结构中无羟基,不能与水分子形成氢键,在水中的溶解度比乙醇小 得多;HF分解时吸收的热量比HCl分解时吸收的热量多的原因是H—F的键能比H—Cl 的大,与氢键无关。
A. 纤维素是自然界分布广泛的一种多糖
B. 纤维素难溶于水的主要原因是其链间有多个氢键
C. NaOH提供OH-破坏纤维素链之间的氢键
D. 低温降低了纤维素在NaOH溶液中的溶解性
B
解析:纤维素属于多糖,大量存在于我们吃的蔬菜水果中,在自然界广泛分布,A正 确;纤维素难溶于水,一是因为纤维素不能跟水形成氢键,二是因为碳骨架比较大, B错误;纤维素在低温下可溶于氢氧化钠溶液,是因为碱性体系主要破坏的是纤维素 分子内和分子间的氢键促进其溶解,C正确;温度越低,物质的溶解度越低,所以低 温降低了纤维素在氢氧化钠溶液中的溶解性,D正确。
5. (1)NH3在水中的溶解度是常见气体中最大的。
①下列因素与NH3的水溶性没有关系的是 (填字母,下同)。
a.NH3和H2O都是极性分子
b.NH3在水中易形成氢键
d.NH3是一种易液化的气体
d
②NH3溶于水时,大部分NH3与H2O通过氢键结合形成NH3·H2O。根据氨水的性质推 知NH3·H2O的结构式为 。
a. b.
c. d.
b
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2 是 (填“极性”或“非极性”)分子。
解析:(2)CCl4、CS2是非极性溶剂,根据“相似相溶”原理,CrO2Cl2是非极 性分子。
非极性
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)4,呈正四面体 结构。Ni(CO)4易溶于下列 (填字母)。
a.水 b.CCl4
c .C6H6(苯) d.NiSO4溶液
解析:(3)由常温下Ni(CO)4易挥发,可知Ni(CO)4为共价化合物分子,由于Ni (CO)4为正四面体形,所以Ni(CO)4为非极性分子,根据“相似相溶”规律,非 极性溶质Ni(CO)4易溶于非极性溶剂CCl4和苯。
解析:(4)由有机物与H2O分子间能否形成氢键的角度思考其原因。
bc
甲醛、甲醇和甲酸等碳原子个数较少的醛、醇、
羧酸与H2O分子间都能形成氢键,而CH4、HCOOCH3与H2O分子间难形成氢键
范德华力、氢键、共价键的比较
范德华力 氢键 共价键
概 念 物质分子之间普遍存在的一种作用力 已经与电负性很强的原子形成共 价键的氢原子与另一个电负性很 强的原子之间的静电作用 原子间通过共用电子 对所形成的相互作用
作用
粒子 分子 H与N、O、F 原子
特征 无方向性和饱和性 有方向性和饱和性 有方向性和饱和性
范德华力 氢键 共价键
强度 共价键>氢键>范德华力
影响
强度
的因
素 ①随分子极性的增大而增大
②组成和结构相似的由分子构成 的物质,相对分子质量越大,范 德华力越大 X—H…Y—中X、Y的电负性越大,Y原子的半径越小,作用力越强 成键原子半径和共 用电子对数目。键 长越短,键能越 大,共价键越稳定
对物
质性
质的
影响 ①影响物质的熔点、沸点、溶解 度等物理性质
②组成和结构相似的物质,随相 对分子质量的增大,物质的熔、 沸点升高。如熔、沸点:CF4< CCl4<CBr4 分子间氢键的存 在,使物质的熔、 沸点升高,在水中 的溶解度增大。如 熔、沸点:H2O>H2S 共价键键能越大, 分子稳定性越强
第*页
研习任务二 分子的手性
教材 认知
1. 手性分子:具有完全相同的 和 的一对分子,如同左手与右 手一样互为 ,却在三维空间里不能 ,互称手性异构体(或对映异构 体),具有手性异构体的分子称为手性分子。
2. 手性分子的判断
(1)判断方法:有机物分子中是否存在手性碳原子。
(2)手性碳原子:有机物分子中连有四个各不相同的原子或基团的碳原子。 如 ,R1、R2、R3、R4互不相同,即*C是手性碳原子。
组成
原子排列
镜像
叠合
3. 手性分子的重要用途
(1)手性分子:构成生命体的绝大多数分子为手性分子。两个手性分子的性质不 同,且手性有机物中必含手性碳原子。
(2)手性分子的应用:生产手性药物、生产手性催化剂(手性催化剂只催化或主要 催化一种手性分子的合成)。
探究 活动
“手性”指一个物体不能与其镜像相叠合 。如我们的双手,左手与互成镜像的右手 不叠合。一个手性分子与其镜像不叠合,分子的手性通常由不对称碳引起,即一个碳 上的四个基团互不相同。 通常用RS、DL对其进行识别。例如:
[问题探讨]
1. 互为手性分子的物质是同一种物质吗?
二者具有什么关系?
提示:不是同一种物质,二者互为同分异构体。
2. 互为手性分子的物质化学性质几乎完全相同,分析其原因。
提示:物质结构决定性质。互为手性分子的物质组成、结构几乎完全相同,所以其化 学性质几乎完全相同。
A. 互为手性异构体的分子互为镜像
B. 利用手性催化剂可主要得到一种手性分子
C. 手性异构体分子组成相同
D. 手性异构体性质相同
解析:互为手性异构体的分子互为镜像,故A正确;在手性合成中,与催化剂手性匹 配的分子在反应过程中会与手性催化剂形成一种最稳定的过渡态,从而主要诱导生成 一种手性分子,故B正确;手性异构体分子组成相同,故C正确;手性异构体旋光性 不同,化学性质可能有差异,故D错误。
D
A. B.
C. D.
解析:根据手性碳原子的概念判断,A项中有一个手性碳原子,B项中有两个手性碳 原子,C项中有三个手性碳原子,D项中没有手性碳原子。
B
A. B.
C. D.
D
解析:A项中无手性碳原子,B、C、D中含有的手性碳原子(用*标记)分别为 B: ;C: ; D: ,故选项D正确。
第*页
课堂强研习 合作学习 精研重难
课时作业
A. 分子间作用力是分子间静电作用的总称
B. 分子间氢键的形成除使物质的熔、沸点升高外,对物质的溶解、电离等也都有影 响
C. 只有电负性很强、半径很小的原子(如F、O、N)才能形成氢键
D. 氢键是一种特殊的化学键,它广泛存在于自然界中
解析:分子间作用力是分子间静电作用的总称,包括氢键与范德华力,它的作用弱于 化学键,但不属于化学键,它对物质熔、沸点,物质的溶解和电离等均有影响。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. 乙醇可以和水以任意比互溶
B. 冰的密度比液态水的密度小
C. HF的沸点比HCl的沸点高
D. 水分子在较高温度下也很稳定
解析:因乙醇、水分子之间能形成大量氢键,所以乙醇可以和水以任意比互溶,A项 不符合题意;冰中存在的氢键比液态水中氢键多,使冰呈立体网状结构,冰中产生大 量空隙,使其体积变大,则相同质量时冰的密度比液态水的密度小,B项不符合题 意;HF易形成分子间氢键,而HCl分子间不能形成氢键,HF的沸点比HCl高,C项不 符合题意;水分子稳定性与化学键有关,与氢键无关,D项符合题意;故选D。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. CH4 B. CH3CH2OH
C. D. CH3COOH
解析:连有4个不同原子或基团的碳原子叫手性碳原子,含手性碳原子的分子叫手性 分子,手性分子具有手性异构体,称为对映异构。因此4个选项中只有C项物质存在 手性异构体, 中标有“*”的碳原子是手性碳原子,其余碳原子均不是手 性碳原子。
C
1
2
3
4
5
6
7
8
9
10
11
12
A. 利用手性催化剂合成可只得到一种或主要得到一种手性分子
B. 分子间氢键和分子内氢键都会使沸点升高
C. 互为手性异构体的分子互为镜像,且分子组成相同,性质相似
D. 由酸性FCH2COOH>CH3COOH,可知酸性ClCH2COOH>CH3COOH
解析:利用手性催化剂合成可只得到一种或主要得到一种手性分子,称为手性合成, 故A正确;分子间氢键属于分子间作用力,它可使沸点升高,分子内氢键不属于分子 间作用力,故B错误;互为手性异构体的分子互为镜像,且分子组成和原子排列都完 全相同,性质相似,故C正确;F和Cl都是吸电子基,F或Cl取代了乙酸分子中甲基上 的H,使得FCH2COOH和ClCH2COOH中羧基里的羟基的极性更大,酸性都大于乙 酸,所以酸性FCH2COOH>CH3COOH,ClCH2COOH>CH3COOH,故D正确。
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 丙酸酸性弱于乙酸,是因为丙酸的烃基长,推电子效应大,其羧基中羟基的极性小
B. H2O比H2S沸点高,是因为O—H键能大于S—H键能
C. 乙醇与水任意比互溶,主要是因为乙醇与水易形成分子间氢键
D. 沸点:I2>Cl2,是因为范德华力:I2>Cl2
B
解析:丙酸酸性弱于乙酸,是因为丙酸的烃基长,推电子效应大,使其羧基中羟基的 极性小,羟基的H—O键不容易断裂,因此其酸性比CH3COOH弱,A正确;H2O比H2S 沸点高,是因为H2O分子之间除范德华力,还存在氢键,而H2S分子之间只存在分子 间作用力,而与物质分子内的化学键的键能大小无关,B错误;乙醇与水以任意比互 溶,主要是因为乙醇与水易形成大量分子间氢键,C正确;对于结构相似的物质,分 子的相对分子质量越大,范德华力就越大,物质的熔沸点就越高。I2、Cl2都是由分子 构成,二者结构相似,相对分子质量:I2>Cl2,范德华力:I2>Cl2,所以沸点:I2> Cl2,D正确;故选B。
1
2
3
4
5
6
7
8
9
10
11
12
A. F2、Cl2、Br2、I2熔点随相对分子质量的增大而升高
B. 乳酸( )分子中含有2个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D. 氨气极易溶于水、邻羟基苯甲醛的沸点低于对羟基苯甲醛都能用氢键来解释
B
1
2
3
4
5
6
7
8
9
10
11
12
解析:F2、Cl2、Br2、I2是组成和结构相似的分子,熔点随相对分子质量的增大而升 高,故A正确; 中间碳原子上连有四个不同的基团,是手性碳原子,只 有1个,故B错误;碘、四氯化碳、甲烷都为非极性分子,水为极性分子,分子极性 相似的分子易溶,故C正确;氨气分子和水分子之间能形成氢键,所以氨气极易溶于 水,邻羟基苯甲醛分子内存在氢键,而对羟基苯甲醛分子间存在氢键,所以邻羟基苯 甲醛的沸点低于对羟基苯甲醛,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
①CH3CH2OH的沸点高于CH3OCH3
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑤水分子高温下也很稳定
A. ①②③④⑤ B. ①②③④
C. ①②③ D. ①②
B
1
2
3
4
5
6
7
8
9
10
11
12
解析:乙醇能形成分子间氢键,二甲醚不能形成分子间氢键,则乙醇的分子间作用力 大于二甲醚,沸点高于二甲醚,所以乙醇的沸点高于二甲醚与氢键有关,故①正确; 小分子的醇中含有羟基、羧酸中含有羧基,都能与水分子形成分子间氢键,则小分子 的醇、羧酸可以和水以任意比互溶,所以小分子的醇、羧酸可以和水以任意比互溶与 氢键有关,故②正确;冰中水分子与周围四个水分子以分子间氢键形成四面体结构, 中间有空隙,则冰的密度比液态水的密度小,所以冰的密度比液态水的密度小与氢键 有关,故③正确;邻羟基苯甲酸能形成分子内氢键,对羟基苯甲酸能形成分子间氢 键,则邻羟基苯甲酸的分子间作用力小于对羟基苯甲酸,熔、沸点低于对羟基苯甲 酸,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低与氢键有关,故④正确;水分 子高温下也很稳定与氧元素的非金属性强,氢氧键的键能大有关,与氢键无关,故⑤ 错误。故选B。
1
2
3
4
5
6
7
8
9
10
11
12
A. AB2分子的空间构型为V形
B. A—B键为极性共价键,AB2分子为非极性分子
C. AB2与H2O相比,AB2的熔点、沸点比H2O的低
D. AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
选项 物质的结构或性质 解释
A 键角:CH4>H2O C—H的键长大于O—H的键长
B 用乙酸乙酯而不用水溶解油漆 乙酸乙酯与油漆中的成分极性都较小,利用了相似相 溶原理,而水分子极性较大,对油漆溶解效果不好
C 酸性:CH3COOH> CH3CH2COOH 烃基(R—)越长,推电子效应越小,羧基中羟基的 极性越大,羧酸的酸性越弱
D
的沸点高于
因为 分子间的范德华力大于 分子间的范德华力
B
1
2
3
4
5
6
7
8
9
10
11
12
解析:甲烷为sp3杂化,没有孤电子对,为正四面体结构,键角为109°28',水为sp3杂 化,2对孤电子对,为V形,约为105°,所以键角:CH4>H2O,A错误;乙酸乙酯与 油漆中的成分极性都较小,而水分子极性较大,利用了相似相溶原理,极性溶质易溶 于极性溶剂,非极性溶质易溶于非极性溶剂,B正确;烃基(R—)越长推电子效应 越大,则CH3CH2—的推电子效应比CH3—大,从而使—COOH中—OH的极性减弱, 电离能力减弱,酸性减弱,所以酸性:CH3COOH>CH3CH2COOH,C错误;对羟基 苯甲醛可以形成分子间氢键,邻羟基苯甲醛可以形成分子内氢键,分子间氢键使得熔 沸点升高,所以对羟基苯甲醛熔沸点大于邻羟基苯甲醛,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. 水很稳定(1 000 ℃以上才会部分分解)是因为水中含有大量的氢 键
B. 碘易溶于四氯化碳、甲烷难溶于水都可用“相似相溶”规律解释
C. 过氧化氢是含有极性键和非极性键的极性分子
D. 青蒿素的分子式为C15H22O5,结构如图所示,该分子中包含7个手性 碳原子
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:水很稳定(1 000 ℃以上才会部分分解)是因为水中含有的H—O键非常稳定, 与分子间氢键无关,A错误;碘是非极性分子,易溶于非极性溶剂四氯化碳,甲烷属 于非极性分子,难溶于极性溶剂水,所以都可用“相似相溶”规律解释,B正确;过 氧化氢中含有O—H极性键和O—O非极性键,其正电中心和负电中心不重合,属于极 性分子,C正确;由结构简式可知,青蒿素的分子式为C15H22O5,手性碳原子连接的4 个原子或原子团互不相同,根据青蒿素的结构图,可知该分子中包含7个手性碳原 子,如图: ,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
A
A易形成分子内氢键,B易形成分子间氢键,所以B的
沸点比A的高
1
2
3
4
5
6
7
8
9
10
11
12
(2)苯胺( )与甲苯( )的相对分子质量相近,但苯胺的熔 点(-5.9 ℃)、沸点(184.4 ℃)分别高于甲苯的熔点(-95.0 ℃)、沸点(111 ℃),原因是 。
(3)如图为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因是 。
苯胺分子间存在氢键
S8相对分子质量大,分子间范德华力大
H2O>CH3OH>CO2>H2
H2O与CH3OH均
为极性分子,H2O中氢键比甲醇多;CO2与H2均为非极性分子,CO2相对分子质量较
大,范德华力较大
1
2
3
4
5
6
7
8
9
10
11
12
解析:(1)(SCN)2的结构式为N≡C—S—S—C≡N, 单键为σ键,三键中含有1个σ键、2个π键,故1 mol (SCN)2中含有π键的数目为4 NA;异硫氰酸分子间可形 成氢键,而硫氰酸不能,故异硫氰酸的沸点较高。
4 NA
异硫氰酸分子间可
形成氢键,而硫氰酸不能
1
2
3
4
5
6
7
8
9
10
11
12
解析:(2)H2O2与H2O分子间可以形成氢键,溶解度增 大,导致二者之间互溶。
H2O2
与H2O分子之间可以形成氢键
解析:(3)乙二胺(H2N—CH2—CH2—NH2)中N原子形成3个σ键,含1对孤电子对,价层电子对数为4,采取sp3杂化;乙二胺(H2N—CH2—CH2—NH2)分子之间可 以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高。
sp3
乙二胺分子之间可以形成氢键,三甲胺分子
之间不能形成氢键
1
2
3
4
5
6
7
8
9
10
11
12
(4)氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分 子。根据氨水的性质可推知NH3·H2O的结构式为 。
A. B.
C. D.
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(5)在元素周期表中氟的电负性最大,用氢键表示式写出HF水溶液中存在的所有氢 键: 。
解析:(5)HF在水溶液中形成的氢键可从HF和HF、 H2O和H2O、HF和H2O(HF提供氢)、H2O和HF(H2O 提供氢)四个方面来考虑。由此可以得出HF水溶液中存 在的氢键,有四种:F—H…F、F—H…O、O—H…F、 O—H…O。
F—H…F、F—H…O、O—H…F、O—H…O
1
2
3
4
5
6
7
8
9
10
11
12
