人教版高中化学选择性必修2第二章分子结构与性质第二节第一课时分子结构的测定多样的分子空间结构价层电子对互斥模型课件(共62张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修2第二章分子结构与性质第二节第一课时分子结构的测定多样的分子空间结构价层电子对互斥模型课件(共62张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 9.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-18 17:13:59 | ||
图片预览






文档简介
(共62张PPT)
第二章 分子结构与性质
第二节 分子的空间结构
第一课时 分子结构的测定 多样的分子空间结构价层电子对互斥模型
学习目标:1.了解常见的分子结构测定方法。2.认识共价分子结构的多样性和 复杂性。3.理解价层电子对互斥模型的意义。4.能根据有关理论判断简单分子 或离子的结构。
第*页
研习任务一 分子结构的测定
红外
质谱
X射线衍射
化学键
吸
收峰
谱图库
量子化学
化学键
振动
化学键
官能团
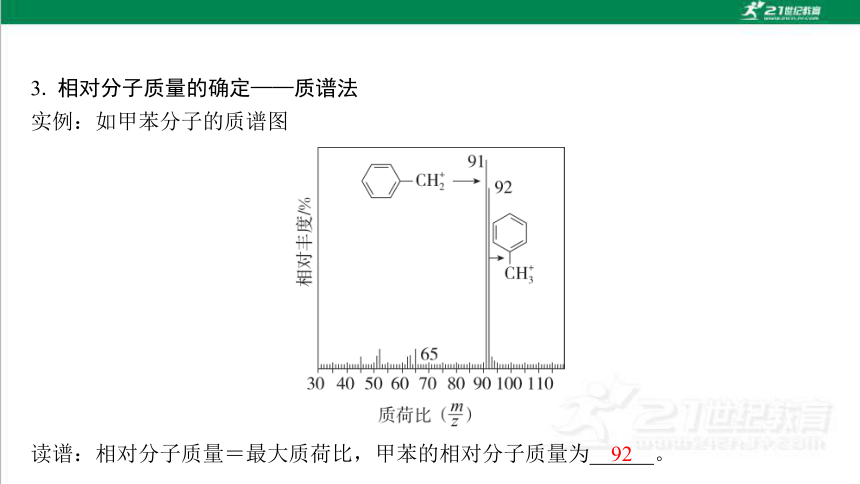
3. 相对分子质量的确定——质谱法
实例:如甲苯分子的质谱图
读谱:相对分子质量=最大质荷比,甲苯的相对分子质量为 。
92
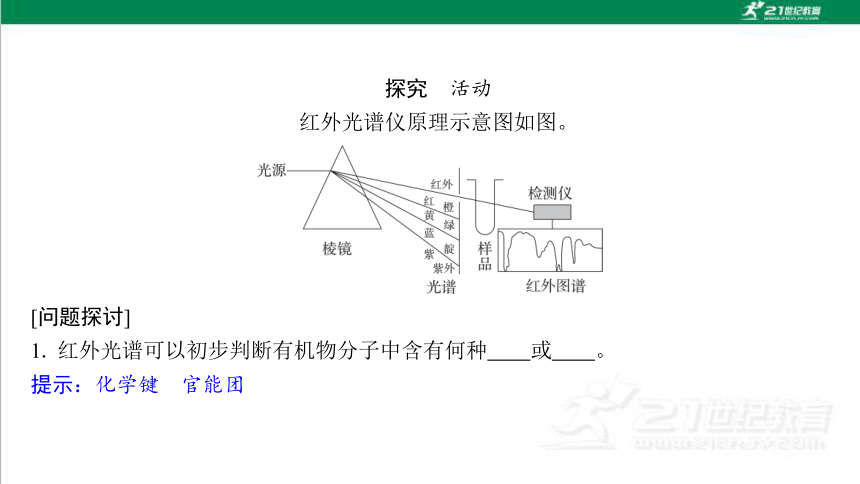
探究 活动
红外光谱仪原理示意图如图。
[问题探讨]
1. 红外光谱可以初步判断有机物分子中含有何种 或 。
提示:化学键 官能团
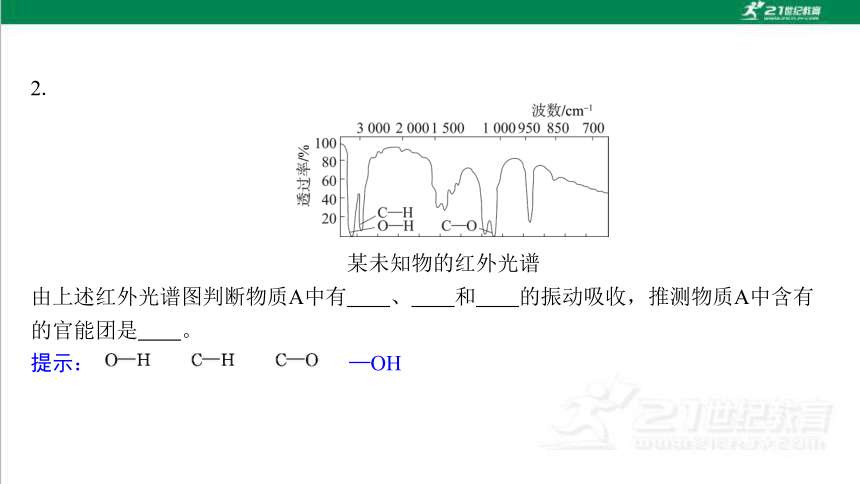
2.
某未知物的红外光谱
由上述红外光谱图判断物质A中有 、 和 的振动吸收,推测物质A中含有 的官能团是 。
提示: —OH
A. 用晶体X射线衍射可测定某些分子结构
B. 红外光谱法是用高能电子流等轰击样品分子,使分子失去电子变成带正电荷的分 子离子和碎片离子等粒子
C. 质谱法具有快速、微量、精确的特点
D. 通过红外光谱法可以测知有机物所含的官能团
解析:质谱法是用高能电子流等轰击样品分子,使分子失去电子变成带正电荷的分子 离子和碎片离子等粒子,故B错误。
B
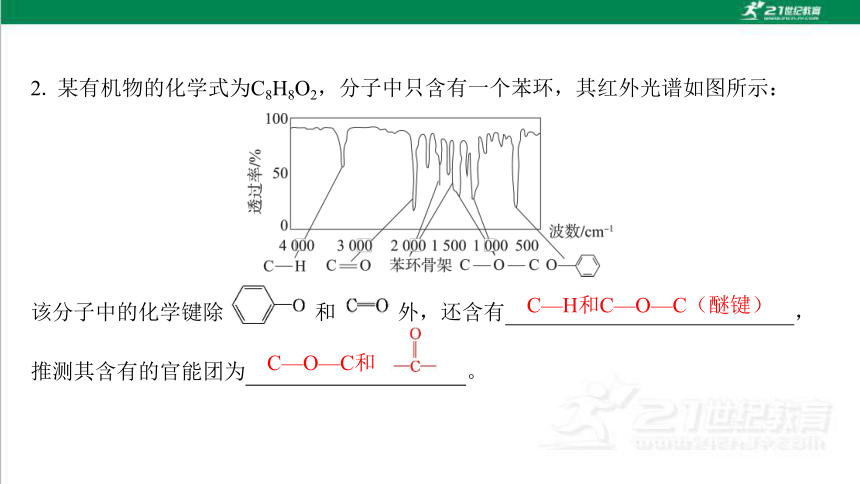
2. 某有机物的化学式为C8H8O2,分子中只含有一个苯环,其红外光谱如图所示:
该分子中的化学键除 和 外,还含有 , 推测其含有的官能团为 。
C—H和C—O—C(醚键)
C—O—C和
第*页
研习任务二 分子结构的多样性
教材 认知
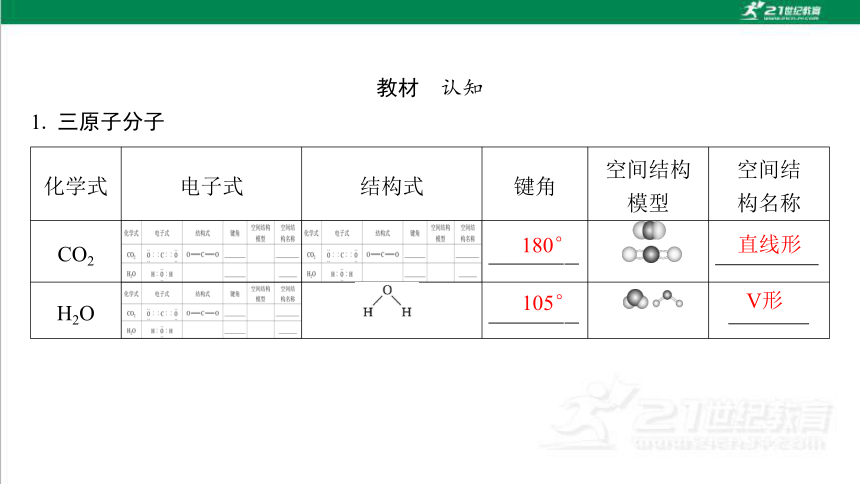
1. 三原子分子
化学式 电子式 结构式 键角 空间结构
模型 空间结
构名称
CO2
H2O
180°
直线形
105°
V形
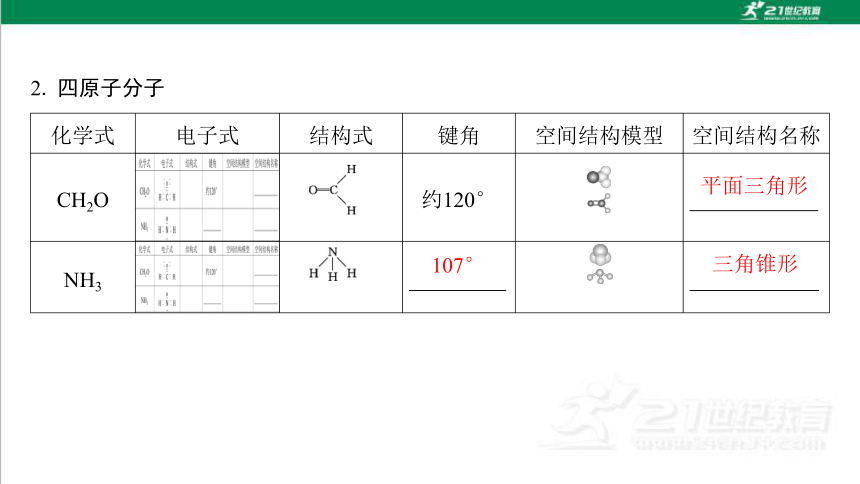
2. 四原子分子
化学式 电子式 结构式 键角 空间结构模型 空间结构名称
CH2O 约120°
NH3
平面三角形
107°
三角锥形
3. 五原子分子
化学式 电子式 结构式 键角 空间结构
模型 空间结构名称
CH4
CCl4
109°28'
正四面体形
109°28'
正四面体形
自我 排查
微判断
√
探究 活动
[问题探讨]
1. 四原子分子都是平面三角形或三角锥形吗?
提示:不是。H2O2分子的结构类似于一本打开的书,两个氧原子在两页书的交接处, 两个氢原子分别在翻开的书的两页上。而白磷(P4)分子为正四面体形。
2. 空间结构相同的分子,其键角完全相同吗?
提示:不一定,如P4和CH4均为正四面体形,但P4的键角是60°,CH4的键角为 109°28'。
A. 键角为180°的分子,空间结构是直线形
B. 键角为120°的分子,空间结构是平面三角形
C. 键角为60°的分子,空间结构可能是正四面体形
D. 键角为90°~109°28'之间的分子,空间结构可能是V形
解析:键角为180°的分子,空间结构为直线形,A正确;苯分子的键角为120°,但 其空间结构是平面正六边形,B错误;白磷分子的键角为60°,空间结构为正四面体 形,C正确;水分子的键角为105°,空间结构为V形,D正确。
B
2. (1)硫化氢(H2S)分子中,两个H—S的夹角接近90°,说明H2S分子的空间结 构为 。
(3)能说明CH4分子不是平面四边形,而是正四面体结构的是 (填字母)。
a.两个键之间的夹角为109°28'
b.C—H为极性共价键
c .4个C—H的键能、键长都相等
d.二氯甲烷(CH2Cl2)只有一种(不存在同分异构体)
V形
直线形
ad
解析:(3)五原子分子CH4可能有平面四边形和正四面体两种空间结构,不管为哪 种,b、c两项都成立;若为前者,则键角为90°,CH2Cl2有两种: 和 ;若为后者,则键角为109°28',CH2Cl2只有一种。
几种常见分子的空间结构
(1)常见的空间结构为直线形的分子有BeCl2、HCN、C2H2、CO2等。
(2)常见的空间结构为V形的分子有H2O、H2S、SO2等。
(3)常见的空间结构为平面三角形的分子有BF3、SO3、HCHO等。
(4)常见的空间结构为三角锥形的分子有PH3、PCl3、NH3等。
(5)常见的空间结构为正四面体形的分子有CH4、CCl4、SiH4、SiF4等;是四面体形 但不是正四面体形的有CH3Cl、CH2Cl2、CHCl3等。
第*页
研习任务三 价层电子对互斥模型
教材 认知
1. 价层电子对互斥模型
对AB n 型的分子或离子,中心原子A的价层电子对(分子中的中心原子与结合原子间 的 和中心原子上的 )之间由于存在排斥力,将使分子的 空间结构总是采取电子对 最弱的那种结构,以使彼此之间 最 小,分子或离子的体系能量最低,最稳定。
2. 价层电子对的空间结构(即VSEPR模型)
价层电子对数目:2 3 4
VSEPR模型:
σ键电子对
孤电子对
相互排斥
斥力
直线形
平面三角形
正四面体形
3. 计算价层电子对数
(1)中心原子价层电子对数=σ键电子对数+孤电子对数。
(2) σ键电子对数的计算
由化学式确定,即中心原子形成几个σ键,就有几对σ键电子对。如H2O分子中, O有 2对σ键电子对。NH3分子中, N有3对σ键电子对。
(3)中心原子上的孤电子对数的计算
① a 表示中心原子的价电子数;
对主族元素: a =最外层电子数;
对于阳离子: a =价电子数-离子所带电荷数;
对于阴离子: a =价电子数+离子所带电荷数。
② x 表示与中心原子结合的原子数。
③ b 表示与中心原子结合的原子最多能接受的电子数,氢和卤族元素均为1,其他原 子=8-该原子的价电子数。
分子或离子 中心原子 a x b 中心原子的孤电子对数
SO2 S 6 2 2 1
N 5-1=4 4 1 0
C 4+2=6 3 2 0
4. VSEPR模型的应用——预测分子或离子空间结构
(1)基本思路
对于AB n 型分子,利用VSEPR模型推测分子或离子空间结构的思路如下:
(2)中心原子不含孤电子对
分子或离子 价层电子对 数 孤电子对数 VSEPR模型及名称 分子(或离子)的空 间结构及名称
CO2
CH4
2
0
3
0
4
0
(3)中心原子含孤电子对
分子 价层电子对数 孤电子对数 VSEPR模型及名称 分子的空间结构及名称
NH3
H2O
SO2
4
1
4
2
3
1
|特别提醒|
运用价电子对互斥理论的注意事项
(1)利用价层电子对互斥理论判断分子的立体结构时应注意:价层电子对互斥理论 模型是电子对的立体结构,而分子的立体结构指的是成键电子对的立体结构,不包括 孤电子对。
(2)二者是否一致取决于中心原子上有无孤电子对,当中心原子上无孤电子对时, 二者的结构一致;当中心原子上有孤电子对时,二者的结构不一致。
自我 排查
微判断
√
探究 活动
[问题探讨]
1. 甲烷分子中的中心原子是什么?写出CH4的电子式,中心原子上有几对成键电子? 其VSEPR模型是什么?分子的空间结构是什么?
2. 氨分子中的中心原子是什么?写出NH3的电子式,中心原子上有几对成键电子,几 对孤电子对?其VSEPR模型是什么?略去VSEPR模型中的中心原子上的孤电子对后 得到NH3的空间结构是什么?
3. 水分子中的中心原子是什么?写出水分子的电子式,中心原子上有几对成键电 子,几对孤电子对?其VSEPR模型是什么?略去VSEPR模型中的中心原子上的孤电 子对后得到水分子的空间结构是什么?
应用 体验
选项 代表物 分子类型 有无孤电子对 空间结构
A SO2 AB2 无 直线形
B CH2O AB3 无 平面三角形
C H2O AB2 有 V形
D NH3 AB3 有 三角锥形
A
A. 价层电子对包括σ键电子对和中心原子上的孤电子对
B. 分子中键角越大,价层电子对相互排斥力越小,分子越稳定
C. 用该理论预测H2S和BF3的空间结构为V形和平面三角形
D. 该理论一定能预测出多中心原子的分子、离子或原子团的空间结构
D
A. ⑤④①②③ B. ⑤①④②③
C. ④①②⑤③ D. ③②④①⑤
A
A. PCl5 C. SiCl4 D. PbCl2
D
5. 用价层电子对互斥理论完成下列问题(带“·”的原子为中心原子)。
分子或离子 σ键电子对数 孤电子对数 价层电子对数 分子空间结构
B.Cl3
P.Cl3
S.O2
2
2
4
V形
3
0
3
平面三角形
3
1
4
三角锥形
2
1
3
V形
4
0
4
正四面体形
常见物质的空间结构
价层 电子对数 成键 电子对数 孤电 子
对数 VSEPR
模型 VSEPR
模型名称 分子或离子
的空间结构 物质
2 2 0 直线形 直线形 CO2
3 2 1 平面三角形 V形 SO2
3 3 0 平面正三角形 平面正三角形
价层 电子对数 成键 电子对数 孤电 子
对数 VSEPR
模型 VSEPR
模型名称 分子或离子
的空间结构 物质
4 4 0 正四面体形 正四面体形
4 3 1 四面体形 三角锥形 NH3、PCl3
4 2 2 四面体形 V形 H2O、SCl2
第*页
课堂强研习 合作学习 精研重难
课时作业
A. 该分子的结构为CH3CH2OH
B. 该分子的相对分子质量可能为27、31、45或46
C. 该分子的结构为CH3—O—CH3
D. 该分子的红外光谱和质谱都可以全面反映分子结构的信息
A
解析:由题中分子的质谱图可知,相对分子质量=最大质荷比,故分子的相对分子质量为46,B错误;从该分子的红外光谱信息可知,分子中有羟基,A正确,C错误;质谱只能反映分子相对分子质量信息,不能全面反映分子结构的信息,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. CH4、CS2、BF3
B. CO2、H2O、NH3
C. 甲醛(CH2O)、C2H2、苯(C6H6)
D. CCl4、BeCl2、PH3
解析:CH4和CCl4均为正四面体形分子,NH3和PH3均为三角锥形分子,所有原子不可 能在同一平面内。
C
1
2
3
4
5
6
7
8
9
10
11
12
A. VSEPR模型可用于预测分子的空间结构
B. VSEPR模型不能用于预测以过渡金属为中心原子的分子
C. 中心原子上的孤电子对也要占据中心原子周围的空间并参与互相排斥
D. 分子中键角越大,价层电子对相互排斥力越大,分子越稳定
解析:VSEPR模型可用来预测分子的空间结构,注意实际空间结构要去掉孤电子对, A正确;VSEPR模型可用于预测简单分子的空间结构,不能用于预测以过渡金属为中 心原子的分子,B正确;中心原子上的孤对电子也要占据中心原子周围的空间并参与 互相排斥,且孤电子对间排斥力>孤电子对和成键电子对间的排斥力,C正确;分子 的稳定性与键角没有关系,与化学键强弱有关,D错误。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. CS2:V形 B. CH4:正四面体形
C. BF3:平面三角形 D. NH3:三角锥形
A
1
2
3
4
5
6
7
8
9
10
11
12
A. BF3 B. SO2
C. H2O
A
1
2
3
4
5
6
7
8
9
10
11
12
A. SO2 B. O3 C. OF2 D. NH3
C
1
2
3
4
5
6
7
8
9
10
11
12
①P4 ②NH3 ③CCl4 ④CH4 ⑤H2S ⑥CO2
A. ③④ B. ⑤⑥ C. ①③④ D. ②③④
解析:①P4分子空间结构为正四面体形、键角为60°;②NH3分子中的氮原子价电子 对数为4,有一个孤电子对,所以空间结构为三角锥形,键角小于109°28';③CCl4分 子中碳原子价电子对数为4,没有孤电子对,所以空间结构为正四面体形且键角为 109°28';④CH4分子中碳原子价电子对数为4,没有孤电子对,所以空间结构为正四 面体形且键角为109°28';⑤H2S分子中硫原子价电子对数为4,有2对孤对电子对, 所以空间结构为V形,键角小于109°28';⑥CO2分子中碳原子价电子对数为2,所以 空间结构为直线形,键角为120°,所以③④正确,故选A。
A
1
2
3
4
5
6
7
8
9
10
11
12
A. NO2、SO2、BF3、NCl3分子中每个原子的最外层电子都满足8电子稳定结构
B. P4和CH4都是正四面体形分子且键角都为109°28'
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
D
1
2
3
4
5
6
7
8
9
10
11
12
A. R与BF3的空间结构相同
B. 键角:PH3<NH3<109°28'
C. R可以是PH3或AsH3
D. R分子的中心原子上的价层电子对数为4
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:R的空间结构为三角锥形,BF3中心原子价层电子对数为3+0=3,其空间结构 是平面三角形,因此其空间结构与BF3不相同,故A错误;PH3、NH3都为三角锥形, 键角小于109°28',而N的电负性大,吸引电子的能力比P强,因此NH3共用电子对之 间的排斥力比PH3共用电子对之间的排斥力大,其键角大,所以键角:PH3<NH3< 109°28',故B正确; 的中心原子价电子数为5,则中心原子位于第ⅤA族,R是 NH3、PH3或AsH3,故C正确;R分子的中心原子上有三对成键电子和一对孤电子对, 价层电子对数为4,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. 全部 B. 除④⑥⑦以外
C. ③④⑤⑥ D. ②④⑤⑥
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:氨分子中氮原子的价层电子对数为4,孤电子对数为1,空间结构为三角锥形, 水分子中的氧原子的价层电子对数为4,孤电子对数为2,空间结构为V形,两者空间 结构不相同,故①错误;氨分子中氮原子和水合氢离子中氧原子的价层电子对数都为 4,孤电子对数都为1,空间结构都为三角锥形,两者的空间结构相同,故②正确;铵 根离子中氮原子的价层电子对数为4,孤电子对数为0,空间结构为正四面体形,水合 氢离子空间结构为三角锥形,两者的空间结构不相同,故③错误;臭氧和二氧化硫的 原子个数和价电子数都相同,互为等电子体,等电子体具有相同的空间结构,故④正 确;二硫化碳中的碳原子和氯化铍中的铍原子的价层电子对数都为2,孤电子对数都 为0,空间结构都为直线形,故⑤正确;原硅酸根离子中的硅原子和硫酸根离子中硫 原子的价层电子对数都为4,孤电子对数都为0,空间结构都为正四面体形,两者的空 间结构相同,故⑥正确;三氟化硼和氯化铝为等电子体,空间结构都为平面三角形, 则双聚氯化铝的分子组成与三氟化硼和氯化铝均不相同,则空间结构与三氟化硼和氯 化铝的空间结构一定不相同,故⑦错误。故选D。
1
2
3
4
5
6
7
8
9
10
11
12
(1)中心原子没有孤电子对的是 (填序号,下同)。
①④⑥⑦
1
2
3
4
5
6
7
8
9
10
11
12
(2)空间结构为直线形的分子或离子有 ;空间结构为平面三角形的分子或离 子有 。
(3)空间结构为V形的分子或离子有 。
①
④⑦
③⑧
1
2
3
4
5
6
7
8
9
10
11
12
(4)空间结构为三角锥形的分子或离子有 ;空间结构为正四面体形的分子 或离子有 。
②⑤
⑥
1
2
3
4
5
6
7
8
9
10
11
12
12.20世纪50年代科学家提出价层电子对互斥理论(简称VSEPR模型),用于预测简 单分子空间结构。其要点可以概括为:
Ⅰ.用AX n E m 表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结 合的原子,E为中心原子最外层未参与成键的电子对(称为孤电子对),( n + m ) 称为价层电子对数。分子中的价层电子对总是互相排斥,均匀地分布在中心原子周围 的空间;
Ⅱ.分子的空间结构是指分子中的原子在空间中的排布,不包括中心原子未成键的孤电 子对;
1
2
3
4
5
6
7
8
9
10
11
12
Ⅲ.分子中价层电子对之间的斥力主要顺序为:
ⅰ.孤电子对之间的斥力>孤电子对与共用电子对之间的斥力>共用电子对之间的 斥力;
ⅱ.双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;
ⅲ.X原子得电子能力越弱,A—X形成的共用电子对之间的斥力越强;
ⅳ.其他。
请仔细阅读上述材料,回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
12
(1)根据要点Ⅰ可以画出AX n E m 的VSEPR模型,请填写下表:
n + m 2
VSEPR模型 正四面体形
价层电子对之间的理想键角 109°28'
解析:(1)当 n + m =2时,VSEPR模型为直线形,其键角是180°,当VSEPR模型 为四面体形,其键角是109°28'时, n + m =4。
解析:(2)根据CO2属AX2E0, n + m =2,故为直线形。
180°
4
直线形
CO2属于AX2E0, n + m =2,
故为直线形
1
2
3
4
5
6
7
8
9
10
11
12
解析:(3)H2O属AX2E2, n + m =4,VSEPR模型为正四面体形,但氧原子有2对孤 电子对,所以分子的空间结构为V形;价层电子对之间的夹角均为109°28',根据Ⅲ -ⅰ,应有∠H—O—H<109°28'。
V形
水分子属于AX2E2, n + m =4,VSEPR模型为正四面体形,价层电子
对之间的夹角均为109°28',根据Ⅲ中的ⅰ,应有∠H—O—H<109°28'
1
2
3
4
5
6
7
8
9
10
11
12
(4)SO2Cl2和SO2F2都属AX4E0型分子,S与O之间以双键结合,S与Cl、S与F之间以 单键结合。请你预测SO2Cl2和SO2F2分子的空间结构: ,SO2Cl2分子中 ∠Cl—S—Cl (填“<”“>”或“=”)SO2F2分子中∠F—S—F。
解析:(4)当 n + m =4时,VSEPR模型为正四面体形,硫原子无孤电子对,所以 SO2Cl2和SO2F2分子空间结构为四面体形,F原子的得电子能力大于氯原子,因为X原 子得电子能力越弱,A—X形成的共用电子对之间的斥力越强,所以SO2Cl2分子中 ∠Cl—S—Cl>SO2F2分子中∠F—S—F。
四面体形
>
1
2
3
4
5
6
7
8
9
10
11
12
第二章 分子结构与性质
第二节 分子的空间结构
第一课时 分子结构的测定 多样的分子空间结构价层电子对互斥模型
学习目标:1.了解常见的分子结构测定方法。2.认识共价分子结构的多样性和 复杂性。3.理解价层电子对互斥模型的意义。4.能根据有关理论判断简单分子 或离子的结构。
第*页
研习任务一 分子结构的测定
红外
质谱
X射线衍射
化学键
吸
收峰
谱图库
量子化学
化学键
振动
化学键
官能团
3. 相对分子质量的确定——质谱法
实例:如甲苯分子的质谱图
读谱:相对分子质量=最大质荷比,甲苯的相对分子质量为 。
92
探究 活动
红外光谱仪原理示意图如图。
[问题探讨]
1. 红外光谱可以初步判断有机物分子中含有何种 或 。
提示:化学键 官能团
2.
某未知物的红外光谱
由上述红外光谱图判断物质A中有 、 和 的振动吸收,推测物质A中含有 的官能团是 。
提示: —OH
A. 用晶体X射线衍射可测定某些分子结构
B. 红外光谱法是用高能电子流等轰击样品分子,使分子失去电子变成带正电荷的分 子离子和碎片离子等粒子
C. 质谱法具有快速、微量、精确的特点
D. 通过红外光谱法可以测知有机物所含的官能团
解析:质谱法是用高能电子流等轰击样品分子,使分子失去电子变成带正电荷的分子 离子和碎片离子等粒子,故B错误。
B
2. 某有机物的化学式为C8H8O2,分子中只含有一个苯环,其红外光谱如图所示:
该分子中的化学键除 和 外,还含有 , 推测其含有的官能团为 。
C—H和C—O—C(醚键)
C—O—C和
第*页
研习任务二 分子结构的多样性
教材 认知
1. 三原子分子
化学式 电子式 结构式 键角 空间结构
模型 空间结
构名称
CO2
H2O
180°
直线形
105°
V形
2. 四原子分子
化学式 电子式 结构式 键角 空间结构模型 空间结构名称
CH2O 约120°
NH3
平面三角形
107°
三角锥形
3. 五原子分子
化学式 电子式 结构式 键角 空间结构
模型 空间结构名称
CH4
CCl4
109°28'
正四面体形
109°28'
正四面体形
自我 排查
微判断
√
探究 活动
[问题探讨]
1. 四原子分子都是平面三角形或三角锥形吗?
提示:不是。H2O2分子的结构类似于一本打开的书,两个氧原子在两页书的交接处, 两个氢原子分别在翻开的书的两页上。而白磷(P4)分子为正四面体形。
2. 空间结构相同的分子,其键角完全相同吗?
提示:不一定,如P4和CH4均为正四面体形,但P4的键角是60°,CH4的键角为 109°28'。
A. 键角为180°的分子,空间结构是直线形
B. 键角为120°的分子,空间结构是平面三角形
C. 键角为60°的分子,空间结构可能是正四面体形
D. 键角为90°~109°28'之间的分子,空间结构可能是V形
解析:键角为180°的分子,空间结构为直线形,A正确;苯分子的键角为120°,但 其空间结构是平面正六边形,B错误;白磷分子的键角为60°,空间结构为正四面体 形,C正确;水分子的键角为105°,空间结构为V形,D正确。
B
2. (1)硫化氢(H2S)分子中,两个H—S的夹角接近90°,说明H2S分子的空间结 构为 。
(3)能说明CH4分子不是平面四边形,而是正四面体结构的是 (填字母)。
a.两个键之间的夹角为109°28'
b.C—H为极性共价键
c .4个C—H的键能、键长都相等
d.二氯甲烷(CH2Cl2)只有一种(不存在同分异构体)
V形
直线形
ad
解析:(3)五原子分子CH4可能有平面四边形和正四面体两种空间结构,不管为哪 种,b、c两项都成立;若为前者,则键角为90°,CH2Cl2有两种: 和 ;若为后者,则键角为109°28',CH2Cl2只有一种。
几种常见分子的空间结构
(1)常见的空间结构为直线形的分子有BeCl2、HCN、C2H2、CO2等。
(2)常见的空间结构为V形的分子有H2O、H2S、SO2等。
(3)常见的空间结构为平面三角形的分子有BF3、SO3、HCHO等。
(4)常见的空间结构为三角锥形的分子有PH3、PCl3、NH3等。
(5)常见的空间结构为正四面体形的分子有CH4、CCl4、SiH4、SiF4等;是四面体形 但不是正四面体形的有CH3Cl、CH2Cl2、CHCl3等。
第*页
研习任务三 价层电子对互斥模型
教材 认知
1. 价层电子对互斥模型
对AB n 型的分子或离子,中心原子A的价层电子对(分子中的中心原子与结合原子间 的 和中心原子上的 )之间由于存在排斥力,将使分子的 空间结构总是采取电子对 最弱的那种结构,以使彼此之间 最 小,分子或离子的体系能量最低,最稳定。
2. 价层电子对的空间结构(即VSEPR模型)
价层电子对数目:2 3 4
VSEPR模型:
σ键电子对
孤电子对
相互排斥
斥力
直线形
平面三角形
正四面体形
3. 计算价层电子对数
(1)中心原子价层电子对数=σ键电子对数+孤电子对数。
(2) σ键电子对数的计算
由化学式确定,即中心原子形成几个σ键,就有几对σ键电子对。如H2O分子中, O有 2对σ键电子对。NH3分子中, N有3对σ键电子对。
(3)中心原子上的孤电子对数的计算
① a 表示中心原子的价电子数;
对主族元素: a =最外层电子数;
对于阳离子: a =价电子数-离子所带电荷数;
对于阴离子: a =价电子数+离子所带电荷数。
② x 表示与中心原子结合的原子数。
③ b 表示与中心原子结合的原子最多能接受的电子数,氢和卤族元素均为1,其他原 子=8-该原子的价电子数。
分子或离子 中心原子 a x b 中心原子的孤电子对数
SO2 S 6 2 2 1
N 5-1=4 4 1 0
C 4+2=6 3 2 0
4. VSEPR模型的应用——预测分子或离子空间结构
(1)基本思路
对于AB n 型分子,利用VSEPR模型推测分子或离子空间结构的思路如下:
(2)中心原子不含孤电子对
分子或离子 价层电子对 数 孤电子对数 VSEPR模型及名称 分子(或离子)的空 间结构及名称
CO2
CH4
2
0
3
0
4
0
(3)中心原子含孤电子对
分子 价层电子对数 孤电子对数 VSEPR模型及名称 分子的空间结构及名称
NH3
H2O
SO2
4
1
4
2
3
1
|特别提醒|
运用价电子对互斥理论的注意事项
(1)利用价层电子对互斥理论判断分子的立体结构时应注意:价层电子对互斥理论 模型是电子对的立体结构,而分子的立体结构指的是成键电子对的立体结构,不包括 孤电子对。
(2)二者是否一致取决于中心原子上有无孤电子对,当中心原子上无孤电子对时, 二者的结构一致;当中心原子上有孤电子对时,二者的结构不一致。
自我 排查
微判断
√
探究 活动
[问题探讨]
1. 甲烷分子中的中心原子是什么?写出CH4的电子式,中心原子上有几对成键电子? 其VSEPR模型是什么?分子的空间结构是什么?
2. 氨分子中的中心原子是什么?写出NH3的电子式,中心原子上有几对成键电子,几 对孤电子对?其VSEPR模型是什么?略去VSEPR模型中的中心原子上的孤电子对后 得到NH3的空间结构是什么?
3. 水分子中的中心原子是什么?写出水分子的电子式,中心原子上有几对成键电 子,几对孤电子对?其VSEPR模型是什么?略去VSEPR模型中的中心原子上的孤电 子对后得到水分子的空间结构是什么?
应用 体验
选项 代表物 分子类型 有无孤电子对 空间结构
A SO2 AB2 无 直线形
B CH2O AB3 无 平面三角形
C H2O AB2 有 V形
D NH3 AB3 有 三角锥形
A
A. 价层电子对包括σ键电子对和中心原子上的孤电子对
B. 分子中键角越大,价层电子对相互排斥力越小,分子越稳定
C. 用该理论预测H2S和BF3的空间结构为V形和平面三角形
D. 该理论一定能预测出多中心原子的分子、离子或原子团的空间结构
D
A. ⑤④①②③ B. ⑤①④②③
C. ④①②⑤③ D. ③②④①⑤
A
A. PCl5 C. SiCl4 D. PbCl2
D
5. 用价层电子对互斥理论完成下列问题(带“·”的原子为中心原子)。
分子或离子 σ键电子对数 孤电子对数 价层电子对数 分子空间结构
B.Cl3
P.Cl3
S.O2
2
2
4
V形
3
0
3
平面三角形
3
1
4
三角锥形
2
1
3
V形
4
0
4
正四面体形
常见物质的空间结构
价层 电子对数 成键 电子对数 孤电 子
对数 VSEPR
模型 VSEPR
模型名称 分子或离子
的空间结构 物质
2 2 0 直线形 直线形 CO2
3 2 1 平面三角形 V形 SO2
3 3 0 平面正三角形 平面正三角形
价层 电子对数 成键 电子对数 孤电 子
对数 VSEPR
模型 VSEPR
模型名称 分子或离子
的空间结构 物质
4 4 0 正四面体形 正四面体形
4 3 1 四面体形 三角锥形 NH3、PCl3
4 2 2 四面体形 V形 H2O、SCl2
第*页
课堂强研习 合作学习 精研重难
课时作业
A. 该分子的结构为CH3CH2OH
B. 该分子的相对分子质量可能为27、31、45或46
C. 该分子的结构为CH3—O—CH3
D. 该分子的红外光谱和质谱都可以全面反映分子结构的信息
A
解析:由题中分子的质谱图可知,相对分子质量=最大质荷比,故分子的相对分子质量为46,B错误;从该分子的红外光谱信息可知,分子中有羟基,A正确,C错误;质谱只能反映分子相对分子质量信息,不能全面反映分子结构的信息,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. CH4、CS2、BF3
B. CO2、H2O、NH3
C. 甲醛(CH2O)、C2H2、苯(C6H6)
D. CCl4、BeCl2、PH3
解析:CH4和CCl4均为正四面体形分子,NH3和PH3均为三角锥形分子,所有原子不可 能在同一平面内。
C
1
2
3
4
5
6
7
8
9
10
11
12
A. VSEPR模型可用于预测分子的空间结构
B. VSEPR模型不能用于预测以过渡金属为中心原子的分子
C. 中心原子上的孤电子对也要占据中心原子周围的空间并参与互相排斥
D. 分子中键角越大,价层电子对相互排斥力越大,分子越稳定
解析:VSEPR模型可用来预测分子的空间结构,注意实际空间结构要去掉孤电子对, A正确;VSEPR模型可用于预测简单分子的空间结构,不能用于预测以过渡金属为中 心原子的分子,B正确;中心原子上的孤对电子也要占据中心原子周围的空间并参与 互相排斥,且孤电子对间排斥力>孤电子对和成键电子对间的排斥力,C正确;分子 的稳定性与键角没有关系,与化学键强弱有关,D错误。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. CS2:V形 B. CH4:正四面体形
C. BF3:平面三角形 D. NH3:三角锥形
A
1
2
3
4
5
6
7
8
9
10
11
12
A. BF3 B. SO2
C. H2O
A
1
2
3
4
5
6
7
8
9
10
11
12
A. SO2 B. O3 C. OF2 D. NH3
C
1
2
3
4
5
6
7
8
9
10
11
12
①P4 ②NH3 ③CCl4 ④CH4 ⑤H2S ⑥CO2
A. ③④ B. ⑤⑥ C. ①③④ D. ②③④
解析:①P4分子空间结构为正四面体形、键角为60°;②NH3分子中的氮原子价电子 对数为4,有一个孤电子对,所以空间结构为三角锥形,键角小于109°28';③CCl4分 子中碳原子价电子对数为4,没有孤电子对,所以空间结构为正四面体形且键角为 109°28';④CH4分子中碳原子价电子对数为4,没有孤电子对,所以空间结构为正四 面体形且键角为109°28';⑤H2S分子中硫原子价电子对数为4,有2对孤对电子对, 所以空间结构为V形,键角小于109°28';⑥CO2分子中碳原子价电子对数为2,所以 空间结构为直线形,键角为120°,所以③④正确,故选A。
A
1
2
3
4
5
6
7
8
9
10
11
12
A. NO2、SO2、BF3、NCl3分子中每个原子的最外层电子都满足8电子稳定结构
B. P4和CH4都是正四面体形分子且键角都为109°28'
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
D
1
2
3
4
5
6
7
8
9
10
11
12
A. R与BF3的空间结构相同
B. 键角:PH3<NH3<109°28'
C. R可以是PH3或AsH3
D. R分子的中心原子上的价层电子对数为4
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:R的空间结构为三角锥形,BF3中心原子价层电子对数为3+0=3,其空间结构 是平面三角形,因此其空间结构与BF3不相同,故A错误;PH3、NH3都为三角锥形, 键角小于109°28',而N的电负性大,吸引电子的能力比P强,因此NH3共用电子对之 间的排斥力比PH3共用电子对之间的排斥力大,其键角大,所以键角:PH3<NH3< 109°28',故B正确; 的中心原子价电子数为5,则中心原子位于第ⅤA族,R是 NH3、PH3或AsH3,故C正确;R分子的中心原子上有三对成键电子和一对孤电子对, 价层电子对数为4,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. 全部 B. 除④⑥⑦以外
C. ③④⑤⑥ D. ②④⑤⑥
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:氨分子中氮原子的价层电子对数为4,孤电子对数为1,空间结构为三角锥形, 水分子中的氧原子的价层电子对数为4,孤电子对数为2,空间结构为V形,两者空间 结构不相同,故①错误;氨分子中氮原子和水合氢离子中氧原子的价层电子对数都为 4,孤电子对数都为1,空间结构都为三角锥形,两者的空间结构相同,故②正确;铵 根离子中氮原子的价层电子对数为4,孤电子对数为0,空间结构为正四面体形,水合 氢离子空间结构为三角锥形,两者的空间结构不相同,故③错误;臭氧和二氧化硫的 原子个数和价电子数都相同,互为等电子体,等电子体具有相同的空间结构,故④正 确;二硫化碳中的碳原子和氯化铍中的铍原子的价层电子对数都为2,孤电子对数都 为0,空间结构都为直线形,故⑤正确;原硅酸根离子中的硅原子和硫酸根离子中硫 原子的价层电子对数都为4,孤电子对数都为0,空间结构都为正四面体形,两者的空 间结构相同,故⑥正确;三氟化硼和氯化铝为等电子体,空间结构都为平面三角形, 则双聚氯化铝的分子组成与三氟化硼和氯化铝均不相同,则空间结构与三氟化硼和氯 化铝的空间结构一定不相同,故⑦错误。故选D。
1
2
3
4
5
6
7
8
9
10
11
12
(1)中心原子没有孤电子对的是 (填序号,下同)。
①④⑥⑦
1
2
3
4
5
6
7
8
9
10
11
12
(2)空间结构为直线形的分子或离子有 ;空间结构为平面三角形的分子或离 子有 。
(3)空间结构为V形的分子或离子有 。
①
④⑦
③⑧
1
2
3
4
5
6
7
8
9
10
11
12
(4)空间结构为三角锥形的分子或离子有 ;空间结构为正四面体形的分子 或离子有 。
②⑤
⑥
1
2
3
4
5
6
7
8
9
10
11
12
12.20世纪50年代科学家提出价层电子对互斥理论(简称VSEPR模型),用于预测简 单分子空间结构。其要点可以概括为:
Ⅰ.用AX n E m 表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结 合的原子,E为中心原子最外层未参与成键的电子对(称为孤电子对),( n + m ) 称为价层电子对数。分子中的价层电子对总是互相排斥,均匀地分布在中心原子周围 的空间;
Ⅱ.分子的空间结构是指分子中的原子在空间中的排布,不包括中心原子未成键的孤电 子对;
1
2
3
4
5
6
7
8
9
10
11
12
Ⅲ.分子中价层电子对之间的斥力主要顺序为:
ⅰ.孤电子对之间的斥力>孤电子对与共用电子对之间的斥力>共用电子对之间的 斥力;
ⅱ.双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;
ⅲ.X原子得电子能力越弱,A—X形成的共用电子对之间的斥力越强;
ⅳ.其他。
请仔细阅读上述材料,回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
12
(1)根据要点Ⅰ可以画出AX n E m 的VSEPR模型,请填写下表:
n + m 2
VSEPR模型 正四面体形
价层电子对之间的理想键角 109°28'
解析:(1)当 n + m =2时,VSEPR模型为直线形,其键角是180°,当VSEPR模型 为四面体形,其键角是109°28'时, n + m =4。
解析:(2)根据CO2属AX2E0, n + m =2,故为直线形。
180°
4
直线形
CO2属于AX2E0, n + m =2,
故为直线形
1
2
3
4
5
6
7
8
9
10
11
12
解析:(3)H2O属AX2E2, n + m =4,VSEPR模型为正四面体形,但氧原子有2对孤 电子对,所以分子的空间结构为V形;价层电子对之间的夹角均为109°28',根据Ⅲ -ⅰ,应有∠H—O—H<109°28'。
V形
水分子属于AX2E2, n + m =4,VSEPR模型为正四面体形,价层电子
对之间的夹角均为109°28',根据Ⅲ中的ⅰ,应有∠H—O—H<109°28'
1
2
3
4
5
6
7
8
9
10
11
12
(4)SO2Cl2和SO2F2都属AX4E0型分子,S与O之间以双键结合,S与Cl、S与F之间以 单键结合。请你预测SO2Cl2和SO2F2分子的空间结构: ,SO2Cl2分子中 ∠Cl—S—Cl (填“<”“>”或“=”)SO2F2分子中∠F—S—F。
解析:(4)当 n + m =4时,VSEPR模型为正四面体形,硫原子无孤电子对,所以 SO2Cl2和SO2F2分子空间结构为四面体形,F原子的得电子能力大于氯原子,因为X原 子得电子能力越弱,A—X形成的共用电子对之间的斥力越强,所以SO2Cl2分子中 ∠Cl—S—Cl>SO2F2分子中∠F—S—F。
四面体形
>
1
2
3
4
5
6
7
8
9
10
11
12
