人教版高中化学选择性必修2第三章晶体结构与性质第四节配合物与超分子课件(共56张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修2第三章晶体结构与性质第四节配合物与超分子课件(共56张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 8.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-18 00:00:00 | ||
图片预览











文档简介
(共56张PPT)
第三章 晶体结构与性质
第四节 配合物与超分子
学习目标:1.知道配位键的特点。2.认识简单的配位化合物的成键特征。3.了解配位 化合物的存在与应用。
第*页
研习任务一 配位键与配合物
教材 认知
1. 配位键
(1)配位键的概念
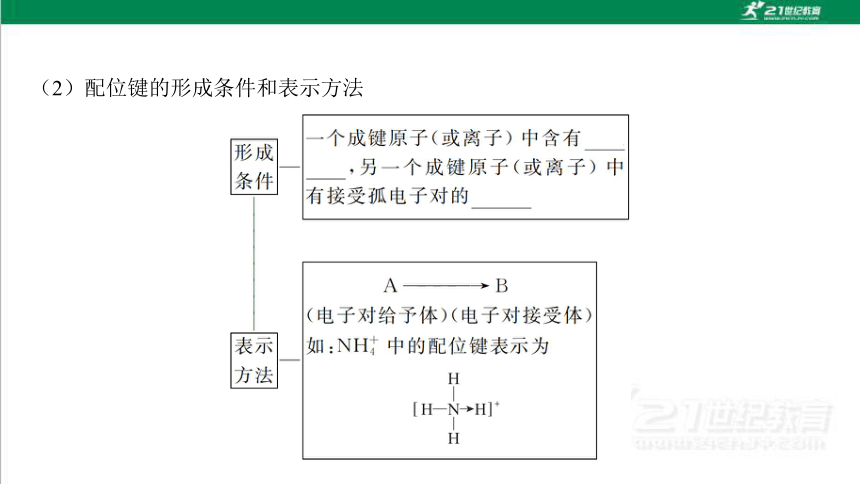
由一个原子单方面提供 ,而另一个原子提供 而形成的共价 键,即“电子对给予—接受”键,是一类特殊的共价键。
孤电子对
空轨道
(2)配位键的形成条件和表示方法
2. 配位化合物
(1)定义:金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体 或配位体)以 结合形成的化合物,简称配合物。
配位键
(2)实验探究配合物的形成
实验 操作 实验现象 有关离子方程式或原因分析
滴加氨水后,试管中首先出现 , 氨水过量后沉淀逐渐溶解得到深蓝色透明溶液,再滴加95% 8 mL乙醇后析出
蓝色沉淀
深蓝色晶体
实验 操作 实验现象 有关离子方程式或原因分析
溶液颜色 Fe3+与SCN-可形成血红色配离子
先有 沉淀,滴加氨水后,沉淀消失
变红
白色
(3)配合物的组成
配合物[Cu(NH3)4]SO4的组成如图所示:
空轨道
②配体:提供 的阴离子或分子,如Cl-、NH3、H2O等。配体中直接同 中心原子配位的原子叫做配位原子。配位原子必须是含有 的原子,如 NH3中的N原子,H2O中的O原子等。
③配位数:直接与中心原子形成的配位键的数目。如[Fe(CN)6]4-中Fe2+的配位数 为6。
孤电子对
孤电子对
(4)配位键与共价键的关系
①形成过程不同:配位键实质上是一种特殊的共价键,在配位键中一方提供孤电子 对,另一方提供具有能够接受孤电子对的空轨道。普通共价键的共用电子对是由成键 原子双方共同提供的。
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子 的金属离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与 CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分 子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO 中毒。
自我 排查
微判断
√
√
√
探究 活动
配位键实质是一种特殊的共价键,配位键的共用电子对由成键原子单方面提供,普通 共价键的共用电子对则由成键原子双方共同提供,但实质是相同的。
[问题探讨]
2. 配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些?
提示:[Cu(NH3)4]SO4中含有的化学键有离子键、共价键和配位键。
3. NH3和BF3可以通过配位键形成NH3·BF3,试分析提供孤电子对、空轨道的分别是 哪种原子?你能写出NH3·BF3的结构式吗?
提示:N原子提供孤电子对,B原子提供空轨道,NH3·BF3的结构式可表示 为 。
应用 体验
①H2O ②NH3 ③F- ④CN- ⑤OH-
A. 仅有①② B. 仅有①②③
C. 仅有①②④ D. ①②③④⑤
解析:水分子中的O原子有孤电子对,可以提供孤对电子与某些金属离子形成配位 键,①符合题意;NH3分子中N原子有孤电子对,可以提供孤对电子与某些金属离子 形成配位键,②符合题意;F-含有孤电子对,可以提供孤对电子与某些金属离子形 成配位键,③符合题意;CN-中C、N原子均有孤电子对,C原子电负性较小,更易给 出电子,与某些金属离子形成配位键,④符合题意;OH-中O原子有孤电子对,可以 提供孤对电子与某些金属离子形成配位键,⑤符合题意。
D
⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+
⑧[Ag(NH3)2]OH
A. ①②④⑦⑧ B. ③④⑤⑥⑦
C. ①④⑤⑥⑦⑧ D. 全部
解析:形成配位键的条件是一个原子(或离子)有孤电子对,另一个原子(或离子) 有空轨道。在②CH4、③OH-中不存在配位键。
C
A. 反应后溶液中没有沉淀,所以反应前后Ag+的浓度不变
B. 沉淀溶解后,生成的[Ag(NH3)2]OH难电离
C. 在[Ag(NH3)2]+中,Ag+给出孤对电子,NH3提供空轨道
D. 该实验能证明[Ag(NH3)2]+比AgOH稳定
D
A. 配位体是Cl-和H2O
B. 中心离子是Co3+,配离子是[Co(NH3)4Cl2]+
C. 内界和外界中的Cl-的数目比是1∶2
D. 加入足量AgNO3溶液,1 mol该配合物可生成3 mol AgCl
B
5. Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2-中的配位键: 。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有 (填字母)。
AC
A. 离子键 B. 金属键
C. 极性共价键 D. 非极性共价键
解析:(1)①Cu2+含有空轨道,OH-含有孤电子对,可形成配位键,配离子[Cu (OH)4]2-中1个Cu2+与4个OH-形成配位键,可表示为 ;②Na2[Cu (OH)4]为离子化合物,含有离子键,并且O—H为极性共价键。
解析:(2)过氧化氢可氧化Cu生成Cu2+,Cu2+与氨分子形成配位键。
过氧化氢为氧化
剂,将Cu氧化为Cu2+,氨分子与Cu2+形成配位键
配位键的稳定性
(1)电子对给予体形成配位键的能力:NH3>H2O。
(2)接受体形成配位键的能力:H+>过渡金属>主族金属。
(3)配位键越强,配合物越稳定。如稳定性:Cu2+←OH-<Cu2+←NH3<H+ ←NH3。
第*页
研习任务二 超分子
两种或两种以上
分子间相互作用
非共价键
氢键
静电作
用
疏水作用
弱配位键
有限
无限
分子识别
自组装
3. 应用实例——分子识别
(1)分离C60和“杯酚”,如图所示。
(2)冠醚识别碱金属离子。不同大小的冠醚可以识别不同大小的碱金属离子,如图 所示。
A. 超分子是如蛋白质一样的大分子
B. 超分子是由小分子通过聚合得到的高分子
C. 超分子是由高分子通过非化学键作用形成的分子聚集体
D. 超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体
解析:超分子不同于蛋白质、淀粉等大分子,也不同于高分子,超分子是由两种或两 种以上的分子通过分子间相互作用形成的分子聚集体。
D
A. 氢键、静电作用、疏水作用均可形成超分子中的作用力
B. 超分子都是无限伸展的
C. 冠醚可以识别碱金属离子
D. 细胞和细胞器的双分子膜具有自组装性质
解析:超分子通常是指由两种或两种以上分子依靠分子间相互作用结合在一起,分子 间相互作用包括:氢键、静电作用、疏水作用等,故A正确;超分子有的是有限的, 有的是无限伸展的,故B错误;冠醚与碱金属离子形成超分子,可以识别碱金属离 子,故C正确;细胞和细胞器的双分子膜具有自组装性质,生物体的细胞即是由各种 生物分子自组装而成,故D正确。
B
A. C70能溶于甲苯,C60不溶于甲苯
B. C60能与“杯酚”形成超分子
C. C70不能与“杯酚”形成超分子
D. “杯酚”能够循环使用
A
解析:由题图可知,C60能够与“杯酚”通过分子
间作用力形成超分子,而C70不能,C60与“杯酚”形成的
超分子不能溶于甲苯,但不能证明C60是否能溶于甲苯,A
项错误,B、C项正确;通过溶剂氯仿的作用,破坏“杯酚”与C60形成的超分子,可实现将C60与C70分离,且“杯酚”能够循环使用,D项正确。
4. 利用超分子可分离C60和C70。将C60、C70混合物加入一种空腔大小适配C60的杯酚中 进行分离的流程如图所示。
A. 该流程体现了超分子具有“分子识别”的特征
B. 杯酚分子中存在大π键
C. 杯酚与C60形成氢键
D. C60与金刚石晶体类型不同
C
解析:该流程体现了超分子能够识别C60,A正确;杯酚分子中含有苯环结构,存在大 π键,B项正确;杯酚与C60形成的不是氢键,C项错误;金刚石是共价晶体,C60为分 子晶体,二者晶体类型不同,D项正确。
第*页
课堂强研习 合作学习 精研重难
课时作业
1. (2024·长春高二期末)冠醚能与阳离子作用,将阳离子以及对应的阴离子都带入 有机溶剂,例如KMnO4水溶液对烯烃的氧化效果较差,在烯烃中溶入冠醚,可使氧 化反应迅速发生,原理如图。
A. 冠醚属于超分子
C. K+通过弱配位键与冠醚相结合
D. 冠醚中C、O原子间的化学键为σ键
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 杯酚分子与C60可以形成分子间氢键
B. C60和C70互为同素异形体
C. 图中杯酚分子与C60可能是借助分子间作用力形成超分子
D. 利用杯酚分离C60和C70说明人类已经能够从分子层面进行物质的分离和提纯
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:氢键是H与(N、O、F)等电负性大的元素以共价键结合的一种特殊分子间或 分子内相互作用力,所以杯酚与C60形成的不是氢键,故A错误;C60和C70是由碳元素 组成的不同单质,所以互为同素异形体,故B正确;两分子形成一体之间作用力为分 子间作用力,故C正确;利用杯酚分离C60和C70可以说明人类能够从分子层面上进行 分离和提纯,因为C60和C70单体为分子,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. 1 mol SCN-中含有σ键的数目为4 mol
B. FeCl3为分子晶体
D. [Fe(SCN) n (H2O)6- n ]3- n 中心离子的配位数为6
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 溶液颜色由黄色变为红色
B. [Fe(CN)6]3-中由Fe3+提供孤电子对,CN-提供空轨道
C. SCN-和CN-与Fe3+的配位能力:SCN->CN-
D. 1 mol K3[Fe(CN)6]中含σ键的物质的量为12 mol
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:K3[Fe(CN)6]在水中电离出K+和[Fe(CN)6]3-,[Fe(CN)6]3-中由Fe3+提 供空轨道,CN-提供孤电子对,向盛有少量蒸馏水的试管里滴加2滴K3[Fe(CN)6]溶 液,然后再滴加2滴KSCN溶液,溶液颜色不变,说明[Fe(CN)6]3-没有产生三价铁 离子,没有生成Fe(SCN)3,即SCN-和CN-与Fe3+的配位能力:CN->SCN-,据 此分析解答。向盛有少量蒸馏水的试管里滴加2滴K3[Fe(CN)6]溶液,然后再滴加2 滴硫氰化钾溶液,溶液不变色,A错误;[Fe(CN)6]3-中由Fe3+提供空轨道,CN- 提供孤电子对,B错误;K3[Fe(CN)6]溶液中滴加2滴硫氰化钾溶液时,溶液不变 色,说明SCN-和CN-与Fe3+的配位能力:CN->SCN-,C错误;[Fe(CN)6]3-中 Fe3+与CN-形成配位键,CN-中含有碳氮三键,1个三键中含有2个π键和1个σ键,所 以1 mol K3[Fe(CN)6]中含σ键的物质的量为2 mol×6=12 mol,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 此配合物中存在离子键、配位键、极性键
B. 配离子为[Fe(CN)5(NO)]2-,中心离子为Fe3+,配位数为6
C. 1 mol 配合物中σ键数目为10 NA
D. 该配合物为离子化合物,易电离,1 mol配合物电离共得到3 NA阴、阳离子
解析:Na+与[Fe(CN)5(NO)]2-存在离子键,NO分子、CN-与Fe3+形成配位 键,碳氮之间,氮氧之间存在极性共价键,A正确;NO分子、CN-与Fe3+形成配位 键,共有6个,B正确;1 mol配合物中σ键数目为(5×2+1×2)× NA=12 NA,C错 误;配合物Na2[Fe(CN)5(NO)]为离子化合物,电离出2个Na+与1个[Fe(CN)5 (NO)]2-,所以1 mol配合物电离共得到3 NA阴、阳离子,D正确。
C
1
2
3
4
5
6
7
8
9
10
11
12
A. Co和Br位于元素周期表的同一周期
B. 两种物质中基态钴离子的轨道表示式均为
C. ①中钴离子的配位数为6,配体为NH3、Br-
D. 可用AgNO3溶液鉴别①和②
B
1
2
3
4
5
6
7
8
9
10
11
12
解析:Co和Br原子核外有4个电子层,因此二者都是位于元素周期表的同一周期的元 素,A正确;在题述两种化合物中Co元素化合价为+3价,是Co原子价电子排布式为 3d74s2,失去最外层的2个4s电子和失去1个3d电子后得到Co3+,根据构造原理可知两 种物质中基态Co3+的轨道表示式均为 ,B错误;根据物质化学式可知①中Co3+的配位数为6,其中含有5个配体NH3、1个配体Br-,C正确;络合物中内界配离子不容易电离出来,而外界离子容易发生电离。根据两种钴的络合物化学式可知:①中Br-为内界配离子,向其中加入AgNO3溶液,无明显现象;②中Br-为外界离子,在溶液中容易电离,向其中加入AgNO3溶液,会产生浅黄色沉淀,实验现象不同,因此可用AgNO3溶液鉴别①和②,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
D
1
2
3
4
5
6
7
8
9
10
11
12
A. [Ni(NH3)6]2+在稀硫酸中能稳定存在
B. [Ni(NH3)6]2+中H—N—H的键角小于NH3中的键角
C. 向AgCl悬浊液中逐滴加入氨水,可以形成[Ag(NH3)2]Cl
D. 由于[Ni(NH3)6]SO4是配合物,故向其中滴加BaCl2溶液不会产生沉淀
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 二乙二胺合铜配离子[Cu(H2NCH2CH2NH2)2]2+的
结构如图所示,可知Cu2+的价电子排布式为3d9,
配位数为4,配体数也为4
C
B. 1 mol Fe(CO)5配合物中含有5 mol配位键
C. 配合物K4Fe(CN)6中的配位原子是C
D. 配合物[TiCl(H2O)5]Cl2·H2O中心离子为Ti3+,1 mol该配合物与AgNO3溶液作 用,生成3 mol AgCl
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(2)向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液,再加入氨水,观察到的现 象是 。
Ag+
N
2
先产生白色沉淀,加入氨水后,白色沉淀溶解
解析:(1)在配合物[Ag(NH3)2]OH中,中心离子是Ag+,配位原子是NH3分子中 的N原子,配位数是2。
解析:(3)Ni2+与NH3之间形成共价键时Ni2+提供空轨道,N提供孤电子对,形成配位键。
(3)在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为 ,提供孤电子 对的成键原子是 。
配位键
N
1
2
3
4
5
6
7
8
9
10
11
12
O
1
2
3
4
5
6
7
8
9
10
11
12
12. (2023·济宁高二期中)配位化合物在生产生活中有重要应用,请根据要求回答下 列问题:
(1)光谱证实单质铝与强碱性溶液反应有[Al(OH)4]-生成,则[Al(OH)4]-中存 在 (填序号)。
a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
解析:(1)[Al(OH)4]-中OH-和Al3+之间存在配位键,属于 共价键,也属于σ键,H和O之间形成共价键,属于极性键,为σ 键,因此选acd。
acd
1
2
3
4
5
6
7
8
9
10
11
12
(2)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的 配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,在第二种配合物的溶液中加BaCl2溶液时,则无明显现象。 则第一种配合物的结构式可表示为 ,第二种配合物的结构式 可表示为 。若在第二种配合物的溶液中滴加AgNO3溶液, 则产生的现象是 。(提示:TiCl(H2O)5Cl2这种
配合物的结构可表示为[TiCl(H2O)5]Cl2)
生成淡黄色沉淀
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(3)关于[Ti(NH3)5Cl]Cl2的说法中错误的是 (填字母)。
A. 1 mol [Ti(NH3)5Cl]Cl2含有σ键的数目为15 NA
B. 中心原子的化合价为+3价
C. 中心原子的配位数是6
D. 向含1 mol [Ti(NH3)5Cl]Cl2的水溶液中加入足量AgNO3溶液,产生3 mol白色沉淀
AD
解析:(3)关于[Ti(NH3)5Cl]Cl2的说法:NH3中含3个N—H键,6个配位键,则1 mol [Ti(NH3)5Cl]Cl2含有σ键的数目为(3×5+6) NA=21 NA,A错误;[Ti(NH3)5Cl]Cl2含[Ti(NH3)5Cl]2+,则中心Ti原子的化合价为+3价,B正确;配离子[Ti(NH3)5Cl]2+中Ti为中心原子,配体为NH3和Cl-,则配位数是6,C正确;[Ti(NH3)5Cl]Cl2中外界为2个Cl-,则向含1 mol [Ti(NH3)5Cl]Cl2的水溶液中加入足量AgNO3溶液,产生2 mol白色沉淀,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
(4)已知[Co(NH3)6]3+的立体结构如图,其中1~6处的小圆圈表示NH3分子,且 各相邻的NH3分子间的距离相等(图中虚线长度相等)。Co3+位于八面体的中心,若 其中两个NH3被Cl-取代,所形成的[Co(NH3)4Cl2]+的结构的数目为 。
解析:(4)两个Cl-可能在同一正方形的相邻顶点或相对顶点, 即[Co(NH3)6]3+中两个NH3被Cl-取代,所形成的[Co(NH3) 4Cl2]+有2种结构。
2
1
2
3
4
5
6
7
8
9
10
11
12
第三章 晶体结构与性质
第四节 配合物与超分子
学习目标:1.知道配位键的特点。2.认识简单的配位化合物的成键特征。3.了解配位 化合物的存在与应用。
第*页
研习任务一 配位键与配合物
教材 认知
1. 配位键
(1)配位键的概念
由一个原子单方面提供 ,而另一个原子提供 而形成的共价 键,即“电子对给予—接受”键,是一类特殊的共价键。
孤电子对
空轨道
(2)配位键的形成条件和表示方法
2. 配位化合物
(1)定义:金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体 或配位体)以 结合形成的化合物,简称配合物。
配位键
(2)实验探究配合物的形成
实验 操作 实验现象 有关离子方程式或原因分析
滴加氨水后,试管中首先出现 , 氨水过量后沉淀逐渐溶解得到深蓝色透明溶液,再滴加95% 8 mL乙醇后析出
蓝色沉淀
深蓝色晶体
实验 操作 实验现象 有关离子方程式或原因分析
溶液颜色 Fe3+与SCN-可形成血红色配离子
先有 沉淀,滴加氨水后,沉淀消失
变红
白色
(3)配合物的组成
配合物[Cu(NH3)4]SO4的组成如图所示:
空轨道
②配体:提供 的阴离子或分子,如Cl-、NH3、H2O等。配体中直接同 中心原子配位的原子叫做配位原子。配位原子必须是含有 的原子,如 NH3中的N原子,H2O中的O原子等。
③配位数:直接与中心原子形成的配位键的数目。如[Fe(CN)6]4-中Fe2+的配位数 为6。
孤电子对
孤电子对
(4)配位键与共价键的关系
①形成过程不同:配位键实质上是一种特殊的共价键,在配位键中一方提供孤电子 对,另一方提供具有能够接受孤电子对的空轨道。普通共价键的共用电子对是由成键 原子双方共同提供的。
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子 的金属离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与 CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分 子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO 中毒。
自我 排查
微判断
√
√
√
探究 活动
配位键实质是一种特殊的共价键,配位键的共用电子对由成键原子单方面提供,普通 共价键的共用电子对则由成键原子双方共同提供,但实质是相同的。
[问题探讨]
2. 配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些?
提示:[Cu(NH3)4]SO4中含有的化学键有离子键、共价键和配位键。
3. NH3和BF3可以通过配位键形成NH3·BF3,试分析提供孤电子对、空轨道的分别是 哪种原子?你能写出NH3·BF3的结构式吗?
提示:N原子提供孤电子对,B原子提供空轨道,NH3·BF3的结构式可表示 为 。
应用 体验
①H2O ②NH3 ③F- ④CN- ⑤OH-
A. 仅有①② B. 仅有①②③
C. 仅有①②④ D. ①②③④⑤
解析:水分子中的O原子有孤电子对,可以提供孤对电子与某些金属离子形成配位 键,①符合题意;NH3分子中N原子有孤电子对,可以提供孤对电子与某些金属离子 形成配位键,②符合题意;F-含有孤电子对,可以提供孤对电子与某些金属离子形 成配位键,③符合题意;CN-中C、N原子均有孤电子对,C原子电负性较小,更易给 出电子,与某些金属离子形成配位键,④符合题意;OH-中O原子有孤电子对,可以 提供孤对电子与某些金属离子形成配位键,⑤符合题意。
D
⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+
⑧[Ag(NH3)2]OH
A. ①②④⑦⑧ B. ③④⑤⑥⑦
C. ①④⑤⑥⑦⑧ D. 全部
解析:形成配位键的条件是一个原子(或离子)有孤电子对,另一个原子(或离子) 有空轨道。在②CH4、③OH-中不存在配位键。
C
A. 反应后溶液中没有沉淀,所以反应前后Ag+的浓度不变
B. 沉淀溶解后,生成的[Ag(NH3)2]OH难电离
C. 在[Ag(NH3)2]+中,Ag+给出孤对电子,NH3提供空轨道
D. 该实验能证明[Ag(NH3)2]+比AgOH稳定
D
A. 配位体是Cl-和H2O
B. 中心离子是Co3+,配离子是[Co(NH3)4Cl2]+
C. 内界和外界中的Cl-的数目比是1∶2
D. 加入足量AgNO3溶液,1 mol该配合物可生成3 mol AgCl
B
5. Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2-中的配位键: 。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有 (填字母)。
AC
A. 离子键 B. 金属键
C. 极性共价键 D. 非极性共价键
解析:(1)①Cu2+含有空轨道,OH-含有孤电子对,可形成配位键,配离子[Cu (OH)4]2-中1个Cu2+与4个OH-形成配位键,可表示为 ;②Na2[Cu (OH)4]为离子化合物,含有离子键,并且O—H为极性共价键。
解析:(2)过氧化氢可氧化Cu生成Cu2+,Cu2+与氨分子形成配位键。
过氧化氢为氧化
剂,将Cu氧化为Cu2+,氨分子与Cu2+形成配位键
配位键的稳定性
(1)电子对给予体形成配位键的能力:NH3>H2O。
(2)接受体形成配位键的能力:H+>过渡金属>主族金属。
(3)配位键越强,配合物越稳定。如稳定性:Cu2+←OH-<Cu2+←NH3<H+ ←NH3。
第*页
研习任务二 超分子
两种或两种以上
分子间相互作用
非共价键
氢键
静电作
用
疏水作用
弱配位键
有限
无限
分子识别
自组装
3. 应用实例——分子识别
(1)分离C60和“杯酚”,如图所示。
(2)冠醚识别碱金属离子。不同大小的冠醚可以识别不同大小的碱金属离子,如图 所示。
A. 超分子是如蛋白质一样的大分子
B. 超分子是由小分子通过聚合得到的高分子
C. 超分子是由高分子通过非化学键作用形成的分子聚集体
D. 超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体
解析:超分子不同于蛋白质、淀粉等大分子,也不同于高分子,超分子是由两种或两 种以上的分子通过分子间相互作用形成的分子聚集体。
D
A. 氢键、静电作用、疏水作用均可形成超分子中的作用力
B. 超分子都是无限伸展的
C. 冠醚可以识别碱金属离子
D. 细胞和细胞器的双分子膜具有自组装性质
解析:超分子通常是指由两种或两种以上分子依靠分子间相互作用结合在一起,分子 间相互作用包括:氢键、静电作用、疏水作用等,故A正确;超分子有的是有限的, 有的是无限伸展的,故B错误;冠醚与碱金属离子形成超分子,可以识别碱金属离 子,故C正确;细胞和细胞器的双分子膜具有自组装性质,生物体的细胞即是由各种 生物分子自组装而成,故D正确。
B
A. C70能溶于甲苯,C60不溶于甲苯
B. C60能与“杯酚”形成超分子
C. C70不能与“杯酚”形成超分子
D. “杯酚”能够循环使用
A
解析:由题图可知,C60能够与“杯酚”通过分子
间作用力形成超分子,而C70不能,C60与“杯酚”形成的
超分子不能溶于甲苯,但不能证明C60是否能溶于甲苯,A
项错误,B、C项正确;通过溶剂氯仿的作用,破坏“杯酚”与C60形成的超分子,可实现将C60与C70分离,且“杯酚”能够循环使用,D项正确。
4. 利用超分子可分离C60和C70。将C60、C70混合物加入一种空腔大小适配C60的杯酚中 进行分离的流程如图所示。
A. 该流程体现了超分子具有“分子识别”的特征
B. 杯酚分子中存在大π键
C. 杯酚与C60形成氢键
D. C60与金刚石晶体类型不同
C
解析:该流程体现了超分子能够识别C60,A正确;杯酚分子中含有苯环结构,存在大 π键,B项正确;杯酚与C60形成的不是氢键,C项错误;金刚石是共价晶体,C60为分 子晶体,二者晶体类型不同,D项正确。
第*页
课堂强研习 合作学习 精研重难
课时作业
1. (2024·长春高二期末)冠醚能与阳离子作用,将阳离子以及对应的阴离子都带入 有机溶剂,例如KMnO4水溶液对烯烃的氧化效果较差,在烯烃中溶入冠醚,可使氧 化反应迅速发生,原理如图。
A. 冠醚属于超分子
C. K+通过弱配位键与冠醚相结合
D. 冠醚中C、O原子间的化学键为σ键
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 杯酚分子与C60可以形成分子间氢键
B. C60和C70互为同素异形体
C. 图中杯酚分子与C60可能是借助分子间作用力形成超分子
D. 利用杯酚分离C60和C70说明人类已经能够从分子层面进行物质的分离和提纯
A
1
2
3
4
5
6
7
8
9
10
11
12
解析:氢键是H与(N、O、F)等电负性大的元素以共价键结合的一种特殊分子间或 分子内相互作用力,所以杯酚与C60形成的不是氢键,故A错误;C60和C70是由碳元素 组成的不同单质,所以互为同素异形体,故B正确;两分子形成一体之间作用力为分 子间作用力,故C正确;利用杯酚分离C60和C70可以说明人类能够从分子层面上进行 分离和提纯,因为C60和C70单体为分子,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. 1 mol SCN-中含有σ键的数目为4 mol
B. FeCl3为分子晶体
D. [Fe(SCN) n (H2O)6- n ]3- n 中心离子的配位数为6
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 溶液颜色由黄色变为红色
B. [Fe(CN)6]3-中由Fe3+提供孤电子对,CN-提供空轨道
C. SCN-和CN-与Fe3+的配位能力:SCN->CN-
D. 1 mol K3[Fe(CN)6]中含σ键的物质的量为12 mol
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:K3[Fe(CN)6]在水中电离出K+和[Fe(CN)6]3-,[Fe(CN)6]3-中由Fe3+提 供空轨道,CN-提供孤电子对,向盛有少量蒸馏水的试管里滴加2滴K3[Fe(CN)6]溶 液,然后再滴加2滴KSCN溶液,溶液颜色不变,说明[Fe(CN)6]3-没有产生三价铁 离子,没有生成Fe(SCN)3,即SCN-和CN-与Fe3+的配位能力:CN->SCN-,据 此分析解答。向盛有少量蒸馏水的试管里滴加2滴K3[Fe(CN)6]溶液,然后再滴加2 滴硫氰化钾溶液,溶液不变色,A错误;[Fe(CN)6]3-中由Fe3+提供空轨道,CN- 提供孤电子对,B错误;K3[Fe(CN)6]溶液中滴加2滴硫氰化钾溶液时,溶液不变 色,说明SCN-和CN-与Fe3+的配位能力:CN->SCN-,C错误;[Fe(CN)6]3-中 Fe3+与CN-形成配位键,CN-中含有碳氮三键,1个三键中含有2个π键和1个σ键,所 以1 mol K3[Fe(CN)6]中含σ键的物质的量为2 mol×6=12 mol,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 此配合物中存在离子键、配位键、极性键
B. 配离子为[Fe(CN)5(NO)]2-,中心离子为Fe3+,配位数为6
C. 1 mol 配合物中σ键数目为10 NA
D. 该配合物为离子化合物,易电离,1 mol配合物电离共得到3 NA阴、阳离子
解析:Na+与[Fe(CN)5(NO)]2-存在离子键,NO分子、CN-与Fe3+形成配位 键,碳氮之间,氮氧之间存在极性共价键,A正确;NO分子、CN-与Fe3+形成配位 键,共有6个,B正确;1 mol配合物中σ键数目为(5×2+1×2)× NA=12 NA,C错 误;配合物Na2[Fe(CN)5(NO)]为离子化合物,电离出2个Na+与1个[Fe(CN)5 (NO)]2-,所以1 mol配合物电离共得到3 NA阴、阳离子,D正确。
C
1
2
3
4
5
6
7
8
9
10
11
12
A. Co和Br位于元素周期表的同一周期
B. 两种物质中基态钴离子的轨道表示式均为
C. ①中钴离子的配位数为6,配体为NH3、Br-
D. 可用AgNO3溶液鉴别①和②
B
1
2
3
4
5
6
7
8
9
10
11
12
解析:Co和Br原子核外有4个电子层,因此二者都是位于元素周期表的同一周期的元 素,A正确;在题述两种化合物中Co元素化合价为+3价,是Co原子价电子排布式为 3d74s2,失去最外层的2个4s电子和失去1个3d电子后得到Co3+,根据构造原理可知两 种物质中基态Co3+的轨道表示式均为 ,B错误;根据物质化学式可知①中Co3+的配位数为6,其中含有5个配体NH3、1个配体Br-,C正确;络合物中内界配离子不容易电离出来,而外界离子容易发生电离。根据两种钴的络合物化学式可知:①中Br-为内界配离子,向其中加入AgNO3溶液,无明显现象;②中Br-为外界离子,在溶液中容易电离,向其中加入AgNO3溶液,会产生浅黄色沉淀,实验现象不同,因此可用AgNO3溶液鉴别①和②,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
D
1
2
3
4
5
6
7
8
9
10
11
12
A. [Ni(NH3)6]2+在稀硫酸中能稳定存在
B. [Ni(NH3)6]2+中H—N—H的键角小于NH3中的键角
C. 向AgCl悬浊液中逐滴加入氨水,可以形成[Ag(NH3)2]Cl
D. 由于[Ni(NH3)6]SO4是配合物,故向其中滴加BaCl2溶液不会产生沉淀
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 二乙二胺合铜配离子[Cu(H2NCH2CH2NH2)2]2+的
结构如图所示,可知Cu2+的价电子排布式为3d9,
配位数为4,配体数也为4
C
B. 1 mol Fe(CO)5配合物中含有5 mol配位键
C. 配合物K4Fe(CN)6中的配位原子是C
D. 配合物[TiCl(H2O)5]Cl2·H2O中心离子为Ti3+,1 mol该配合物与AgNO3溶液作 用,生成3 mol AgCl
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(2)向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液,再加入氨水,观察到的现 象是 。
Ag+
N
2
先产生白色沉淀,加入氨水后,白色沉淀溶解
解析:(1)在配合物[Ag(NH3)2]OH中,中心离子是Ag+,配位原子是NH3分子中 的N原子,配位数是2。
解析:(3)Ni2+与NH3之间形成共价键时Ni2+提供空轨道,N提供孤电子对,形成配位键。
(3)在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为 ,提供孤电子 对的成键原子是 。
配位键
N
1
2
3
4
5
6
7
8
9
10
11
12
O
1
2
3
4
5
6
7
8
9
10
11
12
12. (2023·济宁高二期中)配位化合物在生产生活中有重要应用,请根据要求回答下 列问题:
(1)光谱证实单质铝与强碱性溶液反应有[Al(OH)4]-生成,则[Al(OH)4]-中存 在 (填序号)。
a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
解析:(1)[Al(OH)4]-中OH-和Al3+之间存在配位键,属于 共价键,也属于σ键,H和O之间形成共价键,属于极性键,为σ 键,因此选acd。
acd
1
2
3
4
5
6
7
8
9
10
11
12
(2)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的 配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,在第二种配合物的溶液中加BaCl2溶液时,则无明显现象。 则第一种配合物的结构式可表示为 ,第二种配合物的结构式 可表示为 。若在第二种配合物的溶液中滴加AgNO3溶液, 则产生的现象是 。(提示:TiCl(H2O)5Cl2这种
配合物的结构可表示为[TiCl(H2O)5]Cl2)
生成淡黄色沉淀
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(3)关于[Ti(NH3)5Cl]Cl2的说法中错误的是 (填字母)。
A. 1 mol [Ti(NH3)5Cl]Cl2含有σ键的数目为15 NA
B. 中心原子的化合价为+3价
C. 中心原子的配位数是6
D. 向含1 mol [Ti(NH3)5Cl]Cl2的水溶液中加入足量AgNO3溶液,产生3 mol白色沉淀
AD
解析:(3)关于[Ti(NH3)5Cl]Cl2的说法:NH3中含3个N—H键,6个配位键,则1 mol [Ti(NH3)5Cl]Cl2含有σ键的数目为(3×5+6) NA=21 NA,A错误;[Ti(NH3)5Cl]Cl2含[Ti(NH3)5Cl]2+,则中心Ti原子的化合价为+3价,B正确;配离子[Ti(NH3)5Cl]2+中Ti为中心原子,配体为NH3和Cl-,则配位数是6,C正确;[Ti(NH3)5Cl]Cl2中外界为2个Cl-,则向含1 mol [Ti(NH3)5Cl]Cl2的水溶液中加入足量AgNO3溶液,产生2 mol白色沉淀,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
(4)已知[Co(NH3)6]3+的立体结构如图,其中1~6处的小圆圈表示NH3分子,且 各相邻的NH3分子间的距离相等(图中虚线长度相等)。Co3+位于八面体的中心,若 其中两个NH3被Cl-取代,所形成的[Co(NH3)4Cl2]+的结构的数目为 。
解析:(4)两个Cl-可能在同一正方形的相邻顶点或相对顶点, 即[Co(NH3)6]3+中两个NH3被Cl-取代,所形成的[Co(NH3) 4Cl2]+有2种结构。
2
1
2
3
4
5
6
7
8
9
10
11
12
