人教版高中化学选择性必修2第一章原子结构与性质第一节第一课时能层与能级基态与激发态原子光谱课件(共41张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修2第一章原子结构与性质第一节第一课时能层与能级基态与激发态原子光谱课件(共41张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-18 17:28:50 | ||
图片预览











文档简介
(共41张PPT)
第一章 原子结构与性质
第一节 原子结构
第一课时 能层与能级 基态与激发态 原子光谱
学习目标:1.认识原子的核外电子排布,知道原子核外电子排布遵循的规则。2.知道 原子的基态和激发态的含义。3.知道原子核外电子的跃迁及吸收光谱和发射光谱,了 解其简单应用。
第*页
研习任务一 能层与能级
教材 认知
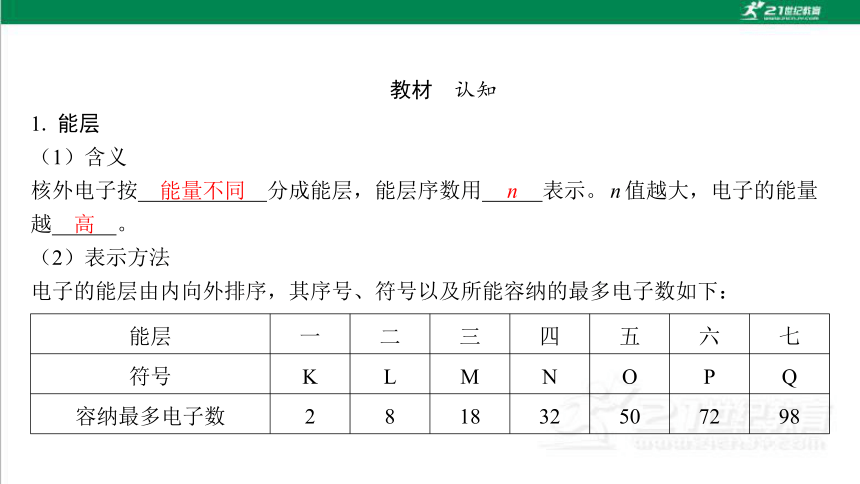
1. 能层
(1)含义
核外电子按 分成能层,能层序数用 表示。 n 值越大,电子的能量 越 。
(2)表示方法
电子的能层由内向外排序,其序号、符号以及所能容纳的最多电子数如下:
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
容纳最多电子数 2 8 18 32 50 72 98
能量不同
n
高
能级
n s
n p
n d
n f
等于
3s、3p、
3d
2
3. 能层、能级与其容纳的最多电子数之间的关系
1s
2s
2p
3p
3d
4s
4p
4d
4f
5s
2
8
18
32
4. 能层与能级的能量比较
(1)能层越高,电子的能量越高,能量的高低顺序为 E (K)< E (L)< E (M) < E (N)< E (O)< E (P)< E (Q)。
(2)同一能层各能级能量由低到高的顺序是 E ( n s)< E ( n p)< E ( n d)< E ( n f)……
(3)不同能层中同一能级,能层数越大,能量越高。例如: E (1s)< E (2s)< E (3s)< E (4s)……
√
探究 活动
如图所示,在多电子原子中,核外电子是分层排布的。
[问题探讨]
1. 多电子原子中,各电子的能量是否相同?
提示:多电子原子中,各电子的能量是不同的。
2. 核外电子共分为几个能层?它们的能量高低顺序是什么?
提示:核外电子共分7个能层,由内向外能量越来越高。
3. 同一原子中同一能层不同能级的电子最根本的区别是什么?
提示:将同一能层中的电子划分为不同能级的依据是能量大小不同。
4. 理论上第8能层有几个能级?该能层最多能容纳多少个电子?
提示:由能级数=能层序数知,第8能层有8个能级,每一能层最多容纳的电子数为2 n2,则该能层可容纳128个电子。
A. ①④ B. ②③
C. ③④ D. ①②
解析:s能级在每一层上都有,因此存在1s能级,故①正确;d能级至少在第三层及以 上,第二能层只有2s、2p能级,故②错误;f能级至少在第四层及以上,第三能层只 有3s、3p、3d能级,故③错误;p能级至少在第二层及以上,因此存在4p能级,故④ 正确;故选A。
A
A. 各能级最多可容纳的电子数按s、p、d、f……的顺序依次为1、3、5、7……的2倍
B. 各能层的能级都是从s能级开始至f能级结束
C. 各能层含有的能级数为 n -1
D. 各能层含有的电子数为2 n2
解析:按s、p、d、f……排序的各能级可容纳的最多电子数依次为1、3、5、7……的 2倍,A说法正确;任一能层的能级总是从s能级开始,但不一定至f能级结束,B说法 错误;能级数等于该能层序数,C说法错误;每个能层可容纳的最多电子数为2 n2,但 不一定含有2 n2个电子,D说法错误。
A
A. 原子核外每能层最多可容纳的电子数为 n2
B. 能层序数较大的能级,能量不一定较高
C. 同一原子中,1s、2s、3s电子的能量逐渐减小
D. 同一原子中,2p、3p、4p能容纳的电子数逐渐增多
解析:原子核外每能层最多可容纳的电子数为2 n2,故A错误;能层序数越大的能 级,能量不一定越高,如4s的能量低于3d,故B正确;不同能层的s轨道,能层序数越 大,其能量越高,即 E (1s)< E (2s)< E (3s),故C错误;p能级上有3个原子轨 道,能容纳的电子数相同,故D错误。
B
A. M电子层有s、p共2个能级,最多能容纳8个电子
B. 3d能级最多容纳5个电子,3f能级最多容纳7个电子
C. 无论哪一电子层的s能级最多容纳的电子数均为2
D. 任一电子层都有s、p能级,但不一定有d能级
解析:M电子层有3s、3p、3d共3个能级,最多能容纳18个电子,故A错误;3d能级最 多容纳10个电子,3f能级是不存在的,故B错误;s能级容纳电子数最多为2,无论哪 一电子层的s能级最多容纳的电子数均为2,故C正确;K电子层只有s能级,不含p能 级,故D错误。
C
5. 比较各能层或能级中电子能量大小:
(1) E (2s) E (4s);
(2) E (3p) E (3d);
(3) E (5d) E (4d);
(4) E (3s) E (2p);
(5) E (K) E (L) E (M)。
解析:不同能层的能量按K、L、M、N、O、P、Q……的顺序依次升高,同一能层 里,各能级的能量按s、p、d、f……的顺序依次升高。
<
<
>
>
<
<
(1)任何能层均含有s能级,但并不是任何能层都含有p、d、f能级。如第二能层中 不含d能级。
(2)能层与能级数的关系可用如图表示:
第*页
研习任务二 基态与激发态 原子光谱
教材 认知
1. 基态与激发态
(1)基态原子
处于 状态的原子叫做基态原子。
(2)激发态原子
基态原子 能量,它的电子会跃迁到 能级,变为激发态原子。
(3)基态原子与激发态原子的关系
最低能量
吸收
较高
2. 光谱
(1)原子光谱
不同元素原子的电子发生跃迁时会 或 不同的光,可以用光谱仪摄取 各种元素原子的 或 ,总称原子光谱。
(2)光谱分析
在现代化学中,常利用原子光谱上的 来鉴定元素,称为光谱分析。
吸收
释放
吸收光谱
发射光谱
特征谱线
氦
释
放
√
×
√
×
√
×
探究 活动
每到夜幕降临的时候,大街上的霓虹灯就会渐渐亮起来,整个城市也变得那么迷人, 霓虹灯内因为充有稀薄氖气或其他稀有气体才会发出颜色各异的光,你知道霓虹灯为 什么能发出颜色各异的光吗?
[问题探讨]
1. 我们看到的LED灯光、霓虹灯光、激光、焰火都与什么有关?
提示:与原子核外电子发生跃迁有关。
2. 什么是基态原子和激发态原子?
提示:处于最低能量状态的原子叫做基态原子。基态原子吸收能量,它的电子会跃迁 到较高能级,变为激发态原子。
3. 某些金属进行焰色试验产生不同火焰颜色的原因是什么?
提示:某些金属原子的电子在高温火焰中,吸收能量,使原子外层的电子从基态跃迁 到激发态;处于激发态的电子是不稳定的,在极短的时间内(约10-8 s)便跃迁到基 态或较低能级上,在跃迁过程中将产生发射光谱。
A. 原子中的电子在跃迁时会发生能量的变化,能量的表现形式之一是光(辐射), 这也是原子光谱产生的原因
B. 霓虹灯光、激光、焰火、物理成像都与电子跃迁释放能量有关
C. 通过原子光谱可以发现新的元素,也可以鉴定某些元素
D. 同一原子的发射光谱和吸收光谱的特征谱线位置相同
B
解析:原子中的电子在跃迁时会发生能量的变化,能量的表现形式之一是光(辐 射),不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元 素的电子的吸收光谱或发生光谱,故A正确;焰火、激光、霓虹灯光都与电子跃迁释 放能量有关,而物理成像与电子跃迁释放能量无关,故B错误;不同元素的原子发生 跃迁时会吸收或释放不同的光,许多元素是通过原子光谱发现的,如铯和铷;在现代 化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析,故C正确;同一 原子的发射光谱和吸收光谱的特征谱线位置相同,故D正确。
A. 基态时的能量比激发态时高
B. 激发态时比较稳定
C. 由基态转化为激发态过程中吸收能量
D. 电子仅在激发态跃迁到基态时才会产生原子光谱
解析:激发态时能量较高,较不稳定,A、B不正确。电子从较低能量的基态跃迁到 较高能量的激发态时,也会产生原子光谱,D不正确。
C
A. ③④ B. ①②③⑤
C. ④ D. ①②③④
解析:棱镜分光是由于不同色彩的光在玻璃中的折射率不同引起的,与电子跃迁无 关,故①不符合题意;石油蒸馏是利用石油中各成分的沸点不同加以分离,与电子跃 迁无关,故②不符合题意;凸透镜聚光是由光的折射形成的,与电子跃迁无关,故③ 不符合题意;日光灯通电发光是因为电子发生能级跃迁时将多余的能量以光的形式放 出,与电子跃迁有关,故④符合题意;冷却结晶是由于温度降低,溶质的溶解度减小 而析出,与电子跃迁无关,故⑤不符合题意。
C
A. 焰色试验是化学变化
B. 在现代化学中,常利用光谱分析法来鉴定元素
C. 同一原子处于激发态时的能量一定大于其处于基态时的能量
D. 焰色试验中观察到的特殊焰色是金属原子的电子从激发态跃迁到基态时产生的光 的颜色
解析:焰色试验是物理变化,A项错误;不同元素的特征谱线不同,故可以利用光谱 分析法来鉴定元素,B项正确;基态是原子能量最低时的状态,C项正确;焰色试验 中观察到的特殊焰色是金属原子的电子从激发态跃迁到基态时产生的光的颜色,D项 正确。
A
第*页
课堂强研习 合作学习 精研重难
课时作业
A. K层上的电子能量比L层上的电子能量低
B. 激发态原子释放能量一定变成基态原子
C. M能层有3s、3p两个能级
D. 3d能级最多可容纳5个电子
解析:离核越远的电子能量越高,则K层上的电子能量比L层上的电子能量低,A正 确;激发态原子释放能量不一定变成基态原子,可能变为较低能量的激发态,B错 误;M能层有3s、3p、3d三个能级,C错误;3d能级最多可容纳10个电子,D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 能层就是电子层
B. 不同能层,s能级能量相同
C. s能级的能量一定比p能级的低
D. 高能层的所有能级能量都比低能层能级能量高
解析:能层是电子层,A正确;不同能层,s能级能量不同,能层越大,s能级能量越 高,B错误;s能级的能量也有可能比p能级高,如4s能级的能量高于2p能级的能量,C 错误;高能层能级的能量不一定比低能层能级的能量高,如3d能级的能量比4s能级的 能量高,D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 1 B. 3 C. 9 D. 18
解析:能级数目=该能层序数,M能层是第三能层,含有3个能级,分别是3s、3p、 3d。
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 多电子原子的所有电子在同一区域里运动
B. 能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
C. 处于最低能量状态的原子叫基态原子
D. 同一原子中,1s、2s、3s所能容纳的电子数越来越多
解析:原子核外有多电子时,电子的能量不尽相同,电子不可能都在同一区域里运 动,而是分层排布的,A项错误;能量低的电子在离原子核近的区域,而能量高的电 子在离核远的区域,B项错误;s能级最多容纳2个电子,与其所在能层高低无关,D 项错误。
C
1
2
3
4
5
6
7
8
9
10
11
12
A. 自然界中所有原子都处于基态
B. 同一原子处于激发态时的能量一定高于基态时的能量
C. 无论原子种类是否相同,基态原子的能量总是低于激发态原子的能量
D. 激发态原子的能量较高,极易失去电子,表现出较强的还原性
B
解析:自然界中的原子有的处于基态,有的处于激发态,放射性元素处于激发态,A 说法错误;同一种原子处于激发态时的能量一定高于基态时的能量,B说法正确;不 同原子的基态原子的能量不一定低于激发态原子的能量,但同一种原子激发态时的能 量一定高于基态时的能量,C说法错误;激发态原子的能量较高,容易跃迁到能量较 低的激发态或基态,能量降低。激发态原子若要失去电子,仍必须再吸收能量,失去 电子难易程度需根据原子的具体情况而定,有的激发态原子易失去电子,有的激发态 原子难失去电子,D说法错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. 元素K的焰色试验呈紫红色,其中紫色对应的
辐射波长约为700 nm
B. 以上实验装置测得的是氢元素的吸收光谱
C. 电子仅从激发态跃迁到基态时才会产生原子光谱
D. 原子光谱可以用于定性鉴定元素
D
解析:元素K的焰色试验呈紫红色,紫色对应的辐射波长不是700 nm,A错误; 该实验装置测得的是氢元素的发射光谱,B错误;原子光谱有吸收光谱和发射光 谱两种,电子由激发态跃迁到基态时产生的原子光谱属于发射光谱,电子由基 态跃迁到激发态时产生的原子光谱属于吸收光谱,C错误;原子光谱可以用于定 性鉴定元素,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. N层不含电子
B. 该元素是硫元素
C. L层一定有8个电子
D. 原子最外层电子数为4
解析:依题意可知,该元素原子K、L、M层容纳的电子数分别为2、8、6,N层不含 电子,故该元素是硫元素,其原子最外层电子数应为6,D项错误。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. ①③⑥⑦ B. ②④⑤⑧
C. ①③⑤⑥⑦ D. ①②③⑤⑥⑦
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 同一能层中不同能级的能量高低不同
B. 原子核外每个能层容纳的电子数都是 n2( n 表示能层序数)
C. d能级最多能容纳10个电子
D. 任一能层的能级总是从s能级开始
解析:同一能层中不同能级的能量高低不相同,如2s<2p,A正确;原子核外每个能 层最多容纳电子数都是2 n2( n 为电子层数),故B错误;d能级最多能容纳10个电 子,故C正确;由分析可知,任一能层的能级总是从s能级开始,故D正确。
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 各能层含有的能级数等于能层序数减1
B. 3d、4d能级所容纳的最多电子数相同
C. 各能层所含有的电子数一定是该能层序数平方的2倍
D. 不同能层中的s能级的能量高低相同
解析:各能层的能级数等于其能层序数,A项错误;3d、4d能级所容纳的最多电子数 都是10,B项正确;各能层所含有的电子数不一定是该能层序数平方的2倍,例如H原 子的K能层只有1个电子,C项错误;不同能层中的s能级的能量高低不同,如1s<2s< 3s<4s,D项错误。
B
1
2
3
4
5
6
7
8
9
10
11
12
11. (1)用符号填写能层所含能级种类:
K层: ;L层: ;
M层: ;N层: 。
1s
2s、2p
3s、3p、3d
4s、4p、4d、4f
解析:(1)各能层含有的能级数与能层序数相等,故K层:1s;L层:2s、2p;M 层:3s、3p、3d;N层:4s、4p、4d、4f。
(2)用数字填写能级所能容纳的最多电子数目:
s: ;p: ;d: ;f: 。
2
6
10
14
1
2
3
4
5
6
7
8
9
10
11
12
(3)比较下列能级的能量高低(填“<”“=”或“>”)。
① E (4s) E (3s) E (2s) E (1s);
② E (4f) E (4d) E (4p) E (4s);
③ E (1s) E (2p) E (3d) E (4f)。
>
>
>
>
>
>
<
<
<
解析:(3)在原子核外电子排布中,各能级能量高低顺序为①能级符号相同时,能层序数越大,能级能量越高,则 E (1s)< E (2s)< E (3s)< E (4s);②相同能层而不同能级的能量高低顺序为 E ( n s)< E ( n p)< E ( n d)< E ( n f)……;所以 E (4f)> E (4d)> E (4p)> E (4s);③不同能层不同能级,一般能层越高能量越大,所以能量大小顺序是 E (1s)< E (2p)< E (3d)< E (4f)。
1
2
3
4
5
6
7
8
9
10
11
12
12. (1)某元素的原子序数为13,则
①此元素原子的电子总数是 ;
②该元素原子有 个能层,共有 个能级;
③该元素原子能量最低的能级符号是 ,能量最高的能层是 。
13
3
5
1s
M
(2)基态Ca原子中,核外电子占据最高能层的符号为 ,该能层上有 个能 级,含有的电子数为 。
(3)下列现象和应用与电子跃迁有关的是 。
A. 激光 B. 焰色试验 C. 原子光谱 D. 燃烧放热 E. 石墨导电
N
4
2
ABC
1
2
3
4
5
6
7
8
9
10
11
12
第一章 原子结构与性质
第一节 原子结构
第一课时 能层与能级 基态与激发态 原子光谱
学习目标:1.认识原子的核外电子排布,知道原子核外电子排布遵循的规则。2.知道 原子的基态和激发态的含义。3.知道原子核外电子的跃迁及吸收光谱和发射光谱,了 解其简单应用。
第*页
研习任务一 能层与能级
教材 认知
1. 能层
(1)含义
核外电子按 分成能层,能层序数用 表示。 n 值越大,电子的能量 越 。
(2)表示方法
电子的能层由内向外排序,其序号、符号以及所能容纳的最多电子数如下:
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
容纳最多电子数 2 8 18 32 50 72 98
能量不同
n
高
能级
n s
n p
n d
n f
等于
3s、3p、
3d
2
3. 能层、能级与其容纳的最多电子数之间的关系
1s
2s
2p
3p
3d
4s
4p
4d
4f
5s
2
8
18
32
4. 能层与能级的能量比较
(1)能层越高,电子的能量越高,能量的高低顺序为 E (K)< E (L)< E (M) < E (N)< E (O)< E (P)< E (Q)。
(2)同一能层各能级能量由低到高的顺序是 E ( n s)< E ( n p)< E ( n d)< E ( n f)……
(3)不同能层中同一能级,能层数越大,能量越高。例如: E (1s)< E (2s)< E (3s)< E (4s)……
√
探究 活动
如图所示,在多电子原子中,核外电子是分层排布的。
[问题探讨]
1. 多电子原子中,各电子的能量是否相同?
提示:多电子原子中,各电子的能量是不同的。
2. 核外电子共分为几个能层?它们的能量高低顺序是什么?
提示:核外电子共分7个能层,由内向外能量越来越高。
3. 同一原子中同一能层不同能级的电子最根本的区别是什么?
提示:将同一能层中的电子划分为不同能级的依据是能量大小不同。
4. 理论上第8能层有几个能级?该能层最多能容纳多少个电子?
提示:由能级数=能层序数知,第8能层有8个能级,每一能层最多容纳的电子数为2 n2,则该能层可容纳128个电子。
A. ①④ B. ②③
C. ③④ D. ①②
解析:s能级在每一层上都有,因此存在1s能级,故①正确;d能级至少在第三层及以 上,第二能层只有2s、2p能级,故②错误;f能级至少在第四层及以上,第三能层只 有3s、3p、3d能级,故③错误;p能级至少在第二层及以上,因此存在4p能级,故④ 正确;故选A。
A
A. 各能级最多可容纳的电子数按s、p、d、f……的顺序依次为1、3、5、7……的2倍
B. 各能层的能级都是从s能级开始至f能级结束
C. 各能层含有的能级数为 n -1
D. 各能层含有的电子数为2 n2
解析:按s、p、d、f……排序的各能级可容纳的最多电子数依次为1、3、5、7……的 2倍,A说法正确;任一能层的能级总是从s能级开始,但不一定至f能级结束,B说法 错误;能级数等于该能层序数,C说法错误;每个能层可容纳的最多电子数为2 n2,但 不一定含有2 n2个电子,D说法错误。
A
A. 原子核外每能层最多可容纳的电子数为 n2
B. 能层序数较大的能级,能量不一定较高
C. 同一原子中,1s、2s、3s电子的能量逐渐减小
D. 同一原子中,2p、3p、4p能容纳的电子数逐渐增多
解析:原子核外每能层最多可容纳的电子数为2 n2,故A错误;能层序数越大的能 级,能量不一定越高,如4s的能量低于3d,故B正确;不同能层的s轨道,能层序数越 大,其能量越高,即 E (1s)< E (2s)< E (3s),故C错误;p能级上有3个原子轨 道,能容纳的电子数相同,故D错误。
B
A. M电子层有s、p共2个能级,最多能容纳8个电子
B. 3d能级最多容纳5个电子,3f能级最多容纳7个电子
C. 无论哪一电子层的s能级最多容纳的电子数均为2
D. 任一电子层都有s、p能级,但不一定有d能级
解析:M电子层有3s、3p、3d共3个能级,最多能容纳18个电子,故A错误;3d能级最 多容纳10个电子,3f能级是不存在的,故B错误;s能级容纳电子数最多为2,无论哪 一电子层的s能级最多容纳的电子数均为2,故C正确;K电子层只有s能级,不含p能 级,故D错误。
C
5. 比较各能层或能级中电子能量大小:
(1) E (2s) E (4s);
(2) E (3p) E (3d);
(3) E (5d) E (4d);
(4) E (3s) E (2p);
(5) E (K) E (L) E (M)。
解析:不同能层的能量按K、L、M、N、O、P、Q……的顺序依次升高,同一能层 里,各能级的能量按s、p、d、f……的顺序依次升高。
<
<
>
>
<
<
(1)任何能层均含有s能级,但并不是任何能层都含有p、d、f能级。如第二能层中 不含d能级。
(2)能层与能级数的关系可用如图表示:
第*页
研习任务二 基态与激发态 原子光谱
教材 认知
1. 基态与激发态
(1)基态原子
处于 状态的原子叫做基态原子。
(2)激发态原子
基态原子 能量,它的电子会跃迁到 能级,变为激发态原子。
(3)基态原子与激发态原子的关系
最低能量
吸收
较高
2. 光谱
(1)原子光谱
不同元素原子的电子发生跃迁时会 或 不同的光,可以用光谱仪摄取 各种元素原子的 或 ,总称原子光谱。
(2)光谱分析
在现代化学中,常利用原子光谱上的 来鉴定元素,称为光谱分析。
吸收
释放
吸收光谱
发射光谱
特征谱线
氦
释
放
√
×
√
×
√
×
探究 活动
每到夜幕降临的时候,大街上的霓虹灯就会渐渐亮起来,整个城市也变得那么迷人, 霓虹灯内因为充有稀薄氖气或其他稀有气体才会发出颜色各异的光,你知道霓虹灯为 什么能发出颜色各异的光吗?
[问题探讨]
1. 我们看到的LED灯光、霓虹灯光、激光、焰火都与什么有关?
提示:与原子核外电子发生跃迁有关。
2. 什么是基态原子和激发态原子?
提示:处于最低能量状态的原子叫做基态原子。基态原子吸收能量,它的电子会跃迁 到较高能级,变为激发态原子。
3. 某些金属进行焰色试验产生不同火焰颜色的原因是什么?
提示:某些金属原子的电子在高温火焰中,吸收能量,使原子外层的电子从基态跃迁 到激发态;处于激发态的电子是不稳定的,在极短的时间内(约10-8 s)便跃迁到基 态或较低能级上,在跃迁过程中将产生发射光谱。
A. 原子中的电子在跃迁时会发生能量的变化,能量的表现形式之一是光(辐射), 这也是原子光谱产生的原因
B. 霓虹灯光、激光、焰火、物理成像都与电子跃迁释放能量有关
C. 通过原子光谱可以发现新的元素,也可以鉴定某些元素
D. 同一原子的发射光谱和吸收光谱的特征谱线位置相同
B
解析:原子中的电子在跃迁时会发生能量的变化,能量的表现形式之一是光(辐 射),不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元 素的电子的吸收光谱或发生光谱,故A正确;焰火、激光、霓虹灯光都与电子跃迁释 放能量有关,而物理成像与电子跃迁释放能量无关,故B错误;不同元素的原子发生 跃迁时会吸收或释放不同的光,许多元素是通过原子光谱发现的,如铯和铷;在现代 化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析,故C正确;同一 原子的发射光谱和吸收光谱的特征谱线位置相同,故D正确。
A. 基态时的能量比激发态时高
B. 激发态时比较稳定
C. 由基态转化为激发态过程中吸收能量
D. 电子仅在激发态跃迁到基态时才会产生原子光谱
解析:激发态时能量较高,较不稳定,A、B不正确。电子从较低能量的基态跃迁到 较高能量的激发态时,也会产生原子光谱,D不正确。
C
A. ③④ B. ①②③⑤
C. ④ D. ①②③④
解析:棱镜分光是由于不同色彩的光在玻璃中的折射率不同引起的,与电子跃迁无 关,故①不符合题意;石油蒸馏是利用石油中各成分的沸点不同加以分离,与电子跃 迁无关,故②不符合题意;凸透镜聚光是由光的折射形成的,与电子跃迁无关,故③ 不符合题意;日光灯通电发光是因为电子发生能级跃迁时将多余的能量以光的形式放 出,与电子跃迁有关,故④符合题意;冷却结晶是由于温度降低,溶质的溶解度减小 而析出,与电子跃迁无关,故⑤不符合题意。
C
A. 焰色试验是化学变化
B. 在现代化学中,常利用光谱分析法来鉴定元素
C. 同一原子处于激发态时的能量一定大于其处于基态时的能量
D. 焰色试验中观察到的特殊焰色是金属原子的电子从激发态跃迁到基态时产生的光 的颜色
解析:焰色试验是物理变化,A项错误;不同元素的特征谱线不同,故可以利用光谱 分析法来鉴定元素,B项正确;基态是原子能量最低时的状态,C项正确;焰色试验 中观察到的特殊焰色是金属原子的电子从激发态跃迁到基态时产生的光的颜色,D项 正确。
A
第*页
课堂强研习 合作学习 精研重难
课时作业
A. K层上的电子能量比L层上的电子能量低
B. 激发态原子释放能量一定变成基态原子
C. M能层有3s、3p两个能级
D. 3d能级最多可容纳5个电子
解析:离核越远的电子能量越高,则K层上的电子能量比L层上的电子能量低,A正 确;激发态原子释放能量不一定变成基态原子,可能变为较低能量的激发态,B错 误;M能层有3s、3p、3d三个能级,C错误;3d能级最多可容纳10个电子,D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 能层就是电子层
B. 不同能层,s能级能量相同
C. s能级的能量一定比p能级的低
D. 高能层的所有能级能量都比低能层能级能量高
解析:能层是电子层,A正确;不同能层,s能级能量不同,能层越大,s能级能量越 高,B错误;s能级的能量也有可能比p能级高,如4s能级的能量高于2p能级的能量,C 错误;高能层能级的能量不一定比低能层能级的能量高,如3d能级的能量比4s能级的 能量高,D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 1 B. 3 C. 9 D. 18
解析:能级数目=该能层序数,M能层是第三能层,含有3个能级,分别是3s、3p、 3d。
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 多电子原子的所有电子在同一区域里运动
B. 能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
C. 处于最低能量状态的原子叫基态原子
D. 同一原子中,1s、2s、3s所能容纳的电子数越来越多
解析:原子核外有多电子时,电子的能量不尽相同,电子不可能都在同一区域里运 动,而是分层排布的,A项错误;能量低的电子在离原子核近的区域,而能量高的电 子在离核远的区域,B项错误;s能级最多容纳2个电子,与其所在能层高低无关,D 项错误。
C
1
2
3
4
5
6
7
8
9
10
11
12
A. 自然界中所有原子都处于基态
B. 同一原子处于激发态时的能量一定高于基态时的能量
C. 无论原子种类是否相同,基态原子的能量总是低于激发态原子的能量
D. 激发态原子的能量较高,极易失去电子,表现出较强的还原性
B
解析:自然界中的原子有的处于基态,有的处于激发态,放射性元素处于激发态,A 说法错误;同一种原子处于激发态时的能量一定高于基态时的能量,B说法正确;不 同原子的基态原子的能量不一定低于激发态原子的能量,但同一种原子激发态时的能 量一定高于基态时的能量,C说法错误;激发态原子的能量较高,容易跃迁到能量较 低的激发态或基态,能量降低。激发态原子若要失去电子,仍必须再吸收能量,失去 电子难易程度需根据原子的具体情况而定,有的激发态原子易失去电子,有的激发态 原子难失去电子,D说法错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. 元素K的焰色试验呈紫红色,其中紫色对应的
辐射波长约为700 nm
B. 以上实验装置测得的是氢元素的吸收光谱
C. 电子仅从激发态跃迁到基态时才会产生原子光谱
D. 原子光谱可以用于定性鉴定元素
D
解析:元素K的焰色试验呈紫红色,紫色对应的辐射波长不是700 nm,A错误; 该实验装置测得的是氢元素的发射光谱,B错误;原子光谱有吸收光谱和发射光 谱两种,电子由激发态跃迁到基态时产生的原子光谱属于发射光谱,电子由基 态跃迁到激发态时产生的原子光谱属于吸收光谱,C错误;原子光谱可以用于定 性鉴定元素,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. N层不含电子
B. 该元素是硫元素
C. L层一定有8个电子
D. 原子最外层电子数为4
解析:依题意可知,该元素原子K、L、M层容纳的电子数分别为2、8、6,N层不含 电子,故该元素是硫元素,其原子最外层电子数应为6,D项错误。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. ①③⑥⑦ B. ②④⑤⑧
C. ①③⑤⑥⑦ D. ①②③⑤⑥⑦
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 同一能层中不同能级的能量高低不同
B. 原子核外每个能层容纳的电子数都是 n2( n 表示能层序数)
C. d能级最多能容纳10个电子
D. 任一能层的能级总是从s能级开始
解析:同一能层中不同能级的能量高低不相同,如2s<2p,A正确;原子核外每个能 层最多容纳电子数都是2 n2( n 为电子层数),故B错误;d能级最多能容纳10个电 子,故C正确;由分析可知,任一能层的能级总是从s能级开始,故D正确。
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 各能层含有的能级数等于能层序数减1
B. 3d、4d能级所容纳的最多电子数相同
C. 各能层所含有的电子数一定是该能层序数平方的2倍
D. 不同能层中的s能级的能量高低相同
解析:各能层的能级数等于其能层序数,A项错误;3d、4d能级所容纳的最多电子数 都是10,B项正确;各能层所含有的电子数不一定是该能层序数平方的2倍,例如H原 子的K能层只有1个电子,C项错误;不同能层中的s能级的能量高低不同,如1s<2s< 3s<4s,D项错误。
B
1
2
3
4
5
6
7
8
9
10
11
12
11. (1)用符号填写能层所含能级种类:
K层: ;L层: ;
M层: ;N层: 。
1s
2s、2p
3s、3p、3d
4s、4p、4d、4f
解析:(1)各能层含有的能级数与能层序数相等,故K层:1s;L层:2s、2p;M 层:3s、3p、3d;N层:4s、4p、4d、4f。
(2)用数字填写能级所能容纳的最多电子数目:
s: ;p: ;d: ;f: 。
2
6
10
14
1
2
3
4
5
6
7
8
9
10
11
12
(3)比较下列能级的能量高低(填“<”“=”或“>”)。
① E (4s) E (3s) E (2s) E (1s);
② E (4f) E (4d) E (4p) E (4s);
③ E (1s) E (2p) E (3d) E (4f)。
>
>
>
>
>
>
<
<
<
解析:(3)在原子核外电子排布中,各能级能量高低顺序为①能级符号相同时,能层序数越大,能级能量越高,则 E (1s)< E (2s)< E (3s)< E (4s);②相同能层而不同能级的能量高低顺序为 E ( n s)< E ( n p)< E ( n d)< E ( n f)……;所以 E (4f)> E (4d)> E (4p)> E (4s);③不同能层不同能级,一般能层越高能量越大,所以能量大小顺序是 E (1s)< E (2p)< E (3d)< E (4f)。
1
2
3
4
5
6
7
8
9
10
11
12
12. (1)某元素的原子序数为13,则
①此元素原子的电子总数是 ;
②该元素原子有 个能层,共有 个能级;
③该元素原子能量最低的能级符号是 ,能量最高的能层是 。
13
3
5
1s
M
(2)基态Ca原子中,核外电子占据最高能层的符号为 ,该能层上有 个能 级,含有的电子数为 。
(3)下列现象和应用与电子跃迁有关的是 。
A. 激光 B. 焰色试验 C. 原子光谱 D. 燃烧放热 E. 石墨导电
N
4
2
ABC
1
2
3
4
5
6
7
8
9
10
11
12
