人教版(2019)必修一 1.2.1 离子反应 课件(共28张PPT)
文档属性
| 名称 | 人教版(2019)必修一 1.2.1 离子反应 课件(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-18 19:53:03 | ||
图片预览







文档简介
(共28张PPT)
心中有梦想 脚下有力量
2024级新课教学课件
第2节 离子反应
学习目标
从宏观上理解电解质的概念,对化合物进行重新分类;从微观上了解电解质的电离。
通过实验探究,对物质导电的原因进行分析,总结电解质的电离规律,建立电解质电离的基本模型。
通过对常见物质电离过程的分析,掌握典型物质电离方程式的书写。
导入
因为水会导电~
湿手不要摸电器
干燥绝缘要牢记
生活常识告诉我们,给电器设备通电时,湿手操作容易发生触电事故。
可能的原因是什么呢?
为什么NaCl、KNO3固体不导电,而溶于水或熔化后却能导电呢?
【思考与讨论】
一、物质导电的本质
1.金属、石墨等单质为什么可以导电?
金属、石墨中存在自由移动的电子。
2.化合物导电的本质是什么?
在外加电场下,可自由移动的带电离子作定向移动。
科学探究
探究NaCl溶液能导电的原因
NaCl晶体
及其结构模型
NaCl
离子不能自由移动。干燥的NaCl不导电!!!
科学探究
探究NaCl溶液能导电的原因
NaCl晶体及其结构模型
NaCl固体在水中的溶解和形成水合离子示意图
NaCl溶液导电示意图
科学探究
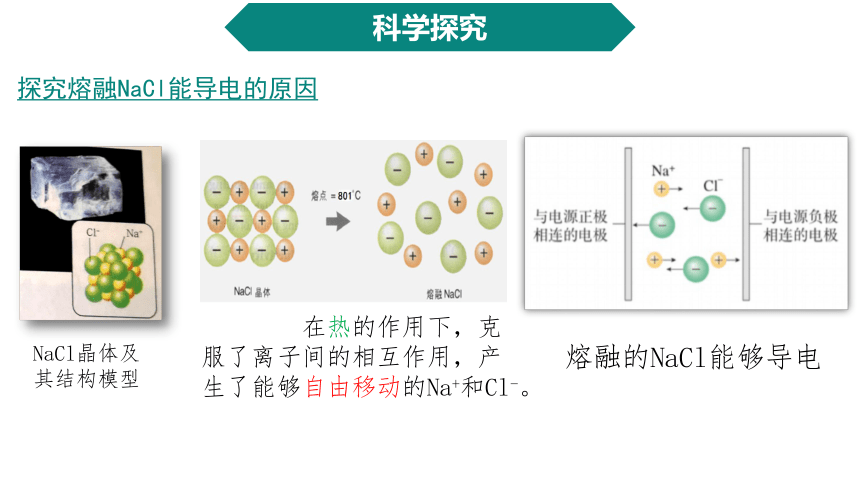
探究熔融NaCl能导电的原因
NaCl晶体及其结构模型
熔融的NaCl能够导电
在热的作用下,克服了离子间的相互作用,产生了能够自由移动的Na+和Cl-。
序号 物质 导电性 原因
1 NaCl溶液 能够导电 有可自由移动的带电粒子
2 NaCl固体 不能导电 带电粒子不能自由移动
3 熔融NaCl 能够导电 有可自由移动的带电粒子
4 水 不能导电 无大量可自由移动的带电粒子
3、物质的导电能力
溶液的导电能力取决于单位体积溶液里的离子数目(即离子浓度)和离子所带电荷数。
【思考与讨论】
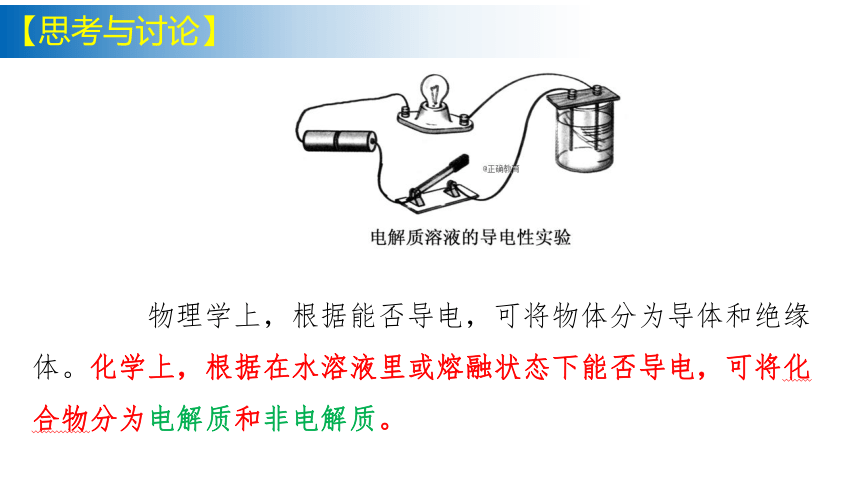
物理学上,根据能否导电,可将物体分为导体和绝缘体。化学上,根据在水溶液里或熔融状态下能否导电,可将化合物分为电解质和非电解质。
电解质的电离——模型认知
NaCl固体
NaCl溶液
加水溶解
能够导电
微观
宏观
不能导电
Na+和Cl
能
自由移动
-
Na+和Cl
不能
自由移动
-
熔融NaCl
加热熔化
电离
模型
在对研究对象进行实验观察和证据推理的基础上,利用简化、抽象和
类比等方法,将反映研究对象的本质特征形成一种概括性的描述或认识思路,这就是模型。模型在科学认识中具有描述、解释和预测等功能,是理论发展的一种重要方式。
化学中的模型有实物模型、理论模型等,其中,理论模型应用范围最广。例如,十九世纪后期,瑞典化学家阿伦尼乌斯在前人研究的基础上,通过研究电解质稀溶液的导电性等,提出了电离模型,即电解质溶于水会自动地解离成离子,而不是当时流行的说法——离子是通电后才产生的,并对电解质的电离进行了定量计算。电离模型很好地解释了酸、碱、盐溶液的某些性质,如酸、碱的强度等,因此发展成为近代的电离理论。阿伦尼乌斯也因此获得1903年诺贝尔化学奖。
方法导引
二、电解质和非电解质
1、电解质:在水溶液里或熔融状态下能够导电的化合物。
2、非电解质:在水溶液里和熔融状态下都不导电的化合物。
酸、 碱、 盐、金属氧化物、水等
非金属氧化物、大部分有机物、NH3等
如:HCl、NaOH、K2SO4、Na2O、H2O等
如:CO2、SO2、NH3、蔗糖、乙醇等
【课堂练习】
根据定义,判断下列说法是否正确?
① 铁能导电,所以铁是电解质;液溴不能导电,它是非电解质。
② MgCl2溶液能导电,所以MgCl2溶液是电解质。
③ 盐酸能导电,是电解质。
单质和混合物既不是电解质也不是非电解质。
注意电解质和电解质溶液的区分。
④液态氯化氢不能导电,但氯化氢是电解质。
√
电解质一定是自身能够产生阴阳离子。
④CO2、NH3都溶于水,其水溶液都能导电,所以CO2、NH3是电解质。
⑤硫酸钡难溶于水,其水溶液几乎不导电,硫酸钡是非电解质。
判断化合物是电解质还是非电解质,与其溶解性无关。
下列物质哪些是电解质?哪些是非电解质?哪些能导电?
①金属铜 ②NaOH固体 ③O2 ④H2SO4 ⑤酒精水溶液 ⑥碳棒 ⑦KOH水溶液⑧熔融状态的KNO3 ⑨葡萄糖
电解质:
非电解质:
能导电的物质:
⑨
②④⑧
①⑥⑦⑧
物质
混合物
纯净物
化合物
单质
电解质
非电解质
既不是电解质也不是非电解质
【思考与讨论】
人的手上常会沾有汗液(含有氯化钠)或其他物质,当遇到水时,形成自由移动的离子而导电,因此湿手直接接触电源时容易发生触电事故。
1、电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程。
三、电离和电离方程式
条件:
结果:
水分子作用(溶于水)或受热熔化
产生自由移动的离子
如何表示电解质的电离过程?
2、电离方程式:
用化学式和离子符号表示电解质电离的式子。
NaCl = Na+ + Cl-
遵守质量守恒和电荷守恒
左边:化学式 右边:离子符号
三、电离和电离方程式
写出下列酸的电离方程式:HCl 、HNO3 、H2SO4。
H2SO4 === 2H+ + SO42-
HCl === H+ + Cl-
HNO3 === H+ + NO3-
酸:电离时生成的 全部是 的化合物。
阳离子
H+
3、酸、碱、盐的定义
三、电离和电离方程式
(1) 写出下列碱的电离方程式:NaOH 、KOH、Ba(OH)2 。
NaOH === Na+ + OH-
碱:电离时生成的 全部是 的化合物。
Ba(OH)2 === Ba2+ + 2OH-
KOH === K+ + OH-
阴离子
OH-
【思考与讨论】
(2) 请结合以上电离方程式,并参考酸的本质,从电离的角度认识碱的本质。
写出下列盐的电离方程式:NaCl 、NH4Cl、NaHSO4。
NaCl === Na+ + Cl-
NH4Cl === NH4+ + Cl-
NaHSO4 === Na+ + H+ + SO42-
盐:电离时能生成 (或 )和 的化合物。
金属阳离子
NH4+
酸根离子
【思考与讨论】
物质
混和物
纯净物
化合物
单质
电解质
非电解质
不是电解质,也不是非电解质
酸
碱
金属氧化物
乙醇、蔗糖等大部分有机物
盐
非金属氧化物(如CO2、SO2、SO3)
NH3
总结
【作业】
A 组
2、下列状态的物质,既能导电又属于电解质的是( )
A. MgCl2 晶体 B. NaCl 溶液
C. 液态氯化氢 D. 熔融 KOH
1、下列物质属于电解质的是( )
A. 盐酸 B. CO2 C. Fe D. BaSO4
D
D
【作业】
B 组
1、下列电解质,溶于水时可以电离,而熔化时难以电离的是( )
A. AgCl B. NaCl C. HCl D. NaOH
2、下列物质的水溶液不能导电的是( )
A. 氯酸钾 B. 酒精 C. 食盐 D. 碳酸氢钙
C
B
小试牛刀——导电问题
【练习】下列说法中正确的是 ( )
①将硫酸钡放入水中不能导电,所以硫酸钡是非电解质
②氨溶于水得到的溶液氨水能导电,所以氨气是电解质
③氯化氢溶于水能导电,但液态氯化氢不能导电
④KNO3溶液能导电,所以KNO3溶液是电解质
⑤溶于水后能电离出H+的化合物都是酸
⑥电解质未必能导电,能导电的未必是电解质
⑦硫酸溶液的导电性一定比盐酸溶液的导电性强
A.①④ B.⑤⑦ C.③⑥ D.②⑦
熔融状态可导电
NH3·H2O是电解质
KNO3是电解质
NaHSO4 = Na+ + H+ + SO42-
溶液导电性
自由移动离子的浓度
离子所带电荷的多少
C
1.能导电的物质不一定是电解质。
2.电解质的导电需要条件:水溶液或熔融状态。
3.电解质导电必须是化合物本身发生电离。
4.有些电解质的水溶液不导电,在熔融状态下能导电,如BaSO4
心中有梦想 脚下有力量
2024级新课教学课件
第2节 离子反应
学习目标
从宏观上理解电解质的概念,对化合物进行重新分类;从微观上了解电解质的电离。
通过实验探究,对物质导电的原因进行分析,总结电解质的电离规律,建立电解质电离的基本模型。
通过对常见物质电离过程的分析,掌握典型物质电离方程式的书写。
导入
因为水会导电~
湿手不要摸电器
干燥绝缘要牢记
生活常识告诉我们,给电器设备通电时,湿手操作容易发生触电事故。
可能的原因是什么呢?
为什么NaCl、KNO3固体不导电,而溶于水或熔化后却能导电呢?
【思考与讨论】
一、物质导电的本质
1.金属、石墨等单质为什么可以导电?
金属、石墨中存在自由移动的电子。
2.化合物导电的本质是什么?
在外加电场下,可自由移动的带电离子作定向移动。
科学探究
探究NaCl溶液能导电的原因
NaCl晶体
及其结构模型
NaCl
离子不能自由移动。干燥的NaCl不导电!!!
科学探究
探究NaCl溶液能导电的原因
NaCl晶体及其结构模型
NaCl固体在水中的溶解和形成水合离子示意图
NaCl溶液导电示意图
科学探究
探究熔融NaCl能导电的原因
NaCl晶体及其结构模型
熔融的NaCl能够导电
在热的作用下,克服了离子间的相互作用,产生了能够自由移动的Na+和Cl-。
序号 物质 导电性 原因
1 NaCl溶液 能够导电 有可自由移动的带电粒子
2 NaCl固体 不能导电 带电粒子不能自由移动
3 熔融NaCl 能够导电 有可自由移动的带电粒子
4 水 不能导电 无大量可自由移动的带电粒子
3、物质的导电能力
溶液的导电能力取决于单位体积溶液里的离子数目(即离子浓度)和离子所带电荷数。
【思考与讨论】
物理学上,根据能否导电,可将物体分为导体和绝缘体。化学上,根据在水溶液里或熔融状态下能否导电,可将化合物分为电解质和非电解质。
电解质的电离——模型认知
NaCl固体
NaCl溶液
加水溶解
能够导电
微观
宏观
不能导电
Na+和Cl
能
自由移动
-
Na+和Cl
不能
自由移动
-
熔融NaCl
加热熔化
电离
模型
在对研究对象进行实验观察和证据推理的基础上,利用简化、抽象和
类比等方法,将反映研究对象的本质特征形成一种概括性的描述或认识思路,这就是模型。模型在科学认识中具有描述、解释和预测等功能,是理论发展的一种重要方式。
化学中的模型有实物模型、理论模型等,其中,理论模型应用范围最广。例如,十九世纪后期,瑞典化学家阿伦尼乌斯在前人研究的基础上,通过研究电解质稀溶液的导电性等,提出了电离模型,即电解质溶于水会自动地解离成离子,而不是当时流行的说法——离子是通电后才产生的,并对电解质的电离进行了定量计算。电离模型很好地解释了酸、碱、盐溶液的某些性质,如酸、碱的强度等,因此发展成为近代的电离理论。阿伦尼乌斯也因此获得1903年诺贝尔化学奖。
方法导引
二、电解质和非电解质
1、电解质:在水溶液里或熔融状态下能够导电的化合物。
2、非电解质:在水溶液里和熔融状态下都不导电的化合物。
酸、 碱、 盐、金属氧化物、水等
非金属氧化物、大部分有机物、NH3等
如:HCl、NaOH、K2SO4、Na2O、H2O等
如:CO2、SO2、NH3、蔗糖、乙醇等
【课堂练习】
根据定义,判断下列说法是否正确?
① 铁能导电,所以铁是电解质;液溴不能导电,它是非电解质。
② MgCl2溶液能导电,所以MgCl2溶液是电解质。
③ 盐酸能导电,是电解质。
单质和混合物既不是电解质也不是非电解质。
注意电解质和电解质溶液的区分。
④液态氯化氢不能导电,但氯化氢是电解质。
√
电解质一定是自身能够产生阴阳离子。
④CO2、NH3都溶于水,其水溶液都能导电,所以CO2、NH3是电解质。
⑤硫酸钡难溶于水,其水溶液几乎不导电,硫酸钡是非电解质。
判断化合物是电解质还是非电解质,与其溶解性无关。
下列物质哪些是电解质?哪些是非电解质?哪些能导电?
①金属铜 ②NaOH固体 ③O2 ④H2SO4 ⑤酒精水溶液 ⑥碳棒 ⑦KOH水溶液⑧熔融状态的KNO3 ⑨葡萄糖
电解质:
非电解质:
能导电的物质:
⑨
②④⑧
①⑥⑦⑧
物质
混合物
纯净物
化合物
单质
电解质
非电解质
既不是电解质也不是非电解质
【思考与讨论】
人的手上常会沾有汗液(含有氯化钠)或其他物质,当遇到水时,形成自由移动的离子而导电,因此湿手直接接触电源时容易发生触电事故。
1、电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程。
三、电离和电离方程式
条件:
结果:
水分子作用(溶于水)或受热熔化
产生自由移动的离子
如何表示电解质的电离过程?
2、电离方程式:
用化学式和离子符号表示电解质电离的式子。
NaCl = Na+ + Cl-
遵守质量守恒和电荷守恒
左边:化学式 右边:离子符号
三、电离和电离方程式
写出下列酸的电离方程式:HCl 、HNO3 、H2SO4。
H2SO4 === 2H+ + SO42-
HCl === H+ + Cl-
HNO3 === H+ + NO3-
酸:电离时生成的 全部是 的化合物。
阳离子
H+
3、酸、碱、盐的定义
三、电离和电离方程式
(1) 写出下列碱的电离方程式:NaOH 、KOH、Ba(OH)2 。
NaOH === Na+ + OH-
碱:电离时生成的 全部是 的化合物。
Ba(OH)2 === Ba2+ + 2OH-
KOH === K+ + OH-
阴离子
OH-
【思考与讨论】
(2) 请结合以上电离方程式,并参考酸的本质,从电离的角度认识碱的本质。
写出下列盐的电离方程式:NaCl 、NH4Cl、NaHSO4。
NaCl === Na+ + Cl-
NH4Cl === NH4+ + Cl-
NaHSO4 === Na+ + H+ + SO42-
盐:电离时能生成 (或 )和 的化合物。
金属阳离子
NH4+
酸根离子
【思考与讨论】
物质
混和物
纯净物
化合物
单质
电解质
非电解质
不是电解质,也不是非电解质
酸
碱
金属氧化物
乙醇、蔗糖等大部分有机物
盐
非金属氧化物(如CO2、SO2、SO3)
NH3
总结
【作业】
A 组
2、下列状态的物质,既能导电又属于电解质的是( )
A. MgCl2 晶体 B. NaCl 溶液
C. 液态氯化氢 D. 熔融 KOH
1、下列物质属于电解质的是( )
A. 盐酸 B. CO2 C. Fe D. BaSO4
D
D
【作业】
B 组
1、下列电解质,溶于水时可以电离,而熔化时难以电离的是( )
A. AgCl B. NaCl C. HCl D. NaOH
2、下列物质的水溶液不能导电的是( )
A. 氯酸钾 B. 酒精 C. 食盐 D. 碳酸氢钙
C
B
小试牛刀——导电问题
【练习】下列说法中正确的是 ( )
①将硫酸钡放入水中不能导电,所以硫酸钡是非电解质
②氨溶于水得到的溶液氨水能导电,所以氨气是电解质
③氯化氢溶于水能导电,但液态氯化氢不能导电
④KNO3溶液能导电,所以KNO3溶液是电解质
⑤溶于水后能电离出H+的化合物都是酸
⑥电解质未必能导电,能导电的未必是电解质
⑦硫酸溶液的导电性一定比盐酸溶液的导电性强
A.①④ B.⑤⑦ C.③⑥ D.②⑦
熔融状态可导电
NH3·H2O是电解质
KNO3是电解质
NaHSO4 = Na+ + H+ + SO42-
溶液导电性
自由移动离子的浓度
离子所带电荷的多少
C
1.能导电的物质不一定是电解质。
2.电解质的导电需要条件:水溶液或熔融状态。
3.电解质导电必须是化合物本身发生电离。
4.有些电解质的水溶液不导电,在熔融状态下能导电,如BaSO4
