第五单元 定量研究化学反应 单元复习课件(共32张PPT)
文档属性
| 名称 | 第五单元 定量研究化学反应 单元复习课件(共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 13.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-16 22:56:22 | ||
图片预览










文档简介
(共32张PPT)
感受化学魅力
探寻化学之美
定量研究化学反应
第五单元
单元知识复习
目
录
CONTENTS
1
认识质量守恒定律,了解化学反应中反应物与生成物的质量关系,掌握化学反应中质量守恒定律的计算方法
2
掌握化学反应方程式的书写、表示方法及其意义,能够正确书写并配平简单的化学方程式
3
掌握根据化学方程式计算的方法、格式和步骤及含杂质物质的计算,进一步认识定性和定量研究物质的变化
感受化学魅力
探寻化学之美
重点:质量守恒定律,化学方程式书写,根据化学方程式的计算
难点:质量守恒定律的验证,化学方程式的配平,含杂质物质的计算
知识网络
定量研究化学反应
化学反应中的质量守恒
化学方程式中的有关计算
化学反应的表示
设计实验验证质量守恒定律
质量守恒定律
质量守恒的微观本质
含杂质物质的计算—纯净物的质量代入化学方程式计算
概念
化学方程式书写
根据化学方程式计算的解题步骤和格式
化学方程式计算的基本思路
注意事项
实验设计
化学方程式及其意义
意义及读法
概念
定量—数量及质量
定性
步骤:写→注→配→等
原则
遵循质量守恒定律
客观事实为依据
1.概念:化学反应后生成的各物质的质量总和,等于参加化学反应的各物质的质量总和。
2.概念的深化:(1)质量守恒定律适用于 ,不适用于物理变化。
(2)概念中的“参加化学反应的各物质的质量”是指 化学反应的那部分物质的质量。
(3)概念中生成的“各物质的质量总和”包括“ ”三种状态的物质的质量,不能将 的质量忽略不计。
(4)质量守恒定律适用于 守恒,不包括体积、分子个数等方面的守恒。
化学反应中的质量守恒
01
知识清单
化学变化
真正参加
固、液、气
气体
质量
3.质量守恒的微观实质:
化学反应的实质就是反应物的分子分裂为原子,原子又重新组合成新的分子,在反应前后原子的 没变,原子的 没有增减,原子的 没有变化,所以化学反应前后各物质的质量总和必然相等。
4.实验验证注意事项:
有气体 或 的反应,一定要在密闭容器
中进行,否则天平会不平衡,造成这种现象的原因一般是生成的气体
或外界气体 装置。不涉及气体的反应可以在开放容器中进行。
参加
数目
质量
生成
种类
逸出
进入
化学反应的表示
02
知识清单
1.化学方程式:
化学方程式是用 表示 的式子。通常用“ ”表示反应需要加热,用“↑”或“↓”注明生成物是 或 。
2.化学方程式的书写:
(1)原则:以客观事实为依据,遵循质量守恒定律
(2)步骤:①描述反应事实,写出反应物和生成物的 ,注明 及 ;
②配平,在相应化学式前面配上适当 使各元素的原子个数相等。
化学式
化学反应
气体
△
沉淀
化学式
反应条件
生成物的状态
数字
3.化学方程式的意义及读法:
化学方程式(2H2 + O2 点燃 2H2O)
意义 读法
宏观 角度 表明了反应物、生成物和反应条件 。 氢气和氧气在点燃条件下反应生成水。
微观 角度 表明各物质之间微粒数目比(化学计量数)。 每2个氢分子和1个氧分子在点燃的条件下反应生成2个水分子。
量的 角度 表明各物质之间的质量比(物质相对分子质量×化学计量数)。 每4份质量的氢气和32份质量的氧气在点燃的条件下反应生成36份质量的水。
化学反应中的有关计算
03
知识清单
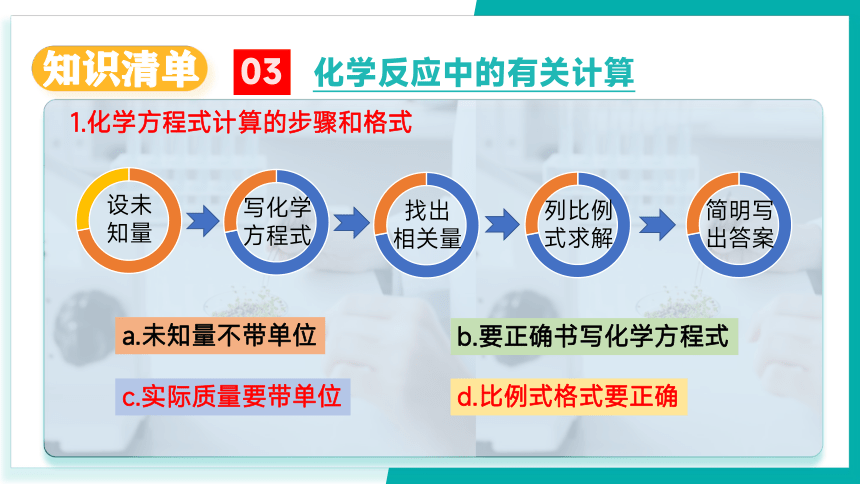
1.化学方程式计算的步骤和格式
a.未知量不带单位
b.要正确书写化学方程式
c.实际质量要带单位
d.比例式格式要正确
设未
知量
写化学方程式
找出
相关量
列比例式求解
简明写出答案
2.解题过程中容易出错的环节
(1)化学方程式写不正确(化学式不正确、未配平、未注明反应条件)
(2)化学式量计算错误
(3)求质量比时忘记乘以化学式前的化学计量数
(4)质量关系没有写在对应物质的正下方
(5)列比例式不正确
(6)题设未知量带单位,或解题过程中无单位、单位不统一
(7)解题步骤书写不完整
3.含杂质物质的计算
化学方程式中所有的反应物和生成物都是指纯净物,因此必须用纯净物质的质量带入计算。若题目中给出的是不纯物质的质量,则必须现将不纯物质的质量换算成纯净物的质量,然后代入计算。
(1)纯物质质量=含杂质物质质量×纯度
(2)含杂质物质质量=纯物质质量÷纯度
(3)纯度=纯物质质量÷含杂质物质质量×100%
1.下列说法不符合质量守恒定律的是( )
A.细铁丝在氧气中燃烧后,质量增大,是因为生成物中增加了氧元素的质量
B.双氧水在二氧化锰作用下分解,生成氧气与水的质量等于双氧水与二氧化锰的质量
C.高锰酸钾受热分解后固体剩余物的质量减小,是因为放出了氧气
D.镁条在密闭容器中燃烧,反应前后总质量不变
课堂达标
B
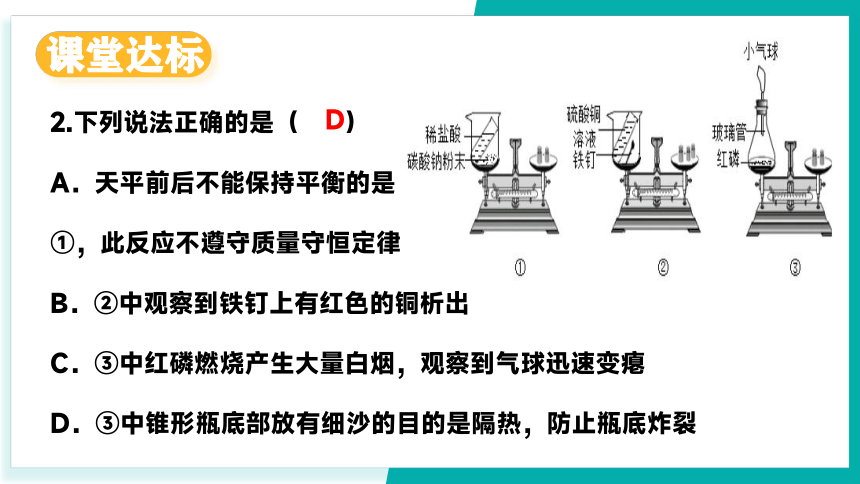
2.下列说法正确的是( )
A.天平前后不能保持平衡的是
①,此反应不遵守质量守恒定律
B.②中观察到铁钉上有红色的铜析出
C.③中红磷燃烧产生大量白烟,观察到气球迅速变瘪
D.③中锥形瓶底部放有细沙的目的是隔热,防止瓶底炸裂
课堂达标
D
3.下列关于Fe在O2中燃烧的反应叙述不正确的是( )
A.放出热量
B.生成黑色固体
C.反应前后固体质量相等
D.参加反应的Fe与生成物中铁元素质量相等
C
课堂达标
4.现将40gA和足量的B混合加热。A与B发生化学反应,40gA完全反应后生成32gC和22gD,则参加反应的B与生成的D的质量比是( )
A.20:7 B.7:11
C.5:4 D.16:11
B
课堂达标
5.乙醇(C2H5OH)是常用的燃料。现有4.6g乙醇与一定量氧气混合于密闭容器内,在一定条件下反应物全部转化为一氧化碳、二氧化碳和水,恢复到室温,测得所得气体中氧元素质量分数为70%,则参加反应的氧气质量为( )
A.6.4g B.8.0g C.8.8g D.9.6g
C
课堂达标
6.一定条件下,甲、乙、丙、丁四种物质反应前后的质量关系如表所示。下列说法中错误的是( )
A.x=7
B.丙可能是该反应的催化剂
C.该反应属于化合反应
D.反应中甲和丁的质量比是9∶8
课堂达标
C
物质 甲 乙 丙 丁
反应前的质量/g 40 3 5 2
反应后的质量/g 4 x 5 34
7.某化学反应的微观示意图如下(反应条件已省略),根据图示,下列选项正确的是( )
A.反应前后分子总数不变
B.生成物中共有3种单质
C.该反应的反应物是H2O2
D.反应前后原子种类不变
D
课堂达标
8.火药是我国四大发明之一。黑火药是由木炭、硫黄和硝酸钾按一定比例混合而成的,爆炸时发生的主要反应为S+2KNO3+xC点燃K2S+
N2↑+3CO2↑。其中x的数值和K2S中硫元素的化合价分别是( )
A.2,-2 B.2,+3 C.3,+4 D.3,-2
D
课堂达标
课堂达标
9.密闭容器内有甲、乙、丙、丁四种物质,在一定条件下发生某一化学反应,反应前后各物质质量如图所示。下列说法不正确的是( )
A.该反应遵循质量守恒定律
B.丙可能为该反应的催化剂
C.反应前后乙和丁的质量变化之比为
D.甲和丁的相对分子质量之比为
D
课堂达标
10.在反应C+2ZnO高温2Zn+CO2↑中,下列有关说法正确的是( )
A.反应前后各元素的化合价均无变化
B.反应前后锌元素的质量没有发生改变
C.参加反应的碳与氧化锌的质量比为4:27
D.反应后固体质量减轻,不遵循质量守恒定律
B
11.四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示,则以下有关说法中不正确的是( )
A.此反应是分解反应
B.乙可能是这个反应的催化剂
C.生成的甲、丙两物质的质量比为19:41
D.参加反应的丁的质量一定等于生成的甲和丙的质量之和
课堂达标
C
12.某密闭容器中只有乙、丙、丁三种物质,在一定条件下发生了化学反应,容器中乙、丙、丁的质量随甲的质量变化情况如图所示。下列说法错误的是( )
A.a的值为12
B.丙可能是该反应的催化剂
C.丁一定是化合物
D.当丁的质量为5g时,甲的质量也是5g
D
课堂达标
13.下列化学方程式书写正确的是( )
A.加热分解氧化汞:HgO△Hg+O2↑
B.红磷在氧气中燃烧4P+5O2=2P2O5
C.铝片与稀盐酸反应生成氯化铝与氢气2Al+6HCl=2AlCl3+3H2↑
D.加热高锰酸钾制氧气:2KMnO4=K2MnO4+MnO2+O2
C
课堂达标
14.质量守恒定律是帮助我们认识化学反应实质的重要理论。在化学反应aA+bB=cC+dD中,下列说法正确的是( )
A.化学计量数a与b之和一定等于c与d之和
B.若取xgA和xgB反应,生成C和D的质量总和一定≤2xg
C.反应物A和B的质量比一定等于生成物C和D的质量比
D.若C和D都是化合物,则A和B也一定是化合物
B
课堂达标
15. FeCl3溶液用于制作印刷电路板,反应为2FeCl3+Cu=
CuCl2+2X。X的化学式是( )
A.Fe B.FeCl2
C.Fe(OH)2 D.Fe(OH)3
课堂达标
B
16.写出下列反应的化学方程式。
(1)硫在氧气中燃烧 ;
(2)锌与稀硫酸反应生成硫酸锌和氢气 ;
(3)双氧水在二氧化锰催化下分解制取氧气 ;
(4)气体二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀和水
;
S+O2 点燃 SO2
课堂达标
Zn+H2SO4=ZnSO4+H2↑
2H2O2MnO22H2O+O2↑
CO2+Ca(OH)2=CaCO3↓+H2O
17.从宏观、微观、符号相结合的视角探究物质及其变化规律是化学独特的研究方法。根据信息,回答下列问题:
(1)宏观辨识:通过科学探究可以认识化学反应中各物质质量之间的关系,如图实验中,
将NaOH溶液滴入锥形瓶中,反应结束用,再次称量,观家到托盘天平的指针______
(填“向左”“向右”或“不”)偏转。
(2)微观探析:下图是氢气在空气中燃烧的微观示意图,
该反应的基本反应类型为______反应。从微观角度分析,
过程I表示分子分解成______的过程。
(3)符号表征:合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg2Cu+3H2 350℃
3MgH2+MgCu2,熔炼制备Mg2Cu合金时,Mg、Cu金属的质量比为_______,氩气能作保护气的原因是___________________________;MgH2与水反应生成氢氧化镁沉淀,并释放出H2。写出反应的化学方程式为:___________________________________________。
不
课堂达标
化合
原子
3:4
化学性质很稳定
MgH2 + 2H2O = Mg(OH)2↓+ 2H2↑
18.工业上煅烧石灰石(主要成分为CaCO3)可制得生石灰(CaO)和二氧化碳。若现有50 t含碳酸钙80%的石灰石完全分解,可得到生石灰的质量为多少吨。
课堂达标
解:碳酸钙质量为50t×80%=40t
设生成氧化钙的质量为x
CaCO3 ==== CaO + CO2↑
100 56
40t x
100/56=40t/x
x=22.4t
答:可得到生石灰的质量为22.4 t。
高温
19.硅酸钠(Na2SiO3)是我国优先发展的精细
化工产品,工业制备硅酸钠的反应为2NaOH
+SiO2 = Na2SiO3+H2O。现以125 t石英
砂(SiO2的质量分数为96%)为原料,与足量
的NaOH溶液反应。(已知硅的相对原子质量
为28)
(1)125 t石英砂中SiO2的质量为_____t。
(2)计算理论上可得到Na2SiO3的质量。
课堂达标
解:(1)125t×96%=120t
(2)设理论上可得到Na2SiO3的质量为x
2NaOH+SiO2 = Na2SiO3+H2O
60 122
120t x
60/122=120t/x
x=244t
答:理论上可得到Na2SiO3的质量为244 t。
20.某一矿山上的石灰石样品,其中只含二氧化硅杂质(二氧化硅是一种既不溶于水也不与盐酸反应且耐高温的固体)。某学校的同学们想测定该样品中碳酸钙的质量分数,他们选取了一块石灰石样品,将其敲打粉碎后,称出6g放入烧杯内(烧杯质量为20g),然后加入50g某一定溶质质量分数的足量的稀盐酸,用玻璃棒搅拌至不再产生气泡为止。反应所需时间(t)和烧杯及其所盛物质总质量(m)的关系如下图所示。
请完成下列问题:
(1)实验结束时,理论上共放出二氧化碳的质量为_________g。
(2)计算该石灰石样品中碳酸钙的质量分数。(保留一位小数)
课堂达标
解:(1)根据反应前后固体质量的差值,可求出二氧化碳的质量76g-73.8g=2.2g;
(2)设参加反应的碳酸钙的质量为x
2HCl + CaCO = CaCl + H O + CO ↑
100 44
x 2.2g
100/44 = x/2.2g
x=5g
该石灰石样品中碳酸钙的质量分数5g/6g×100% = 83.3%
答:石灰石样品中碳酸钙的质量分数83.3%。
课堂达标
谢谢您的观看
THANKS
感受化学魅力
探寻化学之美
感受化学魅力
探寻化学之美
定量研究化学反应
第五单元
单元知识复习
目
录
CONTENTS
1
认识质量守恒定律,了解化学反应中反应物与生成物的质量关系,掌握化学反应中质量守恒定律的计算方法
2
掌握化学反应方程式的书写、表示方法及其意义,能够正确书写并配平简单的化学方程式
3
掌握根据化学方程式计算的方法、格式和步骤及含杂质物质的计算,进一步认识定性和定量研究物质的变化
感受化学魅力
探寻化学之美
重点:质量守恒定律,化学方程式书写,根据化学方程式的计算
难点:质量守恒定律的验证,化学方程式的配平,含杂质物质的计算
知识网络
定量研究化学反应
化学反应中的质量守恒
化学方程式中的有关计算
化学反应的表示
设计实验验证质量守恒定律
质量守恒定律
质量守恒的微观本质
含杂质物质的计算—纯净物的质量代入化学方程式计算
概念
化学方程式书写
根据化学方程式计算的解题步骤和格式
化学方程式计算的基本思路
注意事项
实验设计
化学方程式及其意义
意义及读法
概念
定量—数量及质量
定性
步骤:写→注→配→等
原则
遵循质量守恒定律
客观事实为依据
1.概念:化学反应后生成的各物质的质量总和,等于参加化学反应的各物质的质量总和。
2.概念的深化:(1)质量守恒定律适用于 ,不适用于物理变化。
(2)概念中的“参加化学反应的各物质的质量”是指 化学反应的那部分物质的质量。
(3)概念中生成的“各物质的质量总和”包括“ ”三种状态的物质的质量,不能将 的质量忽略不计。
(4)质量守恒定律适用于 守恒,不包括体积、分子个数等方面的守恒。
化学反应中的质量守恒
01
知识清单
化学变化
真正参加
固、液、气
气体
质量
3.质量守恒的微观实质:
化学反应的实质就是反应物的分子分裂为原子,原子又重新组合成新的分子,在反应前后原子的 没变,原子的 没有增减,原子的 没有变化,所以化学反应前后各物质的质量总和必然相等。
4.实验验证注意事项:
有气体 或 的反应,一定要在密闭容器
中进行,否则天平会不平衡,造成这种现象的原因一般是生成的气体
或外界气体 装置。不涉及气体的反应可以在开放容器中进行。
参加
数目
质量
生成
种类
逸出
进入
化学反应的表示
02
知识清单
1.化学方程式:
化学方程式是用 表示 的式子。通常用“ ”表示反应需要加热,用“↑”或“↓”注明生成物是 或 。
2.化学方程式的书写:
(1)原则:以客观事实为依据,遵循质量守恒定律
(2)步骤:①描述反应事实,写出反应物和生成物的 ,注明 及 ;
②配平,在相应化学式前面配上适当 使各元素的原子个数相等。
化学式
化学反应
气体
△
沉淀
化学式
反应条件
生成物的状态
数字
3.化学方程式的意义及读法:
化学方程式(2H2 + O2 点燃 2H2O)
意义 读法
宏观 角度 表明了反应物、生成物和反应条件 。 氢气和氧气在点燃条件下反应生成水。
微观 角度 表明各物质之间微粒数目比(化学计量数)。 每2个氢分子和1个氧分子在点燃的条件下反应生成2个水分子。
量的 角度 表明各物质之间的质量比(物质相对分子质量×化学计量数)。 每4份质量的氢气和32份质量的氧气在点燃的条件下反应生成36份质量的水。
化学反应中的有关计算
03
知识清单
1.化学方程式计算的步骤和格式
a.未知量不带单位
b.要正确书写化学方程式
c.实际质量要带单位
d.比例式格式要正确
设未
知量
写化学方程式
找出
相关量
列比例式求解
简明写出答案
2.解题过程中容易出错的环节
(1)化学方程式写不正确(化学式不正确、未配平、未注明反应条件)
(2)化学式量计算错误
(3)求质量比时忘记乘以化学式前的化学计量数
(4)质量关系没有写在对应物质的正下方
(5)列比例式不正确
(6)题设未知量带单位,或解题过程中无单位、单位不统一
(7)解题步骤书写不完整
3.含杂质物质的计算
化学方程式中所有的反应物和生成物都是指纯净物,因此必须用纯净物质的质量带入计算。若题目中给出的是不纯物质的质量,则必须现将不纯物质的质量换算成纯净物的质量,然后代入计算。
(1)纯物质质量=含杂质物质质量×纯度
(2)含杂质物质质量=纯物质质量÷纯度
(3)纯度=纯物质质量÷含杂质物质质量×100%
1.下列说法不符合质量守恒定律的是( )
A.细铁丝在氧气中燃烧后,质量增大,是因为生成物中增加了氧元素的质量
B.双氧水在二氧化锰作用下分解,生成氧气与水的质量等于双氧水与二氧化锰的质量
C.高锰酸钾受热分解后固体剩余物的质量减小,是因为放出了氧气
D.镁条在密闭容器中燃烧,反应前后总质量不变
课堂达标
B
2.下列说法正确的是( )
A.天平前后不能保持平衡的是
①,此反应不遵守质量守恒定律
B.②中观察到铁钉上有红色的铜析出
C.③中红磷燃烧产生大量白烟,观察到气球迅速变瘪
D.③中锥形瓶底部放有细沙的目的是隔热,防止瓶底炸裂
课堂达标
D
3.下列关于Fe在O2中燃烧的反应叙述不正确的是( )
A.放出热量
B.生成黑色固体
C.反应前后固体质量相等
D.参加反应的Fe与生成物中铁元素质量相等
C
课堂达标
4.现将40gA和足量的B混合加热。A与B发生化学反应,40gA完全反应后生成32gC和22gD,则参加反应的B与生成的D的质量比是( )
A.20:7 B.7:11
C.5:4 D.16:11
B
课堂达标
5.乙醇(C2H5OH)是常用的燃料。现有4.6g乙醇与一定量氧气混合于密闭容器内,在一定条件下反应物全部转化为一氧化碳、二氧化碳和水,恢复到室温,测得所得气体中氧元素质量分数为70%,则参加反应的氧气质量为( )
A.6.4g B.8.0g C.8.8g D.9.6g
C
课堂达标
6.一定条件下,甲、乙、丙、丁四种物质反应前后的质量关系如表所示。下列说法中错误的是( )
A.x=7
B.丙可能是该反应的催化剂
C.该反应属于化合反应
D.反应中甲和丁的质量比是9∶8
课堂达标
C
物质 甲 乙 丙 丁
反应前的质量/g 40 3 5 2
反应后的质量/g 4 x 5 34
7.某化学反应的微观示意图如下(反应条件已省略),根据图示,下列选项正确的是( )
A.反应前后分子总数不变
B.生成物中共有3种单质
C.该反应的反应物是H2O2
D.反应前后原子种类不变
D
课堂达标
8.火药是我国四大发明之一。黑火药是由木炭、硫黄和硝酸钾按一定比例混合而成的,爆炸时发生的主要反应为S+2KNO3+xC点燃K2S+
N2↑+3CO2↑。其中x的数值和K2S中硫元素的化合价分别是( )
A.2,-2 B.2,+3 C.3,+4 D.3,-2
D
课堂达标
课堂达标
9.密闭容器内有甲、乙、丙、丁四种物质,在一定条件下发生某一化学反应,反应前后各物质质量如图所示。下列说法不正确的是( )
A.该反应遵循质量守恒定律
B.丙可能为该反应的催化剂
C.反应前后乙和丁的质量变化之比为
D.甲和丁的相对分子质量之比为
D
课堂达标
10.在反应C+2ZnO高温2Zn+CO2↑中,下列有关说法正确的是( )
A.反应前后各元素的化合价均无变化
B.反应前后锌元素的质量没有发生改变
C.参加反应的碳与氧化锌的质量比为4:27
D.反应后固体质量减轻,不遵循质量守恒定律
B
11.四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示,则以下有关说法中不正确的是( )
A.此反应是分解反应
B.乙可能是这个反应的催化剂
C.生成的甲、丙两物质的质量比为19:41
D.参加反应的丁的质量一定等于生成的甲和丙的质量之和
课堂达标
C
12.某密闭容器中只有乙、丙、丁三种物质,在一定条件下发生了化学反应,容器中乙、丙、丁的质量随甲的质量变化情况如图所示。下列说法错误的是( )
A.a的值为12
B.丙可能是该反应的催化剂
C.丁一定是化合物
D.当丁的质量为5g时,甲的质量也是5g
D
课堂达标
13.下列化学方程式书写正确的是( )
A.加热分解氧化汞:HgO△Hg+O2↑
B.红磷在氧气中燃烧4P+5O2=2P2O5
C.铝片与稀盐酸反应生成氯化铝与氢气2Al+6HCl=2AlCl3+3H2↑
D.加热高锰酸钾制氧气:2KMnO4=K2MnO4+MnO2+O2
C
课堂达标
14.质量守恒定律是帮助我们认识化学反应实质的重要理论。在化学反应aA+bB=cC+dD中,下列说法正确的是( )
A.化学计量数a与b之和一定等于c与d之和
B.若取xgA和xgB反应,生成C和D的质量总和一定≤2xg
C.反应物A和B的质量比一定等于生成物C和D的质量比
D.若C和D都是化合物,则A和B也一定是化合物
B
课堂达标
15. FeCl3溶液用于制作印刷电路板,反应为2FeCl3+Cu=
CuCl2+2X。X的化学式是( )
A.Fe B.FeCl2
C.Fe(OH)2 D.Fe(OH)3
课堂达标
B
16.写出下列反应的化学方程式。
(1)硫在氧气中燃烧 ;
(2)锌与稀硫酸反应生成硫酸锌和氢气 ;
(3)双氧水在二氧化锰催化下分解制取氧气 ;
(4)气体二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀和水
;
S+O2 点燃 SO2
课堂达标
Zn+H2SO4=ZnSO4+H2↑
2H2O2MnO22H2O+O2↑
CO2+Ca(OH)2=CaCO3↓+H2O
17.从宏观、微观、符号相结合的视角探究物质及其变化规律是化学独特的研究方法。根据信息,回答下列问题:
(1)宏观辨识:通过科学探究可以认识化学反应中各物质质量之间的关系,如图实验中,
将NaOH溶液滴入锥形瓶中,反应结束用,再次称量,观家到托盘天平的指针______
(填“向左”“向右”或“不”)偏转。
(2)微观探析:下图是氢气在空气中燃烧的微观示意图,
该反应的基本反应类型为______反应。从微观角度分析,
过程I表示分子分解成______的过程。
(3)符号表征:合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg2Cu+3H2 350℃
3MgH2+MgCu2,熔炼制备Mg2Cu合金时,Mg、Cu金属的质量比为_______,氩气能作保护气的原因是___________________________;MgH2与水反应生成氢氧化镁沉淀,并释放出H2。写出反应的化学方程式为:___________________________________________。
不
课堂达标
化合
原子
3:4
化学性质很稳定
MgH2 + 2H2O = Mg(OH)2↓+ 2H2↑
18.工业上煅烧石灰石(主要成分为CaCO3)可制得生石灰(CaO)和二氧化碳。若现有50 t含碳酸钙80%的石灰石完全分解,可得到生石灰的质量为多少吨。
课堂达标
解:碳酸钙质量为50t×80%=40t
设生成氧化钙的质量为x
CaCO3 ==== CaO + CO2↑
100 56
40t x
100/56=40t/x
x=22.4t
答:可得到生石灰的质量为22.4 t。
高温
19.硅酸钠(Na2SiO3)是我国优先发展的精细
化工产品,工业制备硅酸钠的反应为2NaOH
+SiO2 = Na2SiO3+H2O。现以125 t石英
砂(SiO2的质量分数为96%)为原料,与足量
的NaOH溶液反应。(已知硅的相对原子质量
为28)
(1)125 t石英砂中SiO2的质量为_____t。
(2)计算理论上可得到Na2SiO3的质量。
课堂达标
解:(1)125t×96%=120t
(2)设理论上可得到Na2SiO3的质量为x
2NaOH+SiO2 = Na2SiO3+H2O
60 122
120t x
60/122=120t/x
x=244t
答:理论上可得到Na2SiO3的质量为244 t。
20.某一矿山上的石灰石样品,其中只含二氧化硅杂质(二氧化硅是一种既不溶于水也不与盐酸反应且耐高温的固体)。某学校的同学们想测定该样品中碳酸钙的质量分数,他们选取了一块石灰石样品,将其敲打粉碎后,称出6g放入烧杯内(烧杯质量为20g),然后加入50g某一定溶质质量分数的足量的稀盐酸,用玻璃棒搅拌至不再产生气泡为止。反应所需时间(t)和烧杯及其所盛物质总质量(m)的关系如下图所示。
请完成下列问题:
(1)实验结束时,理论上共放出二氧化碳的质量为_________g。
(2)计算该石灰石样品中碳酸钙的质量分数。(保留一位小数)
课堂达标
解:(1)根据反应前后固体质量的差值,可求出二氧化碳的质量76g-73.8g=2.2g;
(2)设参加反应的碳酸钙的质量为x
2HCl + CaCO = CaCl + H O + CO ↑
100 44
x 2.2g
100/44 = x/2.2g
x=5g
该石灰石样品中碳酸钙的质量分数5g/6g×100% = 83.3%
答:石灰石样品中碳酸钙的质量分数83.3%。
课堂达标
谢谢您的观看
THANKS
感受化学魅力
探寻化学之美
同课章节目录
