2025中考九年级化学工艺流程题专题复习真题汇总(含解析)
文档属性
| 名称 | 2025中考九年级化学工艺流程题专题复习真题汇总(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-18 15:57:43 | ||
图片预览

文档简介
2025中考九年级化学工艺流程题专题复习真题汇总
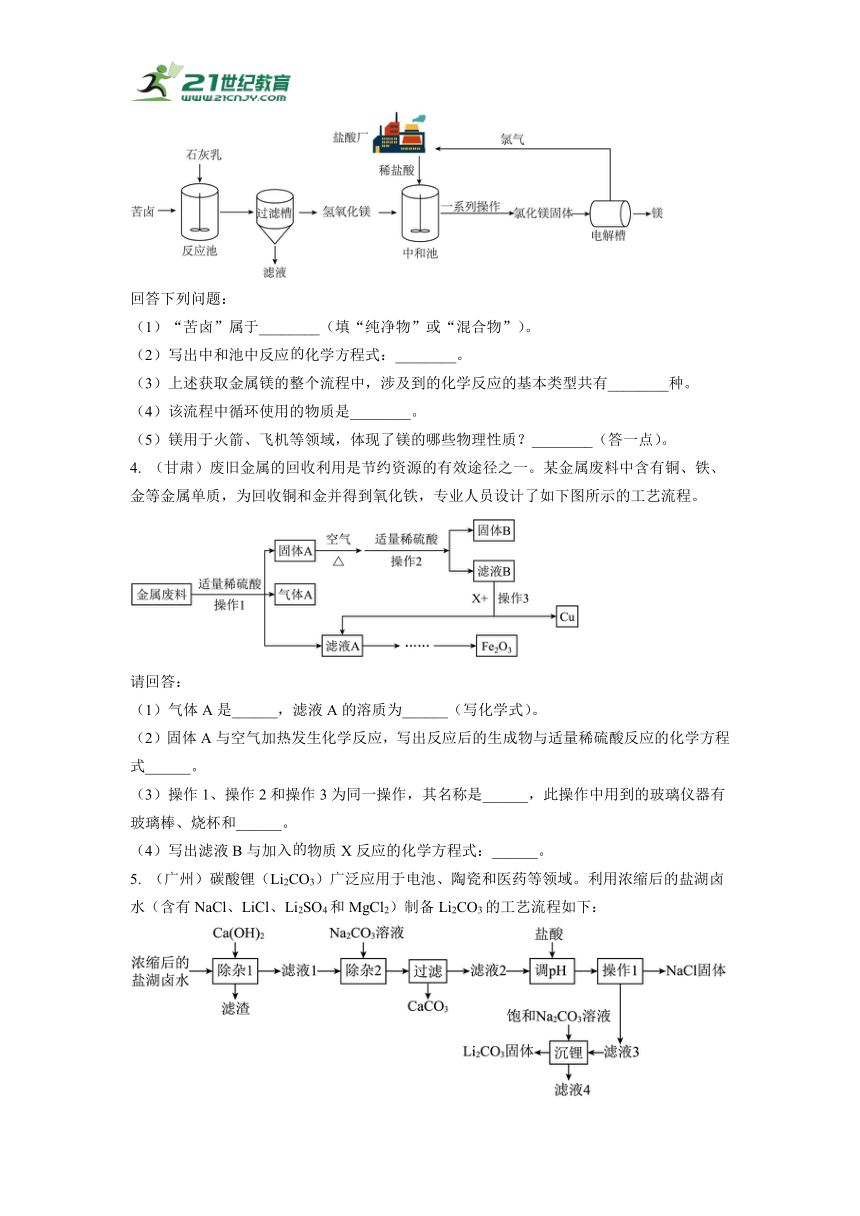
1. (安徽)碳酸锂(Li2CO3)是制备新能源汽车电池的重要原料。我国盐湖卤水中主要含有氯化锂、氯化钠、硫酸镁等溶质,一种以化学沉淀法从卤水中生产碳酸锂的工艺如图:
回答下列问题:
(1)步骤①发生反应的化学方程式为______。
(2)步骤②操作a的名称是______。
(3)步骤③中加入草酸钠,其中草酸根(C2O)的化合价是-2价,则草酸钠的化学式为______。
(4)滤液2中含有LiCl,步骤④中生成Li2CO3的反应类型是______。
(5)该工艺中用到的氧化物有______(写1种即可)。
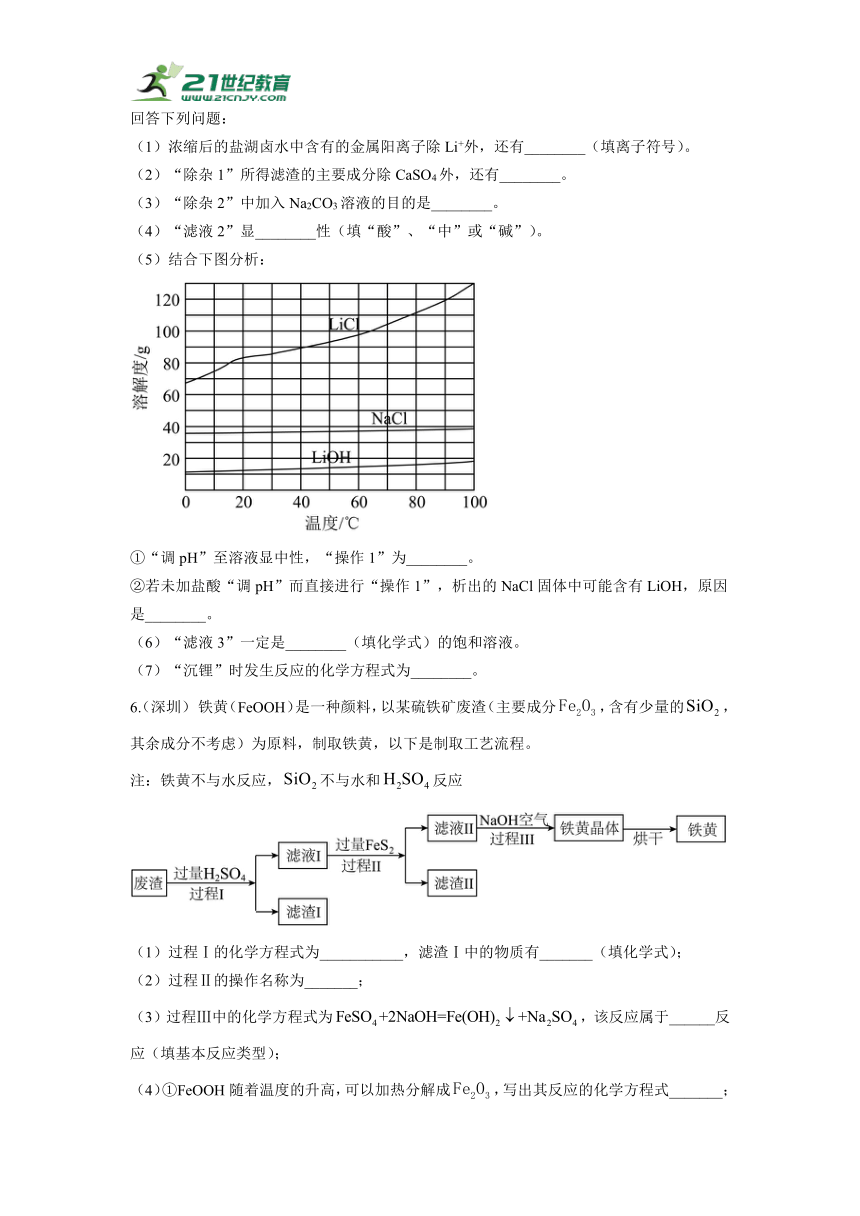
2. (北京)硫化钠()广泛应用于染料、造纸等工业、以为原料制备的部分流程如图所示。
已知:为副产物,直接排放会造成环境污染。
(1)配平化学方程式:
(2)中S的化合价为______。
(3)图中标示出的物质中,属于单质的是______。
(4)设备2中,加入NaOH溶液的目的是______。
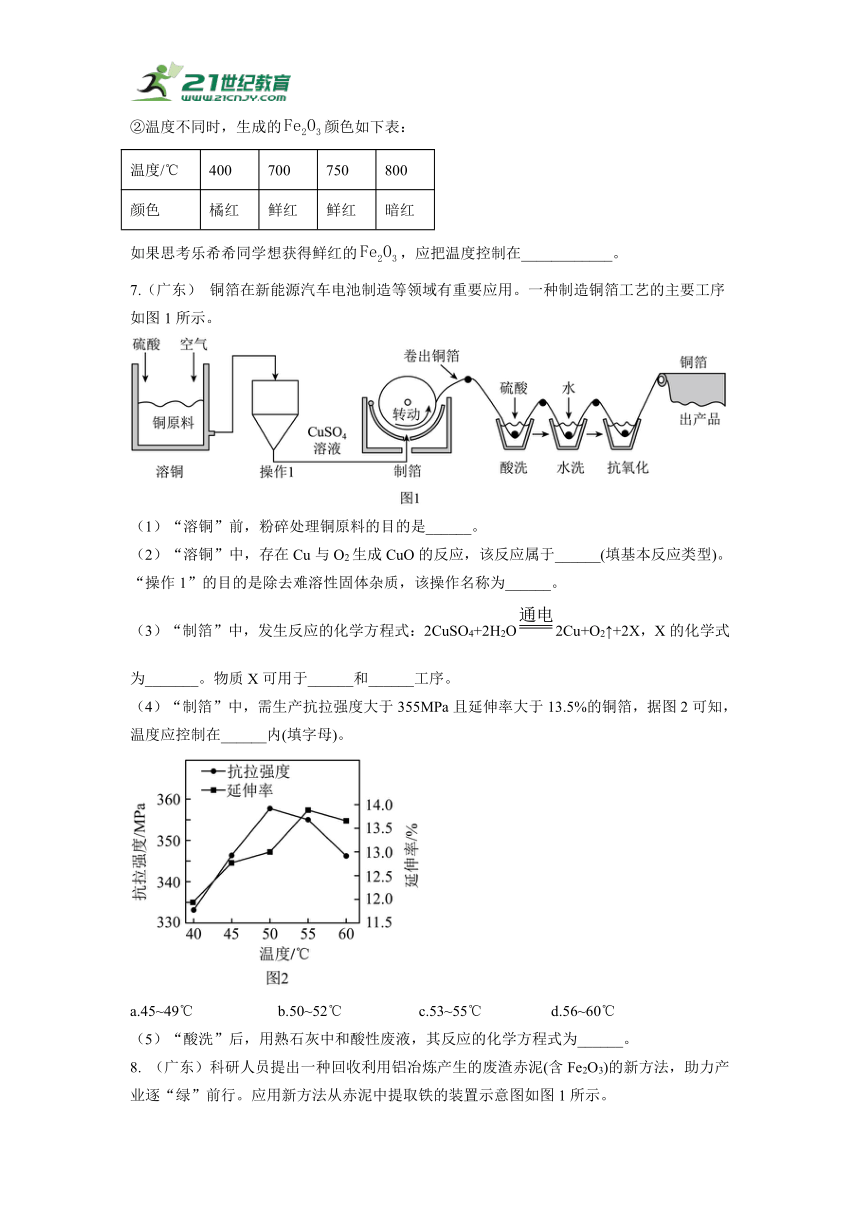
3. (兰州)镁被誉为“21世纪最具开发应用潜力、绿色的战略性原材料”。用海水晒盐得到苦卤(含、NaCl等物质),从苦卤中提取镁的部分流程如下图所示。
回答下列问题:
(1)“苦卤”属于________(填“纯净物”或“混合物”)。
(2)写出中和池中反应化学方程式:________。
(3)上述获取金属镁的整个流程中,涉及到的化学反应的基本类型共有________种。
(4)该流程中循环使用的物质是________。
(5)镁用于火箭、飞机等领域,体现了镁的哪些物理性质?________(答一点)。
4. (甘肃)废旧金属的回收利用是节约资源的有效途径之一。某金属废料中含有铜、铁、金等金属单质,为回收铜和金并得到氧化铁,专业人员设计了如下图所示的工艺流程。
请回答:
(1)气体A是______,滤液A的溶质为______(写化学式)。
(2)固体A与空气加热发生化学反应,写出反应后的生成物与适量稀硫酸反应的化学方程式______。
(3)操作1、操作2和操作3为同一操作,其名称是______,此操作中用到的玻璃仪器有玻璃棒、烧杯和______。
(4)写出滤液B与加入物质X反应的化学方程式:______。
5. (广州)碳酸锂(Li2CO3)广泛应用于电池、陶瓷和医药等领域。利用浓缩后的盐湖卤水(含有NaCl、LiCl、Li2SO4和MgCl2)制备Li2CO3的工艺流程如下:
回答下列问题:
(1)浓缩后的盐湖卤水中含有的金属阳离子除Li+外,还有________(填离子符号)。
(2)“除杂1”所得滤渣的主要成分除CaSO4外,还有________。
(3)“除杂2”中加入Na2CO3溶液的目的是________。
(4)“滤液2”显________性(填“酸”、“中”或“碱”)。
(5)结合下图分析:
①“调pH”至溶液显中性,“操作1”为________。
②若未加盐酸“调pH”而直接进行“操作1”,析出的NaCl固体中可能含有LiOH,原因是________。
(6)“滤液3”一定是________(填化学式)的饱和溶液。
(7)“沉锂”时发生反应的化学方程式为________。
6.(深圳) 铁黄(FeOOH)是一种颜料,以某硫铁矿废渣(主要成分,含有少量的,其余成分不考虑)为原料,制取铁黄,以下是制取工艺流程。
注:铁黄不与水反应,不与水和反应
(1)过程Ⅰ的化学方程式为___________,滤渣Ⅰ中的物质有_______(填化学式);
(2)过程Ⅱ的操作名称为_______;
(3)过程Ⅲ中的化学方程式为,该反应属于______反应(填基本反应类型);
(4)①FeOOH随着温度的升高,可以加热分解成,写出其反应的化学方程式_______;
②温度不同时,生成的颜色如下表:
温度/℃ 400 700 750 800
颜色 橘红 鲜红 鲜红 暗红
如果思考乐希希同学想获得鲜红的,应把温度控制在____________。
7.(广东) 铜箔在新能源汽车电池制造等领域有重要应用。一种制造铜箔工艺的主要工序如图1所示。
(1)“溶铜”前,粉碎处理铜原料的目的是______。
(2)“溶铜”中,存在Cu与O2生成CuO的反应,该反应属于______(填基本反应类型)。“操作1”的目的是除去难溶性固体杂质,该操作名称为______。
(3)“制箔”中,发生反应的化学方程式:2CuSO4+2H2O2Cu+O2↑+2X,X的化学式为_______。物质X可用于______和______工序。
(4)“制箔”中,需生产抗拉强度大于355MPa且延伸率大于13.5%的铜箔,据图2可知,温度应控制在______内(填字母)。
a.45~49℃ b.50~52℃ c.53~55℃ d.56~60℃
(5)“酸洗”后,用熟石灰中和酸性废液,其反应的化学方程式为______。
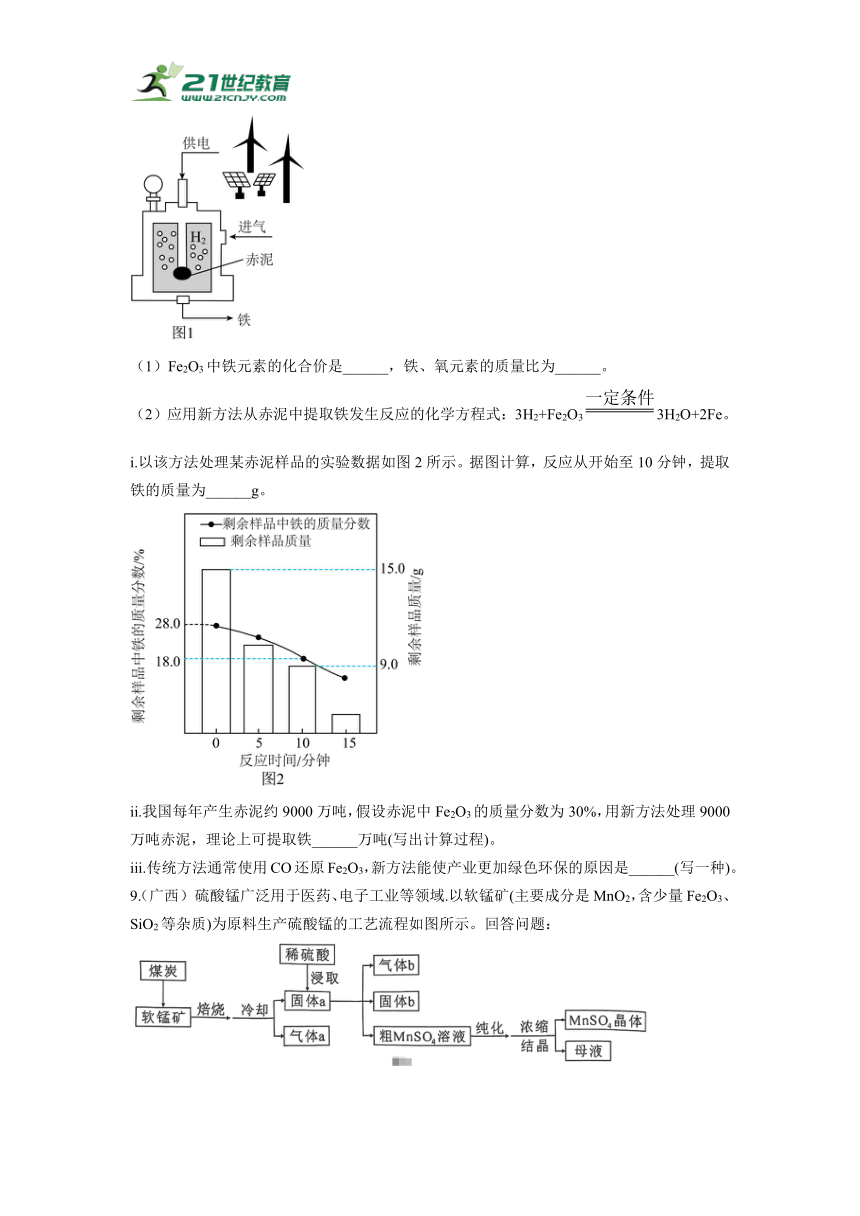
8. (广东)科研人员提出一种回收利用铝冶炼产生的废渣赤泥(含Fe2O3)的新方法,助力产业逐“绿”前行。应用新方法从赤泥中提取铁的装置示意图如图1所示。
(1)Fe2O3中铁元素的化合价是______,铁、氧元素的质量比为______。
(2)应用新方法从赤泥中提取铁发生反应的化学方程式:3H2+Fe2O33H2O+2Fe。
i.以该方法处理某赤泥样品的实验数据如图2所示。据图计算,反应从开始至10分钟,提取铁的质量为______g。
ii.我国每年产生赤泥约9000万吨,假设赤泥中Fe2O3的质量分数为30%,用新方法处理9000万吨赤泥,理论上可提取铁______万吨(写出计算过程)。
iii.传统方法通常使用CO还原Fe2O3,新方法能使产业更加绿色环保的原因是______(写一种)。
9.(广西) 硫酸锰广泛用于医药、电子工业等领域.以软锰矿(主要成分是MnO2,含少量Fe2O3、SiO2等杂质)为原料生产硫酸锰的工艺流程如图所示。回答问题:
资料1:2MnO2+C2MnO+CO2↑、2Fe2O3+3C4Fe+3CO2↑。
资料2:SiO2不溶于水,也不溶于稀硫酸。
(1)焙烧前将软锰矿和煤炭粉碎的目的是______。
(2)加入过量的煤炭可保证软锰矿中的MnO2充分转化为MnO,生成的气体a中除了CO2外,还可能含有______。
(3)用稀硫酸浸取MnO时发生反应的化学方程式是______。
(4)固体a中的某物质可与稀硫酸反应生成气体b,该物质是______。
(5)为了提高原料的利用率,浓缩结晶后剩下的母液应该_______(填“回收利用”或“直接排放”)。
10. (贵州)贵州蕴藏丰富的铝、锰、锌、铁、铜等矿产资源。合理开采、充分利用这些矿产资源,可实现“富矿精开”。
Ⅰ.精准识矿
(1)金属的性质与存在形式。
①铝具有很好的抗腐蚀性,因为铝在空气中能与氧气反应形成一层致密的氧化铝薄膜,反应的化学方程式为______。
②分别在放有锰片、铜片的试管中加入稀硫酸,锰片表面有气泡产生,铜片表面无明显变化。由此可知金属活动性:锰______(选填“强”或“弱”)于铜。
③在放有锌片的试管中加入硫酸铜溶液,观察到的现象是______。
多数金属的化学性质比较活泼,它们主要以化合物的形式存在于自然界。如菱锌矿、铝土矿、菱锰矿等。
Ⅱ.精深用矿
(2)工业上用赤铁矿炼铁,CO与反应的化学方程式为______。炼铁时,加入菱锰矿可制得冶炼锰钢的材料。锰钢用作高铁的钢轨,利用了锰钢的______性能。
(3)用某菱锰矿为原料制备高附加值新型电池材料的流程如图1。
已知:菱锰矿中除外,还有;能与稀硫酸发生复分解反应,不溶于水也不与稀硫酸反应;氨水呈碱性。
①过滤器中得到的滤渣是______。
②反应器中,溶液与反应可生成锰的氧化物,如、、。发生的反应之一是,X的化学式是______。
③70℃时,在反应器中保持通入的和溶液的质量不变,只改变溶液的溶质质量分数,测得生成含锰元素的固体中锰元素的质量分数与溶液的溶质质量分数之间的关系如图2。由图可知,当溶液的溶质质量分数为5.1%时,可获得高纯度的,当溶液的溶质质量分数为其它数值时,纯度降低,原因可能是______。
11.(海南) 硫酸镁晶体(MgSO4·7H2O) 可用于炸药、瓷器、肥料等工业中。一种利用菱苦土(主要成分为氧化镁)制备高纯度硫酸镁晶体的工艺流程如下:
(1)X为常见的酸,X是 __________ ;
(2)步骤②加入碳酸镁的目的是 _______________ ;
(3)通过操作Ⅱ可将活性炭等不溶物与溶液2分离,则操作Ⅱ的名称是 ___________ 。
(4)经测定得到的硫酸镁晶体中MgSO4的质量分数为48.48%,
则晶体的纯度为 ______ 。(计算结果保留小数点后两位。纯度指样品中含主要成分的质量分数。)
12.(江苏镇江)一种用炼铜烟灰(主要含CuO、ZnO)制备Cu和ZnSO4 7H2O的流程如图。
溶液X应选用_____(选填序号)。
a.稀HCl b.稀H2SO4 c.稀HNO3
(2)“置换”发生反应的化学方程式为_______。
(3)“过滤”操作用到的玻璃仪器有____、烧杯、玻璃棒等。
(4)“过滤”后滤液制备ZnSO4 7H2O晶体的实验方案:将滤液______(填操作名称),过滤,洗涤并干燥。
13.(江西)研究小组利用炭粉与氧化铜反应后的剩余固体(含Cu、Cu2O、CuO和C)为原料制备胆矾(硫酸铜晶体),操作流程如图:
资料:
(1)步骤①中进行反应时用玻璃棒搅拌的目的是________。
(2)步骤②中反应化学方程式为Cu+H2SO4+H2O2=CuSO4+2X,则X的化学式为________。
(3)步骤③中生成蓝色沉淀的化学方程式为________。
(4)下列分析不正确的是________(填字母,双选)。
A. 操作1和操作2的名称是过滤
B. 固体N的成分是炭粉
C. 步骤④中加入的溶液丙是Na2SO4溶液
D. “一系列操作”中包含降温结晶,说明硫酸铜溶解度随温度的升高而减小
14.(辽宁节选)甲烷(CH4)可作为清洁燃料和化工原料。煤综合利用获得甲烷的一种简化工艺流程图如下所示。
(1)煤属于________(填“纯净物”或“混合物”),在进入“反应室1”前,通常进行粉碎处理,目的是________。
(2)“反应室1”中产生的氢气经净化后,可通入反应室________(填“2”或“3”)直接参与反应。
(3)在“反应室2”中,一氧化碳和水在催化剂、加热条件下生成二氧化碳和氢气,该反应的化学方程式为________。
(4)“反应室3”中发生的反应为。已知CH4中H的化合价为+1,则CH4中C的化合价为________。
15.(内蒙古包头)金属铜广泛用于电子工业和精密仪器零件制造等领域,从含铜电线电缆的废料(主要成分为铜、塑料绝缘材料等)中回收铜的方案如下:
回答下列问题:
(1)浅绿色溶液中溶质是_________(写化学式)。
(2)黑色固体与稀硫酸反应的化学方程式为_________。
(3)写出从和Cu的混合物中得到Cu的一种方法_________。
(4)上述方案中可能造成空气污染的原因是_________。
16.(内蒙古赤峰)以蛋壳为原料生产高纯碳酸钙,可以实现资源的综合利用。其生产流程如图所示(蛋壳主要含CaCO3,不考虑其他成分的影响)。
(1)蛋壳需要经过粉碎处理,目的是_____________。
(2)反应Ⅰ涉及的化学方程式为_____________。
(3)操作a的名称为_____________。
(4)反应所得的NH4Cl在农业上可用作_____________。
17.(内蒙古呼和浩特)作为基建强国,我国在建筑和水利工程中大量使用到水泥。生产水泥时,加入适量CaSO4可调节水泥硬化速率。工厂利用电石渣[主要成分为Ca(OH)2、MgO]制备CaSO4主要流程如下:
已知:MgO难溶,MgSO4易溶,CaSO4微溶。
(1)电石渣粉碎的目的是________。
(2)加入反应器中的试剂X的名称是________。
(3)反应器中发生的主要反应为________(写1个方程式即可),反应的基本类型是________。
(4)上述流程中,用于分离提纯的设备有________和洗涤槽。
18.(呼伦贝尔、兴安盟)某工厂排放的废液中含有硫酸铜和硫酸亚铁,将废液转化为硫酸锌溶液的流程图如下,请回答下列问题。
(1)步骤Ⅰ和步骤Ⅲ的操作名称是___________。
(2)步骤Ⅱ用磁铁吸引分离出的固体B是___________(填化学式)。
(3)写出步骤Ⅲ中反应的化学方程式___________。
19.(内蒙古通辽)某校化学兴趣小组在教师的指导下,查阅大量资料后,设计了在实验室中从废弃脱氧剂(主要成分:Fe、Fe2O3、C、Na2CO3,NaCl、硅藻土,硅藻土既不溶于水也不与酸反应)中回收 Fe 的两种方案。
请回答下列问题。
(1)废弃脱氧剂的主要成分中属于氧化物的是 ___________ (填化学式)。
(2)属于 ___________(填基本反应类型)。
(3)操作A的名称是___________ (填“过滤”“蒸发”或“蒸馏”)。
(4)加过量稀盐酸目的是___________
(5)在不考虑实验用品成本前提下,与方案一相比,方案二的优点是___________(写出一条即可)。
参考答案
1. (安徽)
【答案】(1)CaO + H2O = Ca(OH)2
(2)过滤 (3)Na2C2O4
(4)复分解反应 (5)生石灰(氧化钙)或水
【解析】
【小问1详解】
步骤①发生的反应是氧化钙与水反应生成氢氧化钙,反应的化学方程式为CaO + H2O = Ca(OH)2;
【小问2详解】
步骤②操作a能固体与液体分离,其名称是过滤;
【小问3详解】
钠元素显+1价,草酸根()的化合价是-2价,书写化学式时,一般正价的写在左边,负价的写在右边,根据化合物中各元素化合价代数和为零,草酸钠的化学式为:Na2C2O4;
【小问4详解】
滤液2中含有LiCl,步骤④中生成Li2CO3的反应是碳酸钠与氯化锂相互交换成分生成碳酸锂和氯化钠,该反应是由两种化合物相互交换成分生成两种化合物的反应,属于复分解反应;
【小问5详解】
氧化物是由两种元素组成,其中一种元素是氧元素化合物,该工艺中用到的生石灰(氧化钙)、水都是由两种元素组成,其中一种元素是氧元素的化合物,属于氧化物。
2. (北京)
【答案】(1) (2)-2
(3)氢气##H2 (4)吸收H2S,防止污染环境
【解析】
【小问1详解】
根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含2个Na、1个S、4个O,故硫化钠的化学计量数为1,水的化学计量数为4,生成物中含8个H,则氢气的化学计量数为4,则配平后为:;
【小问2详解】
硫化钠中钠元素显+1价,设硫元素化合价为x,根据化合物中,正、负化合价的代数和为零,可得:,x=-2;
【小问3详解】
图中标示出的物质中,氢气是由氢元素组成的纯净物,属于单质;硫酸钠是由Na、S、O三种元素组成的纯净物,属于化合物;硫化钠是由Na、S元素组成的纯净物,属于化合物;硫化氢是由H、S元素组成的纯净物,属于化合物;氢氧化钠是由Na、O、H元素组成的纯净物,属于化合物,故填:氢气;
【小问4详解】
H2S为副产物,直接排放会造成环境污染,氢氧化钠能与硫化氢反应生成硫化钠和水,故加入氢氧化钠溶液的目的是:吸收H2S,防止污染环境。
3. (兰州)
【答案】(1)混合物 (2)
(3)3##三 (4)氯气##Cl2
(5)轻质或延展性或良好的导电性和导热性等(合理即可)
【解析】
【小问1详解】
苦卤含MgCl2、NaCl等物质,属于混合物;
【小问2详解】
中和池中氢氧化镁和稀盐酸反应生成氯化镁和水,化学方程式为:;
【小问3详解】
苦卤含MgCl2、NaCl等物质,加入石灰乳,氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钠,该反应是两种化合物相互交换成分生成另外两种化合物,属于复分解反应;
中和池中氢氧化镁和稀盐酸反应生成氯化镁和水,该反应是两种化合物相互交换成分生成另外两种化合物,属于复分解反应;
氯化镁通电分解生成镁和氯气,该反应是一种物质生成两种物质,符合“一变多”的特点,属于分解反应;
氯气和氢气点燃生成氯化氢,该反应是两种物质生成一种物质,符合“多变一”的特点,属于化合反应;
故上述获取金属镁的整个流程中,涉及到的化学反应的基本类型共有三种;
【小问4详解】
根据流程,氯气既是生成物,又是反应物,可循环使用;
【小问5详解】
镁广泛应用于火箭、飞机等领域,主要体现了镁的轻质、 延展性、 以及良好的导电性和导热性,均不需要通过化学变化就能表现出来,属于镁的物理性质。
4. (甘肃)
【答案】(1) ①. H2 ②. FeSO4
(2)
(3) ①. 过滤 ②. 漏斗
(4)
【解析】
【分析】金属废料中含有铜、铁、金等金属单质,加入适量稀硫酸,铜、金和稀硫酸不反应,铁和稀硫酸反应生成硫酸亚铁和氢气,操作1是过滤,实现固液分离,则滤液A是硫酸亚铁溶液,气体A是氢气,固体A是铜、金,固体A在空气中加热,金不反应,铜与氧气加热生成氧化铜,加入适量稀硫酸,氧化铜与稀硫酸反应生成硫酸铜和水,操作2是过滤,固体B是金,滤液B是硫酸铜溶液,滤液B加入X,通过操作3过滤,得到铜和硫酸亚铁,则X是铁,滤液A经过一系列反应得到氧化铁。
【小问1详解】
综上分析,气体A是氢气,化学式为H2;滤液A的溶质是硫酸亚铁,化学式为FeSO4;
【小问2详解】
固体A是铜和铁,氧气与铜在加热条件下反应生成氧化铜,氧化铜与稀硫酸反应生成硫酸铜和水,该反应化学方程式:;
【小问3详解】
操作1、操作2和操作3都是将固体和液体分离,为过滤,该操作中用到的玻璃仪器有玻璃棒、烧杯和漏斗;
【小问4详解】
滤液B是硫酸铜溶液,往滤液B中加入的物质X是铁,铁和硫酸铜反应生成铜和硫酸亚铁,化学方程式为。
5. (广州)
【答案】(1)Na+、Mg2+
(2)Mg(OH)2 (3)除去“除杂1”中加入过量的Ca(OH)2
(4)碱 (5) ①. 蒸发结晶,趁热过滤 ②. 溶液中含OH-(LiOH),LiOH溶解度小于NaCl溶解度
(6)NaCl (7)
【解析】
【小问1详解】
浓缩后的盐湖卤水(含有NaCl、LiCl、Li2SO4和MgCl2),故浓缩后的盐湖卤水中含有的金属阳离子除Li+外,还有Na+、Mg2+;
【小问2详解】
Ca(OH)2还能与MgCl2反应生成Mg(OH)2沉淀,故“除杂1”所得滤渣的主要成分除CaSO4外,还有Mg(OH)2;
【小问3详解】
过滤后,由CaCO3产生,故“除杂2”中加入Na2CO3溶液的目的是除去“除杂1”中加入过量的Ca(OH)2;
小问4详解】
Na2CO3溶液与过量的Ca(OH)2生成CaCO3沉淀和NaOH溶液,过滤,得到“滤液2”, “滤液2”中含NaOH,故“滤液2”显碱性;
【小问5详解】
①如图所示,由于氯化钠溶解度受温度影响小,氯化锂溶解度随温度升高而明显增大,因此“操作1”后分离出NaCl固体和滤液3,则“操作1”为蒸发结晶,趁热过滤;
②若未加盐酸“调pH”,则溶液中含OH-(LiOH),根据图示可知,LiOH溶解度小于NaCl溶解度,则直接进行“操作1”,析出的NaCl固体中可能含有LiOH;
【小问6详解】
“滤液3”是析出NaCl固体后所得溶液,故“滤液3”一定是NaCl的饱和溶液;
【小问7详解】
加盐酸“调pH”后,溶液中阴离子只有Cl-,则“沉锂”时,加入的饱和Na2CO3溶液和LiCl反应生成Li2CO3固体和NaCl,化学方程式为。
6.(深圳)
【答案】(1) ①. ②. SiO2
(2)过滤 (3)复分解
(4) ①. ②. 700℃~750℃
【解析】
【小问1详解】
根据资料,铁黄不与水反应,SiO2不与水和H2SO4反应。某硫铁矿废渣(主要成分Fe2O3,含有少量的SiO2,其余成分不考虑),过程Ⅰ加入过量H2SO4,Fe2O3与H2SO4反应生成Fe2(SO4)3、H2O,化学方程式为:。
SiO2不与水和H2SO4反应,所以滤渣Ⅰ中的物质有SiO2。
【小问2详解】
根据流程图,经过过程Ⅱ,得到了滤液Ⅱ和滤渣Ⅱ,说明该过程是过滤。
【小问3详解】
过程Ⅲ中的化学方程式为,该反应由两种化合物交换成分生成两种新的化合物,属于基本反应类型中的复分解反应。
小问4详解】
①根据质量守恒定律,化学反应前后,元素的种类不变。反应物FeOOH含有Fe、O、H这三种元素,产物Fe2O3含有Fe、O这两种元素,则反应一定生成一种含有氢元素的产物,由于FeOOH含有Fe、O、H这三种元素,推知另一种产物是H2O,则FeOOH加热分解成Fe2O3、H2O,化学方程式为:。
②根据表格信息,想获得鲜红的Fe2O3,应把温度控制在700℃~750℃。
7.(广东)
【答案】(1)增大反应物之间的接触面积,使反应更快更充分
(2) ①. 化合反应 ②. 过滤
(3) ①. H2SO4 ②. 溶铜 ③. 酸洗
(4)c (5)
【解析】
【小问1详解】
“溶铜”前,粉碎处理铜原料的目的是:增大反应物之间的接触面积,使反应更快更充分;
【小问2详解】
“溶铜”中,存在Cu与O2生成CuO的反应,该反应符合“多变一”的特点,属于化合反应;
“操作1”的目的是除去难溶性固体杂质,则该操作实现了固液分离,名称为过滤;
【小问3详解】
根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含Cu、S、O、H的个数分别是2、2、10、4,生成物中含Cu、S、O、H的个数分别是2、0、2、0,故生成物中还应含2个S、8个O、4个H,故X的化学式为:H2SO4;
溶铜过程中,铜与氧气反应生成氧化铜,氧化铜与硫酸反应生成硫酸铜和水,且由图可知,酸洗过程中,也用到硫酸,故物质X可用于溶铜和酸洗工序;
小问4详解】
由图可知,“制箔”中,需生产抗拉强度大于355MPa且延伸率大于13.5%的铜箔,故需要温度控制在53~55℃ 。
故选c;
【小问5详解】
“酸洗”后,用熟石灰中和酸性废液,其反应为氢氧化钙和硫酸反应生成硫酸钙和水,该反应的化学方程式为:。
8. (广东)
【答案】(1) ①. +3 ②. 7:3
(2) ①. 2.58 ②. 解:设理论上可提取铁的质量为x,
x=1890万吨
答:理论上可提取铁1890万吨。 ③. 新方法产物是水,对环境无污染(合理即可)
【解析】
【小问1详解】
Fe2O3中氧元素显-2价,根据在化合物中各元素正负化合价代数和为0,则铁元素的化合价是+3价;铁、氧元素的质量比为(56×2):(16×3)=7:3;
【小问2详解】
i、0分钟时,铁的质量为15.0g×28.0%=4.2g;10分钟时,铁的质量为9.0g×18.0%=1.62g;故反应从开始至10分钟,提取铁的质量为4.2g-1.62g=2.58g;
ii、见答案;
iii、传统方法通常使用CO还原Fe2O3,新方法用氢气在一定条件下还原氧化铁,生成铁和水,能使产业更加绿色环保的原因是氢气还原氧化铁产物为水,对环境无污染。
9.(广西)
【答案】(1)增大接触面积,使其充分反应 (2)CO
(3) (4)氢气
(5)回收利用
【解析】
【小问1详解】
将软锰矿粉碎,能增大接触面积,使其充分反应;
【小问2详解】
煤炭过量,碳和二氧化碳高温下反应生成一氧化碳,因此还可能含有一氧化碳;
【小问3详解】
MnO与硫酸反应生成硫酸锰和水,化学方程式为;
【小问4详解】
根据资料1,焙烧过程中,碳和氧化铁反应生成了铁,加入稀硫酸后,铁和硫酸反应生成硫酸亚铁和氢气,故气体b为氢气;
【小问5详解】
为了提高原料的利用率,浓缩结晶后剩下的母液中含有硫酸锰,应该回收利用。
10. (贵州)
【答案】(1) ①. 4Al+3O2=2Al2O3 ②. 强 ③. 锌片附着一层红色固体
(2) ①. Fe2O3+3CO2Fe+3CO2 ②. 硬度大、耐腐蚀
(3) ①. ②. H2SO4 ③. 溶液的溶质质量分数不同,生成不同的锰的氧化物
【解析】
【小问1详解】
①铝具有很好的抗腐蚀性,因为铝在空气中能与氧气反应形成一层致密的氧化铝薄膜,反应的化学方程式为:4Al+3O2=2Al2O3。
②金属活动性顺序中,排在氢前面的金属能与稀盐酸反应生成氢气。分别在放有锰片、铜片的试管中加入稀硫酸,锰片表面有气泡产生,说明锰在氢前。铜片表面无明显变化,说明铜在氢后。由此可知金属活动性:锰强于铜。
③金属活动性顺序中,排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来,在放有锌片的试管中加入硫酸铜溶液,发生反应:Zn+CuSO4=Cu+ZnSO4,生成的铜附着在锌片的表面,所以观察到的现象是:锌片附着一层红色固体。
小问2详解】
工业上用赤铁矿炼铁,CO与反应生成二氧化碳、铁,反应化学方程式为:Fe2O3+3CO2Fe+3CO2。炼铁时,加入菱锰矿可制得冶炼锰钢的材料。锰钢用作高铁的钢轨,利用了锰钢的硬度大、耐腐蚀的性能。
【小问3详解】
①通过过滤可将难溶于水的固体物质与水分离,因为不溶于水也不与稀硫酸反应,所以过滤器中得到的滤渣是。
②反应前有6Mn、32O、12H、6S,反应后(X除外)有6Mn、8O,根据化学反应前后各种原子个数相等,则X的化学式是H2SO4。
③由图可知,当溶液的溶质质量分数为5.1%时,可获得高纯度的,当溶液的溶质质量分数为其它数值时,纯度降低,原因可能是溶液的溶质质量分数不同,生成不同的锰的氧化物。
11.(海南)
【答案】(1)硫酸##H2SO4
(2)将硫酸转化为硫酸镁,提纯硫酸镁
(3)过滤 (4)解:硫酸镁的化学式量=24+32+16×4=120,硫酸镁晶体的化学式量=24+32+16×4+18×7=246,硫酸镁晶体中MgSO4的质量分数为48.48%
设晶体的纯度为x
=
x≈99.4%
答:晶体的纯度为99.4%。
【解析】
【小问1详解】
菱苦土的主要成分为氧化镁,根据质量守恒定律可知,将氧化镁转化为硫酸镁,则加入的X溶液为硫酸镁溶液,即X为硫酸,故填硫酸或H2SO4。
【小问2详解】
由题文可知,操作①加入过量硫酸溶液,则溶液1中除硫酸镁外,还含量过量的硫酸,硫酸能够与碳酸镁反应生成硫酸镁、水和二氧化碳,将硫酸转化为硫酸镁,即步骤②加入碳酸镁的目的是提纯硫酸镁,故填提纯硫酸镁。
【小问3详解】
操作Ⅱ可将活性炭等不溶物与溶液2分离,而过滤能够将难溶性固体与液体进行分离,则操作Ⅱ的名称是过滤,故填过滤。
【小问4详解】
见答案
12.(江苏镇江)
【答案】(1)b (2) (3)漏斗 (4)蒸发浓缩、冷却结晶
【解析】
【小问1详解】
该流程用炼铜烟灰(主要含CuO、ZnO)制备Cu和ZnSO4 7H2O,根据质量守恒定律,化学反应前后,元素种类不变,CuO、ZnO、Zn中不含S元素,而ZnSO4 7H2O中含有S元素,说明X溶液中含有S元素,稀HCl、稀H2SO4、稀HNO3中只有稀H2SO4含有S元素,则X溶液是稀H2SO4,故填:b。
【小问2详解】
CuO与稀H2SO4反应生成CuSO4、H2O,ZnO与稀H2SO4反应生成ZnSO4、H2O,酸溶步骤后,溶液中溶质一定有CuSO4、ZnSO4,不确定是否有H2SO4。加入Zn,Zn与ZnSO4不反应,Zn与CuSO4发生置换反应生成ZnSO4、Cu,化学方程式为,Zn可与H2SO4发生置换反应生成ZnSO4、H2,化学方程式为,根据流程图,置换后没有说明是否产生H2,则一定发生的反应是。
【小问3详解】
“过滤”操作用到的玻璃仪器有漏斗、烧杯、玻璃棒等。
小问4详解】
“过滤”后滤液一定含有ZnSO4,利用滤液制备ZnSO4 7H2O,需要析出溶质,则方案是:将滤液蒸发浓缩、冷却结晶,过滤,洗涤并干燥。
(江西)
【答案】(1)加快化学反应速率(或使反应更充分等)(2)H2O (3) (4)CD
【解析】
【小问1详解】
反应过程中搅拌的目的是使反应物之间充分接触,加快反应速度,使反应更快更充分;
【小问2详解】
化学反应前后原子的种类和个数不变,反应前有6个氧原子、1个铜原子、4个氢原子、1个硫原子,反应后有4个氧原子、1个铜原子、1个硫原子,所以2X中共有2个氧原子、4个氢原子,故一个X的分子中有1个氧原子、2个氢原子,故填:H2O;
【小问3详解】
通过步骤②得到溶液甲,其中的溶质为硫酸铜,加入过量氢氧化钠后,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
【小问4详解】
A、通过操作1和操作2均得到一份溶液和一份固体,属于固液分离操作,为过滤,正确;
B、剩余固体中含Cu、Cu2O、CuO和C,加入过量稀硫酸后得到的固体M中含铜和炭,加入过量过氧化氢溶液和过量稀硫酸后,得到的固体N为不反应的炭,正确;
C、步骤③得到的蓝色沉淀为氢氧化铜沉淀,加入适量溶液丙要得到硫酸铜溶液,而Na2SO4不与氢氧化铜反应,丙应为硫酸,与氢氧化铜反应生成硫酸铜和水,错误;
D、“一系列操作”中包含降温结晶,可通过降温结晶获得晶体,说明硫酸铜的溶解度随温度的升高而增大,错误。
故选:CD。
13.(辽宁节选)
(1)①混合物 ②增大与反应物的接触面积,使反应更快、更充分 (2)3 (3) (4)-4
【小问1详解】
煤由多种物质组成,属于混合物;
在进入“反应室1”前,通常进行粉碎处理,目的是增大与反应物的接触面积,使反应更快、更充分;
【小问2详解】
由流程图可知,“反应室1”中产生的氢气经净化后,可通入反应室3直接参与反应;
【小问3详解】
在“反应室2”中,一氧化碳和水在催化剂、加热条件下生成二氧化碳和氢气,该反应的化学方程式为;
【小问4详解】
已知CH4中H的化合价为+1,根据在化合物中各元素化合价的代数和为零,则CH4中C的化合价为-4。
14.(内蒙古包头)
【答案】(1)FeSO4 (2)
(3)用磁铁吸引;加入过量稀盐酸,过滤 (4)塑料在空气中燃烧会产生有害气体
【解析】
【分析】含铜电线电缆的废料(主要成分为铜、塑料绝缘材料等)在空气中灼烧,得到黑色固体氧化铜,氧化铜与过量稀硫酸反应生成硫酸铜和水,硫酸铜溶液是蓝色溶液,硫酸铜和过量铁反应生成硫酸亚铁和铜,过量铁和稀硫酸反应生成硫酸亚铁和氢气,过滤得到滤渣:铁、铜,说明有铁剩余,稀硫酸反应完全,滤液:硫酸亚铁溶液。
【小问1详解】
浅绿色溶液是指硫酸亚铁溶液,溶质化学式:FeSO4。
【小问2详解】
黑色固体氧化铜与稀硫酸反应生成硫酸铜和水,该反应化学方程式:。
【小问3详解】
磁铁吸引铁、不吸引铜,可利用磁铁吸引;稀盐酸与铁反应,与铜不反应,可以向铁、铜混合物中加入过量稀盐酸,过滤,洗涤、干燥,得到铜。
【小问4详解】
含铜废料中含有塑料,塑料在空气中燃烧会产生有害气体,污染环境。
15.(内蒙古赤峰)
【答案】(1)增大反应物之间的接触面积,使反应更快更充分 (2)
(3)过滤 (4)氮肥
【解析】
【小问1详解】
蛋壳需要经过粉碎处理,目的是:增大反应物之间的接触面积,使反应更快更充分;
【小问2详解】
蛋壳主要成分是碳酸钙,故反应Ⅰ为碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,该反应的化学方程式为:;
【小问3详解】
操作a实现了固液分离,名称是:过滤;
【小问4详解】
氯化铵含N、P、K中的氮元素,故氯化铵在农业上可用作氮肥。
16.(内蒙古呼和浩特)
【答案】(1)使反应完充分接触从而使反应更充分 (2)稀硫酸
(3)① ②复分解反应(4)过滤器
【解析】
【小问1详解】
根据题意,电石渣是固体需要和反应器中的物质反应,粉碎后可以增大接触面积从而使反应更充分;
【小问2详解】
根据氢氧化钙和氧化镁最终经过流程生成硫酸钙和硫酸镁,由氢氧化钙和氧化镁都能和稀硫酸反应生成,故推知X是稀硫酸;
【小问3详解】
根据上述分析可知,反应器中的反应是氢氧化钙和稀硫酸反应生成硫酸钙和水,以及氧化镁和稀硫酸反应生成硫酸镁和水,化学方程式分别是:;;
两个反应都是两种化合物互相交换成分生成另外两种化合物的反应即复分解反应;
【小问4详解】
根据题意和流程,硫酸钙微溶于水,硫酸镁易容,通过过滤器可以将二者分离,故填:过滤器
17.(呼伦贝尔、兴安盟)
【答案】(1)过滤 (2)Fe (3)
【解析】
【小问1详解】
根据流程图,经过步骤Ⅰ、步骤Ⅲ,都得到了滤液和固体,说明步骤Ⅰ、步骤Ⅲ实现了固液分离,这两个步骤都是过滤。
【小问2详解】
废液中含有硫酸铜和硫酸亚铁,步骤Ⅰ加入过量Zn,由于金属活动性:Zn>Fe>Cu,所以Zn能与硫酸铜反应生成硫酸锌、铜单质,Zn能与硫酸亚铁反应生成硫酸锌、铁单质,则过滤后固体A的成分是Zn、Cu、Fe,其中能被磁铁吸引的成分是Fe,则经过步骤Ⅱ,所得固体B是Fe。
【小问3详解】
根据(2)的分析,固体A的成分是Zn、Cu、Fe,固体B的成分是Fe,所以固体C的成分是Zn、Cu。步骤Ⅲ向固体C中加入适量稀硫酸,由于金属活动性:Zn>H>Cu,所以Cu与稀硫酸不反应,Zn与稀硫酸反应生成硫酸锌、氢气,化学方程式为:。
18.(内蒙古通辽)
【答案】(1)Fe2O3 (2)置换反应 (3)过滤 (4)使Fe2O3、Na2CO3完全反应 (5)节约能源
【解析】
【小问1详解】
氧化物是由两种元素组成且其中一种元素为氧元素的化合物,则废弃脱氧剂的主要成分中属于氧化物的是Fe2O3;
【小问2详解】
,该反应符合一种单质与一种化合物反应生成另一种单质和另一种化合物,属于基本反应类型中的置换反应;
【小问3详解】
操作A是分离固液的过滤操作;
【小问4详解】
氧化铁能与稀盐酸反应生成氯化铁和水,碳酸钠能与稀盐酸反应生成氯化钠、二氧化碳和水,氯化钠与稀盐酸不反应,C、硅藻土既不溶于水也不与酸反应,则加过量稀盐酸的目的是使Fe2O3、Na2CO3完全反应;
【小问5详解】
在不考虑实验用品成本的前提下,与方案一相比,方案二不需要进行高温加热操作,故其优点是节约能源。
1. (安徽)碳酸锂(Li2CO3)是制备新能源汽车电池的重要原料。我国盐湖卤水中主要含有氯化锂、氯化钠、硫酸镁等溶质,一种以化学沉淀法从卤水中生产碳酸锂的工艺如图:
回答下列问题:
(1)步骤①发生反应的化学方程式为______。
(2)步骤②操作a的名称是______。
(3)步骤③中加入草酸钠,其中草酸根(C2O)的化合价是-2价,则草酸钠的化学式为______。
(4)滤液2中含有LiCl,步骤④中生成Li2CO3的反应类型是______。
(5)该工艺中用到的氧化物有______(写1种即可)。
2. (北京)硫化钠()广泛应用于染料、造纸等工业、以为原料制备的部分流程如图所示。
已知:为副产物,直接排放会造成环境污染。
(1)配平化学方程式:
(2)中S的化合价为______。
(3)图中标示出的物质中,属于单质的是______。
(4)设备2中,加入NaOH溶液的目的是______。
3. (兰州)镁被誉为“21世纪最具开发应用潜力、绿色的战略性原材料”。用海水晒盐得到苦卤(含、NaCl等物质),从苦卤中提取镁的部分流程如下图所示。
回答下列问题:
(1)“苦卤”属于________(填“纯净物”或“混合物”)。
(2)写出中和池中反应化学方程式:________。
(3)上述获取金属镁的整个流程中,涉及到的化学反应的基本类型共有________种。
(4)该流程中循环使用的物质是________。
(5)镁用于火箭、飞机等领域,体现了镁的哪些物理性质?________(答一点)。
4. (甘肃)废旧金属的回收利用是节约资源的有效途径之一。某金属废料中含有铜、铁、金等金属单质,为回收铜和金并得到氧化铁,专业人员设计了如下图所示的工艺流程。
请回答:
(1)气体A是______,滤液A的溶质为______(写化学式)。
(2)固体A与空气加热发生化学反应,写出反应后的生成物与适量稀硫酸反应的化学方程式______。
(3)操作1、操作2和操作3为同一操作,其名称是______,此操作中用到的玻璃仪器有玻璃棒、烧杯和______。
(4)写出滤液B与加入物质X反应的化学方程式:______。
5. (广州)碳酸锂(Li2CO3)广泛应用于电池、陶瓷和医药等领域。利用浓缩后的盐湖卤水(含有NaCl、LiCl、Li2SO4和MgCl2)制备Li2CO3的工艺流程如下:
回答下列问题:
(1)浓缩后的盐湖卤水中含有的金属阳离子除Li+外,还有________(填离子符号)。
(2)“除杂1”所得滤渣的主要成分除CaSO4外,还有________。
(3)“除杂2”中加入Na2CO3溶液的目的是________。
(4)“滤液2”显________性(填“酸”、“中”或“碱”)。
(5)结合下图分析:
①“调pH”至溶液显中性,“操作1”为________。
②若未加盐酸“调pH”而直接进行“操作1”,析出的NaCl固体中可能含有LiOH,原因是________。
(6)“滤液3”一定是________(填化学式)的饱和溶液。
(7)“沉锂”时发生反应的化学方程式为________。
6.(深圳) 铁黄(FeOOH)是一种颜料,以某硫铁矿废渣(主要成分,含有少量的,其余成分不考虑)为原料,制取铁黄,以下是制取工艺流程。
注:铁黄不与水反应,不与水和反应
(1)过程Ⅰ的化学方程式为___________,滤渣Ⅰ中的物质有_______(填化学式);
(2)过程Ⅱ的操作名称为_______;
(3)过程Ⅲ中的化学方程式为,该反应属于______反应(填基本反应类型);
(4)①FeOOH随着温度的升高,可以加热分解成,写出其反应的化学方程式_______;
②温度不同时,生成的颜色如下表:
温度/℃ 400 700 750 800
颜色 橘红 鲜红 鲜红 暗红
如果思考乐希希同学想获得鲜红的,应把温度控制在____________。
7.(广东) 铜箔在新能源汽车电池制造等领域有重要应用。一种制造铜箔工艺的主要工序如图1所示。
(1)“溶铜”前,粉碎处理铜原料的目的是______。
(2)“溶铜”中,存在Cu与O2生成CuO的反应,该反应属于______(填基本反应类型)。“操作1”的目的是除去难溶性固体杂质,该操作名称为______。
(3)“制箔”中,发生反应的化学方程式:2CuSO4+2H2O2Cu+O2↑+2X,X的化学式为_______。物质X可用于______和______工序。
(4)“制箔”中,需生产抗拉强度大于355MPa且延伸率大于13.5%的铜箔,据图2可知,温度应控制在______内(填字母)。
a.45~49℃ b.50~52℃ c.53~55℃ d.56~60℃
(5)“酸洗”后,用熟石灰中和酸性废液,其反应的化学方程式为______。
8. (广东)科研人员提出一种回收利用铝冶炼产生的废渣赤泥(含Fe2O3)的新方法,助力产业逐“绿”前行。应用新方法从赤泥中提取铁的装置示意图如图1所示。
(1)Fe2O3中铁元素的化合价是______,铁、氧元素的质量比为______。
(2)应用新方法从赤泥中提取铁发生反应的化学方程式:3H2+Fe2O33H2O+2Fe。
i.以该方法处理某赤泥样品的实验数据如图2所示。据图计算,反应从开始至10分钟,提取铁的质量为______g。
ii.我国每年产生赤泥约9000万吨,假设赤泥中Fe2O3的质量分数为30%,用新方法处理9000万吨赤泥,理论上可提取铁______万吨(写出计算过程)。
iii.传统方法通常使用CO还原Fe2O3,新方法能使产业更加绿色环保的原因是______(写一种)。
9.(广西) 硫酸锰广泛用于医药、电子工业等领域.以软锰矿(主要成分是MnO2,含少量Fe2O3、SiO2等杂质)为原料生产硫酸锰的工艺流程如图所示。回答问题:
资料1:2MnO2+C2MnO+CO2↑、2Fe2O3+3C4Fe+3CO2↑。
资料2:SiO2不溶于水,也不溶于稀硫酸。
(1)焙烧前将软锰矿和煤炭粉碎的目的是______。
(2)加入过量的煤炭可保证软锰矿中的MnO2充分转化为MnO,生成的气体a中除了CO2外,还可能含有______。
(3)用稀硫酸浸取MnO时发生反应的化学方程式是______。
(4)固体a中的某物质可与稀硫酸反应生成气体b,该物质是______。
(5)为了提高原料的利用率,浓缩结晶后剩下的母液应该_______(填“回收利用”或“直接排放”)。
10. (贵州)贵州蕴藏丰富的铝、锰、锌、铁、铜等矿产资源。合理开采、充分利用这些矿产资源,可实现“富矿精开”。
Ⅰ.精准识矿
(1)金属的性质与存在形式。
①铝具有很好的抗腐蚀性,因为铝在空气中能与氧气反应形成一层致密的氧化铝薄膜,反应的化学方程式为______。
②分别在放有锰片、铜片的试管中加入稀硫酸,锰片表面有气泡产生,铜片表面无明显变化。由此可知金属活动性:锰______(选填“强”或“弱”)于铜。
③在放有锌片的试管中加入硫酸铜溶液,观察到的现象是______。
多数金属的化学性质比较活泼,它们主要以化合物的形式存在于自然界。如菱锌矿、铝土矿、菱锰矿等。
Ⅱ.精深用矿
(2)工业上用赤铁矿炼铁,CO与反应的化学方程式为______。炼铁时,加入菱锰矿可制得冶炼锰钢的材料。锰钢用作高铁的钢轨,利用了锰钢的______性能。
(3)用某菱锰矿为原料制备高附加值新型电池材料的流程如图1。
已知:菱锰矿中除外,还有;能与稀硫酸发生复分解反应,不溶于水也不与稀硫酸反应;氨水呈碱性。
①过滤器中得到的滤渣是______。
②反应器中,溶液与反应可生成锰的氧化物,如、、。发生的反应之一是,X的化学式是______。
③70℃时,在反应器中保持通入的和溶液的质量不变,只改变溶液的溶质质量分数,测得生成含锰元素的固体中锰元素的质量分数与溶液的溶质质量分数之间的关系如图2。由图可知,当溶液的溶质质量分数为5.1%时,可获得高纯度的,当溶液的溶质质量分数为其它数值时,纯度降低,原因可能是______。
11.(海南) 硫酸镁晶体(MgSO4·7H2O) 可用于炸药、瓷器、肥料等工业中。一种利用菱苦土(主要成分为氧化镁)制备高纯度硫酸镁晶体的工艺流程如下:
(1)X为常见的酸,X是 __________ ;
(2)步骤②加入碳酸镁的目的是 _______________ ;
(3)通过操作Ⅱ可将活性炭等不溶物与溶液2分离,则操作Ⅱ的名称是 ___________ 。
(4)经测定得到的硫酸镁晶体中MgSO4的质量分数为48.48%,
则晶体的纯度为 ______ 。(计算结果保留小数点后两位。纯度指样品中含主要成分的质量分数。)
12.(江苏镇江)一种用炼铜烟灰(主要含CuO、ZnO)制备Cu和ZnSO4 7H2O的流程如图。
溶液X应选用_____(选填序号)。
a.稀HCl b.稀H2SO4 c.稀HNO3
(2)“置换”发生反应的化学方程式为_______。
(3)“过滤”操作用到的玻璃仪器有____、烧杯、玻璃棒等。
(4)“过滤”后滤液制备ZnSO4 7H2O晶体的实验方案:将滤液______(填操作名称),过滤,洗涤并干燥。
13.(江西)研究小组利用炭粉与氧化铜反应后的剩余固体(含Cu、Cu2O、CuO和C)为原料制备胆矾(硫酸铜晶体),操作流程如图:
资料:
(1)步骤①中进行反应时用玻璃棒搅拌的目的是________。
(2)步骤②中反应化学方程式为Cu+H2SO4+H2O2=CuSO4+2X,则X的化学式为________。
(3)步骤③中生成蓝色沉淀的化学方程式为________。
(4)下列分析不正确的是________(填字母,双选)。
A. 操作1和操作2的名称是过滤
B. 固体N的成分是炭粉
C. 步骤④中加入的溶液丙是Na2SO4溶液
D. “一系列操作”中包含降温结晶,说明硫酸铜溶解度随温度的升高而减小
14.(辽宁节选)甲烷(CH4)可作为清洁燃料和化工原料。煤综合利用获得甲烷的一种简化工艺流程图如下所示。
(1)煤属于________(填“纯净物”或“混合物”),在进入“反应室1”前,通常进行粉碎处理,目的是________。
(2)“反应室1”中产生的氢气经净化后,可通入反应室________(填“2”或“3”)直接参与反应。
(3)在“反应室2”中,一氧化碳和水在催化剂、加热条件下生成二氧化碳和氢气,该反应的化学方程式为________。
(4)“反应室3”中发生的反应为。已知CH4中H的化合价为+1,则CH4中C的化合价为________。
15.(内蒙古包头)金属铜广泛用于电子工业和精密仪器零件制造等领域,从含铜电线电缆的废料(主要成分为铜、塑料绝缘材料等)中回收铜的方案如下:
回答下列问题:
(1)浅绿色溶液中溶质是_________(写化学式)。
(2)黑色固体与稀硫酸反应的化学方程式为_________。
(3)写出从和Cu的混合物中得到Cu的一种方法_________。
(4)上述方案中可能造成空气污染的原因是_________。
16.(内蒙古赤峰)以蛋壳为原料生产高纯碳酸钙,可以实现资源的综合利用。其生产流程如图所示(蛋壳主要含CaCO3,不考虑其他成分的影响)。
(1)蛋壳需要经过粉碎处理,目的是_____________。
(2)反应Ⅰ涉及的化学方程式为_____________。
(3)操作a的名称为_____________。
(4)反应所得的NH4Cl在农业上可用作_____________。
17.(内蒙古呼和浩特)作为基建强国,我国在建筑和水利工程中大量使用到水泥。生产水泥时,加入适量CaSO4可调节水泥硬化速率。工厂利用电石渣[主要成分为Ca(OH)2、MgO]制备CaSO4主要流程如下:
已知:MgO难溶,MgSO4易溶,CaSO4微溶。
(1)电石渣粉碎的目的是________。
(2)加入反应器中的试剂X的名称是________。
(3)反应器中发生的主要反应为________(写1个方程式即可),反应的基本类型是________。
(4)上述流程中,用于分离提纯的设备有________和洗涤槽。
18.(呼伦贝尔、兴安盟)某工厂排放的废液中含有硫酸铜和硫酸亚铁,将废液转化为硫酸锌溶液的流程图如下,请回答下列问题。
(1)步骤Ⅰ和步骤Ⅲ的操作名称是___________。
(2)步骤Ⅱ用磁铁吸引分离出的固体B是___________(填化学式)。
(3)写出步骤Ⅲ中反应的化学方程式___________。
19.(内蒙古通辽)某校化学兴趣小组在教师的指导下,查阅大量资料后,设计了在实验室中从废弃脱氧剂(主要成分:Fe、Fe2O3、C、Na2CO3,NaCl、硅藻土,硅藻土既不溶于水也不与酸反应)中回收 Fe 的两种方案。
请回答下列问题。
(1)废弃脱氧剂的主要成分中属于氧化物的是 ___________ (填化学式)。
(2)属于 ___________(填基本反应类型)。
(3)操作A的名称是___________ (填“过滤”“蒸发”或“蒸馏”)。
(4)加过量稀盐酸目的是___________
(5)在不考虑实验用品成本前提下,与方案一相比,方案二的优点是___________(写出一条即可)。
参考答案
1. (安徽)
【答案】(1)CaO + H2O = Ca(OH)2
(2)过滤 (3)Na2C2O4
(4)复分解反应 (5)生石灰(氧化钙)或水
【解析】
【小问1详解】
步骤①发生的反应是氧化钙与水反应生成氢氧化钙,反应的化学方程式为CaO + H2O = Ca(OH)2;
【小问2详解】
步骤②操作a能固体与液体分离,其名称是过滤;
【小问3详解】
钠元素显+1价,草酸根()的化合价是-2价,书写化学式时,一般正价的写在左边,负价的写在右边,根据化合物中各元素化合价代数和为零,草酸钠的化学式为:Na2C2O4;
【小问4详解】
滤液2中含有LiCl,步骤④中生成Li2CO3的反应是碳酸钠与氯化锂相互交换成分生成碳酸锂和氯化钠,该反应是由两种化合物相互交换成分生成两种化合物的反应,属于复分解反应;
【小问5详解】
氧化物是由两种元素组成,其中一种元素是氧元素化合物,该工艺中用到的生石灰(氧化钙)、水都是由两种元素组成,其中一种元素是氧元素的化合物,属于氧化物。
2. (北京)
【答案】(1) (2)-2
(3)氢气##H2 (4)吸收H2S,防止污染环境
【解析】
【小问1详解】
根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含2个Na、1个S、4个O,故硫化钠的化学计量数为1,水的化学计量数为4,生成物中含8个H,则氢气的化学计量数为4,则配平后为:;
【小问2详解】
硫化钠中钠元素显+1价,设硫元素化合价为x,根据化合物中,正、负化合价的代数和为零,可得:,x=-2;
【小问3详解】
图中标示出的物质中,氢气是由氢元素组成的纯净物,属于单质;硫酸钠是由Na、S、O三种元素组成的纯净物,属于化合物;硫化钠是由Na、S元素组成的纯净物,属于化合物;硫化氢是由H、S元素组成的纯净物,属于化合物;氢氧化钠是由Na、O、H元素组成的纯净物,属于化合物,故填:氢气;
【小问4详解】
H2S为副产物,直接排放会造成环境污染,氢氧化钠能与硫化氢反应生成硫化钠和水,故加入氢氧化钠溶液的目的是:吸收H2S,防止污染环境。
3. (兰州)
【答案】(1)混合物 (2)
(3)3##三 (4)氯气##Cl2
(5)轻质或延展性或良好的导电性和导热性等(合理即可)
【解析】
【小问1详解】
苦卤含MgCl2、NaCl等物质,属于混合物;
【小问2详解】
中和池中氢氧化镁和稀盐酸反应生成氯化镁和水,化学方程式为:;
【小问3详解】
苦卤含MgCl2、NaCl等物质,加入石灰乳,氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钠,该反应是两种化合物相互交换成分生成另外两种化合物,属于复分解反应;
中和池中氢氧化镁和稀盐酸反应生成氯化镁和水,该反应是两种化合物相互交换成分生成另外两种化合物,属于复分解反应;
氯化镁通电分解生成镁和氯气,该反应是一种物质生成两种物质,符合“一变多”的特点,属于分解反应;
氯气和氢气点燃生成氯化氢,该反应是两种物质生成一种物质,符合“多变一”的特点,属于化合反应;
故上述获取金属镁的整个流程中,涉及到的化学反应的基本类型共有三种;
【小问4详解】
根据流程,氯气既是生成物,又是反应物,可循环使用;
【小问5详解】
镁广泛应用于火箭、飞机等领域,主要体现了镁的轻质、 延展性、 以及良好的导电性和导热性,均不需要通过化学变化就能表现出来,属于镁的物理性质。
4. (甘肃)
【答案】(1) ①. H2 ②. FeSO4
(2)
(3) ①. 过滤 ②. 漏斗
(4)
【解析】
【分析】金属废料中含有铜、铁、金等金属单质,加入适量稀硫酸,铜、金和稀硫酸不反应,铁和稀硫酸反应生成硫酸亚铁和氢气,操作1是过滤,实现固液分离,则滤液A是硫酸亚铁溶液,气体A是氢气,固体A是铜、金,固体A在空气中加热,金不反应,铜与氧气加热生成氧化铜,加入适量稀硫酸,氧化铜与稀硫酸反应生成硫酸铜和水,操作2是过滤,固体B是金,滤液B是硫酸铜溶液,滤液B加入X,通过操作3过滤,得到铜和硫酸亚铁,则X是铁,滤液A经过一系列反应得到氧化铁。
【小问1详解】
综上分析,气体A是氢气,化学式为H2;滤液A的溶质是硫酸亚铁,化学式为FeSO4;
【小问2详解】
固体A是铜和铁,氧气与铜在加热条件下反应生成氧化铜,氧化铜与稀硫酸反应生成硫酸铜和水,该反应化学方程式:;
【小问3详解】
操作1、操作2和操作3都是将固体和液体分离,为过滤,该操作中用到的玻璃仪器有玻璃棒、烧杯和漏斗;
【小问4详解】
滤液B是硫酸铜溶液,往滤液B中加入的物质X是铁,铁和硫酸铜反应生成铜和硫酸亚铁,化学方程式为。
5. (广州)
【答案】(1)Na+、Mg2+
(2)Mg(OH)2 (3)除去“除杂1”中加入过量的Ca(OH)2
(4)碱 (5) ①. 蒸发结晶,趁热过滤 ②. 溶液中含OH-(LiOH),LiOH溶解度小于NaCl溶解度
(6)NaCl (7)
【解析】
【小问1详解】
浓缩后的盐湖卤水(含有NaCl、LiCl、Li2SO4和MgCl2),故浓缩后的盐湖卤水中含有的金属阳离子除Li+外,还有Na+、Mg2+;
【小问2详解】
Ca(OH)2还能与MgCl2反应生成Mg(OH)2沉淀,故“除杂1”所得滤渣的主要成分除CaSO4外,还有Mg(OH)2;
【小问3详解】
过滤后,由CaCO3产生,故“除杂2”中加入Na2CO3溶液的目的是除去“除杂1”中加入过量的Ca(OH)2;
小问4详解】
Na2CO3溶液与过量的Ca(OH)2生成CaCO3沉淀和NaOH溶液,过滤,得到“滤液2”, “滤液2”中含NaOH,故“滤液2”显碱性;
【小问5详解】
①如图所示,由于氯化钠溶解度受温度影响小,氯化锂溶解度随温度升高而明显增大,因此“操作1”后分离出NaCl固体和滤液3,则“操作1”为蒸发结晶,趁热过滤;
②若未加盐酸“调pH”,则溶液中含OH-(LiOH),根据图示可知,LiOH溶解度小于NaCl溶解度,则直接进行“操作1”,析出的NaCl固体中可能含有LiOH;
【小问6详解】
“滤液3”是析出NaCl固体后所得溶液,故“滤液3”一定是NaCl的饱和溶液;
【小问7详解】
加盐酸“调pH”后,溶液中阴离子只有Cl-,则“沉锂”时,加入的饱和Na2CO3溶液和LiCl反应生成Li2CO3固体和NaCl,化学方程式为。
6.(深圳)
【答案】(1) ①. ②. SiO2
(2)过滤 (3)复分解
(4) ①. ②. 700℃~750℃
【解析】
【小问1详解】
根据资料,铁黄不与水反应,SiO2不与水和H2SO4反应。某硫铁矿废渣(主要成分Fe2O3,含有少量的SiO2,其余成分不考虑),过程Ⅰ加入过量H2SO4,Fe2O3与H2SO4反应生成Fe2(SO4)3、H2O,化学方程式为:。
SiO2不与水和H2SO4反应,所以滤渣Ⅰ中的物质有SiO2。
【小问2详解】
根据流程图,经过过程Ⅱ,得到了滤液Ⅱ和滤渣Ⅱ,说明该过程是过滤。
【小问3详解】
过程Ⅲ中的化学方程式为,该反应由两种化合物交换成分生成两种新的化合物,属于基本反应类型中的复分解反应。
小问4详解】
①根据质量守恒定律,化学反应前后,元素的种类不变。反应物FeOOH含有Fe、O、H这三种元素,产物Fe2O3含有Fe、O这两种元素,则反应一定生成一种含有氢元素的产物,由于FeOOH含有Fe、O、H这三种元素,推知另一种产物是H2O,则FeOOH加热分解成Fe2O3、H2O,化学方程式为:。
②根据表格信息,想获得鲜红的Fe2O3,应把温度控制在700℃~750℃。
7.(广东)
【答案】(1)增大反应物之间的接触面积,使反应更快更充分
(2) ①. 化合反应 ②. 过滤
(3) ①. H2SO4 ②. 溶铜 ③. 酸洗
(4)c (5)
【解析】
【小问1详解】
“溶铜”前,粉碎处理铜原料的目的是:增大反应物之间的接触面积,使反应更快更充分;
【小问2详解】
“溶铜”中,存在Cu与O2生成CuO的反应,该反应符合“多变一”的特点,属于化合反应;
“操作1”的目的是除去难溶性固体杂质,则该操作实现了固液分离,名称为过滤;
【小问3详解】
根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含Cu、S、O、H的个数分别是2、2、10、4,生成物中含Cu、S、O、H的个数分别是2、0、2、0,故生成物中还应含2个S、8个O、4个H,故X的化学式为:H2SO4;
溶铜过程中,铜与氧气反应生成氧化铜,氧化铜与硫酸反应生成硫酸铜和水,且由图可知,酸洗过程中,也用到硫酸,故物质X可用于溶铜和酸洗工序;
小问4详解】
由图可知,“制箔”中,需生产抗拉强度大于355MPa且延伸率大于13.5%的铜箔,故需要温度控制在53~55℃ 。
故选c;
【小问5详解】
“酸洗”后,用熟石灰中和酸性废液,其反应为氢氧化钙和硫酸反应生成硫酸钙和水,该反应的化学方程式为:。
8. (广东)
【答案】(1) ①. +3 ②. 7:3
(2) ①. 2.58 ②. 解:设理论上可提取铁的质量为x,
x=1890万吨
答:理论上可提取铁1890万吨。 ③. 新方法产物是水,对环境无污染(合理即可)
【解析】
【小问1详解】
Fe2O3中氧元素显-2价,根据在化合物中各元素正负化合价代数和为0,则铁元素的化合价是+3价;铁、氧元素的质量比为(56×2):(16×3)=7:3;
【小问2详解】
i、0分钟时,铁的质量为15.0g×28.0%=4.2g;10分钟时,铁的质量为9.0g×18.0%=1.62g;故反应从开始至10分钟,提取铁的质量为4.2g-1.62g=2.58g;
ii、见答案;
iii、传统方法通常使用CO还原Fe2O3,新方法用氢气在一定条件下还原氧化铁,生成铁和水,能使产业更加绿色环保的原因是氢气还原氧化铁产物为水,对环境无污染。
9.(广西)
【答案】(1)增大接触面积,使其充分反应 (2)CO
(3) (4)氢气
(5)回收利用
【解析】
【小问1详解】
将软锰矿粉碎,能增大接触面积,使其充分反应;
【小问2详解】
煤炭过量,碳和二氧化碳高温下反应生成一氧化碳,因此还可能含有一氧化碳;
【小问3详解】
MnO与硫酸反应生成硫酸锰和水,化学方程式为;
【小问4详解】
根据资料1,焙烧过程中,碳和氧化铁反应生成了铁,加入稀硫酸后,铁和硫酸反应生成硫酸亚铁和氢气,故气体b为氢气;
【小问5详解】
为了提高原料的利用率,浓缩结晶后剩下的母液中含有硫酸锰,应该回收利用。
10. (贵州)
【答案】(1) ①. 4Al+3O2=2Al2O3 ②. 强 ③. 锌片附着一层红色固体
(2) ①. Fe2O3+3CO2Fe+3CO2 ②. 硬度大、耐腐蚀
(3) ①. ②. H2SO4 ③. 溶液的溶质质量分数不同,生成不同的锰的氧化物
【解析】
【小问1详解】
①铝具有很好的抗腐蚀性,因为铝在空气中能与氧气反应形成一层致密的氧化铝薄膜,反应的化学方程式为:4Al+3O2=2Al2O3。
②金属活动性顺序中,排在氢前面的金属能与稀盐酸反应生成氢气。分别在放有锰片、铜片的试管中加入稀硫酸,锰片表面有气泡产生,说明锰在氢前。铜片表面无明显变化,说明铜在氢后。由此可知金属活动性:锰强于铜。
③金属活动性顺序中,排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来,在放有锌片的试管中加入硫酸铜溶液,发生反应:Zn+CuSO4=Cu+ZnSO4,生成的铜附着在锌片的表面,所以观察到的现象是:锌片附着一层红色固体。
小问2详解】
工业上用赤铁矿炼铁,CO与反应生成二氧化碳、铁,反应化学方程式为:Fe2O3+3CO2Fe+3CO2。炼铁时,加入菱锰矿可制得冶炼锰钢的材料。锰钢用作高铁的钢轨,利用了锰钢的硬度大、耐腐蚀的性能。
【小问3详解】
①通过过滤可将难溶于水的固体物质与水分离,因为不溶于水也不与稀硫酸反应,所以过滤器中得到的滤渣是。
②反应前有6Mn、32O、12H、6S,反应后(X除外)有6Mn、8O,根据化学反应前后各种原子个数相等,则X的化学式是H2SO4。
③由图可知,当溶液的溶质质量分数为5.1%时,可获得高纯度的,当溶液的溶质质量分数为其它数值时,纯度降低,原因可能是溶液的溶质质量分数不同,生成不同的锰的氧化物。
11.(海南)
【答案】(1)硫酸##H2SO4
(2)将硫酸转化为硫酸镁,提纯硫酸镁
(3)过滤 (4)解:硫酸镁的化学式量=24+32+16×4=120,硫酸镁晶体的化学式量=24+32+16×4+18×7=246,硫酸镁晶体中MgSO4的质量分数为48.48%
设晶体的纯度为x
=
x≈99.4%
答:晶体的纯度为99.4%。
【解析】
【小问1详解】
菱苦土的主要成分为氧化镁,根据质量守恒定律可知,将氧化镁转化为硫酸镁,则加入的X溶液为硫酸镁溶液,即X为硫酸,故填硫酸或H2SO4。
【小问2详解】
由题文可知,操作①加入过量硫酸溶液,则溶液1中除硫酸镁外,还含量过量的硫酸,硫酸能够与碳酸镁反应生成硫酸镁、水和二氧化碳,将硫酸转化为硫酸镁,即步骤②加入碳酸镁的目的是提纯硫酸镁,故填提纯硫酸镁。
【小问3详解】
操作Ⅱ可将活性炭等不溶物与溶液2分离,而过滤能够将难溶性固体与液体进行分离,则操作Ⅱ的名称是过滤,故填过滤。
【小问4详解】
见答案
12.(江苏镇江)
【答案】(1)b (2) (3)漏斗 (4)蒸发浓缩、冷却结晶
【解析】
【小问1详解】
该流程用炼铜烟灰(主要含CuO、ZnO)制备Cu和ZnSO4 7H2O,根据质量守恒定律,化学反应前后,元素种类不变,CuO、ZnO、Zn中不含S元素,而ZnSO4 7H2O中含有S元素,说明X溶液中含有S元素,稀HCl、稀H2SO4、稀HNO3中只有稀H2SO4含有S元素,则X溶液是稀H2SO4,故填:b。
【小问2详解】
CuO与稀H2SO4反应生成CuSO4、H2O,ZnO与稀H2SO4反应生成ZnSO4、H2O,酸溶步骤后,溶液中溶质一定有CuSO4、ZnSO4,不确定是否有H2SO4。加入Zn,Zn与ZnSO4不反应,Zn与CuSO4发生置换反应生成ZnSO4、Cu,化学方程式为,Zn可与H2SO4发生置换反应生成ZnSO4、H2,化学方程式为,根据流程图,置换后没有说明是否产生H2,则一定发生的反应是。
【小问3详解】
“过滤”操作用到的玻璃仪器有漏斗、烧杯、玻璃棒等。
小问4详解】
“过滤”后滤液一定含有ZnSO4,利用滤液制备ZnSO4 7H2O,需要析出溶质,则方案是:将滤液蒸发浓缩、冷却结晶,过滤,洗涤并干燥。
(江西)
【答案】(1)加快化学反应速率(或使反应更充分等)(2)H2O (3) (4)CD
【解析】
【小问1详解】
反应过程中搅拌的目的是使反应物之间充分接触,加快反应速度,使反应更快更充分;
【小问2详解】
化学反应前后原子的种类和个数不变,反应前有6个氧原子、1个铜原子、4个氢原子、1个硫原子,反应后有4个氧原子、1个铜原子、1个硫原子,所以2X中共有2个氧原子、4个氢原子,故一个X的分子中有1个氧原子、2个氢原子,故填:H2O;
【小问3详解】
通过步骤②得到溶液甲,其中的溶质为硫酸铜,加入过量氢氧化钠后,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
【小问4详解】
A、通过操作1和操作2均得到一份溶液和一份固体,属于固液分离操作,为过滤,正确;
B、剩余固体中含Cu、Cu2O、CuO和C,加入过量稀硫酸后得到的固体M中含铜和炭,加入过量过氧化氢溶液和过量稀硫酸后,得到的固体N为不反应的炭,正确;
C、步骤③得到的蓝色沉淀为氢氧化铜沉淀,加入适量溶液丙要得到硫酸铜溶液,而Na2SO4不与氢氧化铜反应,丙应为硫酸,与氢氧化铜反应生成硫酸铜和水,错误;
D、“一系列操作”中包含降温结晶,可通过降温结晶获得晶体,说明硫酸铜的溶解度随温度的升高而增大,错误。
故选:CD。
13.(辽宁节选)
(1)①混合物 ②增大与反应物的接触面积,使反应更快、更充分 (2)3 (3) (4)-4
【小问1详解】
煤由多种物质组成,属于混合物;
在进入“反应室1”前,通常进行粉碎处理,目的是增大与反应物的接触面积,使反应更快、更充分;
【小问2详解】
由流程图可知,“反应室1”中产生的氢气经净化后,可通入反应室3直接参与反应;
【小问3详解】
在“反应室2”中,一氧化碳和水在催化剂、加热条件下生成二氧化碳和氢气,该反应的化学方程式为;
【小问4详解】
已知CH4中H的化合价为+1,根据在化合物中各元素化合价的代数和为零,则CH4中C的化合价为-4。
14.(内蒙古包头)
【答案】(1)FeSO4 (2)
(3)用磁铁吸引;加入过量稀盐酸,过滤 (4)塑料在空气中燃烧会产生有害气体
【解析】
【分析】含铜电线电缆的废料(主要成分为铜、塑料绝缘材料等)在空气中灼烧,得到黑色固体氧化铜,氧化铜与过量稀硫酸反应生成硫酸铜和水,硫酸铜溶液是蓝色溶液,硫酸铜和过量铁反应生成硫酸亚铁和铜,过量铁和稀硫酸反应生成硫酸亚铁和氢气,过滤得到滤渣:铁、铜,说明有铁剩余,稀硫酸反应完全,滤液:硫酸亚铁溶液。
【小问1详解】
浅绿色溶液是指硫酸亚铁溶液,溶质化学式:FeSO4。
【小问2详解】
黑色固体氧化铜与稀硫酸反应生成硫酸铜和水,该反应化学方程式:。
【小问3详解】
磁铁吸引铁、不吸引铜,可利用磁铁吸引;稀盐酸与铁反应,与铜不反应,可以向铁、铜混合物中加入过量稀盐酸,过滤,洗涤、干燥,得到铜。
【小问4详解】
含铜废料中含有塑料,塑料在空气中燃烧会产生有害气体,污染环境。
15.(内蒙古赤峰)
【答案】(1)增大反应物之间的接触面积,使反应更快更充分 (2)
(3)过滤 (4)氮肥
【解析】
【小问1详解】
蛋壳需要经过粉碎处理,目的是:增大反应物之间的接触面积,使反应更快更充分;
【小问2详解】
蛋壳主要成分是碳酸钙,故反应Ⅰ为碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,该反应的化学方程式为:;
【小问3详解】
操作a实现了固液分离,名称是:过滤;
【小问4详解】
氯化铵含N、P、K中的氮元素,故氯化铵在农业上可用作氮肥。
16.(内蒙古呼和浩特)
【答案】(1)使反应完充分接触从而使反应更充分 (2)稀硫酸
(3)① ②复分解反应(4)过滤器
【解析】
【小问1详解】
根据题意,电石渣是固体需要和反应器中的物质反应,粉碎后可以增大接触面积从而使反应更充分;
【小问2详解】
根据氢氧化钙和氧化镁最终经过流程生成硫酸钙和硫酸镁,由氢氧化钙和氧化镁都能和稀硫酸反应生成,故推知X是稀硫酸;
【小问3详解】
根据上述分析可知,反应器中的反应是氢氧化钙和稀硫酸反应生成硫酸钙和水,以及氧化镁和稀硫酸反应生成硫酸镁和水,化学方程式分别是:;;
两个反应都是两种化合物互相交换成分生成另外两种化合物的反应即复分解反应;
【小问4详解】
根据题意和流程,硫酸钙微溶于水,硫酸镁易容,通过过滤器可以将二者分离,故填:过滤器
17.(呼伦贝尔、兴安盟)
【答案】(1)过滤 (2)Fe (3)
【解析】
【小问1详解】
根据流程图,经过步骤Ⅰ、步骤Ⅲ,都得到了滤液和固体,说明步骤Ⅰ、步骤Ⅲ实现了固液分离,这两个步骤都是过滤。
【小问2详解】
废液中含有硫酸铜和硫酸亚铁,步骤Ⅰ加入过量Zn,由于金属活动性:Zn>Fe>Cu,所以Zn能与硫酸铜反应生成硫酸锌、铜单质,Zn能与硫酸亚铁反应生成硫酸锌、铁单质,则过滤后固体A的成分是Zn、Cu、Fe,其中能被磁铁吸引的成分是Fe,则经过步骤Ⅱ,所得固体B是Fe。
【小问3详解】
根据(2)的分析,固体A的成分是Zn、Cu、Fe,固体B的成分是Fe,所以固体C的成分是Zn、Cu。步骤Ⅲ向固体C中加入适量稀硫酸,由于金属活动性:Zn>H>Cu,所以Cu与稀硫酸不反应,Zn与稀硫酸反应生成硫酸锌、氢气,化学方程式为:。
18.(内蒙古通辽)
【答案】(1)Fe2O3 (2)置换反应 (3)过滤 (4)使Fe2O3、Na2CO3完全反应 (5)节约能源
【解析】
【小问1详解】
氧化物是由两种元素组成且其中一种元素为氧元素的化合物,则废弃脱氧剂的主要成分中属于氧化物的是Fe2O3;
【小问2详解】
,该反应符合一种单质与一种化合物反应生成另一种单质和另一种化合物,属于基本反应类型中的置换反应;
【小问3详解】
操作A是分离固液的过滤操作;
【小问4详解】
氧化铁能与稀盐酸反应生成氯化铁和水,碳酸钠能与稀盐酸反应生成氯化钠、二氧化碳和水,氯化钠与稀盐酸不反应,C、硅藻土既不溶于水也不与酸反应,则加过量稀盐酸的目的是使Fe2O3、Na2CO3完全反应;
【小问5详解】
在不考虑实验用品成本的前提下,与方案一相比,方案二不需要进行高温加热操作,故其优点是节约能源。
同课章节目录
