2025中考化学定量分析计算专题复习真题练习题(含解析)
文档属性
| 名称 | 2025中考化学定量分析计算专题复习真题练习题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-18 22:11:40 | ||
图片预览




文档简介
2025中考化学定量分析计算专题复习真题练习题
一、选择题
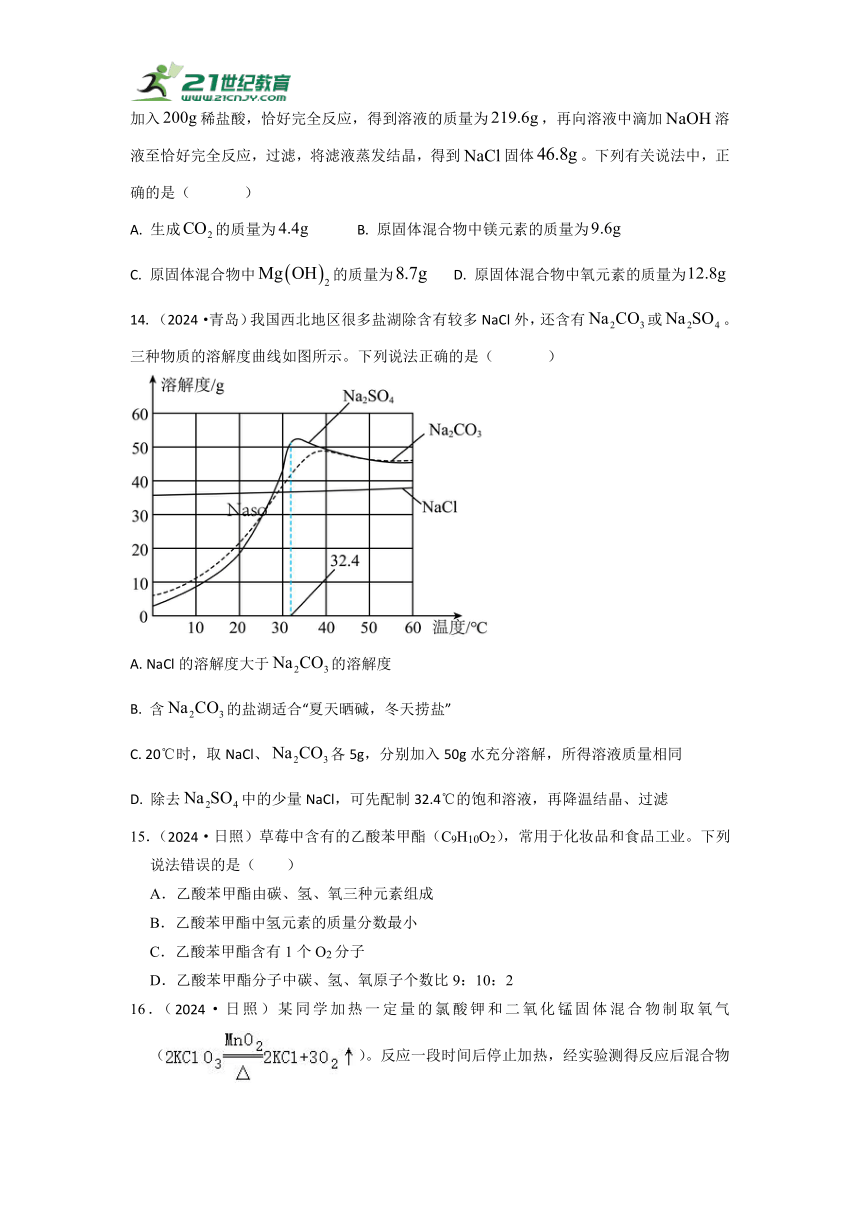
1.(2024·南通) “侯氏制碱法”大幅提高了NaCl的利用率。NaHCO3、NaCl、NH4Cl的溶解度曲线如图所示。下列说法正确的是( )
A. NH4Cl的溶解度一定小于NaCl的溶解度
B. 将20℃的NaCl饱和溶液升高5℃,溶质的质量分数增大
C. 40℃时,NaCl溶液中溶质的质量分数可能小于NaHCO3溶液中溶质的质量分数
D. 40℃时,将15gNaCl溶于50g水中,可获得NaCl饱和溶液
2.(2024·苏州)宋代《千里江山图》历经千年青绿依旧。其中绿色颜料来自孔雀石[主要成分为Cu2(OH)2CO3,也可表示为xCu(OH)2 yCuCO3]。下列说法正确的是( )
A. Cu(OH)2易溶于水 B. Cu(OH)2不能与稀硫酸发生反应
C. CuCO3属于碱 D.
3.(2024·苏州) Na2CO3和NaCl的溶解度曲线如图所示。下列说法正确的是( )
A. Na2CO3的溶解度随温度升高而增大
B. Na2CO3的溶解度一定比NaCl的大
C. T℃时,30gNaCl能完全溶解于50g水中
D. T℃时,Na2CO3和NaCl两种饱和溶液的溶质质量分数相等
4. (2024·苏州)捕集空气中CO2加氢制甲醇(CH3OH),可实现CO2资源化利用和“零碳”排放,其转化流程如图所示。下列说法不正确的是( )
A. 反应①中,电解水生成的H2和O2的分子个数比为2:1
B. 反应②中,生产1.6kgCH3OH理论上要消耗2.2kgCO2
C. 转化过程中,H2O和H2循环转化,无需额外补充
D. 等质量的甲醇制取时消耗的CO2与燃烧时生成的CO2相等,实现“零碳”排放
5.(2024南通) 学习小组为探究氢气还原氧化铜所得固体产物X组成,设计如下实验:
步骤1 观察产物X的颜色为红色。
步骤2 向产物X中加入过量的盐酸充分反应,过滤得到9.6g红色固体和蓝色溶液。
步骤3 向步骤2所得蓝色溶液中加入过量的Na2H2Y溶液,测得与CuCl2反应的Na2H2Y的质量为33.6g。
已知:①Na2H2Y的相对分子质量为336 ②Cu2O为红色固体
③Cu2O+2HCl=Cu+CuCl2+H2O CuCl2+Na2H2Y=CuH2Y+2NaCl
下列说法正确的是( )
A. 产物X为Cu单质 B. 步骤2所得蓝色溶液中仅含有Cu2+、Cl﹣两种离子
C. 步骤3中参加反应的CuCl2的质量为27g D. 产物X中Cu元素的质量分数为90.9%
6.(2024·无锡) 维生素C(C6H8O6)可以调节人体的新陈代谢。下列叙述正确的是( )
A. 维生素C属于有机高分子化合物
B. 维生素C由碳、氢、氧三种元素组成
C. 维生素C由20个原子构成
D. 维生素C中氢元素的质量分数最高
7. (2024·无锡)一定条件下,甲和乙反应的微观过程如图所示。下列叙述正确的是( )
A. 甲、乙、丙、丁中有3种氧化物
B. 反应前后原子种类改变
C. 参加反应的甲和乙的分子个数比为1:1
D. 反应生成的丙和丁的质量比为5:3
8. (2024·徐州)为了实现碳的资源化利用,我国科学家用纳米镍粒子作催化剂将二氧化碳合成甲烷,反应的化学方程式为。下列说法正确的是( )
A. X的化学式为H2O2 B. 甲烷中碳、氢元素的质量比为3∶1
C. 反应前后分子的数目不变 D. 参加反应的CO2和H2的质量比为22∶1
9.(2024·盐城)同学们课后走进实验室,回收处理金属Mg、Cu与氧气反应的废弃物。取和粉末的混合物5g,加入一定量的稀硫酸恰好完全反应,得到100g含硫元素质量分数为的不饱和溶液;经多步处理后,得13g晶体(不含结晶水)。则原混合物中Mg、Cu两种元素质量分数之和为( )
A. B. C. D.
10. (2024·镇江)已知:2NaHCO3Na2CO3+CO2↑+H2O,将16.8gNaHCO3固体加热一段时间后,剩余固体质量为13.7g。下列说法正确的是( )
A. 原固体加热生成3.1gCO2
B. 加热后,固体中钠元素的质量分数减小
C. 剩余固体中NaHCO3和Na2CO3的质量比为42:53
D. 将13.7g剩余固体溶于足量盐酸后,蒸发结晶,得11.7gNaCl
11.(2024·江西)向盛有一定量氢氧化钙溶液的烧杯中通入适量的二氧化碳气体,反应过程中相关量Y与反应时间的关系如图,则Y可以表示( )
A. 烧杯内水的质量 B. 烧杯内溶液的质量
C. 烧杯内物质的总质量 D. 烧杯内物质中氢元素的总质量
12.(2024·济南) 火药是我国四大发明之一。黑火药是由木炭、硫黄和硝酸钾按一定比例混合而成的,爆炸时发生的主要反应为。其中x的数值和K2S中硫元素的化合价分别是( )
A. 2,-2 B. 2,+3 C. 3,+4 D. 3,-2
13.(2024·济南) 常温下,向由、、组成的固体混合物中加入稀盐酸,恰好完全反应,得到溶液的质量为,再向溶液中滴加溶液至恰好完全反应,过滤,将滤液蒸发结晶,得到固体。下列有关说法中,正确的是( )
A. 生成的质量为 B. 原固体混合物中镁元素的质量为
C. 原固体混合物中的质量为 D. 原固体混合物中氧元素的质量为
14. (2024·青岛)我国西北地区很多盐湖除含有较多NaCl外,还含有或。三种物质的溶解度曲线如图所示。下列说法正确的是( )
A. NaCl的溶解度大于的溶解度
B. 含的盐湖适合“夏天晒碱,冬天捞盐”
C. 20℃时,取NaCl、各5g,分别加入50g水充分溶解,所得溶液质量相同
D. 除去中的少量NaCl,可先配制32.4℃的饱和溶液,再降温结晶、过滤
15.(2024·日照)草莓中含有的乙酸苯甲酯(C9H10O2),常用于化妆品和食品工业。下列说法错误的是( )
A.乙酸苯甲酯由碳、氢、氧三种元素组成
B.乙酸苯甲酯中氢元素的质量分数最小
C.乙酸苯甲酯含有1个O2分子
D.乙酸苯甲酯分子中碳、氢、氧原子个数比9:10:2
16.(2024·日照)某同学加热一定量的氯酸钾和二氧化锰固体混合物制取氧气()。反应一段时间后停止加热,经实验测得反应后混合物中钾元素的质量分数为39%,则反应后混合物中氯元素的质量分数为( )
A.20% B.35.5% C.39% D.48%
二、非选择题
17. (2024·苏州)氨气是制备各类含氮化合物的基础原料,在生产和使用过程中会产生氨氮废水,需处理达标后才能排放。
I.氨的合成
(1)工业上利用N2+3H22NH3合成氨气。
①可通过分离液态空气获得原料N2,该过程属于______(填“物理变化”或“化学变化”)。
②催化剂可用Fe3O4。高温下,部分Fe3O4被H2还原为FeO,转化过程中固体所含铁元素的质量分数_______(填“升高”或“降低”)。
Ⅱ.氨的应用
(2)液氨可用作制冷剂。氨气转化为液氨过程中,发生改变的是_______(从微观角度解释)。
(3)利用NH3去除汽车尾气中的NO,生成水和一种气体单质。该过程中化合价发生变化的元素是_______(填元素符号)。
Ⅲ.氨氮测定
(4)测定氨氮含量:取200mL氨氮废水,将氮元素完全转化为NH3,完全吸收所得NH3需要消耗9.8g10%的稀硫酸[反应原理2NH3+H2SO4=(NH4)2SO4]。计算该废水中的氮元素含量。(含量以g L-1表示,写出计算过程。H2SO4的相对分子质量为98)_______。
Ⅳ.氨氮废水处理
某工厂的氨氮废水处理流程如图:
已知:水体中的氮元素通常以氨氮(NH或NH3)、硝氮(NO或NO)形式存在。
(5)“吹脱”时,加入物质X,将NH转化为NH3,并通入热空气将NH3吹出。物质X可选用_______(填字母)。
A. 稀盐酸 B. NaOH溶液 C. NaCl溶液 D. 生石灰
(6)“氧化”时,次氯酸钠投入质量m(NaClO)对废水中的氨氮去除率(×100%)和总氮残留率(×100%)的影响如图所示。
①NaClO将NH3反应转化为N2的化学方程式为_______。
②当m(NaClO)>m1时,废水中总氮残留率上升的原因是______。
18.(2024·宁夏)我国化学家张青莲在测定铒、铟等元素的相对原子质量方面作出了卓越贡献。铒元素在元素周期表中的有关信息如图1所示,铟元素的原子结构示意图如图2所示。
(1)铒的相对原子质量为 。
(2)图2中x= 。
(3)铒、铟属于不同种元素,因为 。
19.(2024·德州)在农业生产上,常用质量分数为16%的氯化钠溶液选种。同学们在实验室欲配制200g上述溶液模拟选种。
【配制溶液】
(1)计算:配制200g质量分数为16%的氯化钠溶液所需氯化钠的质量为 g。
(2)称量:用托盘天平称量所需的氯化钠,放入烧杯中。
(3)量取:用量筒量取 mL的水(水的密度可近似看做1g/cm3),倒入盛有氯化钠的烧杯中。
(4)溶解:用玻璃棒搅拌,使氯化钠溶解。
【问题交流】
配制过程如图所示。下列操作不正确的是 (填序号)。
【模拟选种】
经查阅资料可知:
(1)选种的原理是将种子放入16%的氯化钠溶液中搅拌,空瘪的种子由于密度小会漂浮在溶液表面,而籽粒饱满的种子密度大则沉入溶液底部。
(2)相同条件下,氯化钠溶液的溶质质量分数越大,其密度越大。有的同学尝试用质量分数为26%的氯化钠溶液模拟选种,发现与使用16%的氯化钠溶液相比,漂浮在溶液表面的种子数量变多,原因是 。
20 .(2024·济南)下图所示为常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),兴趣小组的同学利用其进行下列化学实验。
请根据题目要求,回答下列问题:
(1)氧气的制取与物质组成的探究
①在实验室中以过氧化氢溶液(二氧化锰作催化剂)为原料,制备并收集一瓶干燥的氧气,所选仪器的连接顺序为______(从左到右填写仪器序号字母)。
②利用上述装置对某有机物的组成进行探究,所选仪器按“”的顺序连接(、为浓硫酸洗气瓶),实验前检查装置气密性。使该有机物在氧气中充分燃烧,观察现象,收集有关实验数据(设发生的化学反应都充分反应)。反应后测得装置质量增加,装置质量增加,装置质量增加。
通过分析计算可得,此有机物中氢元素的质量为______(精确至),该有机物中______(填最简整数比)。
(2)简易供氧器的设计与评价
兴趣小组的同学根据实验室制取氧气原理设计了简易供氧器。
装置:如图所示。
试剂:共5份(每份包含溶质质量分数为的过氧化氢溶液、颗粒状二氧化锰、纯净水)。
①请完成该供氧器的说明书:
a.制氧原理:__________________(用化学方程式表示)。
b.使用方法:先将纯净水加入______(填“甲”或“乙”)瓶并拧紧接有吸气面罩的瓶盖,再将二氧化锰和过氧化氢溶液加入______(填“甲”或“乙”)瓶并拧紧瓶盖,乙瓶中的气泡连续均匀冒出时,开始吸氧。
c.每份试剂最大供氧质量:。
d.使用完毕,倒出残液,清洗装置。
②请对此简易供氧器提出具体改进建议:____________。
21.(2024·济南) 海水中含有大量的氯化钠,可用于制取纯碱等工业原料。
(1)结合材料,回答问题:
材料一:我国化学家侯德榜在氨碱法的基础上创立了侯氏制碱法。主要流程如下:
上述过程的化学反应原理为;。
材料二:在水中的溶解度不大,常温常压下,每升水能溶解。极易溶于水,常温常压下,每升水能溶解。
①纯碱的主要成分是,从物质分类的角度看,属于______(填“酸”“碱”“盐”之一)。
②侯氏制碱法在制得纯碱的同时还得到的一种氮肥是______(填化学式)。
③综合分析上述制碱流程中,要先向饱和食盐水中通制成饱和氨盐水之后,再通的原因是___________。
(2)如图为、和的溶解度曲线。下列说法中,正确的是______(填选项序号)。
A. 时,的溶解度小于的溶解度
B. 当中混有少量时,可采用降温结晶的方法提纯
C. 时,饱和溶液中溶质与溶液的质量比为
D. 时,各取相同质量的和固体,分别加水至恰好完全溶解,然后降温至,此时所得溶液的质量小于溶液的质量
(3)工业上制得的纯碱中常混有少量氯化钠。为测定某纯碱样品(杂质为氯化钠)中的质量分数,某兴趣小组称取该样品,放入烧杯中,加入水配成溶液,然后向其中逐滴加入溶质质量分数为的溶液至恰好完全反应,过滤并干燥,称得沉淀的质量为,实验过程如下图所示。请回答:
①过程Ⅲ过滤后,所得滤液的质量是______。
②计算该样品中质量分数。(写出计算过程,结果精确至)______
22.(2024·日照)已知硝酸钾、硫酸铜、氯化钠三种固体物质的溶解度曲线如图所示。回答下列问题:
(1)下列说法错误的是 (填标号)。
A.三种物质中氯化钠的溶解度受温度影响最小
B.a1℃时,硝酸钾和硫酸铜的溶解度相同
C.20℃时,饱和硝酸钾溶液中溶质的质量分数为31.6%
D.30℃时,三种物质的溶解度由大到小的顺序:硝酸钾>氯化钠>硫酸铜
(2)a2℃时,将硝酸钾、氯化钠固体各60g,分别加入100g水中,得到硝酸钾溶液的质量 (填“>”“<”或“=”)氯化钠溶液的质量。
(3)30℃时,不改变溶剂的质量,将125g硫酸铜饱和溶液升温到a2℃,需加入 g无水硫酸铜才能重新达到饱和。
(4)除了水是常见的溶剂外,无水乙醇也可以作溶剂。如表是一些物质25℃时在无水乙醇中的溶解度(100g溶剂)。
物质 Ca(NO3)2 BaBr2 Ba(NO3)2 CaBr2
溶解度/g 33.9 3.96 0.002 34.8
如图所示,向盛有Ca(NO3)2的无水乙醇溶液的试管里滴加BaBr2的无水乙醇溶液,观察到溶液中产生沉淀。写出上述复分解反应的化学方程式: 。
答案解析
1.【答案】C【解析】A、选项说法没有指明温度,NH4Cl的溶解度不一定小于NaCl的溶解度,故选项说法错误;B、将20℃的NaCl饱和溶液升高5℃,氯化钠的溶解度增大,但溶液的组成没有发生改变,溶质的质量分数不变,故选项说法错误;
2.【答案】D【解析】A、氢氧化铜是蓝色沉淀,不溶于水,故A说法错误;
B、氢氧化铜与稀硫酸反应生成硫酸铜和水,氢氧化铜能与稀硫酸发生反应,故B说法错误;
C、碳酸铜是由碳酸根离子和铜离子构成的,属于盐,故C说法错误;
D、Cu2(OH)2CO3中含有铜离子、氢氧根离子、碳酸根离子数目比为2:2:1。所以改写后氢氧根离子和碳酸根离子的数目比也应该为2:1,所以,则,故D说法正确;
故本题选D。
3【答案】D【解析】A、由图可知,碳酸钠的溶解度随温度的升高先增大后减小,不符合题意;
B、由于未指明温度,碳酸钠的溶解度不一定比氯化钠的大,如T℃时,碳酸钠和氯化钠的溶解度相等,不符合题意;
C、由图可知,T℃时,氯化钠的溶解度小于40g,即该温度下,100g水中最多可溶解氯化钠的质量小于40g,则该温度下,30g氯化钠不能完全溶解于50g水中,不符合题意;
D、由图可知,T℃时,氯化钠和碳酸钠的溶解度相等,则该温度下,碳酸钠和氯化钠饱和溶液的溶质质量分数相等,符合题意。
故选D。
4.【答案】C【解析】【详解】A、反应①水通电分解生成氢气和氧气,化学方程式为:,由化学方程式可知,电解水生成的H2和O2的分子个数比为2:1,故A说法正确;
B、反应②中,二氧化碳和氢气反应生成甲醇和水,根据碳元素质量守恒,则生产1.6kgCH3OH理论上要消耗CO2的质量为,故B说法正确;
C、反应①水通电分解生成氢气和氧气,化学方程式为: ,反应②为二氧化碳和氢气反应生成甲醇和水,化学方程式为:,综合方程式为:,故转化过程中,H2O和H2虽然可循环转化,但是也需额外补充,故C说法错误;
D、甲醇和氧气点燃生成二氧化碳和水,化学方程式为:,二氧化碳和氢气反应生成甲醇和水,化学方程式为: ,由化学方程式可知,甲醇和二氧化碳的分子个数比均为1:1,故等质量的甲醇制取时消耗的CO2与燃烧时生成的CO2相等,可实现“零碳”排放,故D说法正确;
5【答案】D【解析】【详解】A、由D中的分析可知,产物X为Cu单质和Cu2O,而不是产物X为Cu单质,故A错误;
B、由于步骤2中向产物X中加入过量的盐酸,所以溶液中的溶质含有HCl,则骤2所得蓝色溶液中含有H+、Cu2+、Cl﹣三种离子,故B错误;
C、设步骤3中参加反应的CuCl2的质量为x;
即步骤3中参加反应的CuCl2的质量为13.5g,而不是27g,故C错误;
D、设生成13.5gCuCl2时,参加反应的Cu2O质量为,同时生成铜的质量为z;
即产物X中Cu的质量为9.6g﹣6.4g=3.2g,Cu2O质量为14.4g,14.4gCu2O中铜元素的质量为,故产物X中Cu元素的质量分数为,故D正确。
故选D。
6【答案】B【解析】A.由化学式可知,维生素C含碳元素,属于有机物,维生素C的相对分子质量为:,相对分子质量很小,不属于高分子化合物,故选项叙述错误,不符合题意;
B.维生素C由碳、氢、氧三种元素组成,故选项叙述正确,符合题意;
C.维生素C是由维生素C分子构成,1个维生素C分子是由6个碳原子、8个氢原子和6个氧原子构成的,1个维生素C分子中有20个原子,故选项叙述错误,不符合题意;
D.维生素C中碳、氢、氧三种元素的质量比为,则其中氢元素的质量分数最小,故选项叙述错误,不符合题意;
故选B。
7.【答案】C【解析】
【分析】
发生反应为:
【详解】A、甲、乙、丙、丁都是纯净物,其中乙、丁含有两种元素,且其中一种元素是氧元素,属于氧化物;甲含两种元素,但不含氧元素、丁含有三种元素,甲、丁不属于氧化物,说法不正确;
B、反应前后原子种类不改变,说法不正确;
C、参加反应的甲和乙的分子个数比为1:1,说法正确;
D、反应生成的丙和丁的质量比为,说法不正确。
故选:C。
8.【答案】B【解析】A、反应前碳、氢、氧原子个数分别为1、8、2,反应后生成物中碳、氢、氧原子个数分别为1、4、0,根据化学反应前后原子种类、数目不变,则2X分子中含有4个氢原子和2个氧原子,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为H2O,,故A错误;
B、甲烷中碳、氢元素的质量比为:12∶4=3∶1,故B正确;
C、微观上,该反应是1个二氧化碳分子和4个氢分子反应生成1个甲烷分子和2个水分子,反应前后分子的数目减少,故C错误;
D、参加反应的CO2和H2的质量比为:44∶(4×2)=11∶2,故D错误。
故选B。
9.【答案】C【解析】金属Mg、Cu与氧气反应的废弃物中含有氧化镁和氧化铜,稀硫酸与氧化镁反应生成硫酸镁和水,与氧化铜反应生成硫酸铜和水;完全反应后的溶液中硫元素的质量为:100×3.2%=3.2g;13g 晶体为硫酸镁和硫酸铜的混合物,根据质量守恒定律,其中硫酸根的质量为 ;则镁元素和铜元素的质量之和为 13g-9.6g=3.4g;原混合物的质量为 5g,所以原混合物中 Mg、Cu 两种元素质量分数之和为 。
故选C。
10.【答案】D【解析】A、解:设原固体加热生成二氧化碳的质量为x
x=2.2g,不符合题意;
B、碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,根据质量守恒定律,化学反应前后,元素的种类和质量不变,故固体中钠元素的质量不变,由于生成了气体,加热后,固体的质量减小,故加热后,固体中钠元素的质量分数增大,不符合题意;
C、解:设参加反应的碳酸氢钠的质量为y,反应生成碳酸钠的质量为z
y=8.4g
z=5.3g,则剩余固体中碳酸氢钠和碳酸钠的质量比为:(16.8g-8.4g):5.3g=84:53,不符合题意;
D、碳酸氢钠受热分解:,碳酸氢钠和稀盐酸反应:,碳酸钠和稀盐酸反应:,根据质量守恒定律,化学反应前后,元素的种类和质量不变,由化学方程式可知,最后得到氯化钠中钠元素的质量与16.8g碳酸氢钠中钠元素的质量相同,则生成氯化钠的质量为:,符合题意。
故选D。
11.【答案】D【解析】A、二氧化碳与氢氧化钙反应生成碳酸钙和水,随着反应的进行,溶液的水质量增加,完全反应后不变,错误;
B、二氧化碳与氢氧化钙反应生成碳酸钙和水,根据化学方程式CO2 + Ca(OH)2 = CaCO3↓+ H2O可知,每44份质量的二氧化碳能生成100份质量的碳酸钙沉淀,随着反应的进行,烧杯内溶质质量不断减少,溶液的质量不断减少,错误;
C、二氧化碳与氢氧化钙反应生成碳酸钙和水,随着反应的进行,二氧化碳不断进入,烧杯内物质的总质量不断增加,最后不变,错误;
D、二氧化碳与氢氧化钙反应生成碳酸钙和水,随着反应的进行,烧杯内物质中氢元素的总质量不变,正确。
故选D。
12【答案】D【解析】根据质量守恒定律可知,化学反应前后原子的种类和个数不变,由化学方程式可知,反应后碳原子的个数为3,则反应前的碳原子个数也应为3,故x=3;在K2S中钾元素的化合价为+1价,根据化合物中正负化合价代数和为零可知,硫元素的化合价为-2价。
故选D。
13.【答案】AB【解析】根据题意,由氧化镁、氢氧化镁、碳酸镁和稀盐酸反应的化学方程式:
可知生成二氧化碳的质量是200g+24g-219.6g=4.4g;溶液中溶质是氯化镁,再加入氢氧化钠,氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠,据此分析
【详解】A、根据分析,生成二氧化碳的质量是4.4g,选项正确;
B、根据分析可知原混合物中镁元素与最终生成氯化钠的质量关系是,选项正确;
C、根据分析,求出碳酸镁的质量,碳酸镁中镁元素的质量为,则氧化镁和氢氧化镁质量和是24g-8.4g=15.6g,设氧化镁质量为m,氢氧化镁质量为15.6-n,则
则氢氧化镁的质量是24g-8.4g-3.5g=12.1g,选项错误;
原固体混合物中氧元素的质量,选项错误;
14【答案】CD【解析】A、溶解度大小受温度影响,溶解度大小比较,应指明温度,否则无法比较,说法错误;
B、由溶解度曲线可知:碳酸钠和氯化钠的溶解度均随温度的升高而增加,碳酸钠的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,故“夏天晒盐”通过蒸发结晶获得氯化钠,“冬天捞碱”通过降温结晶得到碳酸钠,说法错误;
C、由溶解度曲线可知:20℃时,100g水中溶解碳酸钠、硫酸钠质量都大于10g,该温度下,取NaCl、各5g,分别加入50g水充分溶解,固体全部溶解,溶质质量都是5g,溶剂质量都是50g,所得溶液质量相等,说法正确;
D、由溶解度曲线可知:时,硫酸钠和氯化钠溶解度随温度降低而减小,且硫酸钠溶解度减小幅度较大,除去中的少量NaCl,可先配制32.4℃的饱和溶液,再降温结晶、过滤,得到硫酸钠,说法正确;
故选:CD。
15.【分析】A、根据乙酸苯甲酯化学式的含义,进行分析判断。
B、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断。
C、根据乙酸苯甲酯的微观构成,进行分析判断。
D、根据1个乙酸苯甲酯分子的构成,进行分析判断。
【解答】解:A、乙酸苯甲酯是由碳、氢、氧三种元素组成的,故选项说法正确。
B、乙酸苯甲酯中碳、氢、氧三种元素的质量比为(12×9):(1×10):(16×2)=54:5:16,则乙酸苯甲酯中氢元素的质量分数最小,故选项说法正确。
C、乙酸苯甲酯是由乙酸苯甲酯分子构成的,不含氧分子,故选项说法错误。
D、1个乙酸苯甲酯分子是由9个碳原子、10个氢原子、2个氧原子构成的,则乙酸苯甲酯分子中碳、氢、氧原子个数比9:10:2,故选项说法正确。
故选:C。
16.【分析】根据氯酸钾在二氧化锰的催化作用下、在加热条件下生成氯化钾和氧气,氯酸钾、氯化钾中钾元素和氯元素的质量比均为39:35.5,进行分析判断。
【解答】解:氯酸钾在二氧化锰的催化作用下、在加热条件下生成氯化钾和氧气,氯酸钾、氯化钾中钾元素和氯元素的质量比均为39:35.5,经实验测得反应后混合物中钾元素的质量分数为39%,则反应后混合物中氯元素的质量分数为35.5%。
故选:B。
17【答案】(1) ①. 物理变化 ②. 升高
(2)氨气分子间的间隙
(3)N (4)
设吸收氨气的质量为x
=
x=0.34g
氮元素的质量为:0.34g××100%=0.28g
废水中的氮元素含量==1.4g L-1
答:废水中的氮元素含量为1.4g L-1 (5)BD
(6) ①. 3NaClO+2NH3=N2+3NaCl+3H2O ②. 部分氨气被转化为NO或NO,留在废水中
【解析】
【小问1详解】
①可通过分离液态空气获得原料N2,该过程中没有新物质生成,属于物理变化;
②Fe3O4中铁元素的质量分数为,FeO中铁元素的质量分数为,所以该转化过程中固体所含铁元素的质量分数升高;
【小问2详解】
氨气转化为液氨过程中,氨气分子间的间隙变小;
【小问3详解】
利用NH3去除汽车尾气中的NO,生成水和一种气体单质,由质量守恒定律可知,化学反应前后元素的种类不变,则该气体为氮气,反应前NH3中氮元素的化合价为-3价,氢元素的化合价为+1价,NO中氮元素的化合价为+2价,氧元素的化合价为-2价,反应后水中氢元素的化合价为+1价,氧元素的化合价为-2价,氮气中氮元素的化合价为0价,则该过程中化合价发生变化的元素是N;
小问4详解】
解析见答案;
【小问5详解】
铵根和氢氧根结合可以生成氨气;
A、稀盐酸中不含氢氧根,故选项不符合题意;
B、NaOH溶液中含氢氧根,故选项符合题意;
C、NaCl溶液中不含氢氧根,故选项不符合题意;
D、生石灰与水反应生成氢氧化钙,氢氧化钙溶液中含氢氧根,故选项符合题意;
故选:BD;
【小问6详解】
①NaClO与NH3反应生成氮气、氯化钠和水,反应的化学方程式为:3NaClO+2NH3=N2+3NaCl+3H2O;
②从图可以看出,当m(NaClO)>m1时,废水中总氮残留率上升,但氨氮去除率为100%,则说明氮元素不以氨气或铵根离子的形式残留。结合“已知:水体中的氮元素通常以氨氮、硝氮形式存在。”可知,此时废水中的氮元素以硝氮形式存在。所以废水中总氮残留率上升,是因为部分氨气被转化为或,留在废水中。
18..【分析】(1)根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,进行分析解答。
(2)根据原子中质子数=核外电子数,进行分析解答。
(3)根据元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),进行分析解答。
【解答】解:(1)根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为167.3。
(2)原子中质子数=核外电子数,49=2+8+x+18+3,x=18。
(3)元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),铒、铟属于不同种元素,因为原子的质子数不同(或原子的核电荷数不同)。
故答案为:
(1)167.3;
(2)18;
(3)原子的质子数不同(或原子的核电荷数不同)。
【点评】本题难度不大,灵活运用元素周期表中元素的信息、原子结构示意图的含义是正确解答本题的关键。
19.【解答】解:(1)计算:配制200g质量分数为16%的氯化钠溶液所需氯化钠的质量为200g×16%=32g;
(3)量取:水的质量=200g﹣32g=168g,合168mL,用量筒量取168mL的水(水的密度可近似看做1g/cm3),倒入盛有氯化钠的烧杯中;
【问题交流】配制过程如图所示,天平称量物体质量应该左物右码,瓶塞应该倒放,所以操作不正确的是AB;
【模拟选种】(2)有的同学尝试用质量分数为26%的氯化钠溶液模拟选种,发现与使用16%的氯化钠溶液相比,漂浮在溶液表面的种子数量变多,原因是:相同条件下,氯化钠溶液的溶质质量分数越大,其密度越大。
故答案为:(1)32;
(3)168;
【问题交流】AB;
【模拟选种】相同条件下,氯化钠溶液的溶质质量分数越大,其密度越大。
【点评】本题难度不大,掌握配制溶质质量分数一定的溶液的基本步骤、注意事项等是正确解答本题的关键。
20.【答案】(1) ①. B-C-E ②. 0.1 ③. 5:4:2
(2) ①. ②. 乙 ③. 甲 ④. 使用轻质材料 :选择轻便且耐用的材料制作供氧器的外壳和部件,减少整体重量
【解析】
【小问1详解】
①装置B中:在锥形瓶中加入二氧化锰固体,然后加入过氧化氢溶液。二氧化锰作为催化剂,可以加快过氧化氢的分解速度 ,装置C中:使用浓硫酸干燥装置来除去氧气中的水分,装置C:用向上排空气法收集氧气。装置连接顺序为 : B(发生装置)→ C(干燥装置)→ E(收集装置) ;
②装置 C 2 质量增加 0.9 g为有机物产生水的质量,根据氢元素守恒得:有机物中的氢元素的质量等于其产生水中的氢元素的质量,即,根据碳元素守恒得:装置D中有机物碳元素的质量等于产生二氧化碳中碳元素的质量,即,有机物中氧元素的质量为:2.4g-0.1g-1.5g=0.8g,
有机物中x:y:z=
【小问2详解】
过氧化氢在二氧化锰作为催化剂生成水和氧气,化学方程式为,先将纯净水加入乙瓶中,为产生的氧气增加湿度,然后在甲瓶中加入氧化锰和过氧化氢溶液产生氧气,氧气通过甲瓶上端排向乙瓶。简易供氧器提出具体改进建议可以从 使用轻质材料 、增强安全措施 等方面提出建议。
21.【答案】(1) ①. 盐 ②. NH4Cl ③. 更易吸收二氧化碳 (2)BD
(3) ①. 216 ②. 设碳酸钠的质量为x
答:该样品中碳酸钠的质量分数84..8%
【答案】CD
【解析】
【详解】A、溶解度大小受温度影响,溶解度大小比较,应指明温度,否则无法比较,说法错误;
B、由溶解度曲线可知:碳酸钠和氯化钠的溶解度均随温度的升高而增加,碳酸钠的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,故“夏天晒盐”通过蒸发结晶获得氯化钠,“冬天捞碱”通过降温结晶得到碳酸钠,说法错误;
C、由溶解度曲线可知:20℃时,100g水中溶解碳酸钠、硫酸钠质量都大于10g,该温度下,取NaCl、各5g,分别加入50g水充分溶解,固体全部溶解,溶质质量都是5g,溶剂质量都是50g,所得溶液质量相等,说法正确;
D、由溶解度曲线可知:时,硫酸钠和氯化钠溶解度随温度降低而减小,且硫酸钠溶解度减小幅度较大,除去中的少量NaCl,可先配制32.4℃的饱和溶液,再降温结晶、过滤,得到硫酸钠,说法正确;
故选:CD。
【分析】根据氯酸钾在二氧化锰的催化作用下、在加热条件下生成氯化钾和氧气,氯酸钾、氯化钾中钾元素和氯元素的质量比均为39:35.5,进行分析判断。
【解答】解:氯酸钾在二氧化锰的催化作用下、在加热条件下生成氯化钾和氧气,氯酸钾、氯化钾中钾元素和氯元素的质量比均为39:35.5,经实验测得反应后混合物中钾元素的质量分数为39%,则反应后混合物中氯元素的质量分数为35.5%。
故选:B。
22.【解答】解:(1)A.三种物质中氯化钠的溶解度受温度影响最小,该选项正确。
B.a1℃时,硝酸钾和硫酸铜的溶解度相同,该选项正确。
C.20℃时硝酸钾的溶解度是31.6g,饱和硝酸钾溶液中溶质的质量分数为×100%≈24.0%,该选项不正确。
D.30℃时,三种物质的溶解度由大到小的顺序:硝酸钾>氯化钠>硫酸铜,该选项正确。
故答案为:C。
(2)a2℃时硝酸钾溶解度是60g,氯化钠溶解度小于60g,将硝酸钾、氯化钠固体各60g,分别加入100g水中,硝酸钾完全溶解,得到160g硝酸钾溶液,氯化钠不能完全溶解,得到氯化钠质量小于160g,得到硝酸钾溶液的质量>氯化钠溶液的质量。
故答案为:>。
(3)30℃时硫酸铜溶解度是25g,不改变溶剂的质量,将125g硫酸铜饱和溶液(100g水和25g硫酸铜)升温到a2℃,硫酸铜溶解度变成60g,需加入60g﹣25g=35g无水硫酸铜才能重新达到饱和。
故答案为:35。
(4)向盛有Ca(NO3)2的无水乙醇溶液的试管里滴加BaBr2的无水乙醇溶液,观察到溶液中产生沉淀,是因为反应生成溴化钙和硝酸钡沉淀,反应的化学方程式是Ca(NO3)2+BaBr2=CaBr2+Ba(NO3)2↓。
故答案为:Ca(NO3)2+BaBr2=CaBr2+Ba(NO3)2↓。
一、选择题
1.(2024·南通) “侯氏制碱法”大幅提高了NaCl的利用率。NaHCO3、NaCl、NH4Cl的溶解度曲线如图所示。下列说法正确的是( )
A. NH4Cl的溶解度一定小于NaCl的溶解度
B. 将20℃的NaCl饱和溶液升高5℃,溶质的质量分数增大
C. 40℃时,NaCl溶液中溶质的质量分数可能小于NaHCO3溶液中溶质的质量分数
D. 40℃时,将15gNaCl溶于50g水中,可获得NaCl饱和溶液
2.(2024·苏州)宋代《千里江山图》历经千年青绿依旧。其中绿色颜料来自孔雀石[主要成分为Cu2(OH)2CO3,也可表示为xCu(OH)2 yCuCO3]。下列说法正确的是( )
A. Cu(OH)2易溶于水 B. Cu(OH)2不能与稀硫酸发生反应
C. CuCO3属于碱 D.
3.(2024·苏州) Na2CO3和NaCl的溶解度曲线如图所示。下列说法正确的是( )
A. Na2CO3的溶解度随温度升高而增大
B. Na2CO3的溶解度一定比NaCl的大
C. T℃时,30gNaCl能完全溶解于50g水中
D. T℃时,Na2CO3和NaCl两种饱和溶液的溶质质量分数相等
4. (2024·苏州)捕集空气中CO2加氢制甲醇(CH3OH),可实现CO2资源化利用和“零碳”排放,其转化流程如图所示。下列说法不正确的是( )
A. 反应①中,电解水生成的H2和O2的分子个数比为2:1
B. 反应②中,生产1.6kgCH3OH理论上要消耗2.2kgCO2
C. 转化过程中,H2O和H2循环转化,无需额外补充
D. 等质量的甲醇制取时消耗的CO2与燃烧时生成的CO2相等,实现“零碳”排放
5.(2024南通) 学习小组为探究氢气还原氧化铜所得固体产物X组成,设计如下实验:
步骤1 观察产物X的颜色为红色。
步骤2 向产物X中加入过量的盐酸充分反应,过滤得到9.6g红色固体和蓝色溶液。
步骤3 向步骤2所得蓝色溶液中加入过量的Na2H2Y溶液,测得与CuCl2反应的Na2H2Y的质量为33.6g。
已知:①Na2H2Y的相对分子质量为336 ②Cu2O为红色固体
③Cu2O+2HCl=Cu+CuCl2+H2O CuCl2+Na2H2Y=CuH2Y+2NaCl
下列说法正确的是( )
A. 产物X为Cu单质 B. 步骤2所得蓝色溶液中仅含有Cu2+、Cl﹣两种离子
C. 步骤3中参加反应的CuCl2的质量为27g D. 产物X中Cu元素的质量分数为90.9%
6.(2024·无锡) 维生素C(C6H8O6)可以调节人体的新陈代谢。下列叙述正确的是( )
A. 维生素C属于有机高分子化合物
B. 维生素C由碳、氢、氧三种元素组成
C. 维生素C由20个原子构成
D. 维生素C中氢元素的质量分数最高
7. (2024·无锡)一定条件下,甲和乙反应的微观过程如图所示。下列叙述正确的是( )
A. 甲、乙、丙、丁中有3种氧化物
B. 反应前后原子种类改变
C. 参加反应的甲和乙的分子个数比为1:1
D. 反应生成的丙和丁的质量比为5:3
8. (2024·徐州)为了实现碳的资源化利用,我国科学家用纳米镍粒子作催化剂将二氧化碳合成甲烷,反应的化学方程式为。下列说法正确的是( )
A. X的化学式为H2O2 B. 甲烷中碳、氢元素的质量比为3∶1
C. 反应前后分子的数目不变 D. 参加反应的CO2和H2的质量比为22∶1
9.(2024·盐城)同学们课后走进实验室,回收处理金属Mg、Cu与氧气反应的废弃物。取和粉末的混合物5g,加入一定量的稀硫酸恰好完全反应,得到100g含硫元素质量分数为的不饱和溶液;经多步处理后,得13g晶体(不含结晶水)。则原混合物中Mg、Cu两种元素质量分数之和为( )
A. B. C. D.
10. (2024·镇江)已知:2NaHCO3Na2CO3+CO2↑+H2O,将16.8gNaHCO3固体加热一段时间后,剩余固体质量为13.7g。下列说法正确的是( )
A. 原固体加热生成3.1gCO2
B. 加热后,固体中钠元素的质量分数减小
C. 剩余固体中NaHCO3和Na2CO3的质量比为42:53
D. 将13.7g剩余固体溶于足量盐酸后,蒸发结晶,得11.7gNaCl
11.(2024·江西)向盛有一定量氢氧化钙溶液的烧杯中通入适量的二氧化碳气体,反应过程中相关量Y与反应时间的关系如图,则Y可以表示( )
A. 烧杯内水的质量 B. 烧杯内溶液的质量
C. 烧杯内物质的总质量 D. 烧杯内物质中氢元素的总质量
12.(2024·济南) 火药是我国四大发明之一。黑火药是由木炭、硫黄和硝酸钾按一定比例混合而成的,爆炸时发生的主要反应为。其中x的数值和K2S中硫元素的化合价分别是( )
A. 2,-2 B. 2,+3 C. 3,+4 D. 3,-2
13.(2024·济南) 常温下,向由、、组成的固体混合物中加入稀盐酸,恰好完全反应,得到溶液的质量为,再向溶液中滴加溶液至恰好完全反应,过滤,将滤液蒸发结晶,得到固体。下列有关说法中,正确的是( )
A. 生成的质量为 B. 原固体混合物中镁元素的质量为
C. 原固体混合物中的质量为 D. 原固体混合物中氧元素的质量为
14. (2024·青岛)我国西北地区很多盐湖除含有较多NaCl外,还含有或。三种物质的溶解度曲线如图所示。下列说法正确的是( )
A. NaCl的溶解度大于的溶解度
B. 含的盐湖适合“夏天晒碱,冬天捞盐”
C. 20℃时,取NaCl、各5g,分别加入50g水充分溶解,所得溶液质量相同
D. 除去中的少量NaCl,可先配制32.4℃的饱和溶液,再降温结晶、过滤
15.(2024·日照)草莓中含有的乙酸苯甲酯(C9H10O2),常用于化妆品和食品工业。下列说法错误的是( )
A.乙酸苯甲酯由碳、氢、氧三种元素组成
B.乙酸苯甲酯中氢元素的质量分数最小
C.乙酸苯甲酯含有1个O2分子
D.乙酸苯甲酯分子中碳、氢、氧原子个数比9:10:2
16.(2024·日照)某同学加热一定量的氯酸钾和二氧化锰固体混合物制取氧气()。反应一段时间后停止加热,经实验测得反应后混合物中钾元素的质量分数为39%,则反应后混合物中氯元素的质量分数为( )
A.20% B.35.5% C.39% D.48%
二、非选择题
17. (2024·苏州)氨气是制备各类含氮化合物的基础原料,在生产和使用过程中会产生氨氮废水,需处理达标后才能排放。
I.氨的合成
(1)工业上利用N2+3H22NH3合成氨气。
①可通过分离液态空气获得原料N2,该过程属于______(填“物理变化”或“化学变化”)。
②催化剂可用Fe3O4。高温下,部分Fe3O4被H2还原为FeO,转化过程中固体所含铁元素的质量分数_______(填“升高”或“降低”)。
Ⅱ.氨的应用
(2)液氨可用作制冷剂。氨气转化为液氨过程中,发生改变的是_______(从微观角度解释)。
(3)利用NH3去除汽车尾气中的NO,生成水和一种气体单质。该过程中化合价发生变化的元素是_______(填元素符号)。
Ⅲ.氨氮测定
(4)测定氨氮含量:取200mL氨氮废水,将氮元素完全转化为NH3,完全吸收所得NH3需要消耗9.8g10%的稀硫酸[反应原理2NH3+H2SO4=(NH4)2SO4]。计算该废水中的氮元素含量。(含量以g L-1表示,写出计算过程。H2SO4的相对分子质量为98)_______。
Ⅳ.氨氮废水处理
某工厂的氨氮废水处理流程如图:
已知:水体中的氮元素通常以氨氮(NH或NH3)、硝氮(NO或NO)形式存在。
(5)“吹脱”时,加入物质X,将NH转化为NH3,并通入热空气将NH3吹出。物质X可选用_______(填字母)。
A. 稀盐酸 B. NaOH溶液 C. NaCl溶液 D. 生石灰
(6)“氧化”时,次氯酸钠投入质量m(NaClO)对废水中的氨氮去除率(×100%)和总氮残留率(×100%)的影响如图所示。
①NaClO将NH3反应转化为N2的化学方程式为_______。
②当m(NaClO)>m1时,废水中总氮残留率上升的原因是______。
18.(2024·宁夏)我国化学家张青莲在测定铒、铟等元素的相对原子质量方面作出了卓越贡献。铒元素在元素周期表中的有关信息如图1所示,铟元素的原子结构示意图如图2所示。
(1)铒的相对原子质量为 。
(2)图2中x= 。
(3)铒、铟属于不同种元素,因为 。
19.(2024·德州)在农业生产上,常用质量分数为16%的氯化钠溶液选种。同学们在实验室欲配制200g上述溶液模拟选种。
【配制溶液】
(1)计算:配制200g质量分数为16%的氯化钠溶液所需氯化钠的质量为 g。
(2)称量:用托盘天平称量所需的氯化钠,放入烧杯中。
(3)量取:用量筒量取 mL的水(水的密度可近似看做1g/cm3),倒入盛有氯化钠的烧杯中。
(4)溶解:用玻璃棒搅拌,使氯化钠溶解。
【问题交流】
配制过程如图所示。下列操作不正确的是 (填序号)。
【模拟选种】
经查阅资料可知:
(1)选种的原理是将种子放入16%的氯化钠溶液中搅拌,空瘪的种子由于密度小会漂浮在溶液表面,而籽粒饱满的种子密度大则沉入溶液底部。
(2)相同条件下,氯化钠溶液的溶质质量分数越大,其密度越大。有的同学尝试用质量分数为26%的氯化钠溶液模拟选种,发现与使用16%的氯化钠溶液相比,漂浮在溶液表面的种子数量变多,原因是 。
20 .(2024·济南)下图所示为常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),兴趣小组的同学利用其进行下列化学实验。
请根据题目要求,回答下列问题:
(1)氧气的制取与物质组成的探究
①在实验室中以过氧化氢溶液(二氧化锰作催化剂)为原料,制备并收集一瓶干燥的氧气,所选仪器的连接顺序为______(从左到右填写仪器序号字母)。
②利用上述装置对某有机物的组成进行探究,所选仪器按“”的顺序连接(、为浓硫酸洗气瓶),实验前检查装置气密性。使该有机物在氧气中充分燃烧,观察现象,收集有关实验数据(设发生的化学反应都充分反应)。反应后测得装置质量增加,装置质量增加,装置质量增加。
通过分析计算可得,此有机物中氢元素的质量为______(精确至),该有机物中______(填最简整数比)。
(2)简易供氧器的设计与评价
兴趣小组的同学根据实验室制取氧气原理设计了简易供氧器。
装置:如图所示。
试剂:共5份(每份包含溶质质量分数为的过氧化氢溶液、颗粒状二氧化锰、纯净水)。
①请完成该供氧器的说明书:
a.制氧原理:__________________(用化学方程式表示)。
b.使用方法:先将纯净水加入______(填“甲”或“乙”)瓶并拧紧接有吸气面罩的瓶盖,再将二氧化锰和过氧化氢溶液加入______(填“甲”或“乙”)瓶并拧紧瓶盖,乙瓶中的气泡连续均匀冒出时,开始吸氧。
c.每份试剂最大供氧质量:。
d.使用完毕,倒出残液,清洗装置。
②请对此简易供氧器提出具体改进建议:____________。
21.(2024·济南) 海水中含有大量的氯化钠,可用于制取纯碱等工业原料。
(1)结合材料,回答问题:
材料一:我国化学家侯德榜在氨碱法的基础上创立了侯氏制碱法。主要流程如下:
上述过程的化学反应原理为;。
材料二:在水中的溶解度不大,常温常压下,每升水能溶解。极易溶于水,常温常压下,每升水能溶解。
①纯碱的主要成分是,从物质分类的角度看,属于______(填“酸”“碱”“盐”之一)。
②侯氏制碱法在制得纯碱的同时还得到的一种氮肥是______(填化学式)。
③综合分析上述制碱流程中,要先向饱和食盐水中通制成饱和氨盐水之后,再通的原因是___________。
(2)如图为、和的溶解度曲线。下列说法中,正确的是______(填选项序号)。
A. 时,的溶解度小于的溶解度
B. 当中混有少量时,可采用降温结晶的方法提纯
C. 时,饱和溶液中溶质与溶液的质量比为
D. 时,各取相同质量的和固体,分别加水至恰好完全溶解,然后降温至,此时所得溶液的质量小于溶液的质量
(3)工业上制得的纯碱中常混有少量氯化钠。为测定某纯碱样品(杂质为氯化钠)中的质量分数,某兴趣小组称取该样品,放入烧杯中,加入水配成溶液,然后向其中逐滴加入溶质质量分数为的溶液至恰好完全反应,过滤并干燥,称得沉淀的质量为,实验过程如下图所示。请回答:
①过程Ⅲ过滤后,所得滤液的质量是______。
②计算该样品中质量分数。(写出计算过程,结果精确至)______
22.(2024·日照)已知硝酸钾、硫酸铜、氯化钠三种固体物质的溶解度曲线如图所示。回答下列问题:
(1)下列说法错误的是 (填标号)。
A.三种物质中氯化钠的溶解度受温度影响最小
B.a1℃时,硝酸钾和硫酸铜的溶解度相同
C.20℃时,饱和硝酸钾溶液中溶质的质量分数为31.6%
D.30℃时,三种物质的溶解度由大到小的顺序:硝酸钾>氯化钠>硫酸铜
(2)a2℃时,将硝酸钾、氯化钠固体各60g,分别加入100g水中,得到硝酸钾溶液的质量 (填“>”“<”或“=”)氯化钠溶液的质量。
(3)30℃时,不改变溶剂的质量,将125g硫酸铜饱和溶液升温到a2℃,需加入 g无水硫酸铜才能重新达到饱和。
(4)除了水是常见的溶剂外,无水乙醇也可以作溶剂。如表是一些物质25℃时在无水乙醇中的溶解度(100g溶剂)。
物质 Ca(NO3)2 BaBr2 Ba(NO3)2 CaBr2
溶解度/g 33.9 3.96 0.002 34.8
如图所示,向盛有Ca(NO3)2的无水乙醇溶液的试管里滴加BaBr2的无水乙醇溶液,观察到溶液中产生沉淀。写出上述复分解反应的化学方程式: 。
答案解析
1.【答案】C【解析】A、选项说法没有指明温度,NH4Cl的溶解度不一定小于NaCl的溶解度,故选项说法错误;B、将20℃的NaCl饱和溶液升高5℃,氯化钠的溶解度增大,但溶液的组成没有发生改变,溶质的质量分数不变,故选项说法错误;
2.【答案】D【解析】A、氢氧化铜是蓝色沉淀,不溶于水,故A说法错误;
B、氢氧化铜与稀硫酸反应生成硫酸铜和水,氢氧化铜能与稀硫酸发生反应,故B说法错误;
C、碳酸铜是由碳酸根离子和铜离子构成的,属于盐,故C说法错误;
D、Cu2(OH)2CO3中含有铜离子、氢氧根离子、碳酸根离子数目比为2:2:1。所以改写后氢氧根离子和碳酸根离子的数目比也应该为2:1,所以,则,故D说法正确;
故本题选D。
3【答案】D【解析】A、由图可知,碳酸钠的溶解度随温度的升高先增大后减小,不符合题意;
B、由于未指明温度,碳酸钠的溶解度不一定比氯化钠的大,如T℃时,碳酸钠和氯化钠的溶解度相等,不符合题意;
C、由图可知,T℃时,氯化钠的溶解度小于40g,即该温度下,100g水中最多可溶解氯化钠的质量小于40g,则该温度下,30g氯化钠不能完全溶解于50g水中,不符合题意;
D、由图可知,T℃时,氯化钠和碳酸钠的溶解度相等,则该温度下,碳酸钠和氯化钠饱和溶液的溶质质量分数相等,符合题意。
故选D。
4.【答案】C【解析】【详解】A、反应①水通电分解生成氢气和氧气,化学方程式为:,由化学方程式可知,电解水生成的H2和O2的分子个数比为2:1,故A说法正确;
B、反应②中,二氧化碳和氢气反应生成甲醇和水,根据碳元素质量守恒,则生产1.6kgCH3OH理论上要消耗CO2的质量为,故B说法正确;
C、反应①水通电分解生成氢气和氧气,化学方程式为: ,反应②为二氧化碳和氢气反应生成甲醇和水,化学方程式为:,综合方程式为:,故转化过程中,H2O和H2虽然可循环转化,但是也需额外补充,故C说法错误;
D、甲醇和氧气点燃生成二氧化碳和水,化学方程式为:,二氧化碳和氢气反应生成甲醇和水,化学方程式为: ,由化学方程式可知,甲醇和二氧化碳的分子个数比均为1:1,故等质量的甲醇制取时消耗的CO2与燃烧时生成的CO2相等,可实现“零碳”排放,故D说法正确;
5【答案】D【解析】【详解】A、由D中的分析可知,产物X为Cu单质和Cu2O,而不是产物X为Cu单质,故A错误;
B、由于步骤2中向产物X中加入过量的盐酸,所以溶液中的溶质含有HCl,则骤2所得蓝色溶液中含有H+、Cu2+、Cl﹣三种离子,故B错误;
C、设步骤3中参加反应的CuCl2的质量为x;
即步骤3中参加反应的CuCl2的质量为13.5g,而不是27g,故C错误;
D、设生成13.5gCuCl2时,参加反应的Cu2O质量为,同时生成铜的质量为z;
即产物X中Cu的质量为9.6g﹣6.4g=3.2g,Cu2O质量为14.4g,14.4gCu2O中铜元素的质量为,故产物X中Cu元素的质量分数为,故D正确。
故选D。
6【答案】B【解析】A.由化学式可知,维生素C含碳元素,属于有机物,维生素C的相对分子质量为:,相对分子质量很小,不属于高分子化合物,故选项叙述错误,不符合题意;
B.维生素C由碳、氢、氧三种元素组成,故选项叙述正确,符合题意;
C.维生素C是由维生素C分子构成,1个维生素C分子是由6个碳原子、8个氢原子和6个氧原子构成的,1个维生素C分子中有20个原子,故选项叙述错误,不符合题意;
D.维生素C中碳、氢、氧三种元素的质量比为,则其中氢元素的质量分数最小,故选项叙述错误,不符合题意;
故选B。
7.【答案】C【解析】
【分析】
发生反应为:
【详解】A、甲、乙、丙、丁都是纯净物,其中乙、丁含有两种元素,且其中一种元素是氧元素,属于氧化物;甲含两种元素,但不含氧元素、丁含有三种元素,甲、丁不属于氧化物,说法不正确;
B、反应前后原子种类不改变,说法不正确;
C、参加反应的甲和乙的分子个数比为1:1,说法正确;
D、反应生成的丙和丁的质量比为,说法不正确。
故选:C。
8.【答案】B【解析】A、反应前碳、氢、氧原子个数分别为1、8、2,反应后生成物中碳、氢、氧原子个数分别为1、4、0,根据化学反应前后原子种类、数目不变,则2X分子中含有4个氢原子和2个氧原子,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为H2O,,故A错误;
B、甲烷中碳、氢元素的质量比为:12∶4=3∶1,故B正确;
C、微观上,该反应是1个二氧化碳分子和4个氢分子反应生成1个甲烷分子和2个水分子,反应前后分子的数目减少,故C错误;
D、参加反应的CO2和H2的质量比为:44∶(4×2)=11∶2,故D错误。
故选B。
9.【答案】C【解析】金属Mg、Cu与氧气反应的废弃物中含有氧化镁和氧化铜,稀硫酸与氧化镁反应生成硫酸镁和水,与氧化铜反应生成硫酸铜和水;完全反应后的溶液中硫元素的质量为:100×3.2%=3.2g;13g 晶体为硫酸镁和硫酸铜的混合物,根据质量守恒定律,其中硫酸根的质量为 ;则镁元素和铜元素的质量之和为 13g-9.6g=3.4g;原混合物的质量为 5g,所以原混合物中 Mg、Cu 两种元素质量分数之和为 。
故选C。
10.【答案】D【解析】A、解:设原固体加热生成二氧化碳的质量为x
x=2.2g,不符合题意;
B、碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,根据质量守恒定律,化学反应前后,元素的种类和质量不变,故固体中钠元素的质量不变,由于生成了气体,加热后,固体的质量减小,故加热后,固体中钠元素的质量分数增大,不符合题意;
C、解:设参加反应的碳酸氢钠的质量为y,反应生成碳酸钠的质量为z
y=8.4g
z=5.3g,则剩余固体中碳酸氢钠和碳酸钠的质量比为:(16.8g-8.4g):5.3g=84:53,不符合题意;
D、碳酸氢钠受热分解:,碳酸氢钠和稀盐酸反应:,碳酸钠和稀盐酸反应:,根据质量守恒定律,化学反应前后,元素的种类和质量不变,由化学方程式可知,最后得到氯化钠中钠元素的质量与16.8g碳酸氢钠中钠元素的质量相同,则生成氯化钠的质量为:,符合题意。
故选D。
11.【答案】D【解析】A、二氧化碳与氢氧化钙反应生成碳酸钙和水,随着反应的进行,溶液的水质量增加,完全反应后不变,错误;
B、二氧化碳与氢氧化钙反应生成碳酸钙和水,根据化学方程式CO2 + Ca(OH)2 = CaCO3↓+ H2O可知,每44份质量的二氧化碳能生成100份质量的碳酸钙沉淀,随着反应的进行,烧杯内溶质质量不断减少,溶液的质量不断减少,错误;
C、二氧化碳与氢氧化钙反应生成碳酸钙和水,随着反应的进行,二氧化碳不断进入,烧杯内物质的总质量不断增加,最后不变,错误;
D、二氧化碳与氢氧化钙反应生成碳酸钙和水,随着反应的进行,烧杯内物质中氢元素的总质量不变,正确。
故选D。
12【答案】D【解析】根据质量守恒定律可知,化学反应前后原子的种类和个数不变,由化学方程式可知,反应后碳原子的个数为3,则反应前的碳原子个数也应为3,故x=3;在K2S中钾元素的化合价为+1价,根据化合物中正负化合价代数和为零可知,硫元素的化合价为-2价。
故选D。
13.【答案】AB【解析】根据题意,由氧化镁、氢氧化镁、碳酸镁和稀盐酸反应的化学方程式:
可知生成二氧化碳的质量是200g+24g-219.6g=4.4g;溶液中溶质是氯化镁,再加入氢氧化钠,氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠,据此分析
【详解】A、根据分析,生成二氧化碳的质量是4.4g,选项正确;
B、根据分析可知原混合物中镁元素与最终生成氯化钠的质量关系是,选项正确;
C、根据分析,求出碳酸镁的质量,碳酸镁中镁元素的质量为,则氧化镁和氢氧化镁质量和是24g-8.4g=15.6g,设氧化镁质量为m,氢氧化镁质量为15.6-n,则
则氢氧化镁的质量是24g-8.4g-3.5g=12.1g,选项错误;
原固体混合物中氧元素的质量,选项错误;
14【答案】CD【解析】A、溶解度大小受温度影响,溶解度大小比较,应指明温度,否则无法比较,说法错误;
B、由溶解度曲线可知:碳酸钠和氯化钠的溶解度均随温度的升高而增加,碳酸钠的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,故“夏天晒盐”通过蒸发结晶获得氯化钠,“冬天捞碱”通过降温结晶得到碳酸钠,说法错误;
C、由溶解度曲线可知:20℃时,100g水中溶解碳酸钠、硫酸钠质量都大于10g,该温度下,取NaCl、各5g,分别加入50g水充分溶解,固体全部溶解,溶质质量都是5g,溶剂质量都是50g,所得溶液质量相等,说法正确;
D、由溶解度曲线可知:时,硫酸钠和氯化钠溶解度随温度降低而减小,且硫酸钠溶解度减小幅度较大,除去中的少量NaCl,可先配制32.4℃的饱和溶液,再降温结晶、过滤,得到硫酸钠,说法正确;
故选:CD。
15.【分析】A、根据乙酸苯甲酯化学式的含义,进行分析判断。
B、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断。
C、根据乙酸苯甲酯的微观构成,进行分析判断。
D、根据1个乙酸苯甲酯分子的构成,进行分析判断。
【解答】解:A、乙酸苯甲酯是由碳、氢、氧三种元素组成的,故选项说法正确。
B、乙酸苯甲酯中碳、氢、氧三种元素的质量比为(12×9):(1×10):(16×2)=54:5:16,则乙酸苯甲酯中氢元素的质量分数最小,故选项说法正确。
C、乙酸苯甲酯是由乙酸苯甲酯分子构成的,不含氧分子,故选项说法错误。
D、1个乙酸苯甲酯分子是由9个碳原子、10个氢原子、2个氧原子构成的,则乙酸苯甲酯分子中碳、氢、氧原子个数比9:10:2,故选项说法正确。
故选:C。
16.【分析】根据氯酸钾在二氧化锰的催化作用下、在加热条件下生成氯化钾和氧气,氯酸钾、氯化钾中钾元素和氯元素的质量比均为39:35.5,进行分析判断。
【解答】解:氯酸钾在二氧化锰的催化作用下、在加热条件下生成氯化钾和氧气,氯酸钾、氯化钾中钾元素和氯元素的质量比均为39:35.5,经实验测得反应后混合物中钾元素的质量分数为39%,则反应后混合物中氯元素的质量分数为35.5%。
故选:B。
17【答案】(1) ①. 物理变化 ②. 升高
(2)氨气分子间的间隙
(3)N (4)
设吸收氨气的质量为x
=
x=0.34g
氮元素的质量为:0.34g××100%=0.28g
废水中的氮元素含量==1.4g L-1
答:废水中的氮元素含量为1.4g L-1 (5)BD
(6) ①. 3NaClO+2NH3=N2+3NaCl+3H2O ②. 部分氨气被转化为NO或NO,留在废水中
【解析】
【小问1详解】
①可通过分离液态空气获得原料N2,该过程中没有新物质生成,属于物理变化;
②Fe3O4中铁元素的质量分数为,FeO中铁元素的质量分数为,所以该转化过程中固体所含铁元素的质量分数升高;
【小问2详解】
氨气转化为液氨过程中,氨气分子间的间隙变小;
【小问3详解】
利用NH3去除汽车尾气中的NO,生成水和一种气体单质,由质量守恒定律可知,化学反应前后元素的种类不变,则该气体为氮气,反应前NH3中氮元素的化合价为-3价,氢元素的化合价为+1价,NO中氮元素的化合价为+2价,氧元素的化合价为-2价,反应后水中氢元素的化合价为+1价,氧元素的化合价为-2价,氮气中氮元素的化合价为0价,则该过程中化合价发生变化的元素是N;
小问4详解】
解析见答案;
【小问5详解】
铵根和氢氧根结合可以生成氨气;
A、稀盐酸中不含氢氧根,故选项不符合题意;
B、NaOH溶液中含氢氧根,故选项符合题意;
C、NaCl溶液中不含氢氧根,故选项不符合题意;
D、生石灰与水反应生成氢氧化钙,氢氧化钙溶液中含氢氧根,故选项符合题意;
故选:BD;
【小问6详解】
①NaClO与NH3反应生成氮气、氯化钠和水,反应的化学方程式为:3NaClO+2NH3=N2+3NaCl+3H2O;
②从图可以看出,当m(NaClO)>m1时,废水中总氮残留率上升,但氨氮去除率为100%,则说明氮元素不以氨气或铵根离子的形式残留。结合“已知:水体中的氮元素通常以氨氮、硝氮形式存在。”可知,此时废水中的氮元素以硝氮形式存在。所以废水中总氮残留率上升,是因为部分氨气被转化为或,留在废水中。
18..【分析】(1)根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,进行分析解答。
(2)根据原子中质子数=核外电子数,进行分析解答。
(3)根据元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),进行分析解答。
【解答】解:(1)根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为167.3。
(2)原子中质子数=核外电子数,49=2+8+x+18+3,x=18。
(3)元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),铒、铟属于不同种元素,因为原子的质子数不同(或原子的核电荷数不同)。
故答案为:
(1)167.3;
(2)18;
(3)原子的质子数不同(或原子的核电荷数不同)。
【点评】本题难度不大,灵活运用元素周期表中元素的信息、原子结构示意图的含义是正确解答本题的关键。
19.【解答】解:(1)计算:配制200g质量分数为16%的氯化钠溶液所需氯化钠的质量为200g×16%=32g;
(3)量取:水的质量=200g﹣32g=168g,合168mL,用量筒量取168mL的水(水的密度可近似看做1g/cm3),倒入盛有氯化钠的烧杯中;
【问题交流】配制过程如图所示,天平称量物体质量应该左物右码,瓶塞应该倒放,所以操作不正确的是AB;
【模拟选种】(2)有的同学尝试用质量分数为26%的氯化钠溶液模拟选种,发现与使用16%的氯化钠溶液相比,漂浮在溶液表面的种子数量变多,原因是:相同条件下,氯化钠溶液的溶质质量分数越大,其密度越大。
故答案为:(1)32;
(3)168;
【问题交流】AB;
【模拟选种】相同条件下,氯化钠溶液的溶质质量分数越大,其密度越大。
【点评】本题难度不大,掌握配制溶质质量分数一定的溶液的基本步骤、注意事项等是正确解答本题的关键。
20.【答案】(1) ①. B-C-E ②. 0.1 ③. 5:4:2
(2) ①. ②. 乙 ③. 甲 ④. 使用轻质材料 :选择轻便且耐用的材料制作供氧器的外壳和部件,减少整体重量
【解析】
【小问1详解】
①装置B中:在锥形瓶中加入二氧化锰固体,然后加入过氧化氢溶液。二氧化锰作为催化剂,可以加快过氧化氢的分解速度 ,装置C中:使用浓硫酸干燥装置来除去氧气中的水分,装置C:用向上排空气法收集氧气。装置连接顺序为 : B(发生装置)→ C(干燥装置)→ E(收集装置) ;
②装置 C 2 质量增加 0.9 g为有机物产生水的质量,根据氢元素守恒得:有机物中的氢元素的质量等于其产生水中的氢元素的质量,即,根据碳元素守恒得:装置D中有机物碳元素的质量等于产生二氧化碳中碳元素的质量,即,有机物中氧元素的质量为:2.4g-0.1g-1.5g=0.8g,
有机物中x:y:z=
【小问2详解】
过氧化氢在二氧化锰作为催化剂生成水和氧气,化学方程式为,先将纯净水加入乙瓶中,为产生的氧气增加湿度,然后在甲瓶中加入氧化锰和过氧化氢溶液产生氧气,氧气通过甲瓶上端排向乙瓶。简易供氧器提出具体改进建议可以从 使用轻质材料 、增强安全措施 等方面提出建议。
21.【答案】(1) ①. 盐 ②. NH4Cl ③. 更易吸收二氧化碳 (2)BD
(3) ①. 216 ②. 设碳酸钠的质量为x
答:该样品中碳酸钠的质量分数84..8%
【答案】CD
【解析】
【详解】A、溶解度大小受温度影响,溶解度大小比较,应指明温度,否则无法比较,说法错误;
B、由溶解度曲线可知:碳酸钠和氯化钠的溶解度均随温度的升高而增加,碳酸钠的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,故“夏天晒盐”通过蒸发结晶获得氯化钠,“冬天捞碱”通过降温结晶得到碳酸钠,说法错误;
C、由溶解度曲线可知:20℃时,100g水中溶解碳酸钠、硫酸钠质量都大于10g,该温度下,取NaCl、各5g,分别加入50g水充分溶解,固体全部溶解,溶质质量都是5g,溶剂质量都是50g,所得溶液质量相等,说法正确;
D、由溶解度曲线可知:时,硫酸钠和氯化钠溶解度随温度降低而减小,且硫酸钠溶解度减小幅度较大,除去中的少量NaCl,可先配制32.4℃的饱和溶液,再降温结晶、过滤,得到硫酸钠,说法正确;
故选:CD。
【分析】根据氯酸钾在二氧化锰的催化作用下、在加热条件下生成氯化钾和氧气,氯酸钾、氯化钾中钾元素和氯元素的质量比均为39:35.5,进行分析判断。
【解答】解:氯酸钾在二氧化锰的催化作用下、在加热条件下生成氯化钾和氧气,氯酸钾、氯化钾中钾元素和氯元素的质量比均为39:35.5,经实验测得反应后混合物中钾元素的质量分数为39%,则反应后混合物中氯元素的质量分数为35.5%。
故选:B。
22.【解答】解:(1)A.三种物质中氯化钠的溶解度受温度影响最小,该选项正确。
B.a1℃时,硝酸钾和硫酸铜的溶解度相同,该选项正确。
C.20℃时硝酸钾的溶解度是31.6g,饱和硝酸钾溶液中溶质的质量分数为×100%≈24.0%,该选项不正确。
D.30℃时,三种物质的溶解度由大到小的顺序:硝酸钾>氯化钠>硫酸铜,该选项正确。
故答案为:C。
(2)a2℃时硝酸钾溶解度是60g,氯化钠溶解度小于60g,将硝酸钾、氯化钠固体各60g,分别加入100g水中,硝酸钾完全溶解,得到160g硝酸钾溶液,氯化钠不能完全溶解,得到氯化钠质量小于160g,得到硝酸钾溶液的质量>氯化钠溶液的质量。
故答案为:>。
(3)30℃时硫酸铜溶解度是25g,不改变溶剂的质量,将125g硫酸铜饱和溶液(100g水和25g硫酸铜)升温到a2℃,硫酸铜溶解度变成60g,需加入60g﹣25g=35g无水硫酸铜才能重新达到饱和。
故答案为:35。
(4)向盛有Ca(NO3)2的无水乙醇溶液的试管里滴加BaBr2的无水乙醇溶液,观察到溶液中产生沉淀,是因为反应生成溴化钙和硝酸钡沉淀,反应的化学方程式是Ca(NO3)2+BaBr2=CaBr2+Ba(NO3)2↓。
故答案为:Ca(NO3)2+BaBr2=CaBr2+Ba(NO3)2↓。
同课章节目录
