1.2 反应热的计算 练习(含答案) 2024-2025学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.2 反应热的计算 练习(含答案) 2024-2025学年高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 218.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-18 21:36:19 | ||
图片预览


文档简介
第二节 反应热的计算
1 已知25 ℃、101 kPa下,1 mol水蒸发为水蒸气需要吸热44.01 kJ。
2H2O(l)===2H2(g)+O2(g) ΔH=+571.66 kJ/mol
C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.29 kJ/mol
则反应C(s)+O2(g)===CO(g)的反应热为( )
A. ΔH=-396.36 kJ/mol
B. ΔH=-198.55 kJ/mol
C. ΔH=-154.54 kJ/mol
D. ΔH=-110.53 kJ/mol
2 已知:①CO(g)+H2O(g)===CO2(g)+H2(g) ΔH1
②CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH2
下列推断正确的是( )
A. 若CO的燃烧热为ΔH3,则H2的燃烧热为ΔH3-ΔH1
B. 反应CH4(g)+CO2(g)===2CO(g)+2H2(g)的ΔH=ΔH1-ΔH2
C. 若反应②的反应物总能量低于生成物总能量,则ΔH2<0
D. 若等物质的量的CO和H2完全燃烧生成气态产物时后者放热更多,则ΔH1>0
3 依据图示关系,下列说法不正确的是( )
A. 石墨燃烧是放热反应
B. 1 mol C(石墨)和1 mol CO分别在足量O2中燃烧,全部转化为CO2,前者放热多
C. C(石墨)+CO2(g)===2CO(g) ΔH=ΔH1-ΔH2
D. 化学反应的ΔH,只与反应体系的始态和终态有关,与反应途径无关
4 [2025镇江期中]已知:
①H2(g)+O2(g)===H2O(g) ΔH1
②N2(g)+O2(g)===NO2(g) ΔH2
③N2(g)+H2(g)===NH3(g) ΔH3
则反应2NH3(g)+O2(g)===2NO2(g)+3H2O(g)的ΔH为( )
A. 2ΔH1+2ΔH2-2ΔH3
B. ΔH1+ΔH2-ΔH3
C. 3ΔH1+2ΔH2+2ΔH3
D. 3ΔH1+2ΔH2-2ΔH3
5 25 ℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则 2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A. -488.3 kJ/mol B. +488.3 kJ/mol
C. -191 kJ/mol D. +191 kJ/mol
6 [2025苏州中学月考]各相关物质的燃烧热数据如表。下列热化学方程式正确的是( )
物质 C2H6(g) CH2===CH2(g) H2(g)
ΔH/(kJ/mol) -1 559.8 -1 411 -285.8
A. C2H4(g)+3O2(g)===2CO2(g)+2H2O(g) ΔH=-1 411 kJ/mol
B. C2H6(g)+O2(g)===2CO2(g)+3H2O(l) ΔH =-1 559.8 kJ/mol
C. C2H6(g)===CH2===CH2(g)+H2(g) ΔH =-137 kJ/mol
D. 2H2O(l)===O2(g)+2H2(g) ΔH =+285.8 kJ/mol
7 氯原子对O3分解有催化作用:O3+Cl===ClO+O2 ΔH1;ClO+O===Cl+O2 ΔH2。大气臭氧层的分解反应是O3+O===2O2 ΔH,该反应的能量变化如图所示,下列叙述正确的是( )
A. 反应O3+O===2O2的ΔH=E1-E3
B. O3+O===2O2是吸热反应
C. ΔH=ΔH1+ΔH2
D. ΔH=E3-E2>0
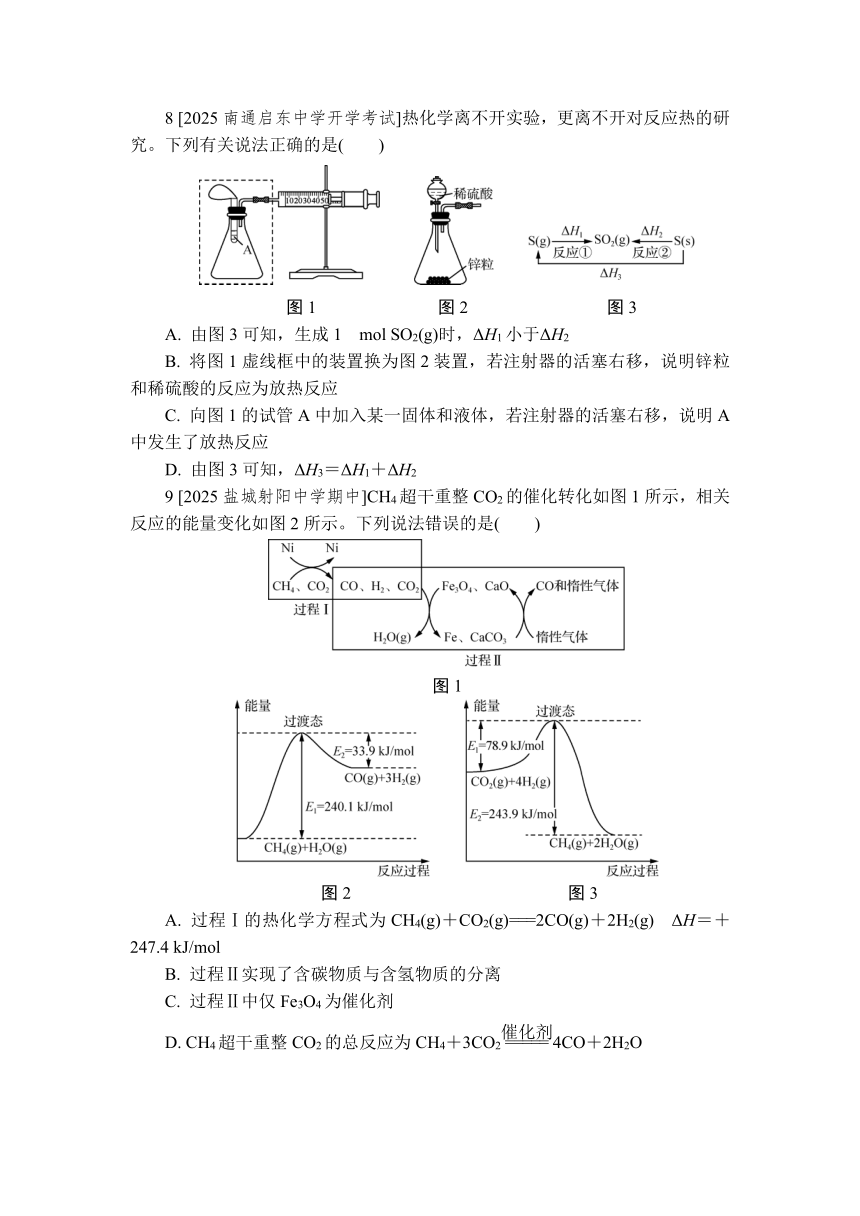
8 [2025南通启东中学开学考试]热化学离不开实验,更离不开对反应热的研究。下列有关说法正确的是( )
图1 图2 图3
A. 由图3可知,生成1 mol SO2(g)时,ΔH1小于ΔH2
B. 将图1虚线框中的装置换为图2装置,若注射器的活塞右移,说明锌粒和稀硫酸的反应为放热反应
C. 向图1的试管A中加入某一固体和液体,若注射器的活塞右移,说明A中发生了放热反应
D. 由图3可知,ΔH3=ΔH1+ΔH2
9 [2025盐城射阳中学期中]CH4超干重整CO2的催化转化如图1所示,相关反应的能量变化如图2所示。下列说法错误的是( )
图1
图2 图3
A. 过程Ⅰ的热化学方程式为CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247.4 kJ/mol
B. 过程Ⅱ实现了含碳物质与含氢物质的分离
C. 过程Ⅱ中仅Fe3O4为催化剂
D. CH4超干重整CO2的总反应为CH4+3CO24CO+2H2O
10 [2025苏州中学月考](1) 已知:
Ⅰ. SO2(g)+I2(g)+2H2O(g)===2HI(g)+H2SO4(l) ΔH1=x kJ/mol
Ⅱ. 2H2SO4(l)===2H2O(g)+2SO2(g)+O2(g) ΔH2=y kJ/mol
Ⅲ. H2(g)+I2(g)===2HI(g) ΔH3=z kJ/mol
则2H2O(g)===2H2(g)+O2(g) ΔH=____________kJ/mol。
(2) 在CH4与CO2重整体系中通入适量H2O(g),可减少C(s)的生成。已知:
Ⅰ. CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH1=+246.5 kJ/mol
Ⅱ. H2(g)+CO2(g)===CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol
Ⅲ. 2CO(g)===CO2(g)+ C(s) ΔH3=-172.5 kJ/mol
则3CH4(g)+ CO2(g)+2H2O(g)===4CO(g)+8H2(g) ΔH4=________kJ/mol。
(3) 部分共价键的键能与热化学方程式的信息如表,则2O(g)===O2(g) ΔH=________kJ/mol。
共价键 H—H H—O
键能/(kJ/mol) 436 463
热化学方程式 2H2(g)+O2(g)===2H2O(g) ΔH=-482 kJ/mol
(4) 利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇。已知:
Ⅰ. CO(g)+2H2(g)===CH3OH(g) ΔH1
Ⅱ. CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH2
Ⅲ. CO2(g)+H2(g)===CO(g)+H2O(g) ΔH3
反应Ⅰ中相关化学键的键能数据如表,则ΔH1=________kJ/mol,若ΔH2=-58 kJ/mol,则ΔH3=________kJ/mol。
化学键 H—H C—O C≡O H—O C—H
键能/(kJ/mol) 436 343 1 076 465 413
11 [2025泰州中学期中]“碳中和”目标如期实现的关键技术之一是CO2的再资源化利用。
(1) 天然气中普遍含有H2S,需回收处理并加以利用。
①已知:
Ⅰ. 2H2S(g)+3O2(g)===2SO2(g)+2H2O(g) ΔH1=-1 036 kJ/mol
Ⅱ. 4H2S(g)+2SO2(g)===3S2(g)+4H2O(g) ΔH2=+94 kJ/mol
Ⅲ. 2H2(g)+O2(g)===2H2O(g) ΔH3=-484 kJ/mol
则Ⅳ. 2H2S(g)===S2(g)+2H2(g) ΔH4=________kJ/mol。
②较普遍采用处理H2S的方法是克劳斯工艺,即利用反应Ⅰ和Ⅱ生成硫单质。相比克劳斯工艺,利用反应Ⅳ处理H2S的优点是____________________________
______________________________________________________________________,
缺点是________________________________________________________________
______________________________________________________________________。
(2) CO2和H2在催化剂作用下可合成CH4,已知:
化学键 C—H H—H C===O H—O
键能/(kJ/mol) a b c d
则CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH=________________kJ/mol。
(3) 工业上以CO2和NH3为原料在一定温度和压强下合成尿素,反应分两步进行:
ⅰ. CO2和NH3生成NH2COONH4;
ⅱ. NH2COONH4分解生成尿素。反应过程中能量变化如图。
①反应ⅰ为________(填“吸热”或“放热”,下同)反应;反应ⅱ为________反应。
②写出CO2和NH3合成尿素总反应的热化学方程式:_____________________
______________________________________________________________________。
第二节 反应热的计算
1 D 从上到下三个热化学方程式分别为①②③,且根据已知条件H2O(l)===H2O(g) ΔH=+44.01 kJ/mol④,目标方程式③=②-①×+④,故ΔH3=ΔH2-ΔH1+ΔH4=-110.53 kJ/mol。
2 D 3 C
4 D 根据盖斯定律,①×3+②×2-③×2可得2NH3(g)+O2(g)===2NO2(g)+3H2O(g),则ΔH=3ΔH1+2ΔH2-2ΔH3,故选D。
5 A
6 B 计算燃烧热时,H2O应该呈液态,A错误;根据盖斯定律,C2H6(g)的燃烧热-CH2===CH2(g)的燃烧热-H2(g)的燃烧热可得C2H6(g)===CH2===CH2(g)+H2(g),则ΔH=(-1 559.8+1 411+285.8) kJ/mol=+137 kJ/mol,C错误;H2(g)+O2(g)===H2O(l) ΔH =-285.8 kJ/mol,且正、逆反应的ΔH之和为0,则H2O(l)===O2(g)+H2(g) ΔH =+285.8 kJ/mol,D错误。
7 C
8 A 气态硫燃烧生成1 mol SO2(g)时放出的热量较多,且燃烧反应的ΔH为负值,故ΔH1小于ΔH2,A正确;图2装置中生成的气体会占据一定体积,也会使注射器的活塞右移,故不能说明锌粒和稀硫酸的反应为放热反应,B错误;固体和液体混合放热,不能说明一定发生了化学反应,如NaOH固体溶于水放热,但该过程不属于放热反应,C错误;根据盖斯定律,ΔH3=-ΔH1+ΔH2,D错误。
9 C 由图2、3知,①CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=(240.1-33.9) kJ/mol=+206.2 kJ/mol、②CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH=-(243.9-78.9) kJ/mol=-165 kJ/mol,根据盖斯定律,由①×2+②可得CH4(g)+CO2(g)===2CO(g)+2H2(g),则ΔH=(206.2×2-165) kJ/mol=+247.4 kJ/mol,A正确;由图1知,过程Ⅱ中第一步反应将C固定在固体中,含氢物质以气态水的形式被分离出去,第二步反应将C从固体中放出,含碳物质以CO的形式被分离出去,过程Ⅱ实现了含碳物质与含氢物质的分离,B正确;过程Ⅱ中反应前后Fe3O4、CaO化学性质不变,为催化剂,C错误;根据流程中物质的参与和生成情况,结合反应过程中有催化剂和中间产物,总反应可表示为CH4+3CO24CO+2H2O,D正确。
10 (1) 2x+y-2z (2) +657.1 (3) -498 (4) -99 +41
解析:(1) 根据盖斯定律,由Ⅰ×2+Ⅱ-Ⅲ×2可得2H2O(g)===2H2(g)+O2(g),则ΔH=(2x+y-2z) kJ/mol。(2) 根据盖斯定律,由Ⅰ×3-Ⅱ×2可得3CH4(g)+CO2(g)+2H2O(g)===4CO(g)+8H2(g),则ΔH=(246.5×3-41.2×2) kJ/mol=+657.1 kJ/mol。(3) ΔH=反应物键能之和-生成物键能之和,则2H2(g)+O2(g)===2H2O(g) ΔH=2E(H—H)+E(O===O)-4E(H—O)=436 kJ/mol×2+E(O===O)-4×463 kJ/mol=-482 kJ/mol,解得E(O===O)=498 kJ/mol,形成化学键需要释放能量,故2O(g)===O2(g) ΔH=-498 kJ/mol。(4) ΔH=反应物键能之和-生成物键能之和,则CO(g)+2H2(g)===CH3OH(g) ΔH1=E(C≡O)+2E(H—H)-3E(C—H)-E(C—O)-E(H—O)=(1 076+2×436-3×413-343-465) kJ/mol=-99 kJ/mol。根据盖斯定律,Ⅱ-Ⅰ=Ⅲ,则ΔH3=-58 kJ/mol-(-99 kJ/mol)=+41 kJ/mol。
11 (1) ①+170 ②获得的H2可作燃料 能耗较高 (2) (2c+4b-4a-4d)
(3) ①放热 吸热 ②CO2(l)+2NH3(l)===CO(NH2)2(l)+H2O(l) ΔH=E1-E2+E3-E4
解析:(1) ①根据盖斯定律,×(Ⅰ+Ⅱ-3×Ⅲ)可得2H2S(g)===S2(g)+2H2(g),则ΔH4=×[-1 036+94-3×(-484)] kJ/mol=+170 kJ/mol。②相比克劳斯工艺,利用反应Ⅳ处理H2S的优点是生成硫单质的同时生成H2,获得的H2可作燃料;缺点是反应Ⅳ是吸热反应,能耗较高。(2) ΔH=反应物的键能总和-生成物的键能总和,则CO2(g)+4H2(g)===CH4(g)+2H2O(g)的ΔH=(2c+4b-4a-4d) kJ/mol。(3) ①图中反应ⅰ的反应物总能量高于生成物总能量,为放热反应;反应ⅱ的反应物总能量低于生成物的总能量,为吸热反应。②ΔH=正反应的活化能-逆反应的活化能,则总反应的热化学方程式为CO2(l)+2NH3(l)===CO(NH2)2(l)+H2O(l) ΔH=E1-E2+E3-E4。
1 已知25 ℃、101 kPa下,1 mol水蒸发为水蒸气需要吸热44.01 kJ。
2H2O(l)===2H2(g)+O2(g) ΔH=+571.66 kJ/mol
C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.29 kJ/mol
则反应C(s)+O2(g)===CO(g)的反应热为( )
A. ΔH=-396.36 kJ/mol
B. ΔH=-198.55 kJ/mol
C. ΔH=-154.54 kJ/mol
D. ΔH=-110.53 kJ/mol
2 已知:①CO(g)+H2O(g)===CO2(g)+H2(g) ΔH1
②CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH2
下列推断正确的是( )
A. 若CO的燃烧热为ΔH3,则H2的燃烧热为ΔH3-ΔH1
B. 反应CH4(g)+CO2(g)===2CO(g)+2H2(g)的ΔH=ΔH1-ΔH2
C. 若反应②的反应物总能量低于生成物总能量,则ΔH2<0
D. 若等物质的量的CO和H2完全燃烧生成气态产物时后者放热更多,则ΔH1>0
3 依据图示关系,下列说法不正确的是( )
A. 石墨燃烧是放热反应
B. 1 mol C(石墨)和1 mol CO分别在足量O2中燃烧,全部转化为CO2,前者放热多
C. C(石墨)+CO2(g)===2CO(g) ΔH=ΔH1-ΔH2
D. 化学反应的ΔH,只与反应体系的始态和终态有关,与反应途径无关
4 [2025镇江期中]已知:
①H2(g)+O2(g)===H2O(g) ΔH1
②N2(g)+O2(g)===NO2(g) ΔH2
③N2(g)+H2(g)===NH3(g) ΔH3
则反应2NH3(g)+O2(g)===2NO2(g)+3H2O(g)的ΔH为( )
A. 2ΔH1+2ΔH2-2ΔH3
B. ΔH1+ΔH2-ΔH3
C. 3ΔH1+2ΔH2+2ΔH3
D. 3ΔH1+2ΔH2-2ΔH3
5 25 ℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则 2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A. -488.3 kJ/mol B. +488.3 kJ/mol
C. -191 kJ/mol D. +191 kJ/mol
6 [2025苏州中学月考]各相关物质的燃烧热数据如表。下列热化学方程式正确的是( )
物质 C2H6(g) CH2===CH2(g) H2(g)
ΔH/(kJ/mol) -1 559.8 -1 411 -285.8
A. C2H4(g)+3O2(g)===2CO2(g)+2H2O(g) ΔH=-1 411 kJ/mol
B. C2H6(g)+O2(g)===2CO2(g)+3H2O(l) ΔH =-1 559.8 kJ/mol
C. C2H6(g)===CH2===CH2(g)+H2(g) ΔH =-137 kJ/mol
D. 2H2O(l)===O2(g)+2H2(g) ΔH =+285.8 kJ/mol
7 氯原子对O3分解有催化作用:O3+Cl===ClO+O2 ΔH1;ClO+O===Cl+O2 ΔH2。大气臭氧层的分解反应是O3+O===2O2 ΔH,该反应的能量变化如图所示,下列叙述正确的是( )
A. 反应O3+O===2O2的ΔH=E1-E3
B. O3+O===2O2是吸热反应
C. ΔH=ΔH1+ΔH2
D. ΔH=E3-E2>0
8 [2025南通启东中学开学考试]热化学离不开实验,更离不开对反应热的研究。下列有关说法正确的是( )
图1 图2 图3
A. 由图3可知,生成1 mol SO2(g)时,ΔH1小于ΔH2
B. 将图1虚线框中的装置换为图2装置,若注射器的活塞右移,说明锌粒和稀硫酸的反应为放热反应
C. 向图1的试管A中加入某一固体和液体,若注射器的活塞右移,说明A中发生了放热反应
D. 由图3可知,ΔH3=ΔH1+ΔH2
9 [2025盐城射阳中学期中]CH4超干重整CO2的催化转化如图1所示,相关反应的能量变化如图2所示。下列说法错误的是( )
图1
图2 图3
A. 过程Ⅰ的热化学方程式为CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247.4 kJ/mol
B. 过程Ⅱ实现了含碳物质与含氢物质的分离
C. 过程Ⅱ中仅Fe3O4为催化剂
D. CH4超干重整CO2的总反应为CH4+3CO24CO+2H2O
10 [2025苏州中学月考](1) 已知:
Ⅰ. SO2(g)+I2(g)+2H2O(g)===2HI(g)+H2SO4(l) ΔH1=x kJ/mol
Ⅱ. 2H2SO4(l)===2H2O(g)+2SO2(g)+O2(g) ΔH2=y kJ/mol
Ⅲ. H2(g)+I2(g)===2HI(g) ΔH3=z kJ/mol
则2H2O(g)===2H2(g)+O2(g) ΔH=____________kJ/mol。
(2) 在CH4与CO2重整体系中通入适量H2O(g),可减少C(s)的生成。已知:
Ⅰ. CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH1=+246.5 kJ/mol
Ⅱ. H2(g)+CO2(g)===CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol
Ⅲ. 2CO(g)===CO2(g)+ C(s) ΔH3=-172.5 kJ/mol
则3CH4(g)+ CO2(g)+2H2O(g)===4CO(g)+8H2(g) ΔH4=________kJ/mol。
(3) 部分共价键的键能与热化学方程式的信息如表,则2O(g)===O2(g) ΔH=________kJ/mol。
共价键 H—H H—O
键能/(kJ/mol) 436 463
热化学方程式 2H2(g)+O2(g)===2H2O(g) ΔH=-482 kJ/mol
(4) 利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇。已知:
Ⅰ. CO(g)+2H2(g)===CH3OH(g) ΔH1
Ⅱ. CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH2
Ⅲ. CO2(g)+H2(g)===CO(g)+H2O(g) ΔH3
反应Ⅰ中相关化学键的键能数据如表,则ΔH1=________kJ/mol,若ΔH2=-58 kJ/mol,则ΔH3=________kJ/mol。
化学键 H—H C—O C≡O H—O C—H
键能/(kJ/mol) 436 343 1 076 465 413
11 [2025泰州中学期中]“碳中和”目标如期实现的关键技术之一是CO2的再资源化利用。
(1) 天然气中普遍含有H2S,需回收处理并加以利用。
①已知:
Ⅰ. 2H2S(g)+3O2(g)===2SO2(g)+2H2O(g) ΔH1=-1 036 kJ/mol
Ⅱ. 4H2S(g)+2SO2(g)===3S2(g)+4H2O(g) ΔH2=+94 kJ/mol
Ⅲ. 2H2(g)+O2(g)===2H2O(g) ΔH3=-484 kJ/mol
则Ⅳ. 2H2S(g)===S2(g)+2H2(g) ΔH4=________kJ/mol。
②较普遍采用处理H2S的方法是克劳斯工艺,即利用反应Ⅰ和Ⅱ生成硫单质。相比克劳斯工艺,利用反应Ⅳ处理H2S的优点是____________________________
______________________________________________________________________,
缺点是________________________________________________________________
______________________________________________________________________。
(2) CO2和H2在催化剂作用下可合成CH4,已知:
化学键 C—H H—H C===O H—O
键能/(kJ/mol) a b c d
则CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH=________________kJ/mol。
(3) 工业上以CO2和NH3为原料在一定温度和压强下合成尿素,反应分两步进行:
ⅰ. CO2和NH3生成NH2COONH4;
ⅱ. NH2COONH4分解生成尿素。反应过程中能量变化如图。
①反应ⅰ为________(填“吸热”或“放热”,下同)反应;反应ⅱ为________反应。
②写出CO2和NH3合成尿素总反应的热化学方程式:_____________________
______________________________________________________________________。
第二节 反应热的计算
1 D 从上到下三个热化学方程式分别为①②③,且根据已知条件H2O(l)===H2O(g) ΔH=+44.01 kJ/mol④,目标方程式③=②-①×+④,故ΔH3=ΔH2-ΔH1+ΔH4=-110.53 kJ/mol。
2 D 3 C
4 D 根据盖斯定律,①×3+②×2-③×2可得2NH3(g)+O2(g)===2NO2(g)+3H2O(g),则ΔH=3ΔH1+2ΔH2-2ΔH3,故选D。
5 A
6 B 计算燃烧热时,H2O应该呈液态,A错误;根据盖斯定律,C2H6(g)的燃烧热-CH2===CH2(g)的燃烧热-H2(g)的燃烧热可得C2H6(g)===CH2===CH2(g)+H2(g),则ΔH=(-1 559.8+1 411+285.8) kJ/mol=+137 kJ/mol,C错误;H2(g)+O2(g)===H2O(l) ΔH =-285.8 kJ/mol,且正、逆反应的ΔH之和为0,则H2O(l)===O2(g)+H2(g) ΔH =+285.8 kJ/mol,D错误。
7 C
8 A 气态硫燃烧生成1 mol SO2(g)时放出的热量较多,且燃烧反应的ΔH为负值,故ΔH1小于ΔH2,A正确;图2装置中生成的气体会占据一定体积,也会使注射器的活塞右移,故不能说明锌粒和稀硫酸的反应为放热反应,B错误;固体和液体混合放热,不能说明一定发生了化学反应,如NaOH固体溶于水放热,但该过程不属于放热反应,C错误;根据盖斯定律,ΔH3=-ΔH1+ΔH2,D错误。
9 C 由图2、3知,①CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=(240.1-33.9) kJ/mol=+206.2 kJ/mol、②CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH=-(243.9-78.9) kJ/mol=-165 kJ/mol,根据盖斯定律,由①×2+②可得CH4(g)+CO2(g)===2CO(g)+2H2(g),则ΔH=(206.2×2-165) kJ/mol=+247.4 kJ/mol,A正确;由图1知,过程Ⅱ中第一步反应将C固定在固体中,含氢物质以气态水的形式被分离出去,第二步反应将C从固体中放出,含碳物质以CO的形式被分离出去,过程Ⅱ实现了含碳物质与含氢物质的分离,B正确;过程Ⅱ中反应前后Fe3O4、CaO化学性质不变,为催化剂,C错误;根据流程中物质的参与和生成情况,结合反应过程中有催化剂和中间产物,总反应可表示为CH4+3CO24CO+2H2O,D正确。
10 (1) 2x+y-2z (2) +657.1 (3) -498 (4) -99 +41
解析:(1) 根据盖斯定律,由Ⅰ×2+Ⅱ-Ⅲ×2可得2H2O(g)===2H2(g)+O2(g),则ΔH=(2x+y-2z) kJ/mol。(2) 根据盖斯定律,由Ⅰ×3-Ⅱ×2可得3CH4(g)+CO2(g)+2H2O(g)===4CO(g)+8H2(g),则ΔH=(246.5×3-41.2×2) kJ/mol=+657.1 kJ/mol。(3) ΔH=反应物键能之和-生成物键能之和,则2H2(g)+O2(g)===2H2O(g) ΔH=2E(H—H)+E(O===O)-4E(H—O)=436 kJ/mol×2+E(O===O)-4×463 kJ/mol=-482 kJ/mol,解得E(O===O)=498 kJ/mol,形成化学键需要释放能量,故2O(g)===O2(g) ΔH=-498 kJ/mol。(4) ΔH=反应物键能之和-生成物键能之和,则CO(g)+2H2(g)===CH3OH(g) ΔH1=E(C≡O)+2E(H—H)-3E(C—H)-E(C—O)-E(H—O)=(1 076+2×436-3×413-343-465) kJ/mol=-99 kJ/mol。根据盖斯定律,Ⅱ-Ⅰ=Ⅲ,则ΔH3=-58 kJ/mol-(-99 kJ/mol)=+41 kJ/mol。
11 (1) ①+170 ②获得的H2可作燃料 能耗较高 (2) (2c+4b-4a-4d)
(3) ①放热 吸热 ②CO2(l)+2NH3(l)===CO(NH2)2(l)+H2O(l) ΔH=E1-E2+E3-E4
解析:(1) ①根据盖斯定律,×(Ⅰ+Ⅱ-3×Ⅲ)可得2H2S(g)===S2(g)+2H2(g),则ΔH4=×[-1 036+94-3×(-484)] kJ/mol=+170 kJ/mol。②相比克劳斯工艺,利用反应Ⅳ处理H2S的优点是生成硫单质的同时生成H2,获得的H2可作燃料;缺点是反应Ⅳ是吸热反应,能耗较高。(2) ΔH=反应物的键能总和-生成物的键能总和,则CO2(g)+4H2(g)===CH4(g)+2H2O(g)的ΔH=(2c+4b-4a-4d) kJ/mol。(3) ①图中反应ⅰ的反应物总能量高于生成物总能量,为放热反应;反应ⅱ的反应物总能量低于生成物的总能量,为吸热反应。②ΔH=正反应的活化能-逆反应的活化能,则总反应的热化学方程式为CO2(l)+2NH3(l)===CO(NH2)2(l)+H2O(l) ΔH=E1-E2+E3-E4。
