4.3 金属的腐蚀与防护 练习(含答案) 2024-2025学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.3 金属的腐蚀与防护 练习(含答案) 2024-2025学年高二化学人教版(2019)选择性必修1 |
|
|
| 格式 | docx | ||
| 文件大小 | 170.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-18 00:00:00 | ||
图片预览

文档简介
第三节 金属的腐蚀与防护
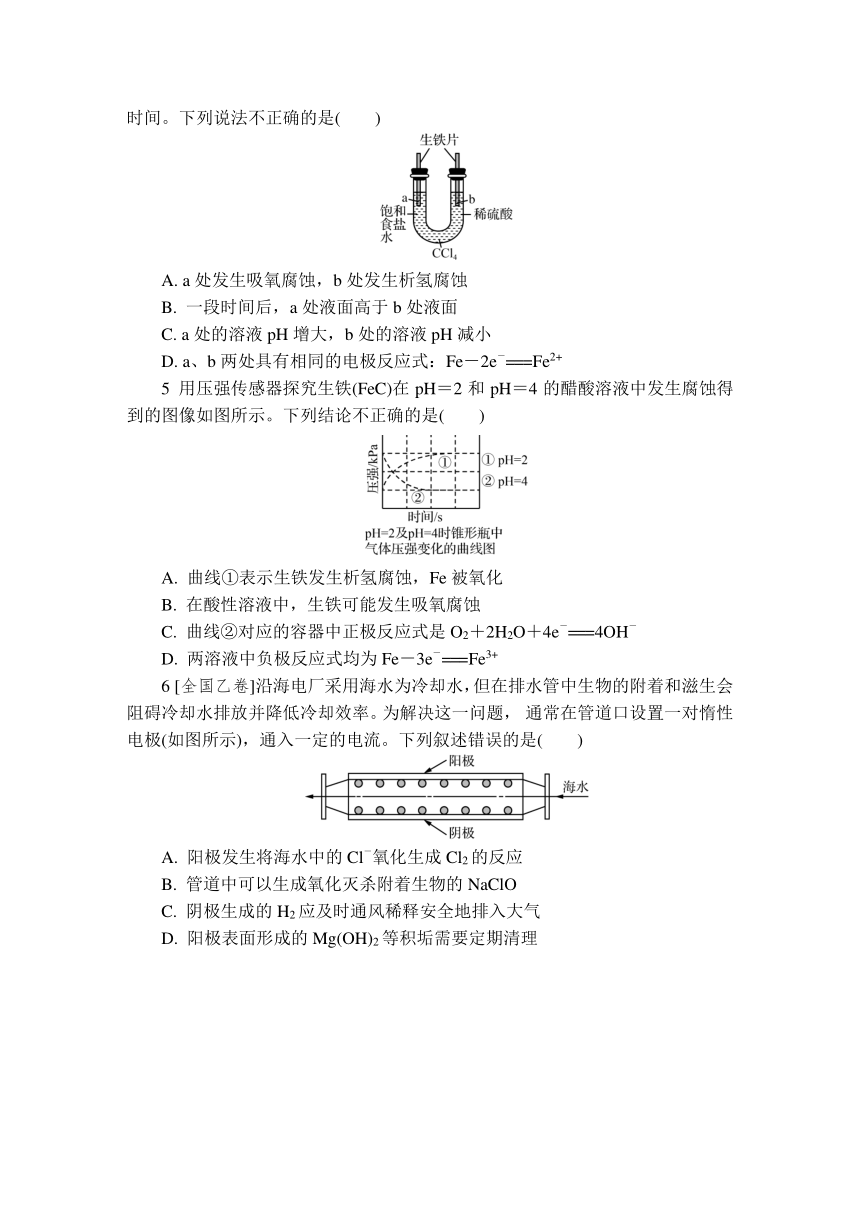
1 [2024扬州高邮月考]为防止海水中钢铁的腐蚀,可将金属Zn连接在钢铁设施表面,减缓水体中钢铁设施的腐蚀,如图所示。下列有关说法正确的是( )
A. 过程中电能转化为化学能
B. 将钢铁闸门与电源的正极相连也能起到保护作用
C. 该保护过程中,锌块质量减小
D. 将金属Zn换成金属Cu也能起到保护作用
2 [2025苏州第十中学月考]下列对如图所示的实验装置的判断错误的是( )
A. 若X为碳棒,开关K置于A处可减缓铁的腐蚀
B. 若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀
C. 若X为锌棒,开关K置于B处时,为外加电流法
D. 若X为碳棒,开关K置于B处时,铁电极未被保护
3 [2025苏州西安交大附中月考]我国有多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是( )
A. 通电时,阳极的电极反应式为Zn-2e-===Zn2+
B. 通电时,阴极上的电极反应为2H2O+2e-===H2↑+2OH-
C. 通电时,该装置为牺牲阳极法
D. 断电时,仍能防止铁帽被腐蚀
4 利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )
A. a处发生吸氧腐蚀,b处发生析氢腐蚀
B. 一段时间后,a处液面高于b处液面
C. a处的溶液pH增大,b处的溶液pH减小
D. a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
5 用压强传感器探究生铁(FeC)在pH=2和pH=4的醋酸溶液中发生腐蚀得到的图像如图所示。下列结论不正确的是( )
A. 曲线①表示生铁发生析氢腐蚀,Fe被氧化
B. 在酸性溶液中,生铁可能发生吸氧腐蚀
C. 曲线②对应的容器中正极反应式是O2+2H2O+4e-===4OH-
D. 两溶液中负极反应式均为Fe-3e-===Fe3+
6 [全国乙卷]沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。为解决这一问题, 通常在管道口设置一对惰性电极(如图所示),通入一定的电流。下列叙述错误的是( )
A. 阳极发生将海水中的Cl-氧化生成Cl2的反应
B. 管道中可以生成氧化灭杀附着生物的NaClO
C. 阴极生成的H2应及时通风稀释安全地排入大气
D. 阳极表面形成的Mg(OH)2等积垢需要定期清理
7 关于铁生锈的机理有人提出如下4个步骤:①Fe-2e-===Fe2+;②H++e-===H;③4H+O2===2H2O;④4Fe2++O2+(4+2x)H2O===2(Fe2O3·xH2O)+8H+,试回答下列问题。
(1) 根据以上机理,判断下列说法正确的是________(填字母,下同)。
A. 以上锈蚀过程发生的是化学腐蚀
B. 从锈蚀反应的最终结果看,水既是氧化剂,又是还原剂
C. 反应的实质是氧气被还原,金属铁被氧化
D. 从反应机理看,锈蚀过程发生的是析氢腐蚀
(2) 某铁件需长期浸于水下,为了减少腐蚀,可采取的措施是________。
A. 给铁件铆上一些锌板
B. 给铁件通入直流电,把铁件与电源正极连接
C. 在制造铁件时,在铁中掺入一定比例的铜制成合金
D. 在铁件表面涂上一层较厚的沥青
(3) 质量为1 000 g的某铁件已在水下生锈,若已知整个锈蚀过程中有6 mol电子发生转移,则参加反应的O2在标准状况下的体积为________L,生锈后铁件的质量为________g(已知铁锈Fe2O3·xH2O中x的值为1)。
8 钢铁工业是国家工业的基础,请回答钢铁腐蚀与防护过程中的有关问题。
(1) 生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式为_______________________________。
(2) 下列可防止铁棒被腐蚀的装置有____________(填字母)。
A B C D
(3) 在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置如图所示。
①A电极对应的金属是________(填元素名称),B电极的电极反应式是______________________。
②若电镀前A、B两个金属片的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为________mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因:___________
____________________________________________________________________________________________________________________________________________。
第三节 金属的腐蚀与防护
1 C 该装置为原电池,过程中化学能转化为电能,A错误;将钢铁闸门与电源的负极相连才能起到保护作用,为外加电流法,B错误;Zn作负极,电极反应式为Zn-2e-=== Zn2+,锌块质量减小,C正确;活泼性:Fe>Cu,Fe作负极,腐蚀更严重,故将金属Zn换成金属Cu不能起到保护作用,D错误。
2 C 若X为碳棒,开关K置于A处时,Fe作阴极,为外加电流法,可减缓铁的腐蚀,A正确;若X为锌棒,开关K置于A处时,分析同选项A,开关K置于B处时,形成原电池,Fe作正极,为牺牲阳极法,可减缓铁的腐蚀,B正确,C错误;若X为碳棒,开关K置于B处时,形成原电池,Fe作负极,腐蚀加剧,铁电极未被保护,D正确。
3 C 通电时,该装置为外加电流法,C错误。
4 C 根据装置图判断,左边铁片发生吸氧腐蚀,右边铁片发生析氢腐蚀。左边,负极:Fe-2e-===Fe2+,正极:O2+4e-+2H2O===4OH-;右边,负极:Fe-2e-===Fe2+,正极:2H++2e-===H2↑。a、b处的溶液pH均增大,C错误。
5 D
6 D 根据题干信息分析知,阳极区海水中的Cl-会优先失电子生成Cl2,发生氧化反应,A正确;设置的装置为电解池原理,阳极区生成的Cl2与阴极区生成的OH-在管道中会发生反应生成NaCl、NaClO和H2O,其中NaClO具有强氧化性,可氧化灭杀附着的生物,B正确;因为H2是易燃性气体,所以阴极区生成的H2需及时通风稀释,安全地排入大气,以排除安全隐患,C正确;阴极的电极反应式为2H2O+2e-===H2↑+2OH-,会使海水中的Mg2+沉淀积垢,所以阴极表面会形成 Mg(OH)2等积垢,需要定期清理,D错误。
7 (1) C (2) AD (3) 33.6 1 066
8 (1) 2FeCl3+Fe===3FeCl2 (2) BD
(3) ①铜 Cu2++2e-===Cu ②0.08
③锌比铁活泼,铁比铜活泼,镀铜铁的镀层破损后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀,而镀锌铁的镀层破损后形成的原电池中,铁为正极,被保护
1 [2024扬州高邮月考]为防止海水中钢铁的腐蚀,可将金属Zn连接在钢铁设施表面,减缓水体中钢铁设施的腐蚀,如图所示。下列有关说法正确的是( )
A. 过程中电能转化为化学能
B. 将钢铁闸门与电源的正极相连也能起到保护作用
C. 该保护过程中,锌块质量减小
D. 将金属Zn换成金属Cu也能起到保护作用
2 [2025苏州第十中学月考]下列对如图所示的实验装置的判断错误的是( )
A. 若X为碳棒,开关K置于A处可减缓铁的腐蚀
B. 若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀
C. 若X为锌棒,开关K置于B处时,为外加电流法
D. 若X为碳棒,开关K置于B处时,铁电极未被保护
3 [2025苏州西安交大附中月考]我国有多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是( )
A. 通电时,阳极的电极反应式为Zn-2e-===Zn2+
B. 通电时,阴极上的电极反应为2H2O+2e-===H2↑+2OH-
C. 通电时,该装置为牺牲阳极法
D. 断电时,仍能防止铁帽被腐蚀
4 利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )
A. a处发生吸氧腐蚀,b处发生析氢腐蚀
B. 一段时间后,a处液面高于b处液面
C. a处的溶液pH增大,b处的溶液pH减小
D. a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
5 用压强传感器探究生铁(FeC)在pH=2和pH=4的醋酸溶液中发生腐蚀得到的图像如图所示。下列结论不正确的是( )
A. 曲线①表示生铁发生析氢腐蚀,Fe被氧化
B. 在酸性溶液中,生铁可能发生吸氧腐蚀
C. 曲线②对应的容器中正极反应式是O2+2H2O+4e-===4OH-
D. 两溶液中负极反应式均为Fe-3e-===Fe3+
6 [全国乙卷]沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。为解决这一问题, 通常在管道口设置一对惰性电极(如图所示),通入一定的电流。下列叙述错误的是( )
A. 阳极发生将海水中的Cl-氧化生成Cl2的反应
B. 管道中可以生成氧化灭杀附着生物的NaClO
C. 阴极生成的H2应及时通风稀释安全地排入大气
D. 阳极表面形成的Mg(OH)2等积垢需要定期清理
7 关于铁生锈的机理有人提出如下4个步骤:①Fe-2e-===Fe2+;②H++e-===H;③4H+O2===2H2O;④4Fe2++O2+(4+2x)H2O===2(Fe2O3·xH2O)+8H+,试回答下列问题。
(1) 根据以上机理,判断下列说法正确的是________(填字母,下同)。
A. 以上锈蚀过程发生的是化学腐蚀
B. 从锈蚀反应的最终结果看,水既是氧化剂,又是还原剂
C. 反应的实质是氧气被还原,金属铁被氧化
D. 从反应机理看,锈蚀过程发生的是析氢腐蚀
(2) 某铁件需长期浸于水下,为了减少腐蚀,可采取的措施是________。
A. 给铁件铆上一些锌板
B. 给铁件通入直流电,把铁件与电源正极连接
C. 在制造铁件时,在铁中掺入一定比例的铜制成合金
D. 在铁件表面涂上一层较厚的沥青
(3) 质量为1 000 g的某铁件已在水下生锈,若已知整个锈蚀过程中有6 mol电子发生转移,则参加反应的O2在标准状况下的体积为________L,生锈后铁件的质量为________g(已知铁锈Fe2O3·xH2O中x的值为1)。
8 钢铁工业是国家工业的基础,请回答钢铁腐蚀与防护过程中的有关问题。
(1) 生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式为_______________________________。
(2) 下列可防止铁棒被腐蚀的装置有____________(填字母)。
A B C D
(3) 在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置如图所示。
①A电极对应的金属是________(填元素名称),B电极的电极反应式是______________________。
②若电镀前A、B两个金属片的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为________mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因:___________
____________________________________________________________________________________________________________________________________________。
第三节 金属的腐蚀与防护
1 C 该装置为原电池,过程中化学能转化为电能,A错误;将钢铁闸门与电源的负极相连才能起到保护作用,为外加电流法,B错误;Zn作负极,电极反应式为Zn-2e-=== Zn2+,锌块质量减小,C正确;活泼性:Fe>Cu,Fe作负极,腐蚀更严重,故将金属Zn换成金属Cu不能起到保护作用,D错误。
2 C 若X为碳棒,开关K置于A处时,Fe作阴极,为外加电流法,可减缓铁的腐蚀,A正确;若X为锌棒,开关K置于A处时,分析同选项A,开关K置于B处时,形成原电池,Fe作正极,为牺牲阳极法,可减缓铁的腐蚀,B正确,C错误;若X为碳棒,开关K置于B处时,形成原电池,Fe作负极,腐蚀加剧,铁电极未被保护,D正确。
3 C 通电时,该装置为外加电流法,C错误。
4 C 根据装置图判断,左边铁片发生吸氧腐蚀,右边铁片发生析氢腐蚀。左边,负极:Fe-2e-===Fe2+,正极:O2+4e-+2H2O===4OH-;右边,负极:Fe-2e-===Fe2+,正极:2H++2e-===H2↑。a、b处的溶液pH均增大,C错误。
5 D
6 D 根据题干信息分析知,阳极区海水中的Cl-会优先失电子生成Cl2,发生氧化反应,A正确;设置的装置为电解池原理,阳极区生成的Cl2与阴极区生成的OH-在管道中会发生反应生成NaCl、NaClO和H2O,其中NaClO具有强氧化性,可氧化灭杀附着的生物,B正确;因为H2是易燃性气体,所以阴极区生成的H2需及时通风稀释,安全地排入大气,以排除安全隐患,C正确;阴极的电极反应式为2H2O+2e-===H2↑+2OH-,会使海水中的Mg2+沉淀积垢,所以阴极表面会形成 Mg(OH)2等积垢,需要定期清理,D错误。
7 (1) C (2) AD (3) 33.6 1 066
8 (1) 2FeCl3+Fe===3FeCl2 (2) BD
(3) ①铜 Cu2++2e-===Cu ②0.08
③锌比铁活泼,铁比铜活泼,镀铜铁的镀层破损后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀,而镀锌铁的镀层破损后形成的原电池中,铁为正极,被保护
