人教版(2019)选择性必修二 第一章解读课件(40张)
文档属性
| 名称 | 人教版(2019)选择性必修二 第一章解读课件(40张) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-20 07:30:08 | ||
图片预览





文档简介
(共40张PPT)
选择性必修2
《物质结构与性质》第一章解读
自选模块(2009-2016年)
2009年:化学与生活、化学与技术
2010年:化学与生活、化学与技术
2011年:化学与生活、化学与技术
2012年:物质结构与性质、化学与技术
2013年:物质结构与性质、化学与技术
2014年:物质结构与性质、化学与技术
2015年:物质结构与性质、有机化学基础
2016年:物质结构与性质、有机化学基础
一.教科书对比(现人教版与原苏教版)
二.课标中内容要求、学业要求
三.教学内容分析
四.教学建议
现人教版 原苏教版
第 一 节 原子结构 原子核外电子的运动
一.教科书对比(现人教版与原苏教版)
1. 编写顺序
①能层与能级
(能层和能级符号表示、能量顺序)
②基态与激发态 原子光谱
③构造原理与电子排布式
(电子排布式、简化电子排布式、价层电子排布式;
科学史:离散的谱线)
④电子云与原子轨道
(s和p电子云轮廓图(形状与取向))
⑤泡利原理、洪特规则、能量最低原理(轨道表示式或电子排布图)
①人类对原子结构的认识
(卢瑟福有核模型、波尔模型、电子云;
拓展:氢原子光谱)
②原子核外电子的运动状态
(电子层、原子轨道)
③原子核外电子的排布
(电子层、原子轨道、电子自旋;
能量最低原理、泡利不相容原理、洪特规则;
原子核外电子排布的轨道能量顺序图;
电子排布式、轨道表示式、外围电子排布式;
基态、原子实;
拓展:焰火、焰色、原子发射光谱和吸收光谱)
现人教版 原苏教版
第 二 节 原子结构与元素的性质 元素性质的递变规律
①原子结构与元素周期表 1.元素周期律、元素周期系和元素周期表 (科学史话:三张有重要历史意义的周期表) 2.构造原理与元素周期表 (周期、列、族、非金属三角区、区(s区、d区、ds区、p区、f区)) ②元素周期律 1.原子半径 2.电离能 3.电负性 (科学史话:稀有气体及其化合物的发现) 回顾化学2和第一节内容:
主族元素原子核外电子排布和元素性质的周期性变化(价电子排布、化合价变化规律、金属性和非金属性变化规律、原子半径变化规律)
①核外电子排布的周期性
(周期表中区的划分)
②元素第一电离能的周期性变化
(化学史话:第一个稀有气体化合物的发现)
③元素电负性的周期性变化
一.教科书对比(现人教版与原苏教版)
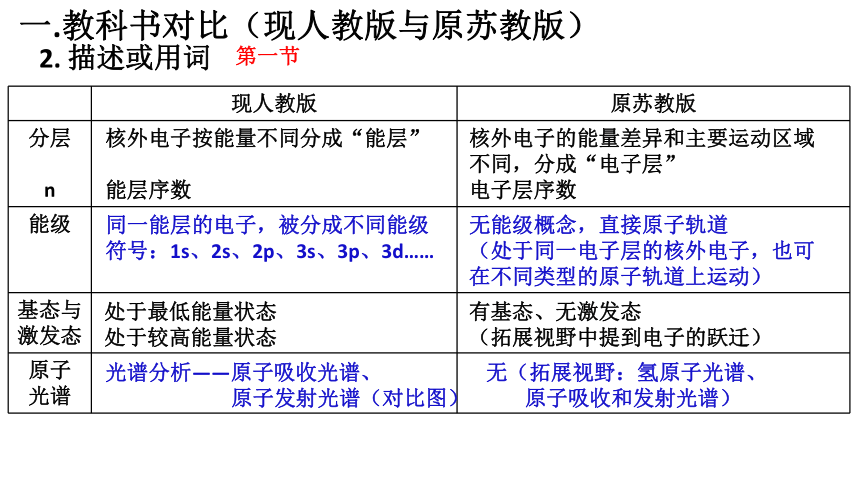
2. 描述或用词
现人教版 原苏教版
分层 n
能级
基态与激发态
原子 光谱
第一节
核外电子按能量不同分成“能层”
能层序数
核外电子的能量差异和主要运动区域不同,分成“电子层”
电子层序数
同一能层的电子,被分成不同能级
符号:1s、2s、2p、3s、3p、3d……
无能级概念,直接原子轨道
(处于同一电子层的核外电子,也可在不同类型的原子轨道上运动)
处于最低能量状态
处于较高能量状态
有基态、无激发态
(拓展视野中提到电子的跃迁)
光谱分析——原子吸收光谱、
原子发射光谱(对比图)
无(拓展视野:氢原子光谱、
原子吸收和发射光谱)
一.教科书对比(现人教版与原苏教版)
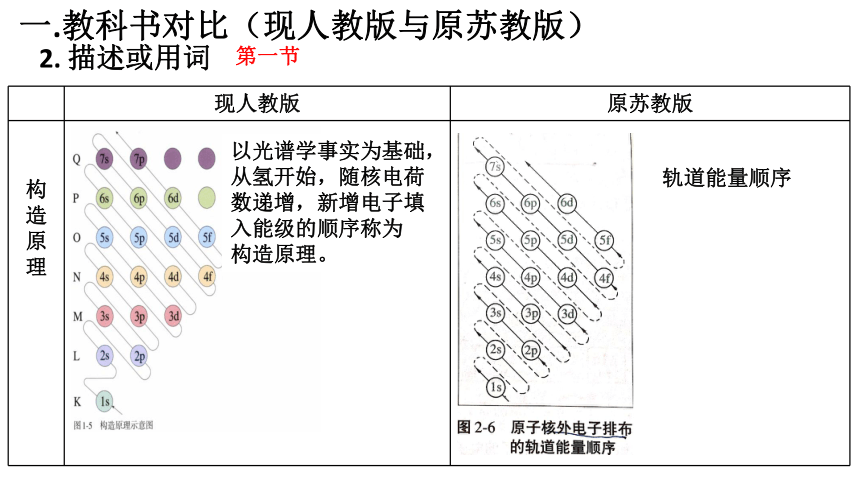
2. 描述或用词
现人教版 原苏教版
构造原理
以光谱学事实为基础,
从氢开始,随核电荷
数递增,新增电子填
入能级的顺序称为
构造原理。
轨道能量顺序
第一节
一.教科书对比(现人教版与原苏教版)
2. 描述或用词
现人教版 原苏教版
电子排布式
体现化合价与 电子排布的关系
第一节
电子排布式、简化电子排布式
两种电子排布式,未出现“简化”
二字,有“原子实”概念
价层电子
价层电子排布式
外围电子
外围电子排布式
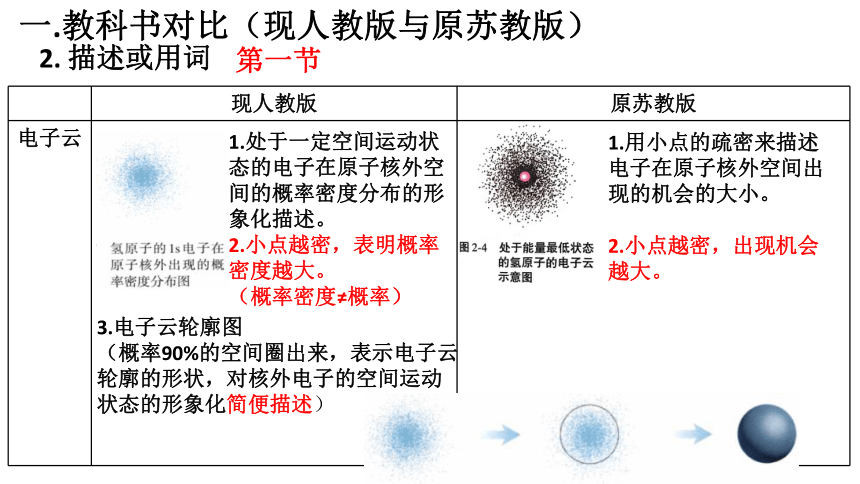
一.教科书对比(现人教版与原苏教版)
2. 描述或用词
现人教版 原苏教版
电子云
1.处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。
2.小点越密,表明概率密度越大。
(概率密度≠概率)
1.用小点的疏密来描述电子在原子核外空间出现的机会的大小。
2.小点越密,出现机会越大。
3.电子云轮廓图
(概率90%的空间圈出来,表示电子云
轮廓的形状,对核外电子的空间运动
状态的形象化简便描述)
第一节
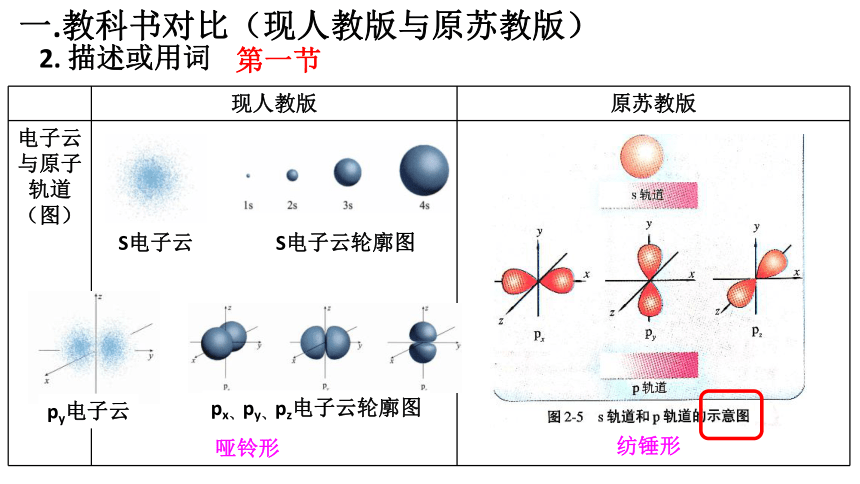
一.教科书对比(现人教版与原苏教版)
2. 描述或用词
现人教版 原苏教版
电子云
与原子轨道 (图)
哑铃形
S电子云
S电子云轮廓图
纺锤形
第一节
py电子云
px、py、pz电子云轮廓图
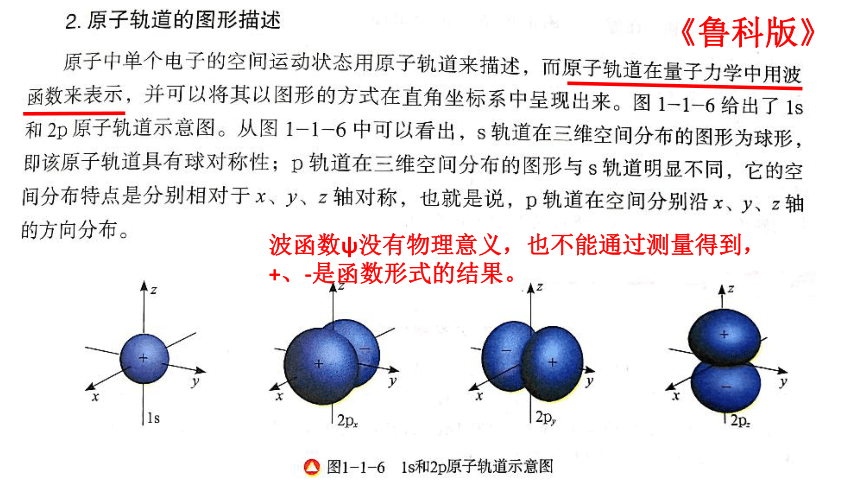
《鲁科版》
波函数ψ没有物理意义,也不能通过测量得到,
+、-是函数形式的结果。
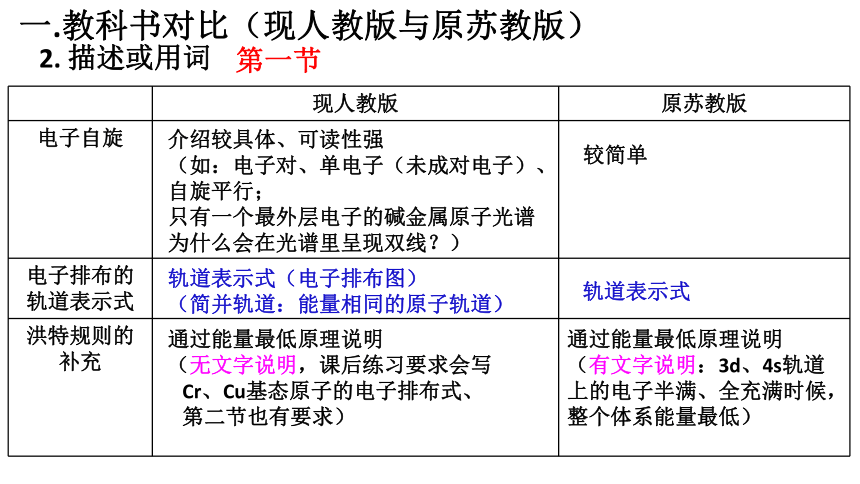
一.教科书对比(现人教版与原苏教版)
2. 描述或用词
现人教版 原苏教版
电子自旋
电子排布的轨道表示式
洪特规则的补充
第一节
介绍较具体、可读性强
(如:电子对、单电子(未成对电子)、自旋平行;
只有一个最外层电子的碱金属原子光谱为什么会在光谱里呈现双线?)
较简单
轨道表示式(电子排布图)
(简并轨道:能量相同的原子轨道)
轨道表示式
通过能量最低原理说明
(无文字说明,课后练习要求会写
Cr、Cu基态原子的电子排布式、
第二节也有要求)
通过能量最低原理说明
(有文字说明:3d、4s轨道上的电子半满、全充满时候,整个体系能量最低)
一.教科书对比(现人教版与原苏教版)
2. 描述或用词
现人教版 原苏教版
元素周期系 元素周期系只有1个,元素周期表可以有多种多样 无
三张有重要意义的周期表 门捷列夫周期表、维尔纳的特长式周期表、玻尔元素周期表 无
半金属或类金属 处于非金属与金属分界线上的元素 无
对角线规则 某些主族元素与 右下方的主族元素 的有些性质相似 无
原子半径的周期性变化 得出结论、原因分析(影响原子半径大小的因素) 回忆结论
第二节
二.课标中内容要求、学业要求
【内容要求】
1.1 原子核外电子的运动状态
了解有关核外电子运动模型的历史发展过程,认识核外电子的运动特点。知道电子运动的能量状态具有量子化的特征(能量不连续),电子可以处于不同的能级,在一定条件下会发生激发与跃迁。知道电子的运动状态(空间分布及能量)可通过原子轨道和电子云模型来描述。
1.2 核外电子排布规律
知道原子核外电子的能级高低顺序,了解原子核外电子排布的构造原理,认识基态原子中核外电子的排布遵循能量最低原理、泡利不相容原理和洪特规则等。知道1~36号元素基态原子核外电子的排布。
1.3 核外电子排布与元素周期律(表)
认识元素的原子半径、第一电离能、电负性等元素性质的周期性变化,知道原子核外电子排布呈现周期性变化是导致元素性质周期性变化的原因。知道元素周期表中分区、周期和族的元素原子核外电子排布特征,了解元素周期律(表)的应用价值。
二.课标中内容要求、学业要求
【学业要求】
能说明微观粒子的运动状态与宏观物体运动特点的差异。
能结合能量最低原理、泡利不相容原理、洪特规则书写1~36号元素基态原子的核外电子排布式和轨道表示式,并说明含义。
能说出元素电离能、电负性的含义,能描述主族元素第一电离能、电负性变化的一般规律,能从电子排布的角度对这一规律进行解释。能说明电负性大小与原子在化合物中吸引电子能力的关系,能利用电负性判断元素的金属性与非金属性的强弱,推测化学键的极性。
能从原子价电子数目和价电子排布的角度解释元素周期表的分区、周期和族的划分。能举例元素周期律(表)的应用。
能说明构建思维模型在人类认识原子结构过程中的重要作用,能论证证据与模型建立及其发展之间的关系。能简要说明原子核外电子运动规律的理论探究对研究元素性质及其变化规律的意义。
三.教学内容分析
原子结构与性质
原子结构
元素的性质
原子核
核外
电子
运动状态
排布规律
能量状态量子化
(能层与能级;激发与跃迁;原子光谱)
核外电子运动模型发展史
电子云
构造原理
原子轨道
泡利原理
洪特规则
能量最低原理
基态原子的
核外电子排布
(1~36号元素)
元素周期律
(原子半径、电离能、电负性)
元素周期表
(周期、列、族、区、
非金属三角区)
决定
四.教学建议
1.课时分配建议
节 内容 课时建议
第一节 原子结构 能层与能级 基态与激发态 原子光谱 构造原理与电子排布式 电子云与原子轨道 泡利原理、洪特规则、能量最低原理 4
第二节 原子结构与元素的性质 原子结构与元素周期表 元素周期律 3
整理与提升 2
合计 9
(电离能、电负性)
四.教学建议
2.教学片断展示
(1)原子光谱
(2)电子云
(3)原子轨道
(4)电离能
(5)电负性
环节1:观察并分析常见的光现象
播放视频——常见的光现象的,如:焰火、霓虹灯、激光、荧光、LED灯光等。
提问:这些发光现象的本质原因?
学生交流讨论
环节2:认识原子光谱的形成原理
分析原子光谱形成的示意图
学生聆听与理解相关概念
能级之间的跃迁,吸收或释放的光的波长是
一定的,可以计算的,原子的能级是量子化的。
任务1:认识原子光谱
环节3:比较两种原子光谱
比较发射光谱和吸收光谱的联系
小组合作,比较、交流,分析原因
发射光谱——线状谱,由暗背景和不连续的彩色亮线组成
吸收光谱——现状谱和连续彩色谱的叠加,由彩色亮背景和不连续的暗线组成
环节4:交流原子光谱的应用
播放视频——氢、汞、氮、氦等原子的线状谱。
思考与讨论
特征谱线——判断元素(定性分析);谱线强度——元素含量(定量分析)
任务1:认识原子光谱
某些波长的光被释放
来自光源
某些波长的光被吸收
就像人的指纹一样
同种元素发射光谱中的彩色亮线和吸收光谱中的暗线处于相同位置
任务2:认识电子云
环节1:了解玻尔氢原子模型
播放视频——玻尔氢原子模型
交流:1.玻尔氢原子模型的进步
2.玻尔氢原子模型的缺陷
学生交流讨论
环节2:认识电子云
播放视频——氢原子的电子云
学生观察思考
电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的
形象化描述。
比较:1.概率与概率密度
2.电子云与电子云轮廓图
3.s、p电子云及电子云轮廓图的形状和方向;
从能量、空间扩展等角度比较不同能层s、p电子云
定态假设:假设氢原子核外电子运动时具有一定的、
不变的能量,不会释放能量的状态。
量子化条件:氢原子核外电子的轨道不连续
跃迁规则:基态与激发态之间
大胆假定光谱来源是核外电子的能量变化
行星模型(新量子力学证明不存在)
只能解释氢原子光谱
形象化的简便描述
任务3:认识原子轨道
环节1:初识原子轨道
提出原子轨道的概念
电子在原子核外的一个空间运动状态
播放视频——不同的原子轨道(三维)或展示实物模型
学生观看、交流
比较:电子云与原子轨道
每个原子轨道对应每个空间状态不同的电子云
环节2:再识原子轨道
比较不同能层的能级、原子轨道及电子云轮廓图
学生交流讨论
说出不同能层的能级、原子轨道数、原子轨道名称、
电子云轮廓图的形状和取向
任务4:探究电离能周期性变化的规律
1.明确概念:第一电离能、逐级电离能
2.探究第一电离能随核电荷数递增出现周期性变化的原因
(1)会读图(规律与反常)
(2)会分析(原子结构入手)
3.第2、3周期,同周期第一电离能曲线呈现锯齿状变化的原因分析
(1)B、Al两个锯齿状分析
(2)O、S两个锯齿状分析
4.碱金属的电离能与碱金属活泼性之间的联系
5.同一原子的逐级电离能越来越大的原因
6.电离能与元素化合价之间的联系
B:2s22p1、Al:3s23p1,I1分别失去np能级的电子,
np能级的能量比左边的ns能级高,故更容易失去
解释1:N:2s22p3、P:3s23p3,半充满,较稳定
解释2:O:2s22p4、S:3s23p4失去已配对电子,配对
电子相互排斥,因此容易失去
耦合,谁为主?
任务5:探究电负性周期性变化的规律
1.明确概念:电负性
2.探究电负性随核电荷数递增出现周期性变化的原因
(1)会读表(规律与反常)
(2)会分析(原子结构入手)
3.电负性的应用
判断金属、非金属(类金属),比较金属性、非金属性强弱
判断化学键的极性、化学键的类别
4.比较原子半径、第一电离能、电负性的变化趋势,分析原因。
角度:原子半径
四.教学建议
3.易错点分析
(1)能层、能级、原子轨道的概念与理解
(2)构造原理中电子填入顺序,不等于轨道能级高低顺序
(3)p区元素基态原子的的简化电子排布式
(4)洪特规则及补充
(5)基态离子的电子排布式和轨道表示式
(6)原子半径周期性变化的原因分析
(7) Li—Ne和Na—Ar的第一电离能曲线呈现锯齿状变化的
原因分析(B、Al、O、S等元素的第一电离的异常分析)
(8)电负性的周期性变化
(1)能层、能级、原子轨道的概念与理解
例:1. Cl原子核外电子能量最高的电子所在的能级是_____。
2. 基态Si原子中,核外电子占据最高能层的符号为____,
该能层上有___个能级,电子数为____。
3p
M
3
4
3.某元素的原子序数为33,该元素原子核外有___个能层,
___个能级,___个原子轨道,有___个单电子,有 种
运动状态不同的电子。
4
3
18
8
4.氢原子中只有一个电子,故氢原子只有一个轨道
×
基态原子
33
电子占据
基态原子
×
4s24p3
(2)构造原理中电子填入顺序,不等于轨道能级高低顺序
例:试比较下列能级的能量高低 (填“>”或“<”)。
①4s____3d;②6s____4f____ 5d。
<
< <
根据构造原理
氢原子(单电子体系):E(ns)=E(np)=E(nd)=E(nf)
多电子原子:E(ns)<E(np)<E(nd)<E(nf)
某一具体的基态原子
(3)p区元素基态原子的的简化电子排布式
(4)洪特规则及补充
基态Br原子
[Ar]4s24p5
价层电子排布
4s24p5
——填入简并轨道的电子总是先单独分占,且自旋平行
基态Cr原子价层电子排布式
基态Cu原子价层电子排布式
3d54s1
3d104s1
仔细考查周期表中各元素基态原子排布式,第5周期开始,
有些不符合构造原理,也不符合全满、半满规则。
尊重事实,整个原子能量最低
价层电子≠最外层电子
主族元素:价层电子=最外层电子
思维的深度与广度
[Ar]3d104s24p5
(5)基态离子的电子排布式和轨道表示式
Zn2+基态核外电子排布式为 ;
Cr3+基态核外电子排布式为 。
[Ar]3d10
[Ar]3d3
[Ar]3d84s2
[Ar]3d14s2
例:某元素正二价离子的最外层电子排布为3d9,则该原子序数为 ,该元素基态原子的电子排布式 。
29
[Ar]3d104s1
大多数电中性基态原子、思维模型、经验规则、实事求是
基态Ca原子
[Ar]4s2
基态Ti2+离子
[Ar]3d2
1.构造原理中电子填入顺序,
不等于轨道能级高低顺序
2.笼统——能量最低原理
3.本质——
4.分析——Ti2+比Ca核电荷大,原子核对电子的吸引力
为主导,电子填入能层低的轨道使能量更低
(5)基态离子的电子排布式和轨道表示式
思
维
进
阶
整个原子的能量取决于两个因素:
原子核对电子的吸引力和电子之间的排斥力。
基态Cu+原子
[Ar]3d10
基态Ni原子
[Ar]3d84s2
谁为主?
为什么?(不拓展)
(6)原子半径周期性变化的原因分析
(7) Li—Ne和Na—Ar的第一电离能曲线呈现锯齿状变化的原因分析(B、Al、O、S等元素的第一电离的异常分析)
(8)电负性的周期性变化
四.教学建议
源于经验的思维模型和假设过程
举例(燃烧产物、氢氧化物酸碱性、最高价含氧酸的酸性强弱等)
4.关注《思考与讨论》、《探究》栏目
——突出探究性教学特点,
素养为导向,思维进阶
四.教学建议
多种影响因素的耦合效应:电子的能层数、核电荷数
电子之间的排斥
看谁的影响大于谁,谁为主导?(矛盾的主要方面)
4.关注《思考与讨论》、《探究》栏目
——突出探究性教学特点,
素养为导向,思维进阶
结论
四.教学建议
4.关注《思考与讨论》、《探究》栏目
——突出探究性教学特点,
素养为导向,思维进阶
原因
分析
应用
四.教学建议
4.关注《思考与讨论》、《探究》栏目
——突出探究性教学特点,
素养为导向,思维进阶
再探元素周期表
【问题】回顾《必修1》第四章
结合价层电子,重新认识周期表
(周期、列、族、非金属三角区)
【解释与整理】
从原子结构入手,分析周期表
【讨论】从原子结构入手,
结合价层电子排布,
再次认识元素周期表(区)
四.教学建议
4.关注《思考与讨论》、《探究》栏目
——突出探究性教学特点,
素养为导向,思维进阶
绘制电负性变化图
比较原子半径、第一电离能、
电负性的变化趋势
分析原因
2021年真题再现
1.(全国)Si的价电子层的电子排式为__________
2.(广东)(1)基态硫原子价电子排布式为__________
(3)汞的原子序数为80,位于元素周期表第____周期第ⅡB族。
3.(河北)(1)在KH2PO4的四种组成元素各自所能形成的简单离子中,
核外电子排布相同的是________(填离子符号)。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋
状态用+1/2表示,与之相反的用-1/2表示,称为电子的自旋磁量子数。
对于基态的磷原子,其价电子自旋磁量子数的代数和为_________
4.(湖南)(1)基态硅原子最外层的电子排布图为_______
区别:基态原子/离子的电子排布式
简化电子排布式
轨道表示式(电子排布图)
基态原子/离子的价层电子的……
2016
2015
2014
(1)31Ga基态原子的核外电子排布式 。某种半导体材料由
Ga和As两种元素组成,该半导体材料的化学式是 。
(1)Cu2+的电子排布式是 。
(1)基态P原子外围电子的轨道表示式为 。与氮(N)相比,
第一电离能P N(填“=”“>”或“<”)
(5)下列有关性质的比较,正确的是 。
A.第一电离能:O>N B.水溶性:CH3CH2OH>CH3CH2OCH2CH3
C.沸点:HCl>HF D.晶格能:NaCl>MgO
2012
(1)可正确表示原子轨道的是
A.2s B.2d C.3px D. 3f
(2)写出基态镓原子的电子排布式
(5)第一电离能的大小:Mg Al
2013
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
电离能 I1 I2 I3 I4 ……
Ia/ kJ·mol-1 578 1817 2745 11578 ……
则该元素是 (填写元素符号)。
(2)基态Ge原子的电子排布式是 。Ge的最高价氯化物分子式
是 。该元素可能的性质或应用有 。
A. 是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
电子云为什么不是电子在核外出现的概率?
概率密度是概率的密度,就是在单位空间(体积)内出现的概率。
1s电子云中点的疏密表示电子在某一位置出现机会的多少
选择性必修2
《物质结构与性质》第一章解读
自选模块(2009-2016年)
2009年:化学与生活、化学与技术
2010年:化学与生活、化学与技术
2011年:化学与生活、化学与技术
2012年:物质结构与性质、化学与技术
2013年:物质结构与性质、化学与技术
2014年:物质结构与性质、化学与技术
2015年:物质结构与性质、有机化学基础
2016年:物质结构与性质、有机化学基础
一.教科书对比(现人教版与原苏教版)
二.课标中内容要求、学业要求
三.教学内容分析
四.教学建议
现人教版 原苏教版
第 一 节 原子结构 原子核外电子的运动
一.教科书对比(现人教版与原苏教版)
1. 编写顺序
①能层与能级
(能层和能级符号表示、能量顺序)
②基态与激发态 原子光谱
③构造原理与电子排布式
(电子排布式、简化电子排布式、价层电子排布式;
科学史:离散的谱线)
④电子云与原子轨道
(s和p电子云轮廓图(形状与取向))
⑤泡利原理、洪特规则、能量最低原理(轨道表示式或电子排布图)
①人类对原子结构的认识
(卢瑟福有核模型、波尔模型、电子云;
拓展:氢原子光谱)
②原子核外电子的运动状态
(电子层、原子轨道)
③原子核外电子的排布
(电子层、原子轨道、电子自旋;
能量最低原理、泡利不相容原理、洪特规则;
原子核外电子排布的轨道能量顺序图;
电子排布式、轨道表示式、外围电子排布式;
基态、原子实;
拓展:焰火、焰色、原子发射光谱和吸收光谱)
现人教版 原苏教版
第 二 节 原子结构与元素的性质 元素性质的递变规律
①原子结构与元素周期表 1.元素周期律、元素周期系和元素周期表 (科学史话:三张有重要历史意义的周期表) 2.构造原理与元素周期表 (周期、列、族、非金属三角区、区(s区、d区、ds区、p区、f区)) ②元素周期律 1.原子半径 2.电离能 3.电负性 (科学史话:稀有气体及其化合物的发现) 回顾化学2和第一节内容:
主族元素原子核外电子排布和元素性质的周期性变化(价电子排布、化合价变化规律、金属性和非金属性变化规律、原子半径变化规律)
①核外电子排布的周期性
(周期表中区的划分)
②元素第一电离能的周期性变化
(化学史话:第一个稀有气体化合物的发现)
③元素电负性的周期性变化
一.教科书对比(现人教版与原苏教版)
2. 描述或用词
现人教版 原苏教版
分层 n
能级
基态与激发态
原子 光谱
第一节
核外电子按能量不同分成“能层”
能层序数
核外电子的能量差异和主要运动区域不同,分成“电子层”
电子层序数
同一能层的电子,被分成不同能级
符号:1s、2s、2p、3s、3p、3d……
无能级概念,直接原子轨道
(处于同一电子层的核外电子,也可在不同类型的原子轨道上运动)
处于最低能量状态
处于较高能量状态
有基态、无激发态
(拓展视野中提到电子的跃迁)
光谱分析——原子吸收光谱、
原子发射光谱(对比图)
无(拓展视野:氢原子光谱、
原子吸收和发射光谱)
一.教科书对比(现人教版与原苏教版)
2. 描述或用词
现人教版 原苏教版
构造原理
以光谱学事实为基础,
从氢开始,随核电荷
数递增,新增电子填
入能级的顺序称为
构造原理。
轨道能量顺序
第一节
一.教科书对比(现人教版与原苏教版)
2. 描述或用词
现人教版 原苏教版
电子排布式
体现化合价与 电子排布的关系
第一节
电子排布式、简化电子排布式
两种电子排布式,未出现“简化”
二字,有“原子实”概念
价层电子
价层电子排布式
外围电子
外围电子排布式
一.教科书对比(现人教版与原苏教版)
2. 描述或用词
现人教版 原苏教版
电子云
1.处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。
2.小点越密,表明概率密度越大。
(概率密度≠概率)
1.用小点的疏密来描述电子在原子核外空间出现的机会的大小。
2.小点越密,出现机会越大。
3.电子云轮廓图
(概率90%的空间圈出来,表示电子云
轮廓的形状,对核外电子的空间运动
状态的形象化简便描述)
第一节
一.教科书对比(现人教版与原苏教版)
2. 描述或用词
现人教版 原苏教版
电子云
与原子轨道 (图)
哑铃形
S电子云
S电子云轮廓图
纺锤形
第一节
py电子云
px、py、pz电子云轮廓图
《鲁科版》
波函数ψ没有物理意义,也不能通过测量得到,
+、-是函数形式的结果。
一.教科书对比(现人教版与原苏教版)
2. 描述或用词
现人教版 原苏教版
电子自旋
电子排布的轨道表示式
洪特规则的补充
第一节
介绍较具体、可读性强
(如:电子对、单电子(未成对电子)、自旋平行;
只有一个最外层电子的碱金属原子光谱为什么会在光谱里呈现双线?)
较简单
轨道表示式(电子排布图)
(简并轨道:能量相同的原子轨道)
轨道表示式
通过能量最低原理说明
(无文字说明,课后练习要求会写
Cr、Cu基态原子的电子排布式、
第二节也有要求)
通过能量最低原理说明
(有文字说明:3d、4s轨道上的电子半满、全充满时候,整个体系能量最低)
一.教科书对比(现人教版与原苏教版)
2. 描述或用词
现人教版 原苏教版
元素周期系 元素周期系只有1个,元素周期表可以有多种多样 无
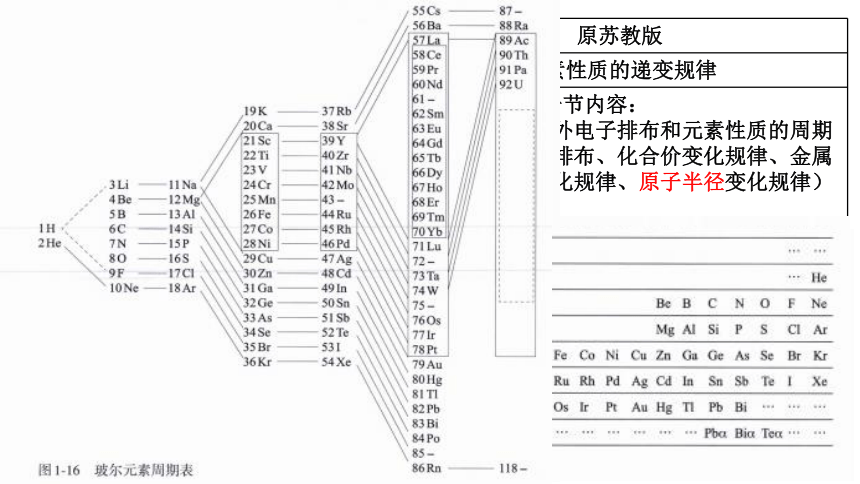
三张有重要意义的周期表 门捷列夫周期表、维尔纳的特长式周期表、玻尔元素周期表 无
半金属或类金属 处于非金属与金属分界线上的元素 无
对角线规则 某些主族元素与 右下方的主族元素 的有些性质相似 无
原子半径的周期性变化 得出结论、原因分析(影响原子半径大小的因素) 回忆结论
第二节
二.课标中内容要求、学业要求
【内容要求】
1.1 原子核外电子的运动状态
了解有关核外电子运动模型的历史发展过程,认识核外电子的运动特点。知道电子运动的能量状态具有量子化的特征(能量不连续),电子可以处于不同的能级,在一定条件下会发生激发与跃迁。知道电子的运动状态(空间分布及能量)可通过原子轨道和电子云模型来描述。
1.2 核外电子排布规律
知道原子核外电子的能级高低顺序,了解原子核外电子排布的构造原理,认识基态原子中核外电子的排布遵循能量最低原理、泡利不相容原理和洪特规则等。知道1~36号元素基态原子核外电子的排布。
1.3 核外电子排布与元素周期律(表)
认识元素的原子半径、第一电离能、电负性等元素性质的周期性变化,知道原子核外电子排布呈现周期性变化是导致元素性质周期性变化的原因。知道元素周期表中分区、周期和族的元素原子核外电子排布特征,了解元素周期律(表)的应用价值。
二.课标中内容要求、学业要求
【学业要求】
能说明微观粒子的运动状态与宏观物体运动特点的差异。
能结合能量最低原理、泡利不相容原理、洪特规则书写1~36号元素基态原子的核外电子排布式和轨道表示式,并说明含义。
能说出元素电离能、电负性的含义,能描述主族元素第一电离能、电负性变化的一般规律,能从电子排布的角度对这一规律进行解释。能说明电负性大小与原子在化合物中吸引电子能力的关系,能利用电负性判断元素的金属性与非金属性的强弱,推测化学键的极性。
能从原子价电子数目和价电子排布的角度解释元素周期表的分区、周期和族的划分。能举例元素周期律(表)的应用。
能说明构建思维模型在人类认识原子结构过程中的重要作用,能论证证据与模型建立及其发展之间的关系。能简要说明原子核外电子运动规律的理论探究对研究元素性质及其变化规律的意义。
三.教学内容分析
原子结构与性质
原子结构
元素的性质
原子核
核外
电子
运动状态
排布规律
能量状态量子化
(能层与能级;激发与跃迁;原子光谱)
核外电子运动模型发展史
电子云
构造原理
原子轨道
泡利原理
洪特规则
能量最低原理
基态原子的
核外电子排布
(1~36号元素)
元素周期律
(原子半径、电离能、电负性)
元素周期表
(周期、列、族、区、
非金属三角区)
决定
四.教学建议
1.课时分配建议
节 内容 课时建议
第一节 原子结构 能层与能级 基态与激发态 原子光谱 构造原理与电子排布式 电子云与原子轨道 泡利原理、洪特规则、能量最低原理 4
第二节 原子结构与元素的性质 原子结构与元素周期表 元素周期律 3
整理与提升 2
合计 9
(电离能、电负性)
四.教学建议
2.教学片断展示
(1)原子光谱
(2)电子云
(3)原子轨道
(4)电离能
(5)电负性
环节1:观察并分析常见的光现象
播放视频——常见的光现象的,如:焰火、霓虹灯、激光、荧光、LED灯光等。
提问:这些发光现象的本质原因?
学生交流讨论
环节2:认识原子光谱的形成原理
分析原子光谱形成的示意图
学生聆听与理解相关概念
能级之间的跃迁,吸收或释放的光的波长是
一定的,可以计算的,原子的能级是量子化的。
任务1:认识原子光谱
环节3:比较两种原子光谱
比较发射光谱和吸收光谱的联系
小组合作,比较、交流,分析原因
发射光谱——线状谱,由暗背景和不连续的彩色亮线组成
吸收光谱——现状谱和连续彩色谱的叠加,由彩色亮背景和不连续的暗线组成
环节4:交流原子光谱的应用
播放视频——氢、汞、氮、氦等原子的线状谱。
思考与讨论
特征谱线——判断元素(定性分析);谱线强度——元素含量(定量分析)
任务1:认识原子光谱
某些波长的光被释放
来自光源
某些波长的光被吸收
就像人的指纹一样
同种元素发射光谱中的彩色亮线和吸收光谱中的暗线处于相同位置
任务2:认识电子云
环节1:了解玻尔氢原子模型
播放视频——玻尔氢原子模型
交流:1.玻尔氢原子模型的进步
2.玻尔氢原子模型的缺陷
学生交流讨论
环节2:认识电子云
播放视频——氢原子的电子云
学生观察思考
电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的
形象化描述。
比较:1.概率与概率密度
2.电子云与电子云轮廓图
3.s、p电子云及电子云轮廓图的形状和方向;
从能量、空间扩展等角度比较不同能层s、p电子云
定态假设:假设氢原子核外电子运动时具有一定的、
不变的能量,不会释放能量的状态。
量子化条件:氢原子核外电子的轨道不连续
跃迁规则:基态与激发态之间
大胆假定光谱来源是核外电子的能量变化
行星模型(新量子力学证明不存在)
只能解释氢原子光谱
形象化的简便描述
任务3:认识原子轨道
环节1:初识原子轨道
提出原子轨道的概念
电子在原子核外的一个空间运动状态
播放视频——不同的原子轨道(三维)或展示实物模型
学生观看、交流
比较:电子云与原子轨道
每个原子轨道对应每个空间状态不同的电子云
环节2:再识原子轨道
比较不同能层的能级、原子轨道及电子云轮廓图
学生交流讨论
说出不同能层的能级、原子轨道数、原子轨道名称、
电子云轮廓图的形状和取向
任务4:探究电离能周期性变化的规律
1.明确概念:第一电离能、逐级电离能
2.探究第一电离能随核电荷数递增出现周期性变化的原因
(1)会读图(规律与反常)
(2)会分析(原子结构入手)
3.第2、3周期,同周期第一电离能曲线呈现锯齿状变化的原因分析
(1)B、Al两个锯齿状分析
(2)O、S两个锯齿状分析
4.碱金属的电离能与碱金属活泼性之间的联系
5.同一原子的逐级电离能越来越大的原因
6.电离能与元素化合价之间的联系
B:2s22p1、Al:3s23p1,I1分别失去np能级的电子,
np能级的能量比左边的ns能级高,故更容易失去
解释1:N:2s22p3、P:3s23p3,半充满,较稳定
解释2:O:2s22p4、S:3s23p4失去已配对电子,配对
电子相互排斥,因此容易失去
耦合,谁为主?
任务5:探究电负性周期性变化的规律
1.明确概念:电负性
2.探究电负性随核电荷数递增出现周期性变化的原因
(1)会读表(规律与反常)
(2)会分析(原子结构入手)
3.电负性的应用
判断金属、非金属(类金属),比较金属性、非金属性强弱
判断化学键的极性、化学键的类别
4.比较原子半径、第一电离能、电负性的变化趋势,分析原因。
角度:原子半径
四.教学建议
3.易错点分析
(1)能层、能级、原子轨道的概念与理解
(2)构造原理中电子填入顺序,不等于轨道能级高低顺序
(3)p区元素基态原子的的简化电子排布式
(4)洪特规则及补充
(5)基态离子的电子排布式和轨道表示式
(6)原子半径周期性变化的原因分析
(7) Li—Ne和Na—Ar的第一电离能曲线呈现锯齿状变化的
原因分析(B、Al、O、S等元素的第一电离的异常分析)
(8)电负性的周期性变化
(1)能层、能级、原子轨道的概念与理解
例:1. Cl原子核外电子能量最高的电子所在的能级是_____。
2. 基态Si原子中,核外电子占据最高能层的符号为____,
该能层上有___个能级,电子数为____。
3p
M
3
4
3.某元素的原子序数为33,该元素原子核外有___个能层,
___个能级,___个原子轨道,有___个单电子,有 种
运动状态不同的电子。
4
3
18
8
4.氢原子中只有一个电子,故氢原子只有一个轨道
×
基态原子
33
电子占据
基态原子
×
4s24p3
(2)构造原理中电子填入顺序,不等于轨道能级高低顺序
例:试比较下列能级的能量高低 (填“>”或“<”)。
①4s____3d;②6s____4f____ 5d。
<
< <
根据构造原理
氢原子(单电子体系):E(ns)=E(np)=E(nd)=E(nf)
多电子原子:E(ns)<E(np)<E(nd)<E(nf)
某一具体的基态原子
(3)p区元素基态原子的的简化电子排布式
(4)洪特规则及补充
基态Br原子
[Ar]4s24p5
价层电子排布
4s24p5
——填入简并轨道的电子总是先单独分占,且自旋平行
基态Cr原子价层电子排布式
基态Cu原子价层电子排布式
3d54s1
3d104s1
仔细考查周期表中各元素基态原子排布式,第5周期开始,
有些不符合构造原理,也不符合全满、半满规则。
尊重事实,整个原子能量最低
价层电子≠最外层电子
主族元素:价层电子=最外层电子
思维的深度与广度
[Ar]3d104s24p5
(5)基态离子的电子排布式和轨道表示式
Zn2+基态核外电子排布式为 ;
Cr3+基态核外电子排布式为 。
[Ar]3d10
[Ar]3d3
[Ar]3d84s2
[Ar]3d14s2
例:某元素正二价离子的最外层电子排布为3d9,则该原子序数为 ,该元素基态原子的电子排布式 。
29
[Ar]3d104s1
大多数电中性基态原子、思维模型、经验规则、实事求是
基态Ca原子
[Ar]4s2
基态Ti2+离子
[Ar]3d2
1.构造原理中电子填入顺序,
不等于轨道能级高低顺序
2.笼统——能量最低原理
3.本质——
4.分析——Ti2+比Ca核电荷大,原子核对电子的吸引力
为主导,电子填入能层低的轨道使能量更低
(5)基态离子的电子排布式和轨道表示式
思
维
进
阶
整个原子的能量取决于两个因素:
原子核对电子的吸引力和电子之间的排斥力。
基态Cu+原子
[Ar]3d10
基态Ni原子
[Ar]3d84s2
谁为主?
为什么?(不拓展)
(6)原子半径周期性变化的原因分析
(7) Li—Ne和Na—Ar的第一电离能曲线呈现锯齿状变化的原因分析(B、Al、O、S等元素的第一电离的异常分析)
(8)电负性的周期性变化
四.教学建议
源于经验的思维模型和假设过程
举例(燃烧产物、氢氧化物酸碱性、最高价含氧酸的酸性强弱等)
4.关注《思考与讨论》、《探究》栏目
——突出探究性教学特点,
素养为导向,思维进阶
四.教学建议
多种影响因素的耦合效应:电子的能层数、核电荷数
电子之间的排斥
看谁的影响大于谁,谁为主导?(矛盾的主要方面)
4.关注《思考与讨论》、《探究》栏目
——突出探究性教学特点,
素养为导向,思维进阶
结论
四.教学建议
4.关注《思考与讨论》、《探究》栏目
——突出探究性教学特点,
素养为导向,思维进阶
原因
分析
应用
四.教学建议
4.关注《思考与讨论》、《探究》栏目
——突出探究性教学特点,
素养为导向,思维进阶
再探元素周期表
【问题】回顾《必修1》第四章
结合价层电子,重新认识周期表
(周期、列、族、非金属三角区)
【解释与整理】
从原子结构入手,分析周期表
【讨论】从原子结构入手,
结合价层电子排布,
再次认识元素周期表(区)
四.教学建议
4.关注《思考与讨论》、《探究》栏目
——突出探究性教学特点,
素养为导向,思维进阶
绘制电负性变化图
比较原子半径、第一电离能、
电负性的变化趋势
分析原因
2021年真题再现
1.(全国)Si的价电子层的电子排式为__________
2.(广东)(1)基态硫原子价电子排布式为__________
(3)汞的原子序数为80,位于元素周期表第____周期第ⅡB族。
3.(河北)(1)在KH2PO4的四种组成元素各自所能形成的简单离子中,
核外电子排布相同的是________(填离子符号)。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋
状态用+1/2表示,与之相反的用-1/2表示,称为电子的自旋磁量子数。
对于基态的磷原子,其价电子自旋磁量子数的代数和为_________
4.(湖南)(1)基态硅原子最外层的电子排布图为_______
区别:基态原子/离子的电子排布式
简化电子排布式
轨道表示式(电子排布图)
基态原子/离子的价层电子的……
2016
2015
2014
(1)31Ga基态原子的核外电子排布式 。某种半导体材料由
Ga和As两种元素组成,该半导体材料的化学式是 。
(1)Cu2+的电子排布式是 。
(1)基态P原子外围电子的轨道表示式为 。与氮(N)相比,
第一电离能P N(填“=”“>”或“<”)
(5)下列有关性质的比较,正确的是 。
A.第一电离能:O>N B.水溶性:CH3CH2OH>CH3CH2OCH2CH3
C.沸点:HCl>HF D.晶格能:NaCl>MgO
2012
(1)可正确表示原子轨道的是
A.2s B.2d C.3px D. 3f
(2)写出基态镓原子的电子排布式
(5)第一电离能的大小:Mg Al
2013
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
电离能 I1 I2 I3 I4 ……
Ia/ kJ·mol-1 578 1817 2745 11578 ……
则该元素是 (填写元素符号)。
(2)基态Ge原子的电子排布式是 。Ge的最高价氯化物分子式
是 。该元素可能的性质或应用有 。
A. 是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
电子云为什么不是电子在核外出现的概率?
概率密度是概率的密度,就是在单位空间(体积)内出现的概率。
1s电子云中点的疏密表示电子在某一位置出现机会的多少
