人教版(2019)选择性必修一 3.2.1 水的电离和溶液的PH 课件(30张)
文档属性
| 名称 | 人教版(2019)选择性必修一 3.2.1 水的电离和溶液的PH 课件(30张) |  | |
| 格式 | pptx | ||
| 文件大小 | 16.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-20 07:50:55 | ||
图片预览






文档简介
第二节 水的电离和溶液的PH
第三章 水溶液中的离子反应与平衡
第一课时
溶液的酸碱性与PH
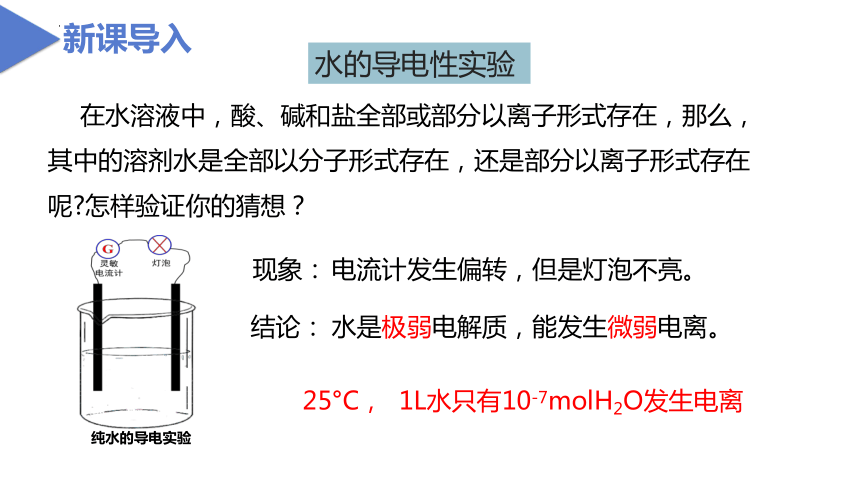
纯水的导电实验
电流计发生偏转,但是灯泡不亮。
水是极弱电解质,能发生微弱电离。
现象:
结论:
在水溶液中,酸、碱和盐全部或部分以离子形式存在,那么,其中的溶剂水是全部以分子形式存在,还是部分以离子形式存在呢?怎样验证你的猜想?
25°C, 1L水只有10-7molH2O发生电离
新课导入
水的导电性实验
01
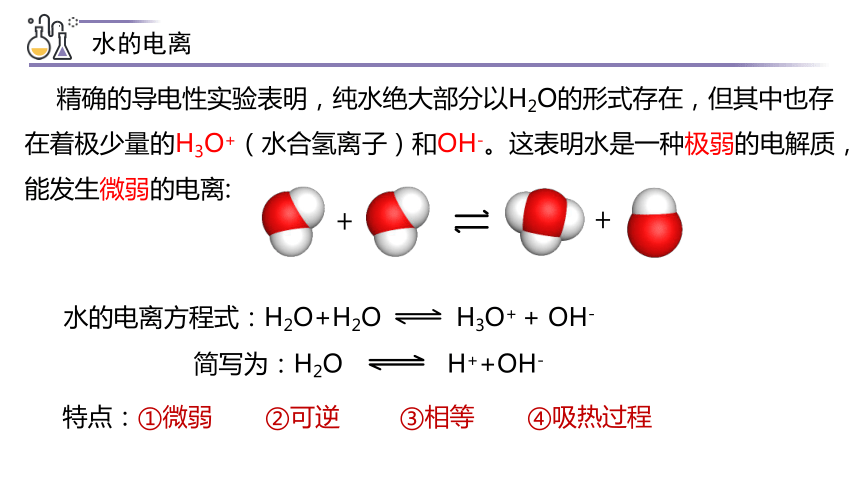
水的电离
精确的导电性实验表明,纯水绝大部分以H2O的形式存在,但其中也存在着极少量的H3O+(水合氢离子)和OH-。这表明水是一种极弱的电解质,能发生微弱的电离:
水的电离方程式:H2O+H2O H3O+ + OH-
简写为:H2O H++OH-
特点:①微弱 ②可逆 ③相等 ④吸热过程
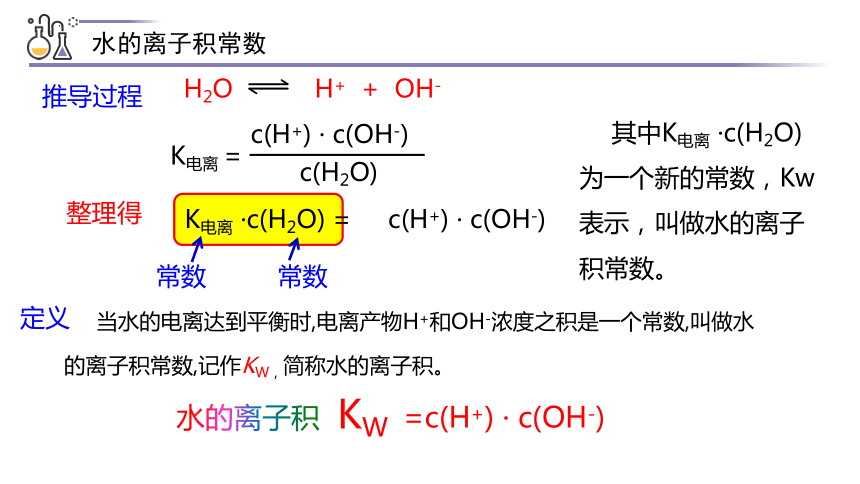
水的电离
H2O H+ + OH-
K电离 =
c(H+) · c(OH-)
c(H2O)
c(H+) · c(OH-)
K电离 ·c(H2O) =
KW
水的离子积
整理得
常数
常数
其中K电离 ·c(H2O)为一个新的常数,Kw表示,叫做水的离子积常数。
=c(H+) · c(OH-)
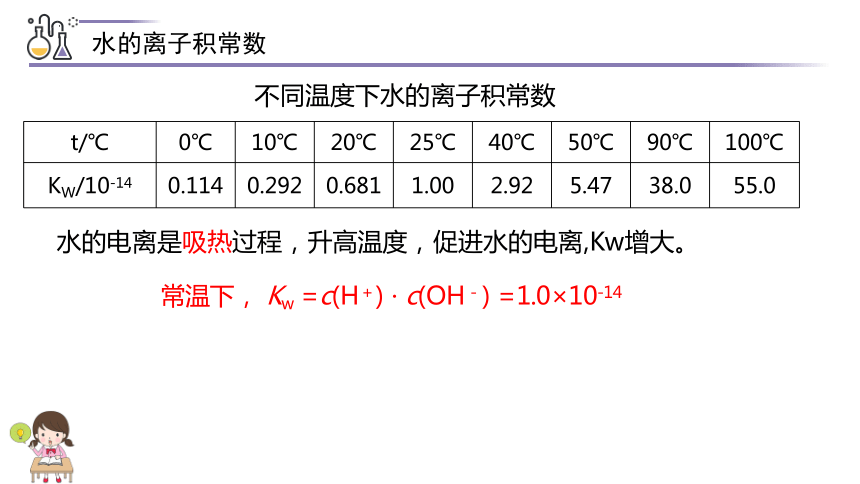
水的离子积常数
推导过程
当水的电离达到平衡时,电离产物H+和OH-浓度之积是一个常数,叫做水的离子积常数,记作KW,简称水的离子积。
定义
水的离子积常数
t/℃
0℃
10℃
20℃
25℃
40℃
50℃
90℃
100℃
KW/10-14
0.114
0.292
0.681
1.00
2.92
5.47
38.0
55.0
不同温度下水的离子积常数
水的电离是吸热过程,升高温度,促进水的电离,Kw增大。
常温下, Kw =c(H+) · c(OH-) =1.0×10-14
H2O H+ +OH-
△H>0
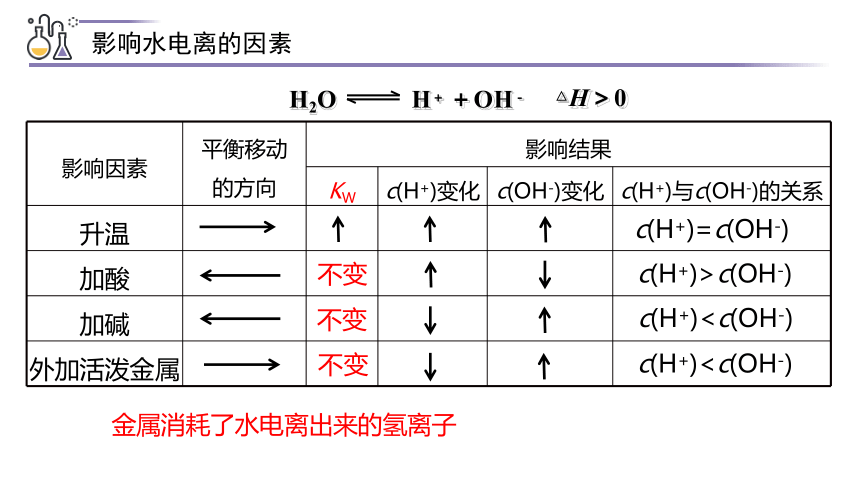
{5940675A-B579-460E-94D1-54222C63F5DA}影响因素
平衡移动
的方向
影响结果
KW
c(H+)变化
c(OH-)变化
c(H+)与c(OH-)的关系
升温
加酸
加碱
外加活泼金属
不变
不变
不变
c(H+)=c(OH-)
c(H+)c(H+)>c(OH-)
c(H+)影响水电离的因素
金属消耗了水电离出来的氢离子
(1)温度
抑制水的电离,Kw保持不变
升高温度促进水的电离,Kw增大
(2)酸
(3)碱
(4)发生化学反应
促进水的电离,Kw不变
影响水电离的因素
总结
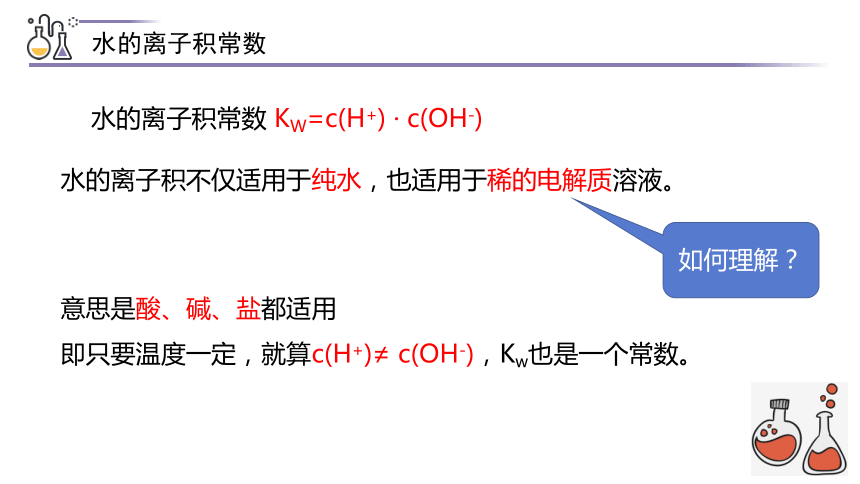
水的离子积不仅适用于纯水,也适用于稀的电解质溶液。
水的离子积常数 KW=c(H+) · c(OH-)
如何理解?
意思是酸、碱、盐都适用
即只要温度一定,就算c(H+)≠ c(OH-),Kw也是一个常数。
水的离子积常数
02
水的离子积常数的应用
常温下,浓度为0.01 mol·L-1的盐酸溶液中,由水电离的c(H+)和c(OH-)各是多少?
HCl === H+ + Cl-
(1) c(H+)
c总(H+) = c酸(H+) + c水(H+) ≈ c酸(H+) = 0.01 mol·L-1
(2) c(OH-)
稀的酸溶液
c总(OH-)=c水(OH-)
Kw=c总(H+)·c总(OH-)=c酸(H+)·c水(OH-)
Kw的应用
1、溶液中水电离出的c(H+)或c(OH-)的计算方法
常温下,浓度为0.01 mol·L-1的NaOH溶液中,由水电离的c(H+)和c(OH-)各是多少?
NaOH === Na+ + OH-
(1) c(H+)
c总(H+) = c水(H+)
(2) c(OH-)
稀的碱溶液
c总(OH-)= c碱(OH-) + c水(OH-) ≈ c碱(OH-) = 0.01 mol·L-1
Kw=c总(H+)·c总(OH-)=c水(H+)·c碱(OH-)
Kw的应用
1、溶液中水电离出的c(H+)或c(OH-)的计算方法
思考:室温下,由水电离产生的 c(H+) = 10-12 mol/L, 该溶液
是酸性还是碱性?
可能是酸性CH+ =0.01mol/L(如0.01mol/L的稀盐酸)
也可能是碱性COH- =0.01mol/L(如0.01mol/L的烧碱)
Kw的应用
1、溶液中水电离出的c(H+)或c(OH-)的计算方法
(2)曲线外的任意点(如d)与曲线上任意点的Kw_____,温度______。
(1) 曲线上的任意点(如a,b,c)的Kw都_______,即c(H+)·c(OH-)______,温度______。
(3)实现曲线上点之间的转化需保持温度不变,改变_________;实现曲线上点与曲线外点之间的转化一定改变________。
相同
不同
酸碱性
温度
相同
相同
不同
Kw的应用
2、水的电离平衡曲线的理解与识别
总结归纳
(1)酸溶液中Kw=c酸(H+)·c水(OH-) (忽略水电离出的H+的浓度)。
(2)碱溶液中Kw=c水(H+)·c碱(OH-) (忽略水电离出的OH-的浓度)。
(3)由水电离出的c(H+)与水电离出的c(OH-)一定相等。
Kw的应用
03
溶液的酸碱性与PH
如何判断溶液酸碱性?
根据常温时水的电离平衡,运用平衡移动原理分析下列问题。
H2O ? H++OH-, Kw =c(H+) · c(OH-) =1.0×10-14
?
溶液的酸碱性
思考与讨论
25℃时,纯水电离出的c(H+)=_____________mol/L,
c(OH-)=____________mol/L。
1×10-7
1×10-7
(2)比较下列情况,溶液中c(H+)、c(OH-)的值或变化趋势(增大或减小)?
{5940675A-B579-460E-94D1-54222C63F5DA}体系
纯水
向纯水中加盐酸
向纯水中加NaOH
c(H+)
c(OH-)
c(H+)和c(OH-)大小
酸碱性
10-7 mol·L-1
10-7 mol·L-1
增大
减小
减小
增大
中性
酸性
碱性
(1)酸性溶液中是否存在OH-?碱性溶液中是否存在H+?
c(H+) = c(OH-)
溶液的酸碱性
思考与讨论
1、酸性溶液:c(H+)_____c(OH-)
2、中性溶液:c(H+)_____c(OH-)
3、碱性溶液:c(H+)_____c(OH-)
>
=
<
判断溶液酸、碱性,只能通过比较c(H+)和c(OH-)的相对大小!
溶液的酸碱性
溶液的酸碱性与c(H+) 、c(OH-)的关系
表达式:pH= -lg c(H+)
溶液的酸碱性与pH的关系
(25 ℃)
溶液呈酸性: c(H+)>10-7 ,pH<7
溶液呈中性: c(H+)= 10-7 ,pH= 7
溶液呈碱性: c(H+)<10-7 ,pH>7
pH的意义与适用范围
①pH越小,溶液酸性越强;pH越大,溶液碱性越强。(pH的范围通常是 0~14)
②当c(H+)或c(OH-)<1 mol/L时用pH表示酸碱性比较方便。
③当c(H+)或c(OH-)≧1 mol/L时直接用它们的浓度表示酸碱性。
溶液的酸碱性与PH
溶液的PH值
【思考1】pH=7的溶液一定呈中性吗?
判断溶液酸碱性的唯一标准是溶液中c(H+)和c(OH-)的相对大小,
不应看pH大小,只有满足c(H+)=c(OH-)的溶液才一定呈中性。
【思考2】100 ℃时,KW =1.0×10-12,pH=7的溶液酸碱性如何?
不一定。在25 ℃时,pH=7的溶液才呈中性。
c(H+)= 10-7
pH=7
c(OH-)= 10-5
溶液的酸碱性与PH
1、利用pH试纸测定
(1)pH试纸分类
广泛pH试纸
精密pH试纸
精度 :读整数
精度 :读至小数点后1位
PH的测定
(2) 使用方法:
取一张pH试纸放在干燥洁净的玻璃片(表面皿)上,用干燥洁净的玻璃棒蘸取待测液点在试纸中央,当试纸变色稳定后立即与标准比色卡对照,读出pH。
1、利用pH试纸测定
PH的测定
(3)使用注意事项
①不能用水湿润
②不能把pH试纸插入待测液
③广泛PH试纸读数为整数
④不能测有色溶液、漂白性、强氧化性溶液的pH
1、利用pH试纸测定
PH的测定
pH计,又叫酸度计,可用来精密测量溶液的pH(读至小数点后2位),其量程为0~14。
2、利用pH计测定
PH的测定
PH的测试和调控的意义
工农业生产和科学实验中常常涉及溶液的酸碱性,人们的生活和健康也与溶液的酸碱性有密切关系。因此,测试和调控溶液的pH,对工农业生产、科学研究,以及日常生活和医疗保健等都具有重要意义。
1.人体健康调节:人体的生理活动要在一定的pH范围内才能正常进行。
1 2 3 4 5 6 7 8 9 10 11 12 13 14 pH
胃液
0.9-1.5
唾液
6.6-7.1
血浆
7.35-7.45
尿液
4.7-8.4
小肠液
约7.6
PH的测试和调控的意义
2.日常生活:洗发时的护发素可以调节头发的pH使之达到适宜的酸碱度
PH的测试和调控的意义
3.农业生产调节:各种农作物的生长都对土壤的pH范围有一定的要求。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}作物
pH
作物
pH
水稻
5.5~7.0
洋葱
6.0~7.0
玉米
6.5~7.5
西瓜
6.0~7.0
棉花
6.0~6.8
柑橘
5.0~7.0
大豆
6.5~7.5
茶树
5.0~5.5
小麦
6.2~7.5
水仙花
6.0~6.5
PH的测试和调控的意义
4.在环保领域,酸性或碱性废水的处理常常利用中和反应,在中和处理的过程中可用pH自动测定仪进行监测和控制。
5.在科学实验和工业生产中,溶液pH的控制常常是影响实验结果或产品质量、产量的一个关键因素。
PH的测试和调控的意义
第三章 水溶液中的离子反应与平衡
第一课时
溶液的酸碱性与PH
纯水的导电实验
电流计发生偏转,但是灯泡不亮。
水是极弱电解质,能发生微弱电离。
现象:
结论:
在水溶液中,酸、碱和盐全部或部分以离子形式存在,那么,其中的溶剂水是全部以分子形式存在,还是部分以离子形式存在呢?怎样验证你的猜想?
25°C, 1L水只有10-7molH2O发生电离
新课导入
水的导电性实验
01
水的电离
精确的导电性实验表明,纯水绝大部分以H2O的形式存在,但其中也存在着极少量的H3O+(水合氢离子)和OH-。这表明水是一种极弱的电解质,能发生微弱的电离:
水的电离方程式:H2O+H2O H3O+ + OH-
简写为:H2O H++OH-
特点:①微弱 ②可逆 ③相等 ④吸热过程
水的电离
H2O H+ + OH-
K电离 =
c(H+) · c(OH-)
c(H2O)
c(H+) · c(OH-)
K电离 ·c(H2O) =
KW
水的离子积
整理得
常数
常数
其中K电离 ·c(H2O)为一个新的常数,Kw表示,叫做水的离子积常数。
=c(H+) · c(OH-)
水的离子积常数
推导过程
当水的电离达到平衡时,电离产物H+和OH-浓度之积是一个常数,叫做水的离子积常数,记作KW,简称水的离子积。
定义
水的离子积常数
t/℃
0℃
10℃
20℃
25℃
40℃
50℃
90℃
100℃
KW/10-14
0.114
0.292
0.681
1.00
2.92
5.47
38.0
55.0
不同温度下水的离子积常数
水的电离是吸热过程,升高温度,促进水的电离,Kw增大。
常温下, Kw =c(H+) · c(OH-) =1.0×10-14
H2O H+ +OH-
△H>0
{5940675A-B579-460E-94D1-54222C63F5DA}影响因素
平衡移动
的方向
影响结果
KW
c(H+)变化
c(OH-)变化
c(H+)与c(OH-)的关系
升温
加酸
加碱
外加活泼金属
不变
不变
不变
c(H+)=c(OH-)
c(H+)
c(H+)
金属消耗了水电离出来的氢离子
(1)温度
抑制水的电离,Kw保持不变
升高温度促进水的电离,Kw增大
(2)酸
(3)碱
(4)发生化学反应
促进水的电离,Kw不变
影响水电离的因素
总结
水的离子积不仅适用于纯水,也适用于稀的电解质溶液。
水的离子积常数 KW=c(H+) · c(OH-)
如何理解?
意思是酸、碱、盐都适用
即只要温度一定,就算c(H+)≠ c(OH-),Kw也是一个常数。
水的离子积常数
02
水的离子积常数的应用
常温下,浓度为0.01 mol·L-1的盐酸溶液中,由水电离的c(H+)和c(OH-)各是多少?
HCl === H+ + Cl-
(1) c(H+)
c总(H+) = c酸(H+) + c水(H+) ≈ c酸(H+) = 0.01 mol·L-1
(2) c(OH-)
稀的酸溶液
c总(OH-)=c水(OH-)
Kw=c总(H+)·c总(OH-)=c酸(H+)·c水(OH-)
Kw的应用
1、溶液中水电离出的c(H+)或c(OH-)的计算方法
常温下,浓度为0.01 mol·L-1的NaOH溶液中,由水电离的c(H+)和c(OH-)各是多少?
NaOH === Na+ + OH-
(1) c(H+)
c总(H+) = c水(H+)
(2) c(OH-)
稀的碱溶液
c总(OH-)= c碱(OH-) + c水(OH-) ≈ c碱(OH-) = 0.01 mol·L-1
Kw=c总(H+)·c总(OH-)=c水(H+)·c碱(OH-)
Kw的应用
1、溶液中水电离出的c(H+)或c(OH-)的计算方法
思考:室温下,由水电离产生的 c(H+) = 10-12 mol/L, 该溶液
是酸性还是碱性?
可能是酸性CH+ =0.01mol/L(如0.01mol/L的稀盐酸)
也可能是碱性COH- =0.01mol/L(如0.01mol/L的烧碱)
Kw的应用
1、溶液中水电离出的c(H+)或c(OH-)的计算方法
(2)曲线外的任意点(如d)与曲线上任意点的Kw_____,温度______。
(1) 曲线上的任意点(如a,b,c)的Kw都_______,即c(H+)·c(OH-)______,温度______。
(3)实现曲线上点之间的转化需保持温度不变,改变_________;实现曲线上点与曲线外点之间的转化一定改变________。
相同
不同
酸碱性
温度
相同
相同
不同
Kw的应用
2、水的电离平衡曲线的理解与识别
总结归纳
(1)酸溶液中Kw=c酸(H+)·c水(OH-) (忽略水电离出的H+的浓度)。
(2)碱溶液中Kw=c水(H+)·c碱(OH-) (忽略水电离出的OH-的浓度)。
(3)由水电离出的c(H+)与水电离出的c(OH-)一定相等。
Kw的应用
03
溶液的酸碱性与PH
如何判断溶液酸碱性?
根据常温时水的电离平衡,运用平衡移动原理分析下列问题。
H2O ? H++OH-, Kw =c(H+) · c(OH-) =1.0×10-14
?
溶液的酸碱性
思考与讨论
25℃时,纯水电离出的c(H+)=_____________mol/L,
c(OH-)=____________mol/L。
1×10-7
1×10-7
(2)比较下列情况,溶液中c(H+)、c(OH-)的值或变化趋势(增大或减小)?
{5940675A-B579-460E-94D1-54222C63F5DA}体系
纯水
向纯水中加盐酸
向纯水中加NaOH
c(H+)
c(OH-)
c(H+)和c(OH-)大小
酸碱性
10-7 mol·L-1
10-7 mol·L-1
增大
减小
减小
增大
中性
酸性
碱性
(1)酸性溶液中是否存在OH-?碱性溶液中是否存在H+?
c(H+) = c(OH-)
溶液的酸碱性
思考与讨论
1、酸性溶液:c(H+)_____c(OH-)
2、中性溶液:c(H+)_____c(OH-)
3、碱性溶液:c(H+)_____c(OH-)
>
=
<
判断溶液酸、碱性,只能通过比较c(H+)和c(OH-)的相对大小!
溶液的酸碱性
溶液的酸碱性与c(H+) 、c(OH-)的关系
表达式:pH= -lg c(H+)
溶液的酸碱性与pH的关系
(25 ℃)
溶液呈酸性: c(H+)>10-7 ,pH<7
溶液呈中性: c(H+)= 10-7 ,pH= 7
溶液呈碱性: c(H+)<10-7 ,pH>7
pH的意义与适用范围
①pH越小,溶液酸性越强;pH越大,溶液碱性越强。(pH的范围通常是 0~14)
②当c(H+)或c(OH-)<1 mol/L时用pH表示酸碱性比较方便。
③当c(H+)或c(OH-)≧1 mol/L时直接用它们的浓度表示酸碱性。
溶液的酸碱性与PH
溶液的PH值
【思考1】pH=7的溶液一定呈中性吗?
判断溶液酸碱性的唯一标准是溶液中c(H+)和c(OH-)的相对大小,
不应看pH大小,只有满足c(H+)=c(OH-)的溶液才一定呈中性。
【思考2】100 ℃时,KW =1.0×10-12,pH=7的溶液酸碱性如何?
不一定。在25 ℃时,pH=7的溶液才呈中性。
c(H+)= 10-7
pH=7
c(OH-)= 10-5
溶液的酸碱性与PH
1、利用pH试纸测定
(1)pH试纸分类
广泛pH试纸
精密pH试纸
精度 :读整数
精度 :读至小数点后1位
PH的测定
(2) 使用方法:
取一张pH试纸放在干燥洁净的玻璃片(表面皿)上,用干燥洁净的玻璃棒蘸取待测液点在试纸中央,当试纸变色稳定后立即与标准比色卡对照,读出pH。
1、利用pH试纸测定
PH的测定
(3)使用注意事项
①不能用水湿润
②不能把pH试纸插入待测液
③广泛PH试纸读数为整数
④不能测有色溶液、漂白性、强氧化性溶液的pH
1、利用pH试纸测定
PH的测定
pH计,又叫酸度计,可用来精密测量溶液的pH(读至小数点后2位),其量程为0~14。
2、利用pH计测定
PH的测定
PH的测试和调控的意义
工农业生产和科学实验中常常涉及溶液的酸碱性,人们的生活和健康也与溶液的酸碱性有密切关系。因此,测试和调控溶液的pH,对工农业生产、科学研究,以及日常生活和医疗保健等都具有重要意义。
1.人体健康调节:人体的生理活动要在一定的pH范围内才能正常进行。
1 2 3 4 5 6 7 8 9 10 11 12 13 14 pH
胃液
0.9-1.5
唾液
6.6-7.1
血浆
7.35-7.45
尿液
4.7-8.4
小肠液
约7.6
PH的测试和调控的意义
2.日常生活:洗发时的护发素可以调节头发的pH使之达到适宜的酸碱度
PH的测试和调控的意义
3.农业生产调节:各种农作物的生长都对土壤的pH范围有一定的要求。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}作物
pH
作物
pH
水稻
5.5~7.0
洋葱
6.0~7.0
玉米
6.5~7.5
西瓜
6.0~7.0
棉花
6.0~6.8
柑橘
5.0~7.0
大豆
6.5~7.5
茶树
5.0~5.5
小麦
6.2~7.5
水仙花
6.0~6.5
PH的测试和调控的意义
4.在环保领域,酸性或碱性废水的处理常常利用中和反应,在中和处理的过程中可用pH自动测定仪进行监测和控制。
5.在科学实验和工业生产中,溶液pH的控制常常是影响实验结果或产品质量、产量的一个关键因素。
PH的测试和调控的意义
