人教版(2019)选择性必修一 解读课件(69张)
文档属性
| 名称 | 人教版(2019)选择性必修一 解读课件(69张) |  | |
| 格式 | pptx | ||
| 文件大小 | 19.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-20 07:54:14 | ||
图片预览









文档简介
(共69张PPT)
化学反应原理(选择性必修1)
学科教学指导意见解读
一、模块概要及素养要求
二、教学实施建议
一、模块概要及素养要求
…………………………………………………………………………
在本课程模块中,将从化学反应与能量,化学反应的方向、限度和连率,以及水溶液中的离子反应与平衡等方面,探素化学反应的规律及其应用。通过本课程模块的学习,引导学生进一步认识化学变化所遵循的基本原理,初步形成关于物质变化的科学观念。了解化学反应中能量转化所遵循的规律,赞赏运用化学反应原理对科学技术和人类社会文明所起的重要作用,发展化学学科核心素养。
…………………………………………………………………………
模块1 化学反应原理
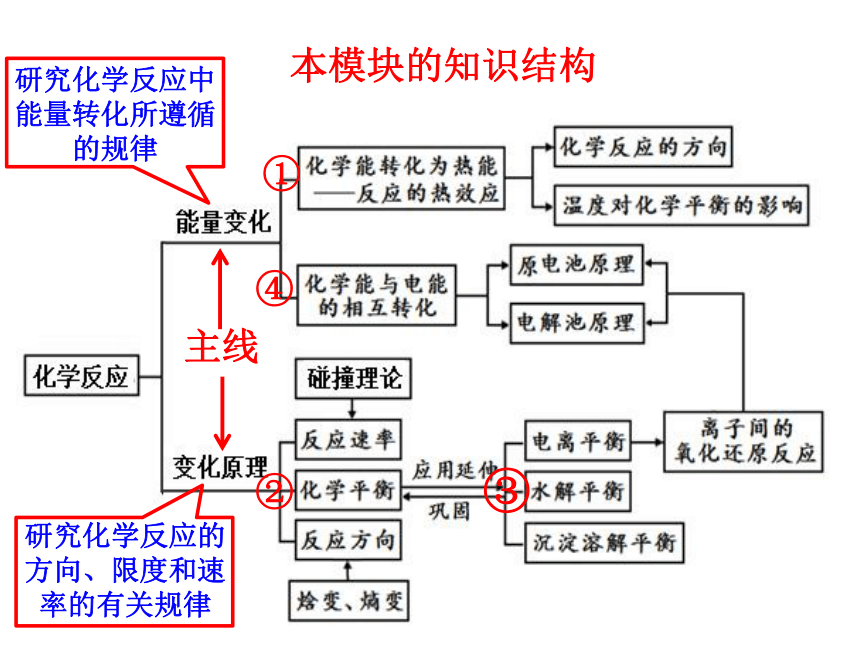
本模块的知识结构
主线
研究化学反应中能量转化所遵循的规律
①
④
②
③
研究化学反应的方向、限度和速率的有关规律
本模块在必修第二册的基础上,总结关于化学反应的一般规律,发展学生对化学反应的认识角度和认识思路。
模块的教育价值和功能
教科书的每个章节的“引言” “思考与讨论”“方法导引”“探究”“实验活动”“研究与实践”栏目、章末的“整理与提升”中都十分强调原理知识学习的认识角度、认识思路,从而建构化学反应的认识模型。
借助能量变化、反应方向、限度和速率等角度完善学生对化学反应的认识角度,提升学生对化学反应和研究方法的认识;
借助反应方向、反应调控、离子平衡等内容,从定性到定量、静态到动态、宏观到微观、孤立到系统,发展学生对化学反应认识的深度,促进学生形成化学的核心观念、知识结构和思想方法,提升学生知识关联的结构化、认识思路的结构化以及核心观念的结构化水平。
能利用真实情境,对生产、生活和自然界中的有关化学变化现象进行合理的解释,挖掘知识的多重属性及教学价值。
学科核心素养角度
认识化学变化的原理、思路与方法,形成物质变化的科学观念,体验并运用化学反应原理对科学技术和人类社会文明所起的重要作用,发展化学学科核心素养。
从化学反应的宏观现象,认识化学反应存在物质变化、能量变化、反应方向、反应速率、反应限度等问题,并进一步从微观层面理解化学反应存在能量、方向、速率、平衡等变化的原因、规律;从宏观、微观层面有效解释、预测、设计并控制化学反应的变化,发展对宏观辨识与微观探析的认识水平。
从不同视角对化学变化进行分类研究,逐步揭示各类变化的特征和规律,认识化学变化是有条件的;能用能量的观点、速率的观点和动态平衡的观点分析化学反应,预测在一定条件下某种物质可能发生的化学变化,发展对变化观念与平衡思想的认识水平。
本模块在必修第二册的基础上,总结关于化学反应的一般规律,发展学生对化学反应的认识角度和认识思路。
学科核心素养角度
从工农业生产和探究实验提出有价值的化学问题,学会通过实验观察、设计、探究化学反应中的能量,影响化学反应的速率和平衡等问题,收集证据、提出假设、基于证据分析推理或实验探究,形成认识模型;养成尊重实验事实和证据,独立思考,敢于质疑和勇于创新的精神。发展证据推理、模型认知、科学探究与创新意识水平。
从化学的认识视角关注能源危机、新型电池开发、金属的腐蚀与防腐、工业生产条件的优化以及生活中的问题中,认识化学对社会发展的重大贡献和意义,增强探究物质变化及规律的兴趣,运用化学反应原理知识和方法综合分析化学过程对自然可能带来的各种影响,形成严谨求实的科学态度、“绿色化学”观念和可持续发展意识,在实践中发展科学态度与社会责任意识。
本模块在必修第二册的基础上,总结关于化学反应的一般规律,发展学生对化学反应的认识角度和认识思路。
化学反应
反应方向
反应限度
反应速率
化学2+选择性必修1
无机反应
(化学1)
有机反应
化学2+选择性必修1
四种基本类型
氧化还原类型
离子反应类型
电离平衡
水解平衡
沉淀溶解平衡
选择性必修1
化学反应与能量
化学2+选择性必修1
电化学
选择性必修1
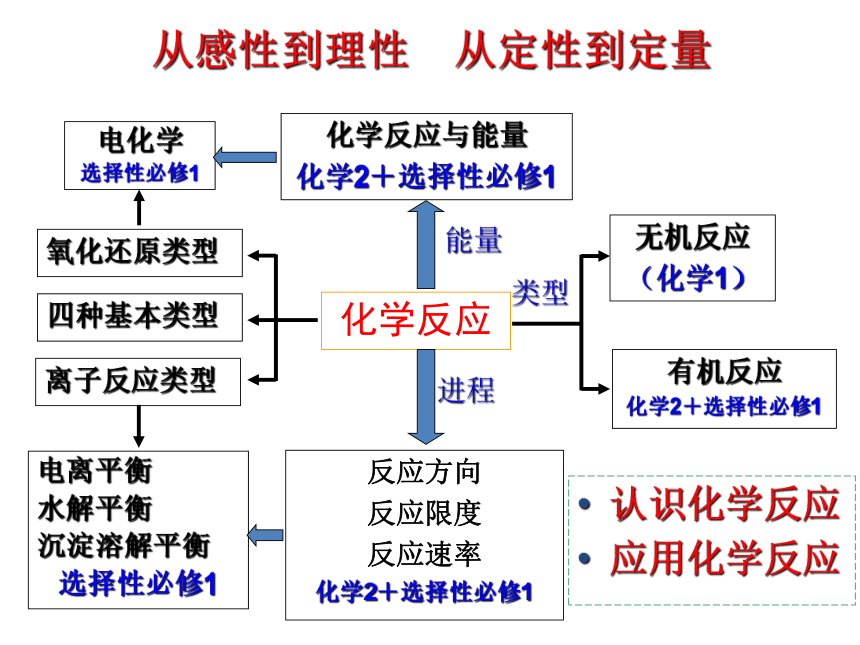
从感性到理性 从定性到定量
能量
进程
类型
认识化学反应
应用化学反应
二、单元教学实施建议
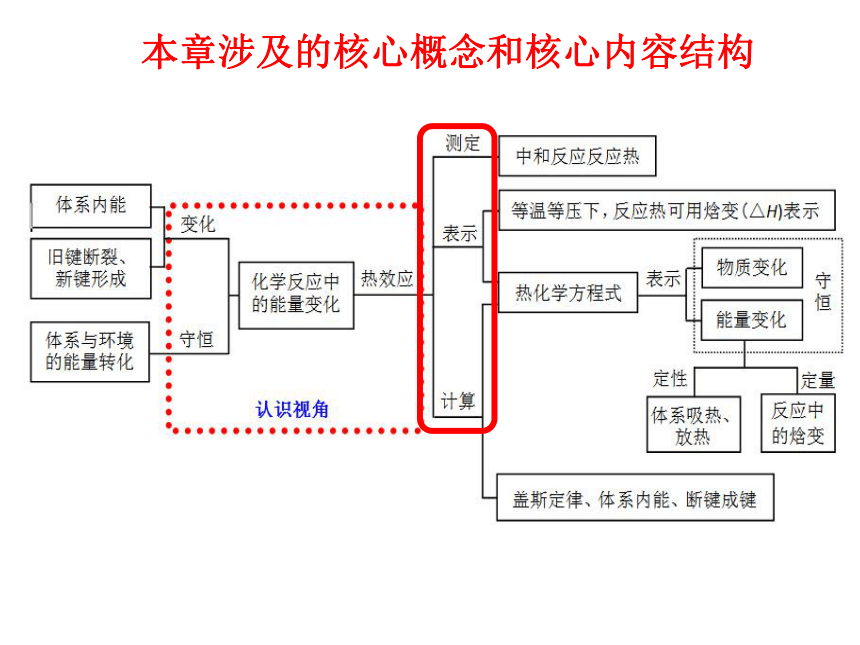
本章涉及的核心概念和核心内容结构
学习目标与评价目标
目标:根据课程标准制定目标
制定的目标具体、可评
教学:活动与目标匹配
评价:评价与目标匹配
“教-学-评”
与目标一致
教师的教、学生的学、教学评价
是一致的,都是围绕目标展开的。
目标确定的依据
课程目标
学业质量
内容要求
学业要求
学习目标
评价目标
“教-学-评”的一致性
评价
1.通过研究盐酸与NaOH溶液的反应,明确体系、环境、热量的相关概念;学习从体系、能量视角认识物质的变化,形成核心观念的结构化认识思路。
2 .通过中和反应反应热的测定实验,能解释测定原理,根据实验中测定并收集的数据计算反应热,基于现象和数据进行分析推理,发现和提出有探究价值的问题。
3.通过对“内能”这一概念的认识,知道内能是体系内物质的各种能量的总和,受温度、压强、物质的聚集状态的影响。通过分析反应中能量变化和绘制化学反应中焓的变化示意图,从宏观角度解释反应热的产生是因为反应前后体系的内能发生了变化,知道反应热和焓变的概念。通过分析微观化学反应中化学键的断裂和形成,解释化学变化中能量变化的本质。能从宏观和微观相结合的视角分析和解决实际问题。
4.通过分析具体的化学反应,能进行反应焓变的简单计算,能用热化学方程式表示反应中的能量变化,运用反应焓变合理选择和利用化学反应。从宏观与微观、定性与定量等角度,分析和表征物质变化中的能量转化。
5.通过燃烧热概念的学习,能分析能源的利用对自然环境和社会发展的影响。通过探究“火箭推进剂、煤炭的综合利用、氢能的利用”等实际问题,综合从物质变化和能量变化来分析、解决实际问题;认识能源在生产、生活中的重要意义,体会化学反应中能量变化的重要价值。
6.通过盖斯定律的学习,认识同一个化学反应的反应热与反应进行的途径无关;能用盖斯定律进行反应热的计算;能合理利用反应热,形成变化观念和守恒思想。
学习目标
只要求知道等压条件下的反应热用“焓变(△H)”这个物理量来表示,不宜拓展“焓”“焓变”的严格的定义。
只要求中和热的实验测定,反应热测定的其他方法不做要求。
表示物质热力学性质的一个参数,数值上等于体系里面所含的内能加上压力与体积的乘积。单位是焦耳。
把握好的教学要求
认真研读《化学课程标准》,把握好内容要求、教学提示、学业要求和学业质量水平标准的内涵,注意学习的阶段性和知识的进阶途径,不盲目拔高,注意将不同素养和水平要求转化为具体的、可操控的学习目标和评价目标。
1.通过研究盐酸与NaOH溶液的反应,明确体系、环境、热量的相关概念;学习从体系、能量视角认识物质的变化,形成核心观念的结构化认识思路。
2 .通过中和反应反应热的测定实验,能解释测定原理,根据实验中测定并收集的数据计算反应热,基于现象和数据进行分析推理,发现和提出有探究价值的问题。
3.通过对“内能”这一概念的认识,知道内能是体系内物质的各种能量的总和,受温度、压强、物质的聚集状态的影响。通过分析反应中能量变化和绘制化学反应中焓的变化示意图,从宏观角度解释反应热的产生是因为反应前后体系的内能发生了变化,知道反应热和焓变的概念。通过分析微观化学反应中化学键的断裂和形成,解释化学变化中能量变化的本质。能从宏观和微观相结合的视角分析和解决实际问题。
4.通过分析具体的化学反应,能进行反应焓变的简单计算,能用热化学方程式表示反应中的能量变化,运用反应焓变合理选择和利用化学反应。从宏观与微观、定性与定量等角度,分析和表征物质变化中的能量转化。
5.通过燃烧热概念的学习,能分析能源的利用对自然环境和社会发展的影响。通过探究“火箭推进剂、煤炭的综合利用、氢能的利用”等实际问题,综合从物质变化和能量变化来分析、解决实际问题;认识能源在生产、生活中的重要意义,体会化学反应中能量变化的重要价值。
6.通过盖斯定律的学习,认识同一个化学反应的反应热与反应进行的途径无关;能用盖斯定律进行反应热的计算;能合理利用反应热,形成变化观念和守恒思想。
学习目标
★只有“燃烧热”,删除了“热值”的要求
化学学习评价包括化学日常学习评价和化学学业成就评价(学业水平合格性考试和等级性考试)。
树立“素养为本”的化学学习评价观,紧紧围绕化学学科核心素养的发展水平和化学学业质量标准来确定化学学习评价目标。
注重过程性评价和结果性评价的有机结合,灵活运用活动表现、纸笔测验和学习档案评价等多样化的评价方式。
倡导学生自评、同伴互评与教师评价相结合,充分发挥评价促进学生化学学科核心素养全面发展的功能。
评价目标
1.通过对具体反应中“体系、环境、热量”相关概念的判断,诊断学生对“体系与环境”、“反应与能量”概念的认识水平,发展学生认识思路的结构化水平。
2 .通过对中和反应反应热测定实验的交流与点评,诊断学生认识能量变化的水平;诊断学生基于实验现象和数据进行分析和定量计算的水平,发展学生探究定量实验误差分析的认识思路。
3.通过对“内能、反应热、焓变”等相关概念的判断,诊断学生对核心概念的认识水平。通过对化学反应中宏观能量变化和微观结构变化的讨论,诊断并发展学生对化学变化中能量变化本质的认识水平。
4.通过对热化学方程式书写要求的讨论,诊断并发展学生符号表征水平和从定量角度分析物质变化和能量变化的认识水平。
5.通过对“火箭推进剂、煤炭的综合利用、氢能的利用”等社会性议题的讨论,诊断并发展学生解决实际问题的能力水平及其对化学学科价值和社会价值的认识水平。
6.通过对盖斯定律及其应用的交流与讨论,诊断并发展学生对能量守恒认识水平和定量计算认识思路的结构化水平。
评价目标
节 教学内容 课时数
第一节 反应热 反应热 焓变 热化学方程式 燃烧热 3
第二节 反应热的计算 盖斯定律 反应热的计算 2
整理与提升 1
合计 6
课时分配
主要内容
本章涉及的核心概念和核心内容结构
化学动力学
化学热力学
1.知道化学反应速率的表示方法,了解测定化学反应速率的简单方法,学会实验数据的记录与处理,能进行化学反应速率的简单计算。通过实验探究,学习运用变量控制的方法研究化学反应速率;理解浓度、压强、温度和催化剂等反应条件对化学反应速率影响的一般规律,能运用规律解释生产、生活和科学实验中的实际问题。
2.知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响。知道催化剂可以改变反应历程,了解碰撞理论,能用简单碰撞理论说明反应条件对化学反应速率的影响;认识催化剂在生产、生活和科学研究领域中的重大作用。体会理论模型的建构过程,强化模型认知意识。
3.认识化学平衡状态,知道化学平衡常数是表征反应限度的物理量,能正确书写化学平衡常数表达式;知道转化率的含义;能进行有关化学平衡常数、平衡转化率等的简单计算。能利用平衡常数和浓度商的关系判断化学反应是否达到平衡及反应进行的方向,提升从定量的角度认识化学反应的水平。
4.通过实验探究,理解温度、浓度、压强等对化学平衡状态的影响规律,能运用规律推测平衡移动方向及浓度、转化率等相关物理量的变化。理解勒夏特列原理,能依据原理分析平衡移动的方向、解释有关的化学现象,体会理论对实践的指导作用。
5.知道化学反应是有方向的,知道可以用“熵”来描述体系的混乱度。了解化学反应发生的总趋势是体系能量降低、熵的增加,简单理解化学反应的方向与反应的焓变和熵变有关。能结合具体事例,用反应的焓变、熵变说明反应自发进行的方向。
6.以工业合成氨为例,能讨论化学反应条件的选择和优化,形成从限度、速率等多角度综合分析化学反应和化工生产条件的思路,认识化学反应速率和化学平衡的综合调控在生产、生活和科学研究中的重要作用,体会化学反应原理的应用价值。
学习目标
★碰撞理论和过渡状态理论不要深入阐述;
★不宜对熵下定义,不宜对熵和熵变的概念做过多拓展;只要求学生知道熵是判断化学反应方向的重要依据。
★不宜拓展自由能的概念和公式、及通过自由能的计算来判断反应方向。
★本单元以定性讨论为主,知道化学平衡常数和转化率的涵义,不宜过多进行化学平衡常数、转化率的定量计算,不涉及化学平衡常数的高次计算。
在教学“熵增”的概念时,保证科学性的基础上简化处理,熵不必给出严格的定义。认识到“熵”是科学家定义的用来描述体系混乱度的物理量,主要用举例法进行定性判断,不涉及计算。对于有兴趣的学生,如果要让学生更加透彻的理解焓变和熵变与化学反应方向的关系,可以引入吉布斯自由能变化的公式: G= H-T S,用于综合焓变和熵变判断化学反应的方向,让学生感受到理论的魅力。
202106选考
1 .通过对“如何表示化学反应速率”的探讨,诊断学生对“化学反应速率可以实验测定”及“简单计算”的认识水平。
2 .通过“定性与定量研究影响化学反应速率的因素”探究活动方案的交流和点评,能简单说明反应条件对化学反应速率的影响规律,诊断并发展学生实验探究的水平和从定性与定量两个视角认识反应条件对化学反应速率影响的认识水平。
3 .通过对HI分解反应的分析,知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响,诊断学生对基元反应、反应历程(反应机理)、有效碰撞、活化分子、活化能等概念的认识水平;通过运用简单碰撞理论解释浓度和温度对化学反应速率影响的分析与交流讨论,体会碰撞理论的建构过程,强化模型认知意识。诊断并发展学生对微观角度解释浓度、温度对化学反应速率影响的认识思路的结构化水平。
4 .通过催化剂催化历程的微观示意图分析与讨论,知道催化剂是通过改变反应历程、改变反应的活化能来改变反应速率,诊断并发展学生对催化剂影响化学反应速率的认识水平和认识思路的结构化水平。
5 .通过对反应中有关物质的浓度随时间变化示意图的分析与讨论,诊断学生对化学平衡状态的理解水平。
6 .通过运用模型进行平衡时物质的浓度、转化率、化学平衡常数等典型计算例题的分析讨论,诊断并发展学生对化学平衡状态的认识水平。
评价目标
7 .通过实验探究、理论分析和讨论交流,诊断并发展学生对平衡移动规律的认识水平。通过利用平衡常数和浓度商的关系对化学反应是否达到平衡及平衡移动方向的分析讨论,诊断学生对模型认知的运用水平。
8 .通过运用平衡移动规律模型对典型案例的平衡移动方向的判断和分析,诊断学生运用勒夏特列原理判断化学平衡移动方向的重要意义的认识水平。
9 .通过具体反应的方向判断,诊断学生对化学反应是有方向的和反应自发进行的认识水平。
10 .通过焓变、熵变与反应自发方向关系的交流讨论,诊断学生对自发反应方向的认识水平。
11 .通过结合生产和生活实际问题提出有效控制反应条件措施的讨论交流,诊断并发展学生对选择适宜生产条件基本思路的认识水平。
12 .通过运用化学原理和方法解释或解决生产、生活和科学实验中与化学相关的一些实际问题的讨论与点评,诊断学生对化学价值的认识水平。
评价目标
课时分配建议
节 教学内容 课时数
第一节 化学反应速率 化学反应速率的表示方法 影响化学反应速率的因素 3
第二节 化学平衡 化学平衡状态 化学平衡常数 影响化学平衡的因素 3
第三节 化学反应的方向 化学反应的方向与焓变、熵变的关系 1
第四节 化学反应的调控 化学反应条件的选择与优化 1
实验活动1 探究影响化学平衡移动的因素 1
整理与提升 1
合计 10
主要内容
本章涉及的核心概念和核心内容结构
1.通过HCl和CH3COOH电离程度的探究实验,进一步掌握物质分类方法,并能从微观层面理解强、弱电解质的本质区别。
2.通过对可逆反应的迁移,认识弱电解质的电离平衡,能运用电离平衡描述和解释化学现象,并预测可能的结果,形成对立统一、联系发展和动态平衡的观点。
3.通过迁移可逆反应的平衡常数,能书写电离平衡常数表达式,计算电离平衡常数,建构电离平衡常数模型,并能应用模型解释弱电解质在水中发生的变化。
4.通过对水的电离平衡及离子积常数的认识,学会运用弱电解质电离模型分析水的电离,形成应用模型解决问题的能力。
5.通过认识溶液的酸碱性与pH的关系,能正确计算溶液的pH;通过测量溶液的pH,运用中和滴定的方法测定溶液浓度,掌握数据分析与处理方法,形成定量研究的能力。
学习目标
★常见的酸、碱、盐、氧化物等与电解质强弱建立联系,明确离子化合物、共价化合物中常见的强电解质和弱电解质。
★复杂的多元弱酸、弱碱的利用电离平衡常数的计算c(H+)不 做要求,只要求当Ka1>>Ka2时计算多元弱酸中的c(H+) 。
★酸碱中和滴定只限于强酸和强碱之间的滴定。
6.通过实验探究盐溶液的酸碱性,认识盐的类型与其溶液酸碱性之间的关系;能分析盐溶液呈不同酸碱性的原因,认识水解原理,归纳盐溶液呈酸碱性的规律。
7.通过实验探究温度、浓度对盐类水解平衡的影响,认识影响水解平衡的主要因素,学会运用化学平衡模型分析水解原理,形成应用模型解决问题的能力。
8.通过认识难溶电解质在水溶液中存在沉淀溶解平衡,能通过实验证实溶解平衡的存在,进一步深化粒子观和平衡观。通过实验探究沉淀的生成、溶解与转化,能应用平衡理论予以解释,能借助Q和Ksp的大小关系判断沉淀的生成与转化,形成定量分析问题的能力。
9.通过人体血液酸碱平衡、利用水解进行物质制备、利用中和法和沉淀法进行废水处理、氟化物预防龋齿等真实情境下问题的解决,感受溶液中的离子平衡在生产生活、生命健康与环境保护等领域的重要价值,体会化学理论、化学知识的学科价值与社会价值。
学习目标
★突出认识思路的结构化。
★不要拓展利用弱酸的电离常数和盐的水解常数进行计算。
★只要求利用溶度积对沉淀的生成、转化作简单的判断,不要求作复杂的计算。
★不宜介绍影响沉淀生成及沉淀完全与否的因素如同离子效应、盐效应等。
1.通过对HCl和CH3COOH电离程度探究实验方案及结果的交流与点评,发展学生的物质分类水平,诊断并发展学生微观探析水平。
2.通过认识弱电解质电离平衡建立的过程、描述和解释现象、预测可能的结果,诊断并发展学生对电离平衡的认识认识思路进阶水平。
3.通过书写弱酸、弱碱电离平衡常数表达式、计算电离平衡常数、解释电解质在水中发生的变化,诊断并发展学生电离平衡常数模型的建构和运用水平。
4.通过对水的电离平衡及离子积常数的探讨,诊断并发展学生对弱电解质电离平衡模型的迁移与运用水平
5.通过对溶液酸碱性与pH的关系、pH计算、pH测定、中和滴定实验的交流与点评,诊断并发展学生对弱酸、弱碱溶液的定量研究水平和实验数据的分析与处理水平。
评价目标
6.通过对盐溶液酸碱性实验探究、理论解释的交流与点评,发展学生宏观辨识与微观探析水平、推理假设与归纳演绎水平。
7.通过对盐类水解平衡影响因素实验的交流与点评,诊断并发展学生对勒夏特列原理的迁移与应用水平。
8.通过对溶解平衡的存在、沉淀的生成与转化实验探究活动的交流与点评,发展学生的粒子观和平衡观;通过借助Q和Ksp的大小关系判断沉淀的生成与转化,诊断并发展学生定量分析沉淀溶解平衡问题的能力。
9.通过综合运用离子反应、电离平衡、水解平衡、沉淀溶解平衡原理,基于微粒观、变化观和平衡观,分析和解决生产生活、生命活动、环境保护等领域有关电解质溶液实际问题的讨论与点评,诊断并发展对化学学科价值、化学社会价值的认识水平。
评价目标
课时分配
节 教学内容 课时数
第一节 电离平衡 强电解质和弱电解质 弱电解质的电离平衡 电离平衡常数 2
第二节 水的电离和溶液的pH 水的电离 溶液的酸碱性与pH 酸碱中和滴定 3
第三节 盐类的水解 盐类的水解 影响盐类水解的主要因素 盐类水解的应用 2
第四节 沉淀溶解平衡 难溶电解质的沉淀溶解平衡 沉淀溶解平衡的应用 2
实验活动 强酸与强碱的中和滴定 盐类水解的应用 2
整理与提升 1
合计 12
主要内容
本章涉及的核心概念和核心内容结构
1.通过探究铜锌双液原电池的形成条件,分析原电池的正负极、导线中电子的运动方向、溶液中离子的运动方向、两个半电池的组成、电极反应式和总反应方程式的书写等,能从宏观和微观两个视角分析、解释原电池的工作原理,构建原电池的系统分析模型,形成认识思路和核心观念的结构化。
2.通过了解常见的化学电源,如碱性锌锰电池、铅酸蓄电池、燃料电池等工作原理,学会运用原电池分析模型,结合信息解释常见化学电源的主要工作原理(如锂离子电池)。能根据原电池原理,设计简单的原电池,强化模型认知意识。通过了解化学电源的发展史,能从物质变化和能量变化两个角度分析新型电池的研发和应用,体会化学知识的社会价值。
3.通过分析电解氯化铜溶液的实验,判断电解池的阴阳极及产物,分析导线中电子的运动方向、溶液中离子的运动方向等,能从宏观和微观两个视角分析、解释电解池的工作原理,构建电解池的系统分析模型,形成认识思路和核心观念的结构化。通过微观分析电解过程,了解粒子的放电顺序与其氧化性、还原性的关系,能预测电解后的产物,并能用电极反应式和总反应式进行表征。
学习目标
★不要求独立书写其它化学电源的电极反应式。
1.通过探究铜锌双液原电池的形成条件,分析原电池的正负极、导线中电子的运动方向、溶液中离子的运动方向、两个半电池的组成、电极反应式和总反应方程式的书写等,能从宏观和微观两个视角分析、解释原电池的工作原理,构建原电池的系统分析模型,形成认识思路和核心观念的结构化。
2.通过了解常见的化学电源,如碱性锌锰电池、铅酸蓄电池、燃料电池等工作原理,学会运用原电池分析模型,结合信息解释常见化学电源的主要工作原理(如锂离子电池)。能根据原电池原理,设计简单的原电池,强化模型认知意识。通过了解化学电源的发展史,能从物质变化和能量变化两个角度分析新型电池的研发和应用,体会化学知识的社会价值。
3.通过分析电解氯化铜溶液的实验,判断电解池的阴阳极及产物,分析导线中电子的运动方向、溶液中离子的运动方向等,能从宏观和微观两个视角分析、解释电解池的工作原理,构建电解池的系统分析模型,形成认识思路和核心观念的结构化。通过微观分析电解过程,了解粒子的放电顺序与其氧化性、还原性的关系,能预测电解后的产物,并能用电极反应式和总反应式进行表征。
学习目标
4.通过电解池反应原理的探究,运用电解池思维模型,分析氯碱工业、电镀、电解精炼和电冶金的反应原理,认识电解在实现物质转化和能量储存中的应用,体会电解原理对人类社会进步的重要贡献。
5.通过查阅金属腐蚀相关资料的学习小组活动,认识金属腐蚀的巨大危害;通过实验探究钢铁的腐蚀原因,了解金属腐蚀的本质,能书写钢铁腐蚀的电极反应式和总反应式。通过探究金属防护的方法,运用化学知识综合评价和设计金属防护的方案,体会化学知识的社会价值。
6.通过“实验活动4简单的电镀实验”的设计和操作,理解构成电解池的四个要素,能运用电解池原理制作镀件。通过“实验活动5制作简单的燃料电池”的设计和操作,能用电解原理制备氢气和氧气,能用原电池原理制作氢氧燃料电池,实现电能和化学能的相互转化。
学习目标
★氯碱工业、电镀、电冶金等的细节问题不作过多拓展,只 要求能写电极反应式或电解的总方程式,以及阴阳极材料的特点、电子转移和氧化还原反应的关系。
1.通过对铜锌双液原电池实验的设计方案和实验现象的交流与点评,诊断并发展学生实验探究水平。通过对原电池原理的分析与讨论,诊断并发展学生从微观视角对原电池原理进行剖析的水平。
2.通过对常见化学电源工作原理和简单原电池设计的讨论与评价,诊断并发展学生对原电池原理的认识进阶。通过交流化学电源的发展史、讨论社会性议题“新型电池的研发和应用”,诊断学生对化学学科价值和社会价值的认识水平。
3.通过对电解氯化铜溶液实验过程的分析与讨论,诊断并发展学生从微观视角对电解池原理进行剖析的水平。
4.通过对氯碱工业、电镀、电解精炼和电冶金等电解原理及金属防护方法的交流与讨论,诊断学生对化学学科价值和社会价值的认识水平。
5.通过对钢铁腐蚀原因、金属防护方法等实验探究活动的交流与点评,诊断并发展学生基于电化学原理的实验设计水平。
6.通过对“简单的电镀实验”“制作简单的燃料电池”两个必做实验的交流与点评,诊断并发展学生基于电化学原理的实验设计和操作水平。
评价目标
课时分配
节 教学内容 课时数
第一节 原电池 原电池的工作原理 化学电源 3
第二节 电解池 电解原理 电解原理的应用 2
第三节 金属的腐蚀与防护 金属的腐蚀 金属的防护 1
实验活动4 简单的电镀实验 1
实验活动5 制作简单的燃料电池 1
整理与提升 1
合计 9
作业设计建议
资料卡片(1-1,2-1,3-4,4-4共10个)
思考与讨论(1-0,2-4,3-7,4-6共17个)
实验(1-0,2-3,3-5,4-4共12个)
方法导引(2-1,3-2,4-2共5个)
探究(1-0,2-1,3-2,4-2共5个)
实验活动(1-1,2-1,3-2,4-0共5个)
研究与实践(1-1,2-1,3-1,4-1共4个)
科学史话(1-1,2-1,3-0,4-1共3个)
科学·技术·社会(1-1,2-2,3-2,4-0共5个)
练习与应用(1个/节)
整理与提升(1个/章)
复习与提高(练习)(1个/章)
●教材栏目
整理与提升
化学反应原理(选择性必修1)
学科教学指导意见解读
一、模块概要及素养要求
二、教学实施建议
一、模块概要及素养要求
…………………………………………………………………………
在本课程模块中,将从化学反应与能量,化学反应的方向、限度和连率,以及水溶液中的离子反应与平衡等方面,探素化学反应的规律及其应用。通过本课程模块的学习,引导学生进一步认识化学变化所遵循的基本原理,初步形成关于物质变化的科学观念。了解化学反应中能量转化所遵循的规律,赞赏运用化学反应原理对科学技术和人类社会文明所起的重要作用,发展化学学科核心素养。
…………………………………………………………………………
模块1 化学反应原理
本模块的知识结构
主线
研究化学反应中能量转化所遵循的规律
①
④
②
③
研究化学反应的方向、限度和速率的有关规律
本模块在必修第二册的基础上,总结关于化学反应的一般规律,发展学生对化学反应的认识角度和认识思路。
模块的教育价值和功能
教科书的每个章节的“引言” “思考与讨论”“方法导引”“探究”“实验活动”“研究与实践”栏目、章末的“整理与提升”中都十分强调原理知识学习的认识角度、认识思路,从而建构化学反应的认识模型。
借助能量变化、反应方向、限度和速率等角度完善学生对化学反应的认识角度,提升学生对化学反应和研究方法的认识;
借助反应方向、反应调控、离子平衡等内容,从定性到定量、静态到动态、宏观到微观、孤立到系统,发展学生对化学反应认识的深度,促进学生形成化学的核心观念、知识结构和思想方法,提升学生知识关联的结构化、认识思路的结构化以及核心观念的结构化水平。
能利用真实情境,对生产、生活和自然界中的有关化学变化现象进行合理的解释,挖掘知识的多重属性及教学价值。
学科核心素养角度
认识化学变化的原理、思路与方法,形成物质变化的科学观念,体验并运用化学反应原理对科学技术和人类社会文明所起的重要作用,发展化学学科核心素养。
从化学反应的宏观现象,认识化学反应存在物质变化、能量变化、反应方向、反应速率、反应限度等问题,并进一步从微观层面理解化学反应存在能量、方向、速率、平衡等变化的原因、规律;从宏观、微观层面有效解释、预测、设计并控制化学反应的变化,发展对宏观辨识与微观探析的认识水平。
从不同视角对化学变化进行分类研究,逐步揭示各类变化的特征和规律,认识化学变化是有条件的;能用能量的观点、速率的观点和动态平衡的观点分析化学反应,预测在一定条件下某种物质可能发生的化学变化,发展对变化观念与平衡思想的认识水平。
本模块在必修第二册的基础上,总结关于化学反应的一般规律,发展学生对化学反应的认识角度和认识思路。
学科核心素养角度
从工农业生产和探究实验提出有价值的化学问题,学会通过实验观察、设计、探究化学反应中的能量,影响化学反应的速率和平衡等问题,收集证据、提出假设、基于证据分析推理或实验探究,形成认识模型;养成尊重实验事实和证据,独立思考,敢于质疑和勇于创新的精神。发展证据推理、模型认知、科学探究与创新意识水平。
从化学的认识视角关注能源危机、新型电池开发、金属的腐蚀与防腐、工业生产条件的优化以及生活中的问题中,认识化学对社会发展的重大贡献和意义,增强探究物质变化及规律的兴趣,运用化学反应原理知识和方法综合分析化学过程对自然可能带来的各种影响,形成严谨求实的科学态度、“绿色化学”观念和可持续发展意识,在实践中发展科学态度与社会责任意识。
本模块在必修第二册的基础上,总结关于化学反应的一般规律,发展学生对化学反应的认识角度和认识思路。
化学反应
反应方向
反应限度
反应速率
化学2+选择性必修1
无机反应
(化学1)
有机反应
化学2+选择性必修1
四种基本类型
氧化还原类型
离子反应类型
电离平衡
水解平衡
沉淀溶解平衡
选择性必修1
化学反应与能量
化学2+选择性必修1
电化学
选择性必修1
从感性到理性 从定性到定量
能量
进程
类型
认识化学反应
应用化学反应
二、单元教学实施建议
本章涉及的核心概念和核心内容结构
学习目标与评价目标
目标:根据课程标准制定目标
制定的目标具体、可评
教学:活动与目标匹配
评价:评价与目标匹配
“教-学-评”
与目标一致
教师的教、学生的学、教学评价
是一致的,都是围绕目标展开的。
目标确定的依据
课程目标
学业质量
内容要求
学业要求
学习目标
评价目标
“教-学-评”的一致性
评价
1.通过研究盐酸与NaOH溶液的反应,明确体系、环境、热量的相关概念;学习从体系、能量视角认识物质的变化,形成核心观念的结构化认识思路。
2 .通过中和反应反应热的测定实验,能解释测定原理,根据实验中测定并收集的数据计算反应热,基于现象和数据进行分析推理,发现和提出有探究价值的问题。
3.通过对“内能”这一概念的认识,知道内能是体系内物质的各种能量的总和,受温度、压强、物质的聚集状态的影响。通过分析反应中能量变化和绘制化学反应中焓的变化示意图,从宏观角度解释反应热的产生是因为反应前后体系的内能发生了变化,知道反应热和焓变的概念。通过分析微观化学反应中化学键的断裂和形成,解释化学变化中能量变化的本质。能从宏观和微观相结合的视角分析和解决实际问题。
4.通过分析具体的化学反应,能进行反应焓变的简单计算,能用热化学方程式表示反应中的能量变化,运用反应焓变合理选择和利用化学反应。从宏观与微观、定性与定量等角度,分析和表征物质变化中的能量转化。
5.通过燃烧热概念的学习,能分析能源的利用对自然环境和社会发展的影响。通过探究“火箭推进剂、煤炭的综合利用、氢能的利用”等实际问题,综合从物质变化和能量变化来分析、解决实际问题;认识能源在生产、生活中的重要意义,体会化学反应中能量变化的重要价值。
6.通过盖斯定律的学习,认识同一个化学反应的反应热与反应进行的途径无关;能用盖斯定律进行反应热的计算;能合理利用反应热,形成变化观念和守恒思想。
学习目标
只要求知道等压条件下的反应热用“焓变(△H)”这个物理量来表示,不宜拓展“焓”“焓变”的严格的定义。
只要求中和热的实验测定,反应热测定的其他方法不做要求。
表示物质热力学性质的一个参数,数值上等于体系里面所含的内能加上压力与体积的乘积。单位是焦耳。
把握好的教学要求
认真研读《化学课程标准》,把握好内容要求、教学提示、学业要求和学业质量水平标准的内涵,注意学习的阶段性和知识的进阶途径,不盲目拔高,注意将不同素养和水平要求转化为具体的、可操控的学习目标和评价目标。
1.通过研究盐酸与NaOH溶液的反应,明确体系、环境、热量的相关概念;学习从体系、能量视角认识物质的变化,形成核心观念的结构化认识思路。
2 .通过中和反应反应热的测定实验,能解释测定原理,根据实验中测定并收集的数据计算反应热,基于现象和数据进行分析推理,发现和提出有探究价值的问题。
3.通过对“内能”这一概念的认识,知道内能是体系内物质的各种能量的总和,受温度、压强、物质的聚集状态的影响。通过分析反应中能量变化和绘制化学反应中焓的变化示意图,从宏观角度解释反应热的产生是因为反应前后体系的内能发生了变化,知道反应热和焓变的概念。通过分析微观化学反应中化学键的断裂和形成,解释化学变化中能量变化的本质。能从宏观和微观相结合的视角分析和解决实际问题。
4.通过分析具体的化学反应,能进行反应焓变的简单计算,能用热化学方程式表示反应中的能量变化,运用反应焓变合理选择和利用化学反应。从宏观与微观、定性与定量等角度,分析和表征物质变化中的能量转化。
5.通过燃烧热概念的学习,能分析能源的利用对自然环境和社会发展的影响。通过探究“火箭推进剂、煤炭的综合利用、氢能的利用”等实际问题,综合从物质变化和能量变化来分析、解决实际问题;认识能源在生产、生活中的重要意义,体会化学反应中能量变化的重要价值。
6.通过盖斯定律的学习,认识同一个化学反应的反应热与反应进行的途径无关;能用盖斯定律进行反应热的计算;能合理利用反应热,形成变化观念和守恒思想。
学习目标
★只有“燃烧热”,删除了“热值”的要求
化学学习评价包括化学日常学习评价和化学学业成就评价(学业水平合格性考试和等级性考试)。
树立“素养为本”的化学学习评价观,紧紧围绕化学学科核心素养的发展水平和化学学业质量标准来确定化学学习评价目标。
注重过程性评价和结果性评价的有机结合,灵活运用活动表现、纸笔测验和学习档案评价等多样化的评价方式。
倡导学生自评、同伴互评与教师评价相结合,充分发挥评价促进学生化学学科核心素养全面发展的功能。
评价目标
1.通过对具体反应中“体系、环境、热量”相关概念的判断,诊断学生对“体系与环境”、“反应与能量”概念的认识水平,发展学生认识思路的结构化水平。
2 .通过对中和反应反应热测定实验的交流与点评,诊断学生认识能量变化的水平;诊断学生基于实验现象和数据进行分析和定量计算的水平,发展学生探究定量实验误差分析的认识思路。
3.通过对“内能、反应热、焓变”等相关概念的判断,诊断学生对核心概念的认识水平。通过对化学反应中宏观能量变化和微观结构变化的讨论,诊断并发展学生对化学变化中能量变化本质的认识水平。
4.通过对热化学方程式书写要求的讨论,诊断并发展学生符号表征水平和从定量角度分析物质变化和能量变化的认识水平。
5.通过对“火箭推进剂、煤炭的综合利用、氢能的利用”等社会性议题的讨论,诊断并发展学生解决实际问题的能力水平及其对化学学科价值和社会价值的认识水平。
6.通过对盖斯定律及其应用的交流与讨论,诊断并发展学生对能量守恒认识水平和定量计算认识思路的结构化水平。
评价目标
节 教学内容 课时数
第一节 反应热 反应热 焓变 热化学方程式 燃烧热 3
第二节 反应热的计算 盖斯定律 反应热的计算 2
整理与提升 1
合计 6
课时分配
主要内容
本章涉及的核心概念和核心内容结构
化学动力学
化学热力学
1.知道化学反应速率的表示方法,了解测定化学反应速率的简单方法,学会实验数据的记录与处理,能进行化学反应速率的简单计算。通过实验探究,学习运用变量控制的方法研究化学反应速率;理解浓度、压强、温度和催化剂等反应条件对化学反应速率影响的一般规律,能运用规律解释生产、生活和科学实验中的实际问题。
2.知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响。知道催化剂可以改变反应历程,了解碰撞理论,能用简单碰撞理论说明反应条件对化学反应速率的影响;认识催化剂在生产、生活和科学研究领域中的重大作用。体会理论模型的建构过程,强化模型认知意识。
3.认识化学平衡状态,知道化学平衡常数是表征反应限度的物理量,能正确书写化学平衡常数表达式;知道转化率的含义;能进行有关化学平衡常数、平衡转化率等的简单计算。能利用平衡常数和浓度商的关系判断化学反应是否达到平衡及反应进行的方向,提升从定量的角度认识化学反应的水平。
4.通过实验探究,理解温度、浓度、压强等对化学平衡状态的影响规律,能运用规律推测平衡移动方向及浓度、转化率等相关物理量的变化。理解勒夏特列原理,能依据原理分析平衡移动的方向、解释有关的化学现象,体会理论对实践的指导作用。
5.知道化学反应是有方向的,知道可以用“熵”来描述体系的混乱度。了解化学反应发生的总趋势是体系能量降低、熵的增加,简单理解化学反应的方向与反应的焓变和熵变有关。能结合具体事例,用反应的焓变、熵变说明反应自发进行的方向。
6.以工业合成氨为例,能讨论化学反应条件的选择和优化,形成从限度、速率等多角度综合分析化学反应和化工生产条件的思路,认识化学反应速率和化学平衡的综合调控在生产、生活和科学研究中的重要作用,体会化学反应原理的应用价值。
学习目标
★碰撞理论和过渡状态理论不要深入阐述;
★不宜对熵下定义,不宜对熵和熵变的概念做过多拓展;只要求学生知道熵是判断化学反应方向的重要依据。
★不宜拓展自由能的概念和公式、及通过自由能的计算来判断反应方向。
★本单元以定性讨论为主,知道化学平衡常数和转化率的涵义,不宜过多进行化学平衡常数、转化率的定量计算,不涉及化学平衡常数的高次计算。
在教学“熵增”的概念时,保证科学性的基础上简化处理,熵不必给出严格的定义。认识到“熵”是科学家定义的用来描述体系混乱度的物理量,主要用举例法进行定性判断,不涉及计算。对于有兴趣的学生,如果要让学生更加透彻的理解焓变和熵变与化学反应方向的关系,可以引入吉布斯自由能变化的公式: G= H-T S,用于综合焓变和熵变判断化学反应的方向,让学生感受到理论的魅力。
202106选考
1 .通过对“如何表示化学反应速率”的探讨,诊断学生对“化学反应速率可以实验测定”及“简单计算”的认识水平。
2 .通过“定性与定量研究影响化学反应速率的因素”探究活动方案的交流和点评,能简单说明反应条件对化学反应速率的影响规律,诊断并发展学生实验探究的水平和从定性与定量两个视角认识反应条件对化学反应速率影响的认识水平。
3 .通过对HI分解反应的分析,知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响,诊断学生对基元反应、反应历程(反应机理)、有效碰撞、活化分子、活化能等概念的认识水平;通过运用简单碰撞理论解释浓度和温度对化学反应速率影响的分析与交流讨论,体会碰撞理论的建构过程,强化模型认知意识。诊断并发展学生对微观角度解释浓度、温度对化学反应速率影响的认识思路的结构化水平。
4 .通过催化剂催化历程的微观示意图分析与讨论,知道催化剂是通过改变反应历程、改变反应的活化能来改变反应速率,诊断并发展学生对催化剂影响化学反应速率的认识水平和认识思路的结构化水平。
5 .通过对反应中有关物质的浓度随时间变化示意图的分析与讨论,诊断学生对化学平衡状态的理解水平。
6 .通过运用模型进行平衡时物质的浓度、转化率、化学平衡常数等典型计算例题的分析讨论,诊断并发展学生对化学平衡状态的认识水平。
评价目标
7 .通过实验探究、理论分析和讨论交流,诊断并发展学生对平衡移动规律的认识水平。通过利用平衡常数和浓度商的关系对化学反应是否达到平衡及平衡移动方向的分析讨论,诊断学生对模型认知的运用水平。
8 .通过运用平衡移动规律模型对典型案例的平衡移动方向的判断和分析,诊断学生运用勒夏特列原理判断化学平衡移动方向的重要意义的认识水平。
9 .通过具体反应的方向判断,诊断学生对化学反应是有方向的和反应自发进行的认识水平。
10 .通过焓变、熵变与反应自发方向关系的交流讨论,诊断学生对自发反应方向的认识水平。
11 .通过结合生产和生活实际问题提出有效控制反应条件措施的讨论交流,诊断并发展学生对选择适宜生产条件基本思路的认识水平。
12 .通过运用化学原理和方法解释或解决生产、生活和科学实验中与化学相关的一些实际问题的讨论与点评,诊断学生对化学价值的认识水平。
评价目标
课时分配建议
节 教学内容 课时数
第一节 化学反应速率 化学反应速率的表示方法 影响化学反应速率的因素 3
第二节 化学平衡 化学平衡状态 化学平衡常数 影响化学平衡的因素 3
第三节 化学反应的方向 化学反应的方向与焓变、熵变的关系 1
第四节 化学反应的调控 化学反应条件的选择与优化 1
实验活动1 探究影响化学平衡移动的因素 1
整理与提升 1
合计 10
主要内容
本章涉及的核心概念和核心内容结构
1.通过HCl和CH3COOH电离程度的探究实验,进一步掌握物质分类方法,并能从微观层面理解强、弱电解质的本质区别。
2.通过对可逆反应的迁移,认识弱电解质的电离平衡,能运用电离平衡描述和解释化学现象,并预测可能的结果,形成对立统一、联系发展和动态平衡的观点。
3.通过迁移可逆反应的平衡常数,能书写电离平衡常数表达式,计算电离平衡常数,建构电离平衡常数模型,并能应用模型解释弱电解质在水中发生的变化。
4.通过对水的电离平衡及离子积常数的认识,学会运用弱电解质电离模型分析水的电离,形成应用模型解决问题的能力。
5.通过认识溶液的酸碱性与pH的关系,能正确计算溶液的pH;通过测量溶液的pH,运用中和滴定的方法测定溶液浓度,掌握数据分析与处理方法,形成定量研究的能力。
学习目标
★常见的酸、碱、盐、氧化物等与电解质强弱建立联系,明确离子化合物、共价化合物中常见的强电解质和弱电解质。
★复杂的多元弱酸、弱碱的利用电离平衡常数的计算c(H+)不 做要求,只要求当Ka1>>Ka2时计算多元弱酸中的c(H+) 。
★酸碱中和滴定只限于强酸和强碱之间的滴定。
6.通过实验探究盐溶液的酸碱性,认识盐的类型与其溶液酸碱性之间的关系;能分析盐溶液呈不同酸碱性的原因,认识水解原理,归纳盐溶液呈酸碱性的规律。
7.通过实验探究温度、浓度对盐类水解平衡的影响,认识影响水解平衡的主要因素,学会运用化学平衡模型分析水解原理,形成应用模型解决问题的能力。
8.通过认识难溶电解质在水溶液中存在沉淀溶解平衡,能通过实验证实溶解平衡的存在,进一步深化粒子观和平衡观。通过实验探究沉淀的生成、溶解与转化,能应用平衡理论予以解释,能借助Q和Ksp的大小关系判断沉淀的生成与转化,形成定量分析问题的能力。
9.通过人体血液酸碱平衡、利用水解进行物质制备、利用中和法和沉淀法进行废水处理、氟化物预防龋齿等真实情境下问题的解决,感受溶液中的离子平衡在生产生活、生命健康与环境保护等领域的重要价值,体会化学理论、化学知识的学科价值与社会价值。
学习目标
★突出认识思路的结构化。
★不要拓展利用弱酸的电离常数和盐的水解常数进行计算。
★只要求利用溶度积对沉淀的生成、转化作简单的判断,不要求作复杂的计算。
★不宜介绍影响沉淀生成及沉淀完全与否的因素如同离子效应、盐效应等。
1.通过对HCl和CH3COOH电离程度探究实验方案及结果的交流与点评,发展学生的物质分类水平,诊断并发展学生微观探析水平。
2.通过认识弱电解质电离平衡建立的过程、描述和解释现象、预测可能的结果,诊断并发展学生对电离平衡的认识认识思路进阶水平。
3.通过书写弱酸、弱碱电离平衡常数表达式、计算电离平衡常数、解释电解质在水中发生的变化,诊断并发展学生电离平衡常数模型的建构和运用水平。
4.通过对水的电离平衡及离子积常数的探讨,诊断并发展学生对弱电解质电离平衡模型的迁移与运用水平
5.通过对溶液酸碱性与pH的关系、pH计算、pH测定、中和滴定实验的交流与点评,诊断并发展学生对弱酸、弱碱溶液的定量研究水平和实验数据的分析与处理水平。
评价目标
6.通过对盐溶液酸碱性实验探究、理论解释的交流与点评,发展学生宏观辨识与微观探析水平、推理假设与归纳演绎水平。
7.通过对盐类水解平衡影响因素实验的交流与点评,诊断并发展学生对勒夏特列原理的迁移与应用水平。
8.通过对溶解平衡的存在、沉淀的生成与转化实验探究活动的交流与点评,发展学生的粒子观和平衡观;通过借助Q和Ksp的大小关系判断沉淀的生成与转化,诊断并发展学生定量分析沉淀溶解平衡问题的能力。
9.通过综合运用离子反应、电离平衡、水解平衡、沉淀溶解平衡原理,基于微粒观、变化观和平衡观,分析和解决生产生活、生命活动、环境保护等领域有关电解质溶液实际问题的讨论与点评,诊断并发展对化学学科价值、化学社会价值的认识水平。
评价目标
课时分配
节 教学内容 课时数
第一节 电离平衡 强电解质和弱电解质 弱电解质的电离平衡 电离平衡常数 2
第二节 水的电离和溶液的pH 水的电离 溶液的酸碱性与pH 酸碱中和滴定 3
第三节 盐类的水解 盐类的水解 影响盐类水解的主要因素 盐类水解的应用 2
第四节 沉淀溶解平衡 难溶电解质的沉淀溶解平衡 沉淀溶解平衡的应用 2
实验活动 强酸与强碱的中和滴定 盐类水解的应用 2
整理与提升 1
合计 12
主要内容
本章涉及的核心概念和核心内容结构
1.通过探究铜锌双液原电池的形成条件,分析原电池的正负极、导线中电子的运动方向、溶液中离子的运动方向、两个半电池的组成、电极反应式和总反应方程式的书写等,能从宏观和微观两个视角分析、解释原电池的工作原理,构建原电池的系统分析模型,形成认识思路和核心观念的结构化。
2.通过了解常见的化学电源,如碱性锌锰电池、铅酸蓄电池、燃料电池等工作原理,学会运用原电池分析模型,结合信息解释常见化学电源的主要工作原理(如锂离子电池)。能根据原电池原理,设计简单的原电池,强化模型认知意识。通过了解化学电源的发展史,能从物质变化和能量变化两个角度分析新型电池的研发和应用,体会化学知识的社会价值。
3.通过分析电解氯化铜溶液的实验,判断电解池的阴阳极及产物,分析导线中电子的运动方向、溶液中离子的运动方向等,能从宏观和微观两个视角分析、解释电解池的工作原理,构建电解池的系统分析模型,形成认识思路和核心观念的结构化。通过微观分析电解过程,了解粒子的放电顺序与其氧化性、还原性的关系,能预测电解后的产物,并能用电极反应式和总反应式进行表征。
学习目标
★不要求独立书写其它化学电源的电极反应式。
1.通过探究铜锌双液原电池的形成条件,分析原电池的正负极、导线中电子的运动方向、溶液中离子的运动方向、两个半电池的组成、电极反应式和总反应方程式的书写等,能从宏观和微观两个视角分析、解释原电池的工作原理,构建原电池的系统分析模型,形成认识思路和核心观念的结构化。
2.通过了解常见的化学电源,如碱性锌锰电池、铅酸蓄电池、燃料电池等工作原理,学会运用原电池分析模型,结合信息解释常见化学电源的主要工作原理(如锂离子电池)。能根据原电池原理,设计简单的原电池,强化模型认知意识。通过了解化学电源的发展史,能从物质变化和能量变化两个角度分析新型电池的研发和应用,体会化学知识的社会价值。
3.通过分析电解氯化铜溶液的实验,判断电解池的阴阳极及产物,分析导线中电子的运动方向、溶液中离子的运动方向等,能从宏观和微观两个视角分析、解释电解池的工作原理,构建电解池的系统分析模型,形成认识思路和核心观念的结构化。通过微观分析电解过程,了解粒子的放电顺序与其氧化性、还原性的关系,能预测电解后的产物,并能用电极反应式和总反应式进行表征。
学习目标
4.通过电解池反应原理的探究,运用电解池思维模型,分析氯碱工业、电镀、电解精炼和电冶金的反应原理,认识电解在实现物质转化和能量储存中的应用,体会电解原理对人类社会进步的重要贡献。
5.通过查阅金属腐蚀相关资料的学习小组活动,认识金属腐蚀的巨大危害;通过实验探究钢铁的腐蚀原因,了解金属腐蚀的本质,能书写钢铁腐蚀的电极反应式和总反应式。通过探究金属防护的方法,运用化学知识综合评价和设计金属防护的方案,体会化学知识的社会价值。
6.通过“实验活动4简单的电镀实验”的设计和操作,理解构成电解池的四个要素,能运用电解池原理制作镀件。通过“实验活动5制作简单的燃料电池”的设计和操作,能用电解原理制备氢气和氧气,能用原电池原理制作氢氧燃料电池,实现电能和化学能的相互转化。
学习目标
★氯碱工业、电镀、电冶金等的细节问题不作过多拓展,只 要求能写电极反应式或电解的总方程式,以及阴阳极材料的特点、电子转移和氧化还原反应的关系。
1.通过对铜锌双液原电池实验的设计方案和实验现象的交流与点评,诊断并发展学生实验探究水平。通过对原电池原理的分析与讨论,诊断并发展学生从微观视角对原电池原理进行剖析的水平。
2.通过对常见化学电源工作原理和简单原电池设计的讨论与评价,诊断并发展学生对原电池原理的认识进阶。通过交流化学电源的发展史、讨论社会性议题“新型电池的研发和应用”,诊断学生对化学学科价值和社会价值的认识水平。
3.通过对电解氯化铜溶液实验过程的分析与讨论,诊断并发展学生从微观视角对电解池原理进行剖析的水平。
4.通过对氯碱工业、电镀、电解精炼和电冶金等电解原理及金属防护方法的交流与讨论,诊断学生对化学学科价值和社会价值的认识水平。
5.通过对钢铁腐蚀原因、金属防护方法等实验探究活动的交流与点评,诊断并发展学生基于电化学原理的实验设计水平。
6.通过对“简单的电镀实验”“制作简单的燃料电池”两个必做实验的交流与点评,诊断并发展学生基于电化学原理的实验设计和操作水平。
评价目标
课时分配
节 教学内容 课时数
第一节 原电池 原电池的工作原理 化学电源 3
第二节 电解池 电解原理 电解原理的应用 2
第三节 金属的腐蚀与防护 金属的腐蚀 金属的防护 1
实验活动4 简单的电镀实验 1
实验活动5 制作简单的燃料电池 1
整理与提升 1
合计 9
作业设计建议
资料卡片(1-1,2-1,3-4,4-4共10个)
思考与讨论(1-0,2-4,3-7,4-6共17个)
实验(1-0,2-3,3-5,4-4共12个)
方法导引(2-1,3-2,4-2共5个)
探究(1-0,2-1,3-2,4-2共5个)
实验活动(1-1,2-1,3-2,4-0共5个)
研究与实践(1-1,2-1,3-1,4-1共4个)
科学史话(1-1,2-1,3-0,4-1共3个)
科学·技术·社会(1-1,2-2,3-2,4-0共5个)
练习与应用(1个/节)
整理与提升(1个/章)
复习与提高(练习)(1个/章)
●教材栏目
整理与提升
