人教版初中化学课件九下第九单元 课题2 溶解度(共40张PPT)
文档属性
| 名称 | 人教版初中化学课件九下第九单元 课题2 溶解度(共40张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 611.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-11 00:00:00 | ||
图片预览






文档简介
课件40张PPT。 第九单元 溶液
课题2 溶解度
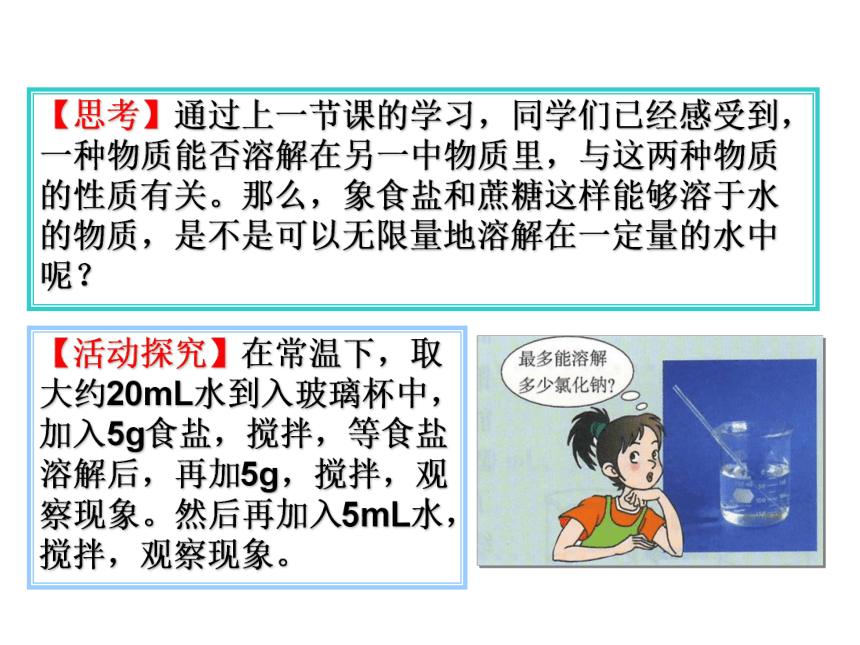
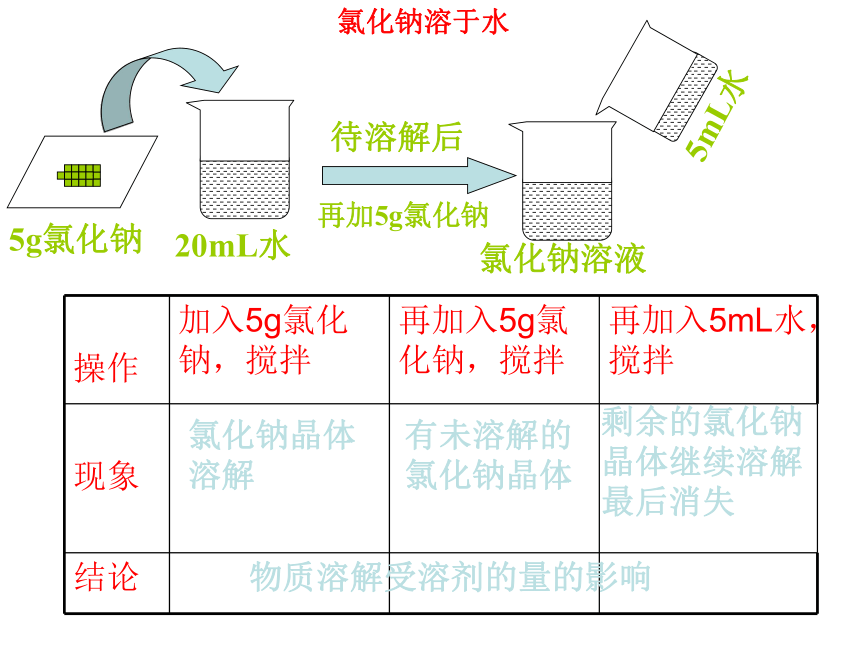
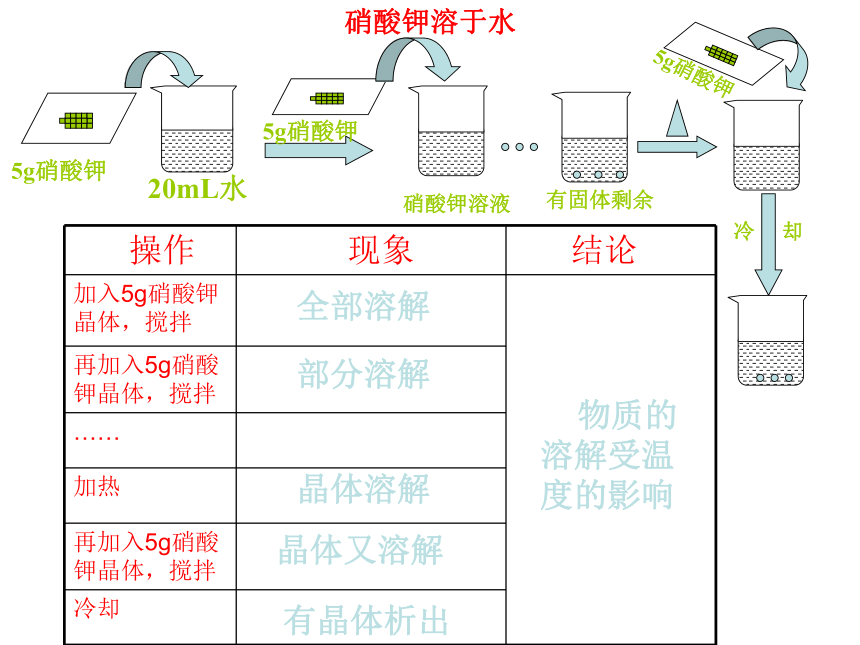
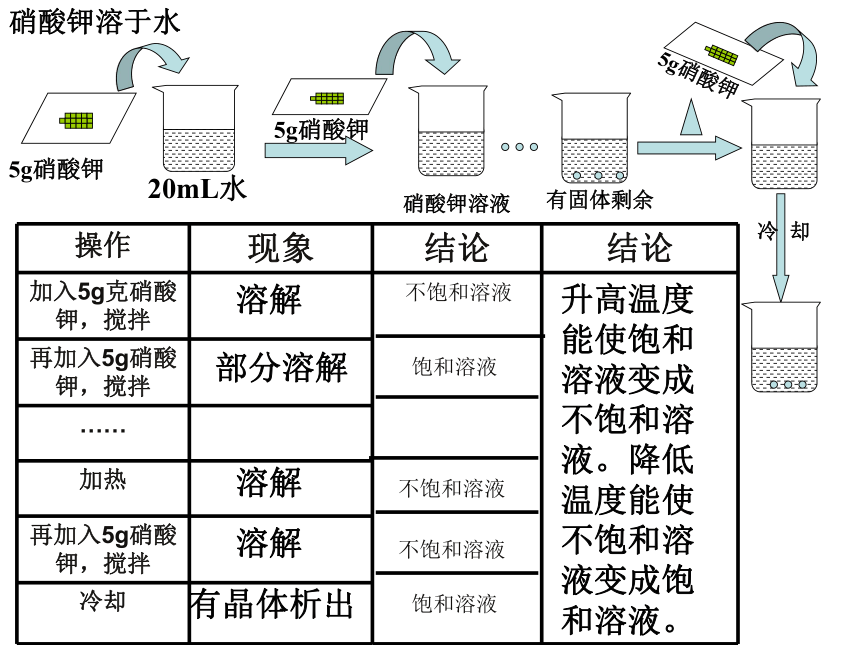
第一课时 饱和溶液【思考】通过上一节课的学习,同学们已经感受到,一种物质能否溶解在另一中物质里,与这两种物质的性质有关。那么,象食盐和蔗糖这样能够溶于水的物质,是不是可以无限量地溶解在一定量的水中呢?【活动探究】在常温下,取大约20mL水到入玻璃杯中,加入5g食盐,搅拌,等食盐溶解后,再加5g,搅拌,观察现象。然后再加入5mL水,搅拌,观察现象。5g氯化钠20mL水再加5g氯化钠5mL水待溶解后氯化钠溶液氯化钠晶体溶解有未溶解的氯化钠晶体剩余的氯化钠晶体继续溶解最后消失物质溶解受溶剂的量的影响氯化钠溶于水【活动探究2】在常温下,取大约20mL水到入玻璃杯中,加入5g硝酸钾,搅拌,等硝酸钾溶解后,再加5g,搅拌……加了几次后,烧杯中的硝酸钾固体才有剩余而不再溶解?然后加热,观察现象。再加5g硝酸钾,观察现象。等溶液冷却后,又有什么现象发生?20mL水5g硝酸钾5g硝酸钾硝酸钾溶液有固体剩余5g硝酸钾冷 却硝酸钾溶于水全部溶解部分溶解晶体溶解晶体又溶解有晶体析出 物质的溶解受温度的影响【小结】溶剂中溶解溶质的多少与溶剂的量和温度有关。一、饱和溶液和不饱和溶液【饱和溶液】在一定温度下,在一定量的溶剂里不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。【不饱和溶液】在一定温度下,在一定量的溶剂里还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。想一想,做一做
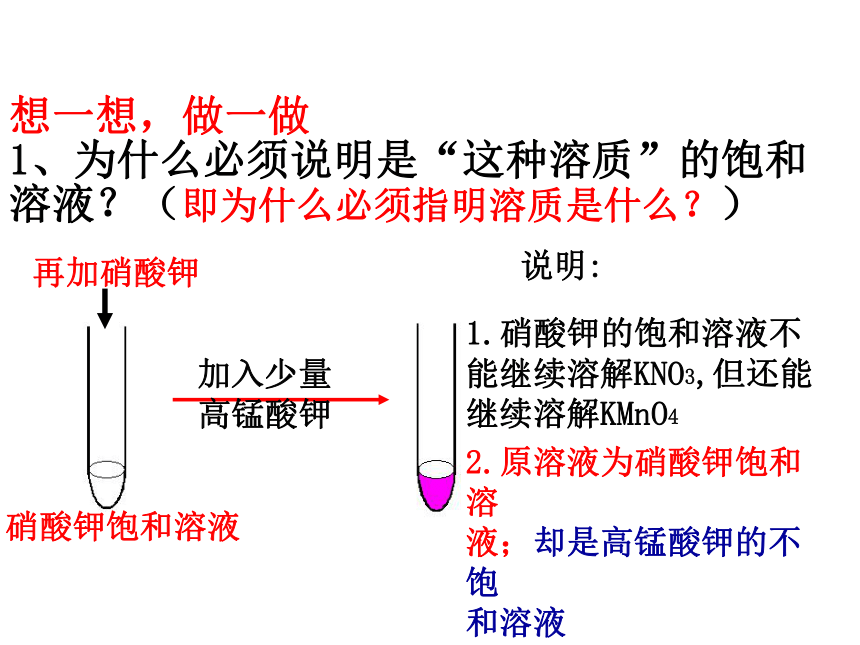
1、为什么必须说明是“这种溶质”的饱和溶液?(即为什么必须指明溶质是什么?)硝酸钾饱和溶液说明:1.硝酸钾的饱和溶液不能继续溶解KNO3,但还能继续溶解KMnO42.原溶液为硝酸钾饱和溶
液;却是高锰酸钾的不饱
和溶液
氯化钠晶体溶解氯化钠晶体部分溶解剩余的氯化钠晶体继续溶解最后消失增加溶质的量,能使不饱和溶液变成饱和溶液想一想,做一做
2、我们在说某溶液是饱和溶液,还是不饱和溶液时,为什么总要强调“一定温度下,一定量的溶剂里,”这两个条件?增加溶剂的量,能使饱和溶液变成不饱和溶液氯化钠溶于水20mL水5g硝酸钾5g硝酸钾硝酸钾溶液有固体剩余5g硝酸钾冷 却硝酸钾溶于水溶解 部分溶解溶解溶解有晶体析出升高温度能使饱和溶液变成不饱和溶液。降低温度能使不饱和溶液变成饱和溶液。不饱和溶液
饱和溶液不饱和溶液
不饱和溶液
饱和溶液不饱和溶液饱和溶液增加溶质、恒温蒸发溶剂或降低温
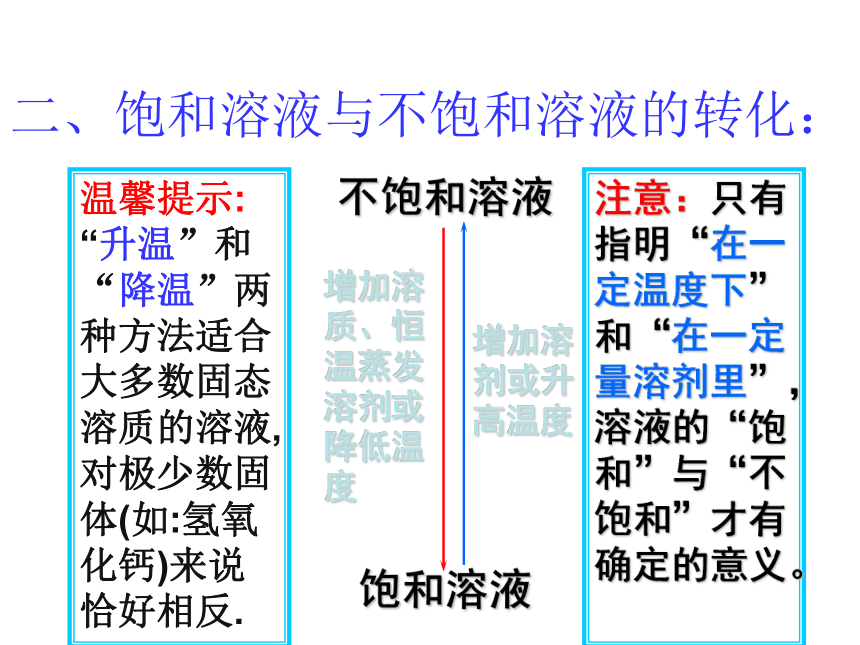
度增加溶剂或升高温度注意:只有指明“在一定温度下”和“在一定量溶剂里”,溶液的“饱和”与“不饱和”才有确定的意义。二、饱和溶液与不饱和溶液的转化:温馨提示: “升温”和“降温”两种方法适合大多数固态溶质的溶液,对极少数固体(如:氢氧化钙)来说恰好相反.1、在一定温度下,某物质的饱和溶液一定是( )
A、 非常浓的溶液;
B、 增加该溶质,能继续溶解的溶液;
C、 非常稀的溶液;
D、 增加该溶质,不能继续溶解的溶液。
2.某物质的饱和溶液中,加入一些该溶质的固体,
则下列说法正确的是( )
A、溶质质量减少; B、溶液质量增大;
C、固体质量不变; D、溶质质量增加.
DC巩固与应用 如何证明你所配制的溶液是否饱和? 一般地说,要确定某一溶液是否饱和:
1、看在一定温度下,该溶液中有没有不能继续溶解的剩余溶质存在。
2、在其他条件不变得情况下,向溶液中加少量该溶液中的溶质,看是否溶解C巩固与应用1.若要将一杯不饱和KNO3溶液变为饱和溶液,下列方法不正确的( )
A、加KNO3 固体 B、 蒸发水
C、倒出一部分溶液 D、降低温度2.在下列三只烧杯中,加入一定量的水,然后在各杯中加
入食盐,且加入食盐的量从A到C依次增加,肯定是饱和
溶液的是 ( ) C 三、浓溶液与稀溶液在同量的溶液中,含溶质较多的溶液——浓溶液;
含溶质较少的溶液——稀溶液不同的溶质:
浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液;饱和溶液也不一定是浓溶液,不饱和溶液也不一定是稀溶液。
相同溶质、相同温度:饱和溶液一定比不饱和溶液浓。溶液的浓与稀跟溶液是否饱和没有必然联系2.下列说法不正确的是( )
A、浓溶液一定是饱和溶液
B、稀溶液可能是饱和溶液
C、在一定条件下,饱和溶液与不饱和溶液之间可
相互转化
D、在提到某种物质的溶解度时,一定要指明温度A巩固与应用 1. 问:“相同溶质、相同温度:饱和溶液一定比不饱和溶液所含溶质多”这句话对不对?错自主学习——结晶
当晶体从饱和溶液中析出后,剩余的液体被称为
,它通常是 (饱和或不饱和)溶液。
母液饱和【结晶】溶解在溶液里的溶质以晶体的形式析出,叫做结晶。【讨论】实验可知结晶的方法有那两种?硝酸钾晶体冷却热饱和溶液结晶的方法 结晶后所得到的溶液是饱和溶液。(适用于溶解度受温度影响较大的物质:硝酸钾)降温结晶/冷却热饱和溶液海水贮水池蒸发池结晶池食盐母液氯化钠多种化工原料从海水中提取食盐蒸发 溶剂NaCl的饱和溶液恒温蒸发溶剂
(适用于溶解度受温度影响比较小的物质:氯化钠)蒸发结晶不饱和溶液饱和溶液增加溶质升高温度蒸发溶剂降低温度增加溶剂蒸发溶剂降低温度晶体析出课堂小结: 1、饱和溶液 2、如何判断一种溶液是否是饱和溶液? 3、1、关于饱和溶液的说法中正确的是( )
A.含有溶质很多的溶液??
B.在一定温度下,一定量的溶剂里,不能再继续溶解某种溶质的溶液??
? C.不能继续溶解某种溶质的溶液??
? D.还能继续溶解某种溶质的溶液 达标检测B2、使不饱和溶液变为饱和溶液,最可靠的方法
是( )
A.升高温度 B.加入溶质
C.降低温度 D.倒出一部分溶液B3、一定温度下,从500克的饱和溶液中倒出100克
溶液,剩余的溶液里,下列数值比原溶液减少的是
①溶质的质量; ②溶剂的质量;
③溶液的密度; ④溶液的质量;
⑤溶质的质量分数(即:浓度);( )
①②③④ B.②③④⑤
C. ①②④ D.①②③④⑤ C4、A、B、C、D四个烧杯里分别盛有质量相等的同种溶剂,向四个烧杯加入某溶质,且固体溶质质量依次减少(温度相同),充分溶解,(如下图所示)回答下列各问(填序号)
(1)_____________中盛的一定是饱和溶液;
(2)_____________中盛的可能是饱和溶液;
(3)_____________中盛的一定是不饱和溶液;
A BCD 第九单元 溶液
课题2 溶解度
第二课时 溶解度
思考:如何判断糖和食盐的溶解性?
(1)用一杯水和一盆水来分别溶解糖和食盐,能判断糖和食盐的溶解性吗?
(2)固定20g的水,温度分别为100。C和20。C的进行比较,可以吗?
(3)限定温度、在20g的水中均可溶解5g糖和食盐,所以表明糖和食盐的溶解性相同?
必须达到一个什么状态才能进行比较?溶解度【溶解性】一种物质溶解在另一种物质的能力一、固体物质的溶解度【思考】食盐和硝酸钾都可以溶解在水中,那么,到底谁溶得更多呢?只有在温度确定、溶剂的量也确定的条件下才能作出比较。【溶解度】在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量。说明:通常所说的溶解度是指物质在水里的溶解度。比较的标准【溶解度】在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量。四大要素:①一定温度
②100g溶剂
③饱和状态
④指的是溶质的质量(单位:g)如:在20℃时,100g水中溶解36g氯化钠达到饱和,我们就说20℃时,氯化钠的溶解度是36g。又如:60℃时,硝酸钾的溶解度是110克,说明在60℃时,100g水里最多能溶解110g硝酸钾。影响因素:
除了溶质、 溶剂本身的性质外,还有温度【例1】判断下列说法是否正确,并指明错误原因。
①把20g某物质溶解在100g水里恰好制成饱和溶液,这种物质的溶解度就是20g。
②20℃时10g氯化钠溶解在水里制成饱和溶液,故20℃时氯化钠的溶解度是10g。
③20℃时10g氯化钠可溶解在100g水里,故20℃时氯化钠的溶解度是10g。
④20℃时36g食盐溶解在100g水中恰好饱和,故20℃时食盐的溶解度是36。未指明温度未指明溶剂的量未指明溶液的状态是饱和溶解度的单位是“克”××××巩固与应用【思考】理解了溶解度的概念,那你了解平时所说的“易溶”“难溶”与溶解度的关系吗?【例2】
①不溶物就是绝对不溶的物质。这句话是否正确?
②20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是___物质。
③20℃时食盐的溶解度是36g,所以食盐属于__
物质。不正确。通常所说的不溶物即难溶物,溶解度<0.01g。实际上没有绝对不溶的物质。难溶易溶×巩固与应用70列表法曲
线
法二、溶解度曲线溶解度的表示方法(以KNO3为例)s/g【思考】 P36的列表法所表示溶解度还不是很直观,不能表示某物质在任意温度溶解度,也不能直观表示某物质溶解度随温度变化的趋向。曲线法可以弥补这些不足。溶解度曲线图9-13 熟石灰的溶解度随温度升高而降低图9-12 几种固体物质溶解度曲线1:曲线表示某物质在不同温度下的溶解度不同及溶解度随温度的变化情况702:曲线上的点表示溶质在该温度下的溶解度。
此时的溶液为饱和溶液BC3:曲线上方的点表示加入溶质后形成饱和溶液,并有固体剩余。曲线下方的点表示形成不饱和溶液溶解度/g温度/ oC1601501401301201101009080706050403020102001901801701010090807060504030200NH4NO3KNO3NaNO3NH4NO3NaCl硼酸图9-12 几种固体物质溶解度曲线4:曲线的交点表示这两种物质在该温度下的溶解度相同5:曲线越陡,该物质的溶解度受温度影响越大找一找50度各物质的溶解度P1: 大多数固体物质的溶解度随温度升高而增大。如KNO3溶解度随温度变化的规律2: 少数固体物质的溶解度受温度影响较小。如NaCl3: 极少数物质的溶解度随温度升高而减小。如Ca(OH)2①不同物质在各温度时的溶解度;
②曲线与曲线的交点的含义:表示两物质在某温度时有相同的溶解度;
③能比较出不同物质在同一温度时溶解度的大小及同一物质在不同温度时溶解度的大小;
④多数物质溶解度随温度升高而增大(如KNO3)、少数的变化不大(如NaCl)、极少数随温度升高而降低(如Ca(OH)2)。溶解度曲线的含义:※不同物质在不同温度时的溶解度的大小不能比较60
70
808
50
10
20
100硼酸硝酸铵硝酸钠硝酸钾氯化铵氯化钾氯化钠6070501020304080901001101801701601501401301201902005010203040090607080温度/℃固体的溶解度曲线:68134g小于p.氯化铵、氯化钾、氯化钠、硼酸巩固与应用三、气体物质溶解度【思考】
1.打开汽水盖时,汽水会自动喷出来,这说明气体在水中的溶解度与什么有关?
2.喝了汽水后,常常会打嗝。这说明气体的溶解度还与什么有关?
3.用什么方法确定汽水中溶解的气体是二氧化碳?
温度:温度升高,气体在水中的溶解度减小。压强:压强减小,气体在水中的溶解度减小。收集气体,通入澄清石灰水中,看石灰水是否会变浑浊气体的溶解度:是指在压强为101kPa和一定温度时,气体溶解在1体积水里达饱和状态时的气体体积。溶解度同种溶质在不同的溶 剂中的溶解能力不同不同的溶质在同种溶 剂中的溶解能力不同溶解性物质的溶解度易溶 、可溶 、 微溶 、 难(不)溶 固体的溶解度气体的溶解度影响因素(温度) 影响因素 (温度、压强)表示方法表示方法小结:再见
课题2 溶解度
第一课时 饱和溶液【思考】通过上一节课的学习,同学们已经感受到,一种物质能否溶解在另一中物质里,与这两种物质的性质有关。那么,象食盐和蔗糖这样能够溶于水的物质,是不是可以无限量地溶解在一定量的水中呢?【活动探究】在常温下,取大约20mL水到入玻璃杯中,加入5g食盐,搅拌,等食盐溶解后,再加5g,搅拌,观察现象。然后再加入5mL水,搅拌,观察现象。5g氯化钠20mL水再加5g氯化钠5mL水待溶解后氯化钠溶液氯化钠晶体溶解有未溶解的氯化钠晶体剩余的氯化钠晶体继续溶解最后消失物质溶解受溶剂的量的影响氯化钠溶于水【活动探究2】在常温下,取大约20mL水到入玻璃杯中,加入5g硝酸钾,搅拌,等硝酸钾溶解后,再加5g,搅拌……加了几次后,烧杯中的硝酸钾固体才有剩余而不再溶解?然后加热,观察现象。再加5g硝酸钾,观察现象。等溶液冷却后,又有什么现象发生?20mL水5g硝酸钾5g硝酸钾硝酸钾溶液有固体剩余5g硝酸钾冷 却硝酸钾溶于水全部溶解部分溶解晶体溶解晶体又溶解有晶体析出 物质的溶解受温度的影响【小结】溶剂中溶解溶质的多少与溶剂的量和温度有关。一、饱和溶液和不饱和溶液【饱和溶液】在一定温度下,在一定量的溶剂里不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。【不饱和溶液】在一定温度下,在一定量的溶剂里还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。想一想,做一做
1、为什么必须说明是“这种溶质”的饱和溶液?(即为什么必须指明溶质是什么?)硝酸钾饱和溶液说明:1.硝酸钾的饱和溶液不能继续溶解KNO3,但还能继续溶解KMnO42.原溶液为硝酸钾饱和溶
液;却是高锰酸钾的不饱
和溶液
氯化钠晶体溶解氯化钠晶体部分溶解剩余的氯化钠晶体继续溶解最后消失增加溶质的量,能使不饱和溶液变成饱和溶液想一想,做一做
2、我们在说某溶液是饱和溶液,还是不饱和溶液时,为什么总要强调“一定温度下,一定量的溶剂里,”这两个条件?增加溶剂的量,能使饱和溶液变成不饱和溶液氯化钠溶于水20mL水5g硝酸钾5g硝酸钾硝酸钾溶液有固体剩余5g硝酸钾冷 却硝酸钾溶于水溶解 部分溶解溶解溶解有晶体析出升高温度能使饱和溶液变成不饱和溶液。降低温度能使不饱和溶液变成饱和溶液。不饱和溶液
饱和溶液不饱和溶液
不饱和溶液
饱和溶液不饱和溶液饱和溶液增加溶质、恒温蒸发溶剂或降低温
度增加溶剂或升高温度注意:只有指明“在一定温度下”和“在一定量溶剂里”,溶液的“饱和”与“不饱和”才有确定的意义。二、饱和溶液与不饱和溶液的转化:温馨提示: “升温”和“降温”两种方法适合大多数固态溶质的溶液,对极少数固体(如:氢氧化钙)来说恰好相反.1、在一定温度下,某物质的饱和溶液一定是( )
A、 非常浓的溶液;
B、 增加该溶质,能继续溶解的溶液;
C、 非常稀的溶液;
D、 增加该溶质,不能继续溶解的溶液。
2.某物质的饱和溶液中,加入一些该溶质的固体,
则下列说法正确的是( )
A、溶质质量减少; B、溶液质量增大;
C、固体质量不变; D、溶质质量增加.
DC巩固与应用 如何证明你所配制的溶液是否饱和? 一般地说,要确定某一溶液是否饱和:
1、看在一定温度下,该溶液中有没有不能继续溶解的剩余溶质存在。
2、在其他条件不变得情况下,向溶液中加少量该溶液中的溶质,看是否溶解C巩固与应用1.若要将一杯不饱和KNO3溶液变为饱和溶液,下列方法不正确的( )
A、加KNO3 固体 B、 蒸发水
C、倒出一部分溶液 D、降低温度2.在下列三只烧杯中,加入一定量的水,然后在各杯中加
入食盐,且加入食盐的量从A到C依次增加,肯定是饱和
溶液的是 ( ) C 三、浓溶液与稀溶液在同量的溶液中,含溶质较多的溶液——浓溶液;
含溶质较少的溶液——稀溶液不同的溶质:
浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液;饱和溶液也不一定是浓溶液,不饱和溶液也不一定是稀溶液。
相同溶质、相同温度:饱和溶液一定比不饱和溶液浓。溶液的浓与稀跟溶液是否饱和没有必然联系2.下列说法不正确的是( )
A、浓溶液一定是饱和溶液
B、稀溶液可能是饱和溶液
C、在一定条件下,饱和溶液与不饱和溶液之间可
相互转化
D、在提到某种物质的溶解度时,一定要指明温度A巩固与应用 1. 问:“相同溶质、相同温度:饱和溶液一定比不饱和溶液所含溶质多”这句话对不对?错自主学习——结晶
当晶体从饱和溶液中析出后,剩余的液体被称为
,它通常是 (饱和或不饱和)溶液。
母液饱和【结晶】溶解在溶液里的溶质以晶体的形式析出,叫做结晶。【讨论】实验可知结晶的方法有那两种?硝酸钾晶体冷却热饱和溶液结晶的方法 结晶后所得到的溶液是饱和溶液。(适用于溶解度受温度影响较大的物质:硝酸钾)降温结晶/冷却热饱和溶液海水贮水池蒸发池结晶池食盐母液氯化钠多种化工原料从海水中提取食盐蒸发 溶剂NaCl的饱和溶液恒温蒸发溶剂
(适用于溶解度受温度影响比较小的物质:氯化钠)蒸发结晶不饱和溶液饱和溶液增加溶质升高温度蒸发溶剂降低温度增加溶剂蒸发溶剂降低温度晶体析出课堂小结: 1、饱和溶液 2、如何判断一种溶液是否是饱和溶液? 3、1、关于饱和溶液的说法中正确的是( )
A.含有溶质很多的溶液??
B.在一定温度下,一定量的溶剂里,不能再继续溶解某种溶质的溶液??
? C.不能继续溶解某种溶质的溶液??
? D.还能继续溶解某种溶质的溶液 达标检测B2、使不饱和溶液变为饱和溶液,最可靠的方法
是( )
A.升高温度 B.加入溶质
C.降低温度 D.倒出一部分溶液B3、一定温度下,从500克的饱和溶液中倒出100克
溶液,剩余的溶液里,下列数值比原溶液减少的是
①溶质的质量; ②溶剂的质量;
③溶液的密度; ④溶液的质量;
⑤溶质的质量分数(即:浓度);( )
①②③④ B.②③④⑤
C. ①②④ D.①②③④⑤ C4、A、B、C、D四个烧杯里分别盛有质量相等的同种溶剂,向四个烧杯加入某溶质,且固体溶质质量依次减少(温度相同),充分溶解,(如下图所示)回答下列各问(填序号)
(1)_____________中盛的一定是饱和溶液;
(2)_____________中盛的可能是饱和溶液;
(3)_____________中盛的一定是不饱和溶液;
A BCD 第九单元 溶液
课题2 溶解度
第二课时 溶解度
思考:如何判断糖和食盐的溶解性?
(1)用一杯水和一盆水来分别溶解糖和食盐,能判断糖和食盐的溶解性吗?
(2)固定20g的水,温度分别为100。C和20。C的进行比较,可以吗?
(3)限定温度、在20g的水中均可溶解5g糖和食盐,所以表明糖和食盐的溶解性相同?
必须达到一个什么状态才能进行比较?溶解度【溶解性】一种物质溶解在另一种物质的能力一、固体物质的溶解度【思考】食盐和硝酸钾都可以溶解在水中,那么,到底谁溶得更多呢?只有在温度确定、溶剂的量也确定的条件下才能作出比较。【溶解度】在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量。说明:通常所说的溶解度是指物质在水里的溶解度。比较的标准【溶解度】在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量。四大要素:①一定温度
②100g溶剂
③饱和状态
④指的是溶质的质量(单位:g)如:在20℃时,100g水中溶解36g氯化钠达到饱和,我们就说20℃时,氯化钠的溶解度是36g。又如:60℃时,硝酸钾的溶解度是110克,说明在60℃时,100g水里最多能溶解110g硝酸钾。影响因素:
除了溶质、 溶剂本身的性质外,还有温度【例1】判断下列说法是否正确,并指明错误原因。
①把20g某物质溶解在100g水里恰好制成饱和溶液,这种物质的溶解度就是20g。
②20℃时10g氯化钠溶解在水里制成饱和溶液,故20℃时氯化钠的溶解度是10g。
③20℃时10g氯化钠可溶解在100g水里,故20℃时氯化钠的溶解度是10g。
④20℃时36g食盐溶解在100g水中恰好饱和,故20℃时食盐的溶解度是36。未指明温度未指明溶剂的量未指明溶液的状态是饱和溶解度的单位是“克”××××巩固与应用【思考】理解了溶解度的概念,那你了解平时所说的“易溶”“难溶”与溶解度的关系吗?【例2】
①不溶物就是绝对不溶的物质。这句话是否正确?
②20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是___物质。
③20℃时食盐的溶解度是36g,所以食盐属于__
物质。不正确。通常所说的不溶物即难溶物,溶解度<0.01g。实际上没有绝对不溶的物质。难溶易溶×巩固与应用70列表法曲
线
法二、溶解度曲线溶解度的表示方法(以KNO3为例)s/g【思考】 P36的列表法所表示溶解度还不是很直观,不能表示某物质在任意温度溶解度,也不能直观表示某物质溶解度随温度变化的趋向。曲线法可以弥补这些不足。溶解度曲线图9-13 熟石灰的溶解度随温度升高而降低图9-12 几种固体物质溶解度曲线1:曲线表示某物质在不同温度下的溶解度不同及溶解度随温度的变化情况702:曲线上的点表示溶质在该温度下的溶解度。
此时的溶液为饱和溶液BC3:曲线上方的点表示加入溶质后形成饱和溶液,并有固体剩余。曲线下方的点表示形成不饱和溶液溶解度/g温度/ oC1601501401301201101009080706050403020102001901801701010090807060504030200NH4NO3KNO3NaNO3NH4NO3NaCl硼酸图9-12 几种固体物质溶解度曲线4:曲线的交点表示这两种物质在该温度下的溶解度相同5:曲线越陡,该物质的溶解度受温度影响越大找一找50度各物质的溶解度P1: 大多数固体物质的溶解度随温度升高而增大。如KNO3溶解度随温度变化的规律2: 少数固体物质的溶解度受温度影响较小。如NaCl3: 极少数物质的溶解度随温度升高而减小。如Ca(OH)2①不同物质在各温度时的溶解度;
②曲线与曲线的交点的含义:表示两物质在某温度时有相同的溶解度;
③能比较出不同物质在同一温度时溶解度的大小及同一物质在不同温度时溶解度的大小;
④多数物质溶解度随温度升高而增大(如KNO3)、少数的变化不大(如NaCl)、极少数随温度升高而降低(如Ca(OH)2)。溶解度曲线的含义:※不同物质在不同温度时的溶解度的大小不能比较60
70
808
50
10
20
100硼酸硝酸铵硝酸钠硝酸钾氯化铵氯化钾氯化钠6070501020304080901001101801701601501401301201902005010203040090607080温度/℃固体的溶解度曲线:68134g小于p.氯化铵、氯化钾、氯化钠、硼酸巩固与应用三、气体物质溶解度【思考】
1.打开汽水盖时,汽水会自动喷出来,这说明气体在水中的溶解度与什么有关?
2.喝了汽水后,常常会打嗝。这说明气体的溶解度还与什么有关?
3.用什么方法确定汽水中溶解的气体是二氧化碳?
温度:温度升高,气体在水中的溶解度减小。压强:压强减小,气体在水中的溶解度减小。收集气体,通入澄清石灰水中,看石灰水是否会变浑浊气体的溶解度:是指在压强为101kPa和一定温度时,气体溶解在1体积水里达饱和状态时的气体体积。溶解度同种溶质在不同的溶 剂中的溶解能力不同不同的溶质在同种溶 剂中的溶解能力不同溶解性物质的溶解度易溶 、可溶 、 微溶 、 难(不)溶 固体的溶解度气体的溶解度影响因素(温度) 影响因素 (温度、压强)表示方法表示方法小结:再见
同课章节目录
